0 引言
【研究意义】蓝莓(Vaccinium spp.)为杜鹃花科越桔属(Vaccinium)多年生灌木,原产于北美,在北美、欧洲、南美和亚洲等地均有种植,其中美国和加拿大为主要生产国,约占世界蓝莓总产量的80%[1]。蓝莓被喻为世界第3代水果,具有抗氧化、抗癌、明目等功效,已被国际粮农组织列为人类五大健康食品之一,其果实在鲜食、加工或作为高级化妆品原料等方面具有广阔的市场前景和较高的经济价值[2-3]。病毒病是蓝莓生产上的一种重要病害,对蓝莓的产量和品质能够造成不同程度的影响。蓝莓休克病毒(Blueberry shock virus,BlShV)是侵染蓝莓的主要病毒之一,该病毒属于雀麦花叶病毒科(Bromoviridae)、等轴不稳环斑病毒属(Ilarvirus)成员,最早在美国被发现[4]。BlShV能够侵染绝大多数蓝莓品种,引起的典型症状为开花期时花和叶片突然完全坏死,造成的产量损失可达34%—90%[5-6]。由于BlShV引起的蓝莓休克病至今尚无有效防治药剂,采用无毒苗是预防该病毒发生的关键,因此加强该病毒检测技术的研究,建立特异性强、准确性好、灵敏度高的快速检测技术具有重要意义。【前人研究进展】目前,用于BlShV检测的主要方法包括血清学ELISA和分子生物学RT-PCR技术。应用商品化的ELISA试剂盒检测BlShV,具有操作简便、特异性好、样品检测量大的优点。SPAK等[7-8]利用ELISA检测试剂盒,分别对捷克、塞尔维亚蓝莓上的BlShV、蓝莓焦枯病毒(Blueberry scorch virus,BlScV)、蓝莓带化病毒(Blueberry shoestring virus,BSSV)等多种病毒的发生情况进行了调查。SEDEGUI等[9]建立了一种能用于蓝莓叶片上BlShV检测的高通量ELISA方法,其特异性、灵敏度与标准ELISA方法相当或更高。由于灵敏度的限制,ELISA方法可能无法准确检测含量较低的病毒,容易出现假阴性的结果。相对于ELISA方法,利用RT-PCR检测BlShV具有时间快、灵敏度高和特异性强的突出优点,该技术已成功用于BlShV的检测。笔者前期根据BlShV外壳蛋白基因序列设计一对特异性引物,建立了以RNA为模板的普通RT-PCR检测方法[10]。因RNA提取步骤较多,不仅操作过程RNA易出现污染,而且操作者需要接触有毒试剂,所以在实际检测中仍有一定的不足。在RT-PCR基础上改进的IC-RT-PCR技术,无需提取RNA作为模板,该技术直接以抗体特异性捕捉病毒粒体,在简化操作、避免接触有毒试剂的同时减少了污染,近年来在病毒检测中应用越来越广泛。代欢欢等[11]以带有鸢尾黄斑病毒(Iris yellow spot virus,IYSV)的烟草叶片为材料,建立了IYSV的IC-RT-PCR检测技术,灵敏度是普通RT-PCR的4倍、DAS-ELISA的100倍以上。KUMAR等[12]通过对病毒提取液和RNA释放条件的优化,建立了用于葡萄卷叶伴随病毒-3(Grapevine leafroll-associated virus 3,GLRaV-3)快速检测的IC-RT-PCR技术。VISWANATHAN等[13]利用能够捕捉甘蔗线条花叶病毒(Sugarcane streak mosaic virus,SCSMV)和甘蔗花叶病毒(Sugarcane mosaic virus,SCMV)的重组抗体,建立了同时检测两种病毒的双重IC-RT-PCR方法,其灵敏度高于ELISA。Nested PCR是根据已报道的病毒基因序列,设计外侧、内侧两套引物,先以外侧引物进行第1轮扩增,再以扩增产物为模板,利用内侧引物进行第2轮扩增,该技术与普通RT-PCR相比,特异性更强、灵敏度更高。周彦等[14]针对柑橘黄化脉明病毒(Citrus yellow vein clearing virus,CYVCV)核酸结合蛋白基因的保守序列设计两对特异性引物,通过优化退火温度,建立了CYVCV巢式RT-PCR检测方法,灵敏度较RT-PCR提高100倍。ADKAR-PURUSHOTHAMA等[15]根据柑橘衰退病毒(Citrus tristeza virus,CTV)外壳蛋白CP基因序列,设计特异性巢式PCR引物,建立了CTV特异、灵敏的RT-Nested PCR检测技术,用于显症和无症植株上CTV的快速检测,检测效果与荧光定量RT-PCR相当。LEE等[16]通过特异性引物设计和筛选,建立了桃丛簇花叶病毒(Peach rosette mosaic virus,PRMV)RT- nested PCR检测方法。【本研究切入点】IC-RT-nested PCR是一种将IC-RT-PCR与nested PCR相结合的病毒检测技术,能够进一步提高检测的特异性和灵敏度。关于应用该技术检测BlShV,到目前为止尚未见相关研究报道。【拟解决的关键问题】以BlShV为研究对象,蓝莓叶片提取液为材料,设计两对特异性引物,通过病毒抗体免疫捕捉病毒粒体和RT-nested PCR,建立BlShV的IC-RT-nested PCR分子检测技术,为农业生产和进出境口岸对蓝莓上BlShV的检测、监测提供有效的技术手段。1 材料与方法
试验于2014年10月至2016年3月在福建省农业科学院果树研究所完成。1.1 材料
供试蓝莓休克病毒(BlShV)、蓝莓焦枯病毒(BlScV)、蓝莓带化病毒(BSSV)、蓝莓叶斑驳病毒(Blueberry leaf mottle virus,BLMoV)、烟草环斑病毒(Tobacco ringspot virus,TRSV)、番茄环斑病毒(Tomato ringspot virus,ToRSV)毒源由笔者实验室保存;蓝莓样品为中国福建、吉林、辽宁地区蓝莓叶片和进境美国蓝莓叶片;BlShV抗体、酶标抗体购自Adgen公司;TrizoL试剂购自Invitrogen公司;RT试剂、PCR mix购自Promega公司;pMD-18T载体购自宝生物(大连)有限公司产品;DNA Marker、胶回收试剂盒购自天根生化科技(北京)有限公司。1.2 引物的设计与合成
根据GenBank已公布的BlShV运动蛋白基因(movement protein,MP)与外壳蛋白(coat protein,CP)的间隔区及CP基因部分区域序列,设计两对特异引物:BlShV-F(外侧正向引物)/BlShV-R(外侧反向引物)、BlShV-1(内侧正向引物)/BlShV-2(内侧反向引物),引物序列见表1。引物委托上海生物工程技术服务有限公司合成。Table 1
表1
表1引物序列
Table 1Sequences of primers
| 引物名称 Primer name | 引物序列 Primer sequence (5′-3′) | 长度 Length (nt) | 目的片段 Expected size (bp) |
|---|---|---|---|
| BlShV-F | CGAGTAATCATGGTTTGCAAG | 21 | 746 |
| BlShV-R | GACCGGTATCGAACCTTCAC | 20 | |
| BlShV-1 | GTGGTCAGTGTAAGAAGTGC | 20 | 486 |
| BlShV-2 | CGTACTCCAAATCGGATGG | 19 |
新窗口打开
1.3 样品提取液的制备
称取蓝莓叶片0.3 g,加入3 mL样品提取缓冲液(磷酸盐缓冲液,pH 7.4,内含2% PVP,0.2%卵清蛋白,0.05%吐温20),研磨后4℃下8 000 r/min 离心10 min,取上清液作为样品提取液。以健康蓝莓叶片采用上述方法制备的提取液作为阴性对照。1.4 DAS-ELISA
BlShV抗体用包被缓冲液(pH 9.6)稀释后,在酶标板中每孔加入100 μL,室温放置4 h或4℃下包被过夜;倒去酶标板中包被抗体溶液,PBST洗3次;在酶标板中每孔加入100 μL样品提取液,室温放置2 h或4℃下包被过夜;倒去酶标板中样品提取液,PBST洗3次;BlShV酶标抗体用酶标抗体缓冲液稀释后,在酶标板中每孔加入100 μL,室温放置2 h;倒去酶标板中酶标抗体溶液,PBST洗3次;在酶标板中每孔加入100 μL新配制的硝基苯磷酸二钠盐(pNPP)底物溶液。室温下避光放置,至阳性对照孔明显显色,用酶标仪测定405 nm下的OD值,若样品OD405 nm/阴性对照OD405 nm≥2,判为阳性;样品OD405 nm /阴性对照OD405 nm<2,判为阴性。试验以健康蓝莓叶片提取液作为阴性对照、感染BlShV病叶提取液作为阳性对照,重复2次。1.5 普通RT-PCR
1.5.1 RNA提取 取样品提取液250 μL,加入1 mL TrizoL试剂,室温剧烈振荡后静置5 min;加入氯仿300 μL,充分颠倒混匀30 s,室温下静置5 min,4℃下12 000 r/min离心15 min,小心吸取上层水相;加入等体积异丙醇,颠倒混匀后室温静置15 min,4℃下12 000 r/min离心10 min,弃上清;沉淀用1 mL 75%冷乙醇洗涤,4℃下7 500 r/min离心3 min,弃上清,重复2次;沉淀充分干燥后用20 μL DEPC-H2O溶解沉淀。1.5.2 RT-PCR 取3 μL RNA,加入外侧反向引物BlShV-R 1 μL、ddH2O 7 μL,70℃水浴10 min后迅速冰浴5 min,再加入5×M-MuLV反转录酶缓冲液5 μL、dNTPs(10 mmol·L-1)2 μL、RNasin(40 U·μL-1)1 μL、M-MuLV反转录酶(200 U·μL-1)1 μL。经42℃ 1 h、70℃ 10 min合成cDNA。PCR采用25 μL反应体系:外侧正向引物BlShV-F(10 μmol·L-1)1 μL,外侧反向引物BlShV-R(10 μmol·L-1)1 μL,2×Taq PCR mix 12.5 μL,cDNA模板3 μL,ddH2O 7.5 μL。PCR反应条件:94℃ 5 min;94℃ 30 s、51℃ 45 s、72℃ 1 min,35个循环,最后一轮循环后72℃延伸10 min。PCR扩增产物经1.5%琼脂糖凝胶电泳后用凝胶成像系统观察结果。
1.6 IC-RT-nested PCR
1.6.1 免疫捕获病毒粒子 将100 μL用包被缓冲液稀释200倍的BlShV抗体加入PCR管中,37℃孵育2 h;倒去抗体溶液,PBST洗3次,再加入100 μL用于DAS-ELISA检测的样品提取液,4℃包被过夜。1.6.2 反转录 倒去PCR管中样品提取液,先后用PBST洗3次、DEPC-H2O洗2次,在PCR管中进行反转录。先向PCR管中加入外侧反向引物BlShV-R(10 μmol·L-1)1 μL、ddH2O 10 μL,70℃水浴10 min后立即冰浴5 min,再加入下列试剂:5×M-MuLV反转录酶缓冲液5 μL,dNTPs(10 mmol·L-1)2 μL,RNasin(40 U·μL-1)1 μL、M-MuLV反转录酶(200 U·μL-1)1 μL。经42℃ 1 h、70℃ 10 min合成cDNA,-20℃保存备用。
1.6.3 第1轮PCR扩增 以合成的cDNA为模板,进行第1轮PCR扩增。PCR反应体系:外侧正向引物BlShV-F(10 μmol·L-1)1 μL,外侧反向引物BlShV-R(10 μmol·L-1)1 μL,2×Taq PCR mix 12.5 μL,cDNA 3 μL,ddH2O 7.5 μL。PCR反应条件同1.5.2。
1.6.4 第2轮PCR扩增 取第1轮PCR产物0.5 μL作为模板,进行第2轮PCR扩增。PCR反应体系:内侧正向引物BlShV-1(10 μmol·L-1)1 μL,内侧反向引物BlShV-2(10 μmol·L-1)1 μL,2×Taq PCR mix 12.5 μL,ddH2O 10.5 μL。PCR反应条件:94℃ 3 min;94℃ 30 s,52℃ 45 s,72℃ 1 min,共30个循环,最后一轮循环后72℃延伸10 min。
1.7 IC-RT-nested PCR特异性测定
分别以BlShV、BlScV、BSSV、BLMoV、TRSV、ToRSV和健康蓝莓的叶片提取液为材料,进行IC-RT-nested PCR,测定特异性。1.8 IC-RT-nested PCR灵敏度测定
将感染BlShV蓝莓病叶提取液用健康蓝莓叶片提取液进行10倍梯度稀释,依次稀释101、102、103、104、105和106倍,以健康蓝莓叶片提取液作为阴性对照,进行IC-RT-nested PCR和DAS-ELISA,测定灵敏度。1.9 PCR产物的克隆和测序
PCR扩增产物经回收试剂盒回收后,连接到pMD18- T载体,连接产物转化大肠杆菌DH5α,然后涂布含氨苄青霉素的LB培养基,筛选阳性克隆,送上海生物工程技术服务有限公司进行测序。1.10 蓝莓样品的IC-RT-nested PCR检测
应用IC-RT-nested PCR技术对收集的中国福建、吉林、辽宁地区蓝莓叶片样品和进境美国蓝莓叶片样品进行实际检测,同时利用普通RT-PCR方法进行测定。2 结果
2.1 IC-RT-nested PCR扩增
设计的两对特异性引物对,外侧引物对(BlShV- F/BlShV-R)预期扩增片段大小为746 bp,内侧引物对(BlShV-1/BlShV-2)预期扩增片段大小为486 bp。利用蓝莓叶片提取液进行IC-RT-nested PCR,结果从感染BlShV病叶提取液中第1轮PCR扩增出约746 bp大小的目的片段,第2轮PCR扩增出约486 bp大小的目的片段,而健康蓝莓叶片提取液和空白对照经两轮PCR,未扩增出相应的目的片段(图1)。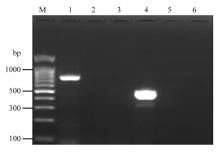 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1IC-RT-nested PCR扩增
M:DNA分子量标准(100 bp) DNA Marker (100 bp);1、4:BlShV样品 BlShV sample;2、5:阴性对照 Negative control;3、6:空白对照 Blank control
-->Fig. 1Amplification of IC-RT-nested PCR
-->
2.2 IC-RT-nested PCR特异性测定
应用建立的IC-RT-nested PCR方法分别对BlShV、BlScV、BSSV、BLMoV、TRSV、ToRSV和健康蓝莓叶片提取液进行检测,结果除BlShV第1轮、第2轮PCR扩增出特异性目的片段外,其余BlScV、BSSV、BLMoV、TRSV、ToRSV及健康蓝莓叶片两轮PCR均未扩增出目的片段(图2),表明建立的IC-RT-nested PCR方法具有很强的特异性。图2IC-RT-nested PCR的特异性
M:DNA分子量标准(100 bp) DNA Marker (100 bp);1:BlShV样品 BlShV sample;2:BlScV样品 BlScV sample;3:BSSV样品 BSSV sample;4:BLMoV样品 BLMoV sample;5:TRSV样品 TRSV sample;6:ToRSV样品 ToRSV sample;7:阴性对照Negative control
-->Fig. 2Specificity of IC-RT-nested PCR
-->
2.3 PCR产物序列分析
将IC-RT-nested PCR获得的BlShV第1轮、第2轮PCR产物分别回收纯化后,进行克隆测序。序列测定结果表明,BlShV的第1轮、第2轮PCR产物的序列全长为746、486 bp,与预先设计的片段大小完全相同。Blast比对发现,两轮PCR产物的序列与GenBank已报道的BlShV病毒基因序列高度一致,一致性达99%。序列测定结果表明,扩增到的目的片段为BlShV特异性产物,进一步验证了IC-RT-nested PCR扩增结果的准确性。2.4 IC-RT-nested PCR灵敏度测定
将感染BlShV病叶提取液用健康蓝莓叶片提取液按10倍梯度稀释后,分别进行IC-RT-nested PCR和DAS-ELISA,比较两种方法的灵敏度。测定结果表明,IC-RT-nested PCR灵敏度较高,第1轮PCR能够检测到稀释102倍的BlShV病叶提取液,经nested PCR,灵敏度提高100倍,能够检测到稀释104倍的BlShV病叶提取液(图3);DAS-ELISA灵敏度与IC-RT-nested PCR的第1轮PCR相当,为稀释102倍的BlShV病叶提取液,当BlShV病叶提取液稀释103倍以及更高倍数时,P/N值都<2(表2)。图3IC-RT-nested PCR的灵敏度
A:第1轮PCR The first round PCR;B:第2轮PCR The second round PCR。M:DNA分子量标准(100 bp) DNA Marker (100 bp); 1:BlShV提取液(100) Crude extract of BlShV (100);2:101稀释101 dilution;3:102稀释 102 dilution;4:103稀释 103 dilution;5:104稀释 104 dilution;6:105稀释 105 dilution;7:106稀释 106 dilution;8:阴性对照 Negative control
-->Fig. 3Sensitivity of IC-RT-nested PCR
-->
Table 2
表2
表2DAS-ELISA检测灵敏度
Table 2Sensitivity of DAS-ELISA
| 稀释倍数 Dilution ratio | P/N值 P/N value | 结果 Result |
|---|---|---|
| 100 | 6.86 | + |
| 101 | 5.24 | + |
| 102 | 2.44 | + |
| 103 | 1.31 | - |
| 104 | 1.12 | - |
| 105 | 1.08 | - |
| 106 | 1.06 | - |
新窗口打开
2.5 不同来源蓝莓样品检测
应用建立的IC-RT-nested PCR对中国福建、吉林、辽宁省蓝莓样品和进境美国蓝莓样品进行检测,结果从进境美国蓝莓2份疑似带毒样品上扩增出大小约486 bp的目的片段(图4),BlShV检出率为13.3%,而从53份中国福建、吉林、辽宁省蓝莓样品上未扩增出目的片段(表3),该结果与普通RT-PCR的验证结果完全相符,表明IC-RT-nested PCR能够有效用于田间及进出境样品上BlShV的检测。图4美国进境蓝莓样品的IC-RT-nested PCR检测
M:DNA分子量标准(100 bp)DNA Marker (100 bp);1—15:蓝莓样品 Blueberry sample;16:阴性对照Negative control
-->Fig. 4IC-RT-nested PCR detection of blueberry samples from America
-->
Table 3
表3
表3不同地区蓝莓样品上BlShV的IC-RT-nested PCR、普通RT-PCR检测
Table 3IC-RT-nested PCR and conventional RT-PCR detection of BlShV of blueberry samples from different regions
| 来源 Source | 数量 Number | 检出率 Detection rate (%) | |
|---|---|---|---|
| IC-RT-nested PCR | 普通RT-PCR Conventional RT-PCR | ||
| 中国福建 Fujian, China | 20 | 0 | 0 |
| 中国吉林 Jilin, China | 18 | 0 | 0 |
| 中国辽宁Liaoning, China | 15 | 0 | 0 |
| 美国 America | 15 | 13.3% | 13.3% |
新窗口打开
3 讨论
蓝莓休克病毒(BlShV)是危害蓝莓生产安全的一种重要病毒,发生严重时对蓝莓产量造成较大的损失。鉴于BlShV的危害性,加强该病毒检测技术的研究,建立快速、准确、灵敏的检测方法,提高早期病毒检出率,对于蓝莓无毒苗的筛选和最大程度地预防该病毒的发生有着重要意义。BlShV侵染蓝莓后引起的症状与蓝莓上另一种病毒蓝莓焦枯病毒(BlScV)极其相似,单从症状上难以区分,BlShV曾被误认为BlScV[17]。近年来,关于BlShV检测技术的研究较少,已报道的检测技术主要为血清学ELISA和普通RT-PCR两种。利用ELISA检测存在灵敏度低,易造成漏检的问题,而RT-PCR检测需要相对较为繁杂的RNA提取步骤,且对操作人员的技术要求较高,因此生产上有必要建立一种灵敏度高、操作简便的BlShV检测技术,以满足常规检测的需求。本研究以蓝莓叶片提取液为材料,利用IC-RT-PCR和Nested PCR技术,建立了用于BlShV快速检测的IC-RT-nested PCR分子检测技术,该技术首先以病毒抗体特异性吸附病毒粒体,再进行反转录和巢式PCR,能够对BlShV进行有效检测。应用IC-RT-PCR检测植物病毒的突出优点在于省去了RNA提取步骤,可以避免因某些植物组织成分的影响造成无法提取高质量的RNA。此外,还可以去除样品中PCR抑制因子,有利于植株体内低浓度病毒的检测[18]。本研究利用BlShV抗体在PCR管中免疫捕捉病毒粒体后,以设计的特异性外侧引物对(BlShV-F/BlShV-R)进行IC-RT-PCR,结果证实该方法能够从BlShV成功扩增出大小约746 bp的特异性目的片段。方法的特异性对于病毒的检测至关重要,直接影响到检测结果的准确性。本研究根据BlShV基因序列设计的引物具有较好的特异性,第1轮PCR外侧引物对、第2轮PCR内侧引物对,结果都仅从BlShV扩增出特异性目的片段,未从其他5种蓝莓RNA病毒(BlScV、BSSV、BLMoV、TRSV、ToRSV)和健康蓝莓叶片上扩增出目的片段。实际上,因内侧引物对的扩增片段位于外侧引物对的扩增片段内部,非特异性目的片段同时包含两对引物结合位点的可能性极小,因此内、外侧两对引物组成的巢式引物,大大提高了检测方法的特异性。除巢式引物的特异性外,BlShV抗体对病毒粒体的特异吸附可能也有助于进一步提高检测的特异性。在病毒的分子检测中,通常需要对PCR产物进行测序验证,以明确PCR产物是否为特异性产物。本研究针对第1轮PCR(IC-RT-PCR)产物及第2轮PCR(巢式PCR)产物分别进行了克隆测序,序列结果证实两轮PCR产物都为BlShV特异性产物,大小分别与预期完全相符,并且与已报道的BlShV序列高度一致,一致性均达99%。
除特异性外,灵敏度是病毒检测方法的另一项重要评价指标。在病毒侵染寄主早期,寄主体内的病毒含量往往很低,因此建立的检测方法灵敏度必须达到一定的水平,才能准确检测到病毒的存在。前人研究表明,IC-RT-PCR的灵敏度比常规血清学ELISA具有更高的灵敏度[19-20]。WU等[21]利用制备的水稻矮缩病毒(Rice dwarf virus,RDV)单克隆抗体,建立了PTA-ELISA、dot-ELISA和IC-RT-PCR检测方法,灵敏度测定结果表明IC-RT-PCR的灵敏度最高,在检测水稻组织内RDV时分别是PTA-ELISA、dot-ELISA的8倍和64倍;闻伟刚等[22]报道,IC-RT-PCR检测齿兰环斑病毒(Odontoglossum ringspot virus,ORSV)的灵敏度比DAS-ELISA高10倍,检测建兰花叶病毒(Cymbidium mosaic virus,CyMV)的灵敏度比TAS-ELISA高100倍。但在本研究中,IC-RT-PCR(第1轮PCR)的灵敏度仅与DAS-ELISA相同,为稀释102倍BlShV病叶提取液,当稀释倍数达103倍或更高时,两种方法均无法检测到BlShV。Nested PCR能够显著提高检测方法的灵敏度,可比普通RT-PCR方法高100倍以上,如宋震等[23]在柑橘碎叶病毒(Citrus tatterle virus,CTLV)一步法RT-PCR检测体系基础上建立的巢式RT-PCR检测方法,灵敏度比一步法RT-PCR至少提高100倍,检测模板总核酸最低浓度约1.27 μg·L-1;MORRIS等[24]建立的甜菜坏死黄脉病毒(Beet necrotic yellow vein virus,BNYVV)巢式RT-PCR,检测灵敏度比普通RT-PCR高103倍;闻伟刚等[25]报道的烟草环斑病毒(TRSV)和番茄环斑病毒(ToRSV)半巢式RT-PCR检测法也比普通RT-PCR提高103倍以上。本研究为提高IC-RT-PCR方法的检测灵敏度,在外侧引物对扩增区域内设计一对内侧引物,通过反应条件和程序优化,建立了IC-RT-nested PCR。经nested PCR,IC-RT-PCR的灵敏度提高了100倍,即通过第2轮PCR,灵敏度达到稀释104倍BlShV病叶提取液,这与前人报道的结果相吻合。
本研究建立的IC-RT-nested PCR快速检测技术具有较好的特异性和灵敏度,利用该技术对来自不同国家和地区的68份蓝莓叶片样品进行BlShV检测,检出的阳性样品及数量与普通RT-PCR方法验证的结果完全一致,表明该体系在实际检测应用中具有很强的可行性。然而,与普通RT-PCR检测相比,IC-RT-nested PCR虽然简化了操作步骤,但整个检测时间相对较长,特别是抗原需要包被较长时间才能进行RT-nested PCR,因此,在后期检测应用中,抗原的包被时间以及病毒粒体释放条件仍需进一步优化,以缩短检测时间,进一步提高检测效率。
4 结论
针对蓝莓上的蓝莓休克病毒(BlShV),建立了IC-RT-nested PCR快速检测技术。该技术特异性强、准确性好、灵敏度高,在蓝莓生产和进出境口岸上对BlShV的检测具有较好的应用价值,尤其是对低浓度病毒蓝莓样品的检测鉴定。The authors have declared that no competing interests exist.
