0 引言
【研究意义】鸭肠炎病毒(duck enteritis virus, DEV),又称鸭瘟病毒,属于疱疹病毒科,能引起鸭、鹅等雁形目禽类发生急性、热性、败血性的传染病。该病也称为鸭瘟,发病率和死亡率很高,对水禽养殖业危害很大[2]。【前人研究进展】1923年荷兰首次报道了该病。1957年,黄引贤在中国最早报道该病并分离到病毒[3-4]。目前预防鸭瘟的主要措施为疫苗免疫接种。常用的疫苗有鸡胚化弱毒活疫苗和灭活疫苗。疱疹病毒基因组很大,可表达外源基因作为活载体疫苗[5],如表达鸡传染性法氏囊病病毒VP2蛋白的重组火鸡疱疹病毒(HVT)活疫苗,免疫效果良好[6-8]。DEV基因组为158—162 kb[1, 9-13],宿主范围小,且具有良好的免疫原性,免疫成年鸭后第3天即可产生一定的免疫力,第4天就能抵抗强毒攻击(内部资料),因此是很有前景的水禽疫苗病毒载体。绿色荧光蛋白(green fluorescent protein, GFP)是20世纪90年代中期发展起来的一种报告分子,它是一个238氨基酸的蛋白质,在UV或蓝光激发下产生绿色荧光,可直接观察,被广泛应用于生物学研究[14-15]。【本研究切入点】本研究将GFP插入到DEV UL2基因中,构建出UL2基因缺失的转移载体,用脂质体转染的方法将其与DEV共转染鸡胚成纤维细胞(CEF),经8轮蚀斑筛选、纯化,获得了表达GFP的重组DEV,测定了其体外生长特性和免疫原性。【拟解决的关键问题】本研究旨在探究UL2基因对DEV生物特性的影响以及DEV作为载体表达外源基因的可行性,为DEV UL2基因功能、DEV活载体疫苗研究奠定了基础。1 材料与方法
1.1 试验时间、地点
试验于2014年6月至2015年7月在中国兽医药品监察所完成。1.2 试验材料
1.2.1 毒株和细胞 DEV细胞适应毒由中国兽医药品监察所病毒制品检测室保存;SPF鸡胚由北京梅里亚维通实验动物技术有限公司提供。按照文献[16]的方法制备CEF。1.2.2 质粒和菌株 含有GFP基因的载体pT-GFP-gpt由中国兽医药品监察所病毒制品检测室构建保存;pMD18T载体购自大连TaKaRa公司,DH5α受体菌购自天根生化科技(北京)有限公司。
1.2.3 主要试剂 Ex Taq DNA 聚合酶、限制性内切酶、T4 DNA 连接酶、T4 DNA 聚合酶购自大连TaKaRa公司;胶回收试剂盒等均购自天根生化科技(北京)有限公司;胎牛血清、M199培养液购自Hyclone公司;OPTI-MEM培养液购自Gibco公司;lipofectamine2000购自Invitrogen公司;无内毒素高纯质粒提取试剂盒Endo-free plasmid mini kit II购自Omega公司。
1.2.4 引物试验所用PCR引物见表1,由上海Invitrogen生物公司合成。
Table 1
表1
表1目的基因的扩增引物及鉴定引物
Table 1Primers for amplification and identification of target gene
| 引物名称 Primer name | 序列(5′-3′) Sequence(5′-3′) |
|---|---|
| DEV UL2-uF1 | GCGAATTCTGGCGGACTTGTGTAGTTTGC |
| DEV UL2-uR1 | GCGTCGACGGATCGCATGTAGACGTTGGT |
| DEV UL2-dF1 | ATGTCGACCGCTGGCGCACCACAAGG |
| DEV UL2-dR1 | GCAAGCTTCGAACCGCATTAGGCGACAA |
| ORFC17F | ATGGCCGACGATAGGCT |
| ORFC17R | TTATACTGTTCCACAAGG |
新窗口打开
1.3 试验方法
1.3.1 基因组DNA的提取 取DEV病毒液437.5μL,加入蛋白酶K(20mg·mL-1)12.5μL、10%SDS 50μL;56℃水浴1 h;分别用酚、酚﹕氯仿﹕异戊醇=25﹕24﹕1、氯仿各抽提1次;取上清,加入1/10体积3 mol·L-1醋酸钠和2倍体积的无水乙醇,-20℃放置30 min;12 000×g离心10 min,沉淀用70%乙醇洗涤1次,沉淀溶于30μL去离子水中,-20℃保存备用。1.3.2 重组质粒的构建 重组质粒pT-UL2-GFP构建策略见图1。以提取的DEV基因组DNA为模板,分别扩增UL2基因上下游两端同源臂UL2-u、UL2-d。将两同源臂片段分别克隆到pMD18T载体,测序正确后,再分别双酶切下UL2-u、UL2-d后连接,获得重组质粒pT-UL2ud。将重组质粒pT-UL2ud用SalI酶切,电泳回收去磷酸化后,与用SalI酶切的pT-GFP-gpt连接,将GFP-gpt表达盒插入到pT-UL2ud中,获得重组质粒pT-UL2-GFP-gpt。
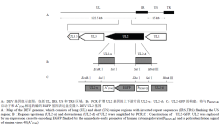 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1重组病毒的构建
-->Fig. 1Construction of recombinant DEV
-->
1.3.3 重组病毒的制备、纯化及鉴定 按说明书进行高纯度转移载体的提取。DEV接种CEF(moi=0.1),吸附1—2 h后,按Lipofectamine 2000说明书转染高纯质粒pT-UL2-GFP-gpt。转染后72—96 h,观察细胞病变情况,待80%细胞产生病变后,冻融3次,接种到新鲜CEF细胞单层的6孔培养板中,用含5%血清、1%双抗、1%琼脂的M199培养液覆盖,置5%CO2、37℃培养箱中培养72—96 h。观察荧光,挑取单个有绿色荧光的蚀斑,在细胞上重复多次传代,直至所有的蚀斑都带绿色荧光,确定为纯化的重组病毒。按1.3.1方法蛋白酶K-SDS方法提取重组病毒DNA,用鉴定引物ORFC17F、ORFC17R进行PCR扩增,PCR产物送上海Invitrogen生物公司测序。
1.3.4 一步生长曲线 将重组病毒及其亲本病毒分别接种25cm2的细胞瓶中(moi=0.01),接种后每隔12 h取出1瓶接毒细胞,分别收集上清和细胞,测量其病毒含量,绘制一步生长曲线。
1.3.5 重组病毒的稳定性 将重组病毒接种CEF(moi=0.01),待80%细胞产生病变后,冻融3次,再接种CEF,如此连续传代20次。荧光显微镜下观察每代重组病毒的绿色荧光表达情况。按1.3.1方法提取病毒DNA,用引物ORFC17F、ORFC17R进行PCR鉴定外源基因GFP是否稳定存在。
1.3.6 免疫原性测定 将15只4周龄SPF鸭,随机分成3组,每组5只。第1组肌肉注射rDEVΔUL2-GFP,每只103 TCID50,第2组肌肉注射DEV亲本毒,每只103 TCID50,第3组不免疫,作对照。每组单独隔离饲养。在免疫后14 d,腿部肌肉注射接种DEV强毒(CVCC AV1221),每只103MLD。观察10 d,每天记录发病死亡情况。
2 结果
2.1 重组质粒的构建及鉴定
2.1.1 同源臂的扩增 以DEV细胞适应毒基因组为模板,分别用上游引物DEV UL2-uF1、UL2-dF1,下游引物DEV UL2-uR1、UL2-dR1扩增,结果扩增出1.1kb左右片段(图2-A)和1.3kb左右片段(图2-B),这与理论值相符。PCR产物克隆到pMD18T载体,转化DH5α,分别获得了重组质粒pMD18T-UL2u和pMD18T-UL2d。测序结果表明,本试验扩增的片段序列与已发表序列同源性100%。2.1.2 重组质粒pT-UL2ud的酶切鉴定 用限制性内切酶SalI和HindIII双酶切鉴定重组质粒pT-UL2ud,得到3.8 kb和1.3 kb大小的两个片段(图2-C),符合理论值。
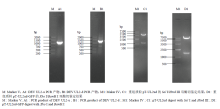 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2重组质粒的构建及酶切鉴定
-->Fig. 2Construction and identification of recombinant plasmid
-->
2.1.3 重组质粒pT-UL2-GFP-gpt的酶切鉴定 将重组质粒pT-UL2-GFP-gpt用限制性内切酶XhoI和BamH I双酶切鉴定,得到大小为5.6 kb和1.6 kb的两个片段(图2-D),符合预期。说明成功构建了含有GFP基因的缺失UL2的转移载体。
2.2 重组病毒的制备、纯化及鉴定
2.2.1 重组病毒的筛选 用Endo-free plasmid mini kit II试剂盒提取高纯度转移载体质粒pT-UL2- GFP-gpt,浓度为1 037µg·mL-1。将该转移质粒载体转染CEF细胞后8 h,即可见转染细胞中有带有绿色荧光的梭形细胞,说明质粒在细胞中瞬时表达。待80%细胞出现病变后,冻融3次,接种到新鲜CEF细胞单层的6孔培养板中,用含5%血清、1%双抗、1%琼脂的M199培养液覆盖,观察荧光,挑取单个有绿色荧光的蚀斑,再接到新的细胞上,经过8代筛选,所有的蚀斑都带绿色荧光,获得纯化的重组病毒。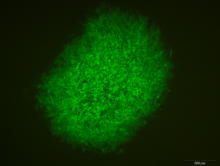 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3表达绿色荧光的重组DEV病毒
-->Fig. 3Recombinant DEV expressing the green flourescent protein
-->
2.2.2 重组病毒的鉴定 用特异性引物ORFC17F/ ORFC17R进行PCR扩增鉴定,得到大小为2 400 bp的片段(图4),和理论值相符。将PCR产物送上海Invitrogen生物公司测序,测序结果表明,GFP标记基因成功地插入到DEV基因组中,替换了DEV UL2基因的196—723位核苷酸。
2.3 一步生长曲线
绘制重组病毒及其亲本毒的一步生长曲线。结果表明,亲本毒接种CEF后36h,细胞样品的病毒含量达到峰值106.3TCID50/0.1mL,72 h上清样品病毒含量达峰值105.5TCID50/0.1mL。重组病毒细胞和上清的病毒含量分别在36和72 h达到峰值,为106.2TCID50/ 0.1mL、105.5TCID50/0.1mL,与亲本毒无明显差异(图5)。表明UL2的缺失对DEV的复制没有明显影响,缺失后培养病毒的滴度几乎无变化。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4重组病毒的鉴定
-->Fig. 4Identification of the recombinant DEV
-->
2.4 重组病毒的传代稳定性
重组病毒经过传代20次,观察绿色荧光在1—5代可以稳定表达,从第6代开始绿色荧光病变细胞开始减少,可观察到少量没有荧光的细胞病变,15—20代只有很少量的带有绿色荧光的细胞病变,绝大部分细胞病变无绿色荧光(图6)。对重组病毒的GPF基因进行PCR、测序,第5代PCR产物大小约2 200 bp,而第20代PCR产物只有800 bp左右。对第20代重组病毒PCR产物进行测序,发现第20代重组病毒从CMV启动子的101bp至gpt的前208 bp共缺失1 456 bp,包括了GFP基因整个开放阅读框、部分启动子和部分gpt基因。2.5 重组病毒免疫原性
重组病毒rDEVΔUL2-GFP及其亲本毒免疫SPF鸭后14d,均能100%抵抗DEV强毒攻击(表2),表明UL2基因缺失后不影响DEV的免疫原性。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5重组病毒的一步生长曲线
-->Fig. 5One step growth curve of recombinant DEV in CEF
-->
Table 2
表2
表2免疫后的攻毒保护效力
Table 2Protective efficacy against lethal challenge post-inoculation
| 组别 Groups | 毒株 Strains | 剂量 Dose | DEV攻毒后每天死亡鸭数 Numbers of dead ducks per day after DEV attract | 累计 Accumulative total | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 死亡 Dead | 保护率 Protected ratio | |||
| 第1组 Group 1 | rDEVΔUL2-GFP | 103TCID50 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0/5 | 100% |
| 第2组 Group 2 | 亲本毒 Parental virus | 103TCID50 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0/5 | 100% |
| 第3组 Group 3 | 对照组 Control | / | 0 | 0 | 0 | 2 | 2 | 1 | / | / | / | / | 5/5 | 0% |
新窗口打开
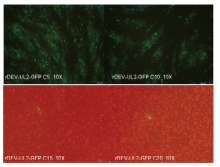 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6重组病毒的传代稳定性检测
-->Fig. 6Identification of stability of the recombinant DEV
-->
3 讨论
本研究通过同源重组将绿色荧光蛋白GFP插入鸭瘟病毒UL2基因,筛选并纯化了表达绿色荧光蛋白的UL2基因功能缺失的重组鸭瘟病毒,并对其生物学特性进行初步研究。表明该重组病毒的生长特性与亲本毒相似,且可以在CEF上稳定传代5次。人单纯疱疹病毒1型(HSV-1)UL2基因编码了尿嘧啶DNA糖基化酶(uracil DNA glycosylase,UNG),UNG是一种普遍存在的极为保守的DNA修复酶,它能将复制过程中dUTP错误插入DNA或是胞嘧啶的脱氨基造成的尿嘧啶残基切除,保证DNA修复的正确性和顺利进行[17-18]。有研究表明,因为培养细胞本身可以提供UNG,因此UL2对HSV-1在细胞培养中的正常复制是非必需的,而在神经系统组织细胞中UNG活性很低甚至无,因而UL2对病毒在神经元中的复制有重要作用;缺失UL2的HSV-1突变体,小鼠颅内直接接种后,其神经毒力比亲本毒低10倍,而外周途径接种后神经毒力低100 000倍[19]。DEV UL2基因是否具有HSV-1相似功能,目前尚未见报道,有待进一步研究。DEV强毒株UL2位于114 943—115 944位核苷酸,全长1 002 bp,共编码333aa,而DEV弱毒Kp63株的UL2基因在195 bp后连续缺失528 bp导致65位氨基酸后缺失176aa[1]。本研究通过同源重组方法,将GFP基因表达盒替换DEV强毒株UL2基因的528 bp,获得了表达绿色荧光蛋白的重组DEV,为研究DEV UL2基因功能、DEV活载体疫苗奠定基础。
构建重组病毒时,常用的报告基因有β-半乳糖苷酶基因、二氢叶酸还原酶基因、氯霉素乙酰转移酶基因、绿色荧光蛋白(GFP)等,这些报告基因各有优缺点[20]。本研究选取比GFP更适合在动物细胞上表达的EGFP和大肠杆菌的黄嘌呤鸟嘌呤磷酸转移酶(gpt)基因作为双报告基因,提高了重组病毒筛选的效率。然而,本研究发现,GFP在DEV中不稳定,随着传代次数的增多,GFP会发生点突变或缺失。GFP在其他病毒中也出现了类似结果 [21-23],这给重组病毒的反向筛选带来了不小难度,本研究结果提示,GFP作为重组DEV的报告基因,应尽量减少传代次数,控制在5代内。
4 结论
4.1
本研究应用同源重组技术,将GFP-gpt表达盒插入到UL2基因,成功构建了一株表达绿色荧光蛋白的重组DEV,并对重组病毒的生物学特性进行了初步研究。4.2
重组病毒的免疫原性和生长特性都与亲本毒相似,表明UL2基因的缺失对DEV的复制无明显影响,首次证明UL2对DEV在细胞中的复制是非必需的,而且UL2缺失后不影响DEV的免疫原性,是一个比较稳定的外源基因插入位点。The authors have declared that no competing interests exist.
