0 引言
【研究意义】鸭瘟(duck plague,DP)是由鸭瘟病毒(duck plague virus,DPV)引起的一种急性、败血性传染病[1],以头颈肿胀、食道黏膜和泄殖腔黏膜出血、头颈部皮下有淡黄色胶冻样渗出为特征。该病一旦发生,发病急、死亡快、死亡率高,对养鸭业危害严重。快速诊断是控制鸭瘟的重要措施之一,可以及时确定病原,以便采取有效防制手段。【前人研究进展】目前已建立了PCR、ELISA、间接免疫荧光技术、微量中和试验等检测鸭瘟的方法[2],但上述检测方法均需特殊的仪器设备,且耗时长,不适于在基层推广应用。胶体金免疫层析技术是近年来发展起来的集胶体金标记技术、蛋白层析技术于一体的新型快速免疫检测技术[3-4]。该技术操作简便、耗时短,不需要特殊的仪器设备[5-6],特别适合在基层推广应用[7-8]。【本研究切入点】鸭瘟对养鸭业危害严重,目前已建立了PCR、ELISA、间接免疫荧光技术、微量中和试验等检测鸭瘟的方法,但上述检测方法均需特殊的仪器设备,且耗时长,不适于在基层推广应用。胶体金免疫层析技术是近年来发展起来的集胶体金标记技术、蛋白层析技术于一体的新型快速免疫检测技术。该技术操作简便、耗时短,不需要特殊的仪器设备,特别适合在基层推广应用。且目前关于鸭瘟病毒胶体金试纸条检测方法的研究尚未见报道,本研究意义较大。【拟解决的关键问题】原核表达DPV-gB蛋白,制备抗DPV-gB蛋白单克隆抗体,从中选取2株单抗分别用于胶体金的标记及检测线的包被,采用柠檬酸三钠还原法制备胶体金颗粒,建立鸭瘟病毒胶体金试纸条检测方法。1 材料与方法
1.1 材料
1.1.1 毒株、细胞株和试验动物 鸭瘟病毒(SD-Y)、鸭呼肠孤病毒(DRV)、减蛋综合征病毒(EDS-76V)、H9亚型禽流感病毒(AIV-H9N2)、坦布苏病毒(TMUV)由山东农业大学禽病学研究室分离并保存。SP2/0骨髓瘤细胞由山东农业大学禽病学研究室保存;6~8周龄SPF级BALB/c雌性小鼠购自山东省实验动物中心。1.1.2 主要试剂 原核表达载体 pET-28a、大肠杆菌DH5α和Rosetta由山东农业大学禽病学研究室保存;DNA 凝胶回收试剂盒、T4 DNA连接酶、IPTG、pMD18-T 载体等购自宝生物工程(大连)有限公司;弗氏完全佐剂、弗氏不完全佐剂、HAT、HT、PEG4000购自Sigma公司;HRP标记的羊抗鼠IgG、HRP标记的羊抗鸭IgG、FITC标记的羊抗鼠IgG、DMEM培养基、胎牛血清购自全式金生物技术(北京)有限公司;Rapid Mouse Isotyping Kit-Gold Series购自RayBiotech;氯金酸(HAuCl4·3H2O)、二氯二甲基硅烷、正辛酸购自Aladdin公司;牛血清白蛋白(BSA)购自北京索莱宝科技有限公司;胶体金卡式套装系列购自上海杰一生物技术有限公司;超敏性辣根过氧化物酶DAB显色试剂盒购自上海生工生物工程股份有限公司。其他试剂均为分析纯。
1.1.3 试验时间与地点 2012年10月至2015年3月在山东农业大学禽病学研究室完成。
1.2 DPV-gB蛋白的制备及纯化
根据GenBank发表的DPV gB基因序列,设计一对引物,上游为gB-f :5′-CCGGAATTCTGGGATTG GATGCCTAA-3′,含有EcoR1酶切位点;下游为gB-r:5′-CCGCTCGAGTATTGTACCGCCGTCTTT-3′,含有XhoL1酶切位点,PCR扩增gB,回收目的基因,将其连接到pMD-18T载体上,鉴定正确后再经双酶切、与pET-28a载体连接,构建重组质粒pET-28a-gB。将重组质粒pET-28a-gB转化入Rosetta感受态细胞,加入IPTG诱导表达gB蛋白。按文献[9]介绍的方法纯化表达的蛋白,并进行SDS-PAGE及Western blotting分析。
1.3 DPV-gB蛋白单抗的制备
按照常规方法进行动物免疫[10]。三免后14 d,尾静脉采血,间接ELISA测定血清效价。选择效价最高的小鼠进行加强免疫,采用gB蛋白腹腔注射,80 μg/只。注射后第3天,进行细胞融合。按照常规方法进行细胞融合[11]。采用间接ELISA对杂交瘤细胞上清进行筛选。阳性孔再经过3次有限稀释法进行亚克隆[12],待阳性率达到100%时扩大培养,用于制备腹水,并保存于液氮。参照文献[13]进行腹水的制备,待小鼠腹部膨大后抽取腹水,离心取上清。
1.4 单抗的鉴定
1.4.1 单抗的纯化及亚类的鉴定 将制备的腹水从1﹕100开始做倍比稀释,采用间接ELISA方法检测腹水效价。利用HiTrapTMProtein G 亲和层析柱纯化腹水,进行SDS-PAGE电泳分析;同时利用紫外分光光度法测定260 nm和280 nm的吸光值A260和A280,按照蛋白质浓度=1.45×A280-0.74×A260公式计算抗体浓度。按照Rapid Mouse Isotyping Kit-Gold Series说明书对单抗的亚类进行鉴定。
1.4.2 Western blotting 鉴定 将纯化的gB蛋白和含 pET28a 空质粒的菌体蛋白进行 SDS-PAGE 电泳后,转印至硝酸纤维素膜上,5%脱脂乳封闭过夜,以阳性单克隆细胞上清为一抗,二抗为 HRP 标记的羊抗鼠IgG(1﹕5 000稀释),DAB 试剂盒显色,进行Western blotting鉴定[14]。
1.4.3 间接免疫荧光(IFA)鉴定 按照常规方法[15]制备鸭胚成纤维细胞(DEF),传代后将其转到24孔细胞培养板上继续培养。待细胞长成单层,且面积为底部面积的70 %—80 %时,用DPV感染DEF细胞,同时设空白对照。待出现细胞病变后,用丙酮与甲醇按照1﹕1的体积比进行固定,以鉴定为阳性的杂交瘤细胞上清为一抗,二抗为FITC标记的羊抗鼠IgG抗体(1﹕200稀释),荧光显微镜下观察结果。
1.4.4 单抗的特异性 分别用DPV、TMUV、AIV- H9N2、EDS-76V、DRV作为抗原包被酶标板,一抗为杂交瘤细胞上清液,二抗为HRP标记的羊抗鼠IgG(1﹕5 000稀释),利用间接ELISA方法检测单克隆抗体细胞上清。
1.4.5 单抗的稳定性 在杂交瘤细胞冻存3个月、6个月时,取出冻存的细胞进行复苏,并对细胞培养上清进行间接ELISA检测,以检测阳性杂交瘤细胞的稳定性。
1.5 胶体金试纸条的研制
1.5.1 标记条件的确定 利用棋盘法[16-17]将溶液的pH分别调为6.5、7.0、7.5、8.0、8.5、9.0、9.5和10.0,以确定胶体金标记抗体的最适pH;用0.01 mol·L-1 PB(pH 7.0)将单抗按照1 mL胶体金标记抗体的量分别为30、35、40、45、50、55和60 μg,以确定抗体最适标记量。1.5.2 胶体金探针的制备 采用柠檬酸三钠还原法[18-19]制备粒径约为30 nm的胶体金颗粒,以制备的一株单克隆抗体H6F6标记胶体金,采用差速离心法[20]对胶体金探针进行纯化。
1.5.3 试纸条的组装 将制备的另一株单克隆抗体A8D7和羊抗鼠IgG包被于硝酸纤维素膜(NC膜)上,分别作为检测线和质控线,按照胶体金试纸条常规构造,在PVC底板上按照NC膜、金标垫、样品垫和吸水垫的顺序粘贴[21],组装试纸条,优化反应条件,于4℃保存备用。
1.6 试纸条性能的评价
1.6.1 特异性试验 用制备的胶体金试纸条分别检测DPV、TMUV、AIV- H9N2、EDS-76V、DRV,观察是否出现交叉反应。1.6.2 敏感性试验 将半数致死量为10-4.33的DPV阳性尿囊液分别按照1﹕10、1﹕50、1﹕100、1﹕200、1﹕500稀释,观察试纸条检测结果。
1.6.3 重复性试验 用前后制备的3个批次的试纸条对阳性鸭瘟病毒尿囊液进行检测,验证试纸条检测结果的重复性。
1.6.4 稳定性试验 每隔一个月用保存的试纸条对阳性鸭瘟病毒尿囊液进行检测,观察其检测结果是否稳定。
1.6.5 试纸条的初步应用 对实验室保存的24份疑似感染鸭瘟病毒的临床样品和14份阳性尿囊液分别进行试纸条和PCR检测,验证二者的符合率。
2 结果
2.1 DPV-gB蛋白单抗的制备
2.1.1 重组质粒的构建及鉴定 PCR扩增gB基因后进行凝胶电泳,结果显示,在915 bp处可见到特异性条带(图1)。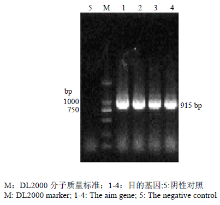 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1重组表达载体的PCR鉴定
-->Fig. 1The PCR identification of recombinant expression vector
-->
2.1.2 gB蛋白的纯化与鉴定 将表达及纯化后的蛋白经 SDS-PAGE 电泳后,转印到NC膜上,用鸭瘟阳性血清进行 Western blotting 鉴定。结果显示,表达的蛋白在约34kD处可见特异性条带,而菌体蛋白无条带(图2)。
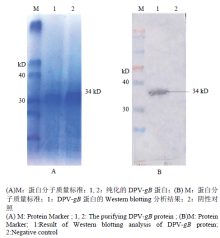 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2诱导表达DPV-gB蛋白SDS-PAGE及Western blotting 分析
-->Fig. 2SDS-PAGE(A)and Western blotting(B)analysis of DPV-gB protein
-->
2.1.3 阳性杂交瘤细胞的筛选 细胞融合后观察,细胞融合率达90%以上,经间接ELISA检测及有限稀释法克隆至阳性率达100%,共获得4株稳定分泌抗gB蛋白的杂交瘤细胞株,分别命名为A8D7,E6C3,H11F8,H6F6。
2.1.4 单抗效价的测定 间接ELISA方法测定腹水的效价分别为A8D7(1﹕103)、E6C3(1﹕103)、H11F8(1﹕105)、H6F6(1﹕103)。
2.1.5 单抗的纯化及浓度测定 利用HiTrapTM Protein G 亲和层析柱对准备试验的两株腹水进行纯化,SDS-PAGE蛋白质电泳结果显示,纯化的单抗有两条明显的重链和轻链,效果较好(图3)。
同时,利用紫外分光光度法计算4株单抗的浓度分别为:A8D7(2.0 mg·mL-1)、E6C3(1.8 mg·mL-1)、H11F8(1.65 mg·mL-1)、H6F6(1.93 mg·mL-1)
2.1.6 单抗亚类的鉴定 获得的4株单抗经亚类鉴定分别为:A8D7(IgG2b)、E6C3(IgG2a)、H11F8 (IgG2b)、H6F6(IgG1),轻链均为kappa链。
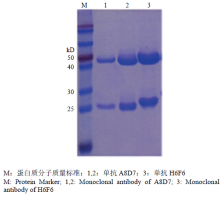 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3单抗的纯化
-->Fig. 3Purification of monoclonal antibodies
-->
2.1.7 Western blotting 鉴定 4株单抗均可特异性识别gB蛋白,在约34kD处出现特异性条带,而不与含空质粒表达的菌体蛋白反应(图4)。
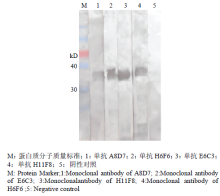 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图44株单抗的Western blotting 分析
-->Fig. 4Western blotting analysis of four monoclonal antibodies
-->
2.1.8 IFA鉴定结果 DPV感染DEF细胞,出现病变后,对4株单抗进行IFA检测,结果显示,4株单抗均可显现特异性的绿色荧光,未感染的细胞未显现绿色荧光(图5)。
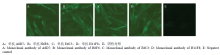 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5单抗与感染的DPV的DEF细胞的IFA试验
-->Fig. 5The indirect immunofluorescence assay of DPV in DEF cells with the four monoclonal antibodies
-->
2.1.9 单抗的特异性 利用间接ELISA方法用DPV、TMUV、AIV- H9N2、EDS-76V、DRV对杂交瘤细胞上清进行检测。结果表明,本试验制备的单抗仅与DPV反应,与TMUV、AIV- H9N2、EDS-76V、DRV不发生反应。
2.1.10 单抗的稳定性 在杂交瘤细胞冻存后3个月,6个月时,取出冻存的细胞进行复苏,并对细胞培养上清进行间接ELISA检测。结果表明,冻存后的杂交瘤细胞仍能稳定的分泌抗体。
2.2 胶体金试纸条的制备
2.2.1 胶体金溶液的制备 制备的胶体金溶液肉眼观察为酒红色或偏紫红色,液面上无油状物质。在日光下观察,溶液为均匀的介质,颜色清亮,静置后底部无杂质,无死金现象。2.2.2 胶体金标记条件的确定 当pH为8.0—8.5、1 mL胶体金溶液中单抗标记量为50 μg时,胶体金溶液稳定,保持红色不变。由此确定胶体金标记单抗的最适pH为8.0—8.5,单抗的最佳标记量为50 μg·mL-1。
2.3 试纸条性能的评价
2.3.1 特异性试验 用胶体金试纸条分别检测DPV、TMUV、AIV- H9N2、EDS-76V、DRV,该试纸条仅与DPV反应,与其他病毒不发生反应(图6)。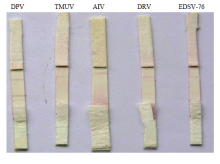 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6特异性检测
-->Fig. 6Detection of specificity
-->
2.3.2 敏感性试验 敏感性试验结果显示,半数致死量为10-4.33的DPV阳性尿囊液稀释50倍后仍能用试纸条检测出来(图7)。
2.3.3 重复性试验 用不同批次的试纸条对DPV尿囊液进行检测,结果无明显差异,表明该试纸条具有较好的重复性。
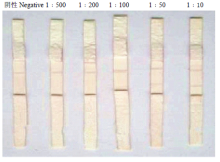 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7敏感性检测
-->Fig. 7Detection of sensitivity
-->
2.3.4 稳定性试验 稳定性试验结果显示,研制的试纸条4℃保存5个月、室温下保存3个月后依然有效。
2.3.5 试纸条的初步应用 用制备的胶体金免疫层析试纸条对实验室保存的24份疑似感染鸭瘟病毒的临床样品和14份阳性尿囊液进行检测,同时做PCR对照检测,检测结果表明,其中21份临床样品及12份尿囊液可在1—5min内得出检测结果;PCR可检测出22份临床样品及14份尿囊液(表1);二者符合率为91.6 %,适用于DPV的快速检测与筛选。
Table 1
表1
表1比较试验结果
Table 1Comparative experiment of the result
| 样品来源 Sample source | 份数 Copies | 胶体金检测阳性结果 The positive result by test strip | PCR检测阳性结果 The positive result by PCR |
|---|---|---|---|
| 临床样品病料 Clinical sample | 24 | 21 | 22 |
| 阳性尿囊液 Positive allantoic fluid | 14 | 12 | 14 |
| 阳性检出率 Positive detection rate(%) | 86.8 | 94.7 | |
| 两者符合率 Coincidence rate(%) | 91.6 |
新窗口打开
3 讨论
3.1
gB蛋白是鸭瘟病毒最为保守的囊膜蛋白之一,在促进病毒吸附细胞及在细胞间的扩散,诱导机体产生中和抗体,介导体液免疫和细胞免疫应答等方面发挥重要作用,具有良好的免疫原性及免疫保护性[22]。本研究采用原核表达系统Rosetta E. coli,表达了鸭瘟病毒gB蛋白,原核表达系统相对于真核表达系统具有成本低、操作简便、表达量高等优点,省去了传统方法中的繁琐步骤,可大大节省时间。单克隆抗体具有高度均一、生物活性单一和与抗原结合特异性强等优点[23],可以为建立更加快速、特异性强的检测方法提供有利的工具。本研究利用表达的gB蛋白免疫小鼠制备的单抗,检测结果显示,仅与鸭瘟病毒反应,而与其他病毒不发生反应,表明制备的单抗具有较高的特异性。3.2
多种因素会影响胶体金标记的效果,如胶体金颗粒的大小、标记蛋白的浓度、溶液的pH值以及所用容器的纯净程度等[24-25]。胶体金颗粒的大小与制备胶体金反应的时间及所用容器的洁净度有较大关系。反应时间小于5 min时,氯金酸还原不彻底,胶体金颗粒大小不一;反应时间超过10 min时,胶体金溶液容易形成大的颗粒甚至沉淀。同时,进入胶体金溶液内的污物都会干扰胶体金颗粒的生成或使生成的胶体金出现聚积现象。所以,反应时间一般控制在5—10min,容器最好经酸洗和硅化处理。溶液的pH可影响胶体金与单抗的结合效率,pH接近和稍高于蛋白质的等电点时,胶体金蛋白质的吸附力最强。pH偏低破坏胶体金表面静电荷,易导致胶体金发生自身聚合,出现变色,静置后有肉眼可见的颗粒性沉淀;pH偏高时,金粒子与单抗间作用力不足,结合蛋白量少,试纸条检测显色明显减弱,灵敏度降低。胶体金溶液与被标蛋白的用量是否合适也是影响标记成功的一个重要因素。蛋白浓度过高,造成浪费的同时引起试纸的拖带现象;蛋白浓度过低,导致胶体金标记不完全,从而降低试纸条的灵敏度及假阳性现象的出现。本研究采用柠檬酸三钠还原法制备胶体金溶液,通过条件优化,以反应时间为5 min、单抗标记量为50 μg·mL-1、溶液的pH为8.0—8.5时获得了较好的标记效果。3.3
对鸭瘟病料及阳性尿囊液检测结果显示,胶体金试纸条检测方法与PCR方法的阳性符合率为91.6 %,胶体金试纸条的检出率稍低于PCR法,但胶体金试纸条检测方法具有检测速度快,在10 min左右即可得到检测结果;无需特殊仪器设备;操作简单,便于基层临床检测等优点。4 结论
本研究制备的DPV-gB蛋白单克隆抗体,特异、稳定。以此为基础建立的DPV胶体金检测方法,特异性强、敏感性高、重复性好,可用于鸭瘟的临床快速诊断。The authors have declared that no competing interests exist.
