0 引言
【研究意义】至2050年,世界人口将新增2.3亿,食物增加70%才能满足需求,然而食物需求量并不与粮食的增加成正比,人口的快速增长与粮食短缺的矛盾日益加重[1]。同时,人类过渡开发利用自然资源,不仅引起严重的生态和环境问题,而且造成作物产量大幅度下降。在各种非生物逆境中,盐碱胁迫成为制约粮食生产和影响粮食安全的最重要的限制因素[2]。据不完全统计,目前,全世界盐碱地面积占总陆地面积的6%和灌溉农用地面积的20%,预计到2050年,将会有超过50%的耕地会变得盐碱化[1]。【前人研究进展】土壤所含致害盐类除了以NaCl和Na2SO3为主的盐土以外,还有NaHCO3和Na2CO3为主的碱土,盐土和碱土往往同时存在,而且面积日益扩大[3]。碱土中主要致害离子为Na+、Cl-、HCO3-和CO32-,这些离子对植物的危害除了包括直接的胁迫效应外,还包括这些离子间复杂的相互作用[3-4]。另外,碱土的pH高达9以上[5]。近年来,有关植物抗碱方面的研究越来越受到关注,YANG等 [6]模拟不同碱胁迫条件研究小麦体内的pH及离子平衡,表明碱胁迫下小麦茎叶内的pH稳定不变,有机酸积累是小麦体内保持离子平衡和pH稳定的关键生理响应。贾娜尔·阿汗等[7]研究认为碱地肤耐碱性强在400 mmol·L-1的碱胁迫下仍能存活并维持一定的生长。赵楠等 [8]研究发现碱蓬种子萌发及幼苗生长均随着碱胁迫浓度升高而降低。【本研究切入点】目前,这些研究主要涉及碱胁迫下植物的生态适应、生理响应、表观遗传学等方面,但很少涉及植物抗碱生理和分子机制,以及碱胁迫下植物代谢网络调控应答机制。【拟解决的关键问题】本研究以普通小麦(Triticum aestivum Linn)为研究对象,依据碱土盐分组成特点,以NaHCO3和Na2CO3模拟碱性盐,对碱胁迫下小麦叶片生长、光合生理特性及相关代谢物进行测量,绘制小麦叶片代谢网络通路,探讨小麦叶片对碱胁迫响应的生理代谢调控机制,以期为耐盐、耐碱小麦品种的筛选、鉴别及利用提供理论依据。1 材料与方法
1.1 试验材料和模拟胁迫
1.1.1 试验材料 冬小麦品种:石家庄8号。1.1.2 模拟胁迫 依据中国内陆碱性土壤特点,选取2种碱性盐NaHCO3和Na2CO3按摩尔比1﹕1混合模拟碱胁迫。利用DDG-2080-S电导仪、美国Wescor Psypro露点水势仪和PHS-3C型数字pH计测定处理液的电导率、渗透势和pH(表1)。
Table 1
表1
表1不同盐浓度处理液电导率、渗透势和pH
Table 1The electrical conductivity (EC), osmotic potential and pH of salinity stress treatment solutions
| 处理Treatment | 盐度Salinity (mmol·L-1) | 电导率EC (dS·m-1) | 渗透势Osmotic potential (MPa) | pH |
|---|---|---|---|---|
| 对照 CK | 0 | 2.16 | -0.05 | 6.95 |
| 碱胁迫 AS | 50 | 4.98 | -0.28 | 9.69 |
| 100 | 9.21 | -0.51 | 9.92 |
新窗口打开
1.2 材料培养
采用盆栽试验,塑料花盆直径18 cm,高12 cm,底直径11 cm,每盆装2.5 kg洗净的细砂,挑选饱满的种子播种,每盆播种10粒。出苗后每盆定苗5株,每天用1倍Hoagland营养液进行浇灌。幼苗生长4周之后,选取长势均匀的20盆分成4组。一组作为胁迫前的基础生物量,一组作为对照组,其余两组作为处理组。对照组只浇灌Hoagland营养液,处理组按照模拟不同盐浓度胁迫对小麦进行连续12 d处理。整个试验在温室内进行,白天温度设定在(25±1)℃,夜间温度设定在(19±1)℃,温室内光照均匀,每日光照时间为15 h。处理结束时,用蒸馏水洗净全株, 并用吸水纸吸去附着的水分,将叶片与茎分离,称取叶片鲜重(fresh weight,FW)并记录。称取少量鲜样用于测定代谢物。然后将样品置于105℃烘箱内杀青15 min处理,杀青后转置80℃的真空干燥器内干燥至恒重,然后测定干重(dry weight,DW)。
1.3 生理指标测定
1.3.1 生长和光合特性指标测定 叶片相对生长率(relative growth rate,RGR)=(ln碱胁迫后干重- ln碱胁迫前干重)/处理天数;叶片含水量(absolute water content,AWC)=(鲜质量-干质量)/鲜质量[9]。光合特性:连续12 d处理后利用LI-6400XT(Li- Cor, USA)便携式光合仪对完全展开的叶片进行净光合速率(net photosynthetic rate,Pn)、气孔导度(stomatal conductance,Gs)、胞间二氧化碳浓度(intercellular CO2 concentration,Ci)和蒸腾速率(transpiration rate,E)的测定,测定时间为早上9:00—11:00,光量子通量设定为1 200 μmol·m-2 ·s-1,每个处理测定3个叶片。
荧光特性:待光合特性测量完毕后,利用IMAGING-PAM(Walz, Effeltrich, Germany)荧光仪测定叶绿素荧光参数:PSII原初光能转换效率(Fv /Fm)、PSII电子传递量子效率(ΦPSⅡ)、光化学淬灭系数(qP)值。测定前,叶片暗适应20 min,每个处理测定3个叶片,所有操作均在背景光强低于1 μmol·m-2·s-1的环境中进行。仪器的饱和脉冲光的强度为2 400 μmol·m-2·s-1,测量光低于0.5 μmol·m-2·s-1[10]。
叶绿素含量:待荧光测量完毕后,将叶片采下洗净磨碎,称取样品0.1 g,用1﹕1的丙酮和无水乙醇作为萃取液进行萃取。在波长440、645和663 nm下测定吸光度OD值,应用以下计算公式[11]:叶绿素a(Chl a)= 9.784×OD663-0.99×OD 645;叶绿素b(Chl b)= 21.426×OD 663-4.65×OD 645;类胡萝卜素(Car)=4.7×OD440-0.27×(20.2×OD645+ 8.02× OD 663)。
1.3.2 阳离子和阴离子含量的测定 应用美国戴安DX-300离子色谱仪(AS4A-SC色谱柱和CDM-Ⅱ电导检测器),以Na2CO3/NaHCO3 = 1.7/1.8 mmol·L-1的混合溶液作为流动相,对叶片中游离阳离子(K+、Na+、Ca2+、Mg2+、Cu2+、Fe2+、Zn2+)和阴离子(NO3-、Cl-、SO42-、H2PO4-)含量进行测定。
1.3.3 代谢物检测和筛选的测定 萃取衍生化:取100 mg小麦叶片样本于2 mL离心管里,加入60 μL核糖醇漩涡混匀;再加入0.35 mL甲醇漩涡混匀。70 Hz 5 min研磨仪处理,70℃烘箱10 min;紧接着将样本离心10 min(4℃,12 000 r/min);移取0.35 mL上清液于2 mL进样瓶。利用真空浓缩器干燥提取物(45℃,1.5 h);干燥后加入80 μL甲氧胺盐试剂,均匀混合后放入烘箱中孵育(37℃,2 h);向每个样品中迅速加入100 μL衍生化试剂N,O-双三甲基硅基三氟乙酰胺Bis(trimethylsilyl)trifluoroacetamide(BSTFA)+ 1%三甲基氯硅烷(trimethylchlorosilane,TCMS),将混合物70℃反应1 h,冷却至室温[12]。
上机检测:利用质谱联机(GC-MS)进行上机检测。检测条件:DN-5MS毛细管柱(30 m×250 μm×0.25 μm,J &W Scientific,Folsom,CA,USA);进样量1 μL;载气:氦气;前进样口吹扫流速:3 mL·min-1;流速:1 mL·min-1;柱温:初始温度90℃保持15 s,以10℃·min-1升至180℃·min-1,再以5℃·min-1升至240℃·min-1,再以20℃·min-1继续升至285℃·min-1保持11.5 min。前进样口温度,传输线温度和离子源温度分别为280、245和220℃。电离电压:-70 eV;扫描方式(全扫描):20—600 m·z-1;扫描速度:100 spectra·s-1;溶剂延迟:492 s。
定性定量:应用Chroma TOF4.3X软件和LECO- Fiehn Rtx5数据库(LECO公司,USA)对通过GC-MS测量得到的数据进行定性和定量分析,使用内标标准化法处理导出的数据,内标物为核糖醇(纯度≥99%)。
1.4 数据分析
生长、光合特性和阴阳离子数据处理及方差分析均用统计学程序SPSS17.0完成。每个数据均是5次重复的平均值及其标准误差(S.E)表示,P<0.05被视为显著性差异。在代谢物分析中,首先采用主成分分析(principal components analysis,PCA)对数据进行分析,观察样本分布和异常值,继而应用正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis)进一步分析两组间区分贡献显著的代谢物。根据相似度>700、VIP(variable importance in the projection)>1。2 结果
2.1 碱胁迫对小麦生长和光合特性的影响
碱胁迫下小麦叶片RGR随盐浓度增加而下降,当盐浓度大于50 mmol·L-1后下降幅度增强;AWC变化趋势和RGR基本相同(图1-A和图1-B,P<0.05)。与对照相比,碱胁迫使小麦叶片光合作用受到抑制,其光合作用参数Pn、Gs、Ci和E下降明显,且下降幅度随盐浓度增加而加强(图1-C、图1-D、图1-E和图1-F,P<0.05)。碱胁迫下叶绿素a含量随盐浓度增加而下降,而叶绿素b含量只有在高盐度时下降明显,碱胁迫没有影响类胡萝卜素含量变化(图1-G、图1-H和图1-I,P<0.05)。碱胁迫下Fv/Fm、ΦPSⅡ和qP下降明显,表明PSII反应中心利用光能的效率和潜在活性受到显著影响(图1-J、图1-K和图1-L,P<0.05)。2.2 碱胁迫对小麦叶片离子平衡的影响
如表2所示,小麦叶片中Na+含量随盐浓度增加呈现上升趋势,碱胁迫下叶片中K+含量低于对照组,但随盐浓度的增加,含量变化不大(表2,P<0.05)。Ca2+和Mg2+含量变化趋势相似,含量随盐浓度增加下降趋势加强(表2,P<0.05)。与其他阳离子相比,Fe2+和Cu2+含量相对较低,Fe2+含量随盐浓度增加呈现下降趋势,对照组中Cu2+含量明显高于碱胁迫,中低胁迫(50 mmol·L-1)下与重度胁迫(100 mmol·L-1)没有统计学上的差异(表2,P<0.05)。随着盐浓度的增加,叶片中大部分的阴离子含量呈现下降的趋势,包括Cl-、NO3-和H2PO4-含量;SO42-含量基本保持不变(表2,P<0.05)。2.3 碱胁迫下小麦叶片代谢组变化轨迹
利用GC-MS技术检测小麦叶片对碱胁迫生理代谢响应过程,主成分分析(PCA)得分图显示,全部样本均分布在95%置信区间的Hotelling T2 ellipsehr椭圆形内,2个主成分得分为88.6%,不仅表明对照组与处理组有明显差异,而且不同盐浓度处理样品分别聚为不同簇(图2-A)。利用OPLS-DA进一步分析对照组与处理组GC-MS数据,R2和Q2分别代表模型的拟合度和预测能力。结果显示,不同盐浓度处理的小麦与对照组间明显分开,各模型的拟合度和预测值均表明这些模型的可靠性,表明对照组和碱胁迫组小麦叶片代谢物发生了显著性变化(图2-B、图2-C和图2-D)。Table 2
表2
表2碱胁迫对小麦叶片干物质中阳离子和阴离子含量的影响(平均值±标准误差,n = 5)
Table 2Effects of alkaline stress on the contents of free cation and anion in the dry mass of leaves of wheat seedlings (mean ± SE, n = 5)
| 处理 Treatment | 盐度 Salinity (mmol·g-1) | 离子平衡 Ionic balance (μmol·g-1 DW) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Na+ | K+ | Ca2+ | Mg2+ | Fe2+ | Cu2+ | Cl- | NO3- | H2PO4- | SO42- | ||
| 对照 Control | 0 | 46.56± 5.93c | 2526.73± 9.97 a | 102.96± 2.84 a | 99.65± 2.32 a | 5.27± 0.71 a | 0.25± 0.01 a | 329.12± 7.67 a | 688.39± 39.60 a | 191.22± 10.18 a | 88.56± 8.07 a |
| 碱胁迫 Alkaline stress | 50 | 420.13± 5.39b | 1856.92± 39.69 b | 90.71± 3.17 ab | 86.60± 1.43 ab | 4.06± 0.44 b | 0.12± 0.01 b | 296.72± 12.67 ab | 475.62± 55.97 b | 102.06± 8.63b | 93.77± 8.66 a |
| 100 | 838.09± 12.08a | 1660.71± 21.13 b | 72.68± 2.14 b | 61.94± 1.49 b | 3.60± 0.25 c | 0.10± 0.00 b | 228.46± 18.86 c | 272.31± 20.89 c | 77.39± 5.55c | 80.89± 3.73 a | |
新窗口打开
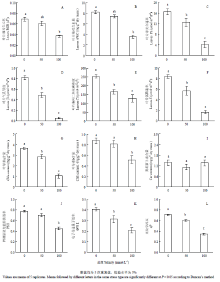 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1碱胁迫对小麦叶片生长特征、光合特性、叶绿素含量和荧光特性的影响
数值均为5次重复值,检验水平为5%
-->Fig. 1Effects of alkaline stress on the growth, photosynthesis, chlorophyll content and fluorescence in wheat
Values are means of 5 replicates. Means followed by different letters in the same stress type are significantly different at P<0.05 according to Duncan’s method
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2小麦叶片在不同碱胁迫强度下代谢变化过程的PCA得分图
-->Fig. 2Principal component analysis (PCA) score plots showing the metabolomic trajectory of leaves of wheat seedlings under different salinity concentration treatments
-->
2.4 碱胁迫对小麦叶片代谢产物及代谢通路的影响
根据PCA和OPLS-DA分析结果,小麦在碱胁迫12 d后各处理组之间的代谢物存在明显差异。与对照组相比,在检测出的73个代谢物中,中度胁迫下,25个代谢物含量发生显著性变化,其中,12个代谢物含量增加,13个代谢物含量减少;重度碱胁迫下,48个代谢物含量发生显著性变化,其中,14个代谢物含量增加,34个代谢物含量减少(图3-A和图3-B,电子附表1)。另外,中度与重度胁迫之间有57个代谢物未发现明显差异,在16个差异代谢物中,重度胁迫造成2个代谢物含量上升和14个代谢物含量下降(图3-C,电子附表1)。碱胁迫对小麦叶片糖代谢产生明显抑制作用,碱胁迫导致参与TCA循环的代谢物柠檬酸、α-酮戊二酸、琥珀酸、延胡索酸、苹果酸以及参与糖酵解的代谢物葡萄糖、果糖-6-磷酸、葡萄糖-6-磷酸、3-磷酸甘油酸、丙酮酸和磷酸烯醇式丙酮酸含量下降,100 mmol·L-1盐浓度条件下的下降趋势明显大于50 mmol·L-1(图4和电子附表1)。卡尔文循环受碱胁迫影响较大,碱胁迫明显抑制其代谢过程。在莽草酸代谢中碱胁迫促使莽草酸和奎尼酸的积累,但却抑制其他参与代谢物的合成,尤其在重度胁迫下。高浓度碱胁迫造成肌醇、甘氨酸和丝氨酸含量大量降低,表明细胞膜代谢受到明显抑制。3 讨论
3.1 碱胁迫对小麦生长和光合特性的影响
碱胁迫主要包括渗透胁迫、离子毒害及高pH胁迫,导致泡内质子减少、破坏细胞膜、影响跨膜电化学势梯度[13]。植物相对生长率(RGR)和含水量(WC)可反映植物体受到外界环境胁迫时的基本生理反应[6]。本研究结果表明,中度碱胁迫已经明显抑制小麦叶片RGR和WC,而且随盐浓度增加急剧下降(图1-A和图1-B)。小麦叶片中Na+大量积累,高pH使得Ca2+和Mg2+沉淀进一步加剧离子毒害,导致生长、发育受到抑制(表2)。小麦受到碱胁迫后,其光合作用受到明显抑制,尽管叶片气孔导度下降,但气孔限制并不是光合作用降低的主要原因(图1-C、图1-D、图1-E和图1-F)。碱胁迫引起Mg2+沉淀从而抑制了叶绿素的合成,尤其是在高浓度碱胁迫下下降明显;同时,高pH阻碍卡尔文循环过程,因此,碱胁迫下光合作用下降的主要原因是叶绿体功能障碍(图1-G和图1-H)。碱胁迫导致叶绿素含量降低,使得PSII、ΦPSⅡ和qP明显下降,这表明碱胁迫影响光系统Ⅱ原初光能转换效率及光系统Ⅱ潜在活性受到抑制,直接影响了光合作用的电子传递和CO2同化过程[6,14]。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3碱胁迫下小麦叶片代谢物比较
-->Fig. 3Comparison of metabolic profiles in leaves under alkaline stress
-->
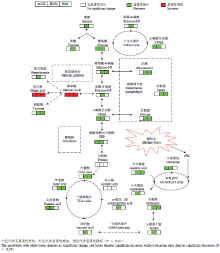 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4PCA和OPLS-DA分析提出碱胁迫下小麦叶片中代谢途径网络变化图
-->Fig. 4Proposed metabolic network changes in wheat leaves under alkaline stress obtained from PCA and OPLS-DA analysis
-->
3.2 碱胁迫对小麦叶片代谢产物的影响
生长在盐渍土壤中的植物通常在体内积累大量Na+,这与渗透调节能力密切相关[15]。由于Na+和K+水合半径相似,因此,它们之间存在拮抗竞争[16-17]。本研究结果显示,碱胁迫下叶片中Na+含量增加不仅可能直接引起K+和Mg2+、Ca2+和微量元素含量降低,还可能影响Cl-、NO3-和H2PO4-积累(表2,P<0.05)。这些重要营养元素的缺乏,可能直接或间接地影响光合作用及其他代谢途径[18-20]。本研究利用GC-MS代谢组学分析方法,对碱胁迫下小麦叶片代谢物进行系统分析,结果表明,碱胁迫引起小麦代谢组改变,包括许多代谢过程如光合作用、TCA循环、糖酵解/糖异生和氨基酸代谢。盐渍条件诱导植物产生大量活性氧(ROS),包括氧化氢(H2O2)和氧(O2-);它们会激活蛋白酶并诱导细胞内部产生过量的NH4+[21]。植物体通常为避免NH4+过量会把多余的NH4+通过转氨作用转化成谷氨酸/谷氨酰胺,或者通过谷氨酸脱氢酶转化为α-酮戊二酸进入TCA循环[22]。研究发现与对照组比较,在碱胁迫条件下5种TCA循环代谢中产物含量显著下降,明显抑制TCA循环,表明能量代谢遭到破坏(图4)。由于TCA循环是糖、脂肪酸和氨基酸代谢过程的枢纽,因此,碱胁迫不仅对糖、脂肪和蛋白质合成代谢过程造成负面影响,而且限制C-N转变过程,直接影响谷氨酸、天冬氨酸、丙氨酸等部分氨基酸的合成[23-24]。转氨基产物(天冬酰胺、天冬氨酸和谷氨酰胺)降低进一步证明碱胁迫阻碍C-N转化,影响N素的积累(图4)。糖类是光合作用的初级产物,为植物的生长发育提供能量及C骨架。本研究结果显示,在碱胁迫条件下,小麦叶片内参与糖酵解过程的代谢物合成受到抑制,如葡萄糖、果糖-6-磷酸、丙酮酸等;与此同时,碱胁迫迫使小麦叶片内糖类及多元醇含量显著性下降,如果糖、蔗糖、塔罗糖、肌醇、木糖醇等(图4,电子附表1)。结合碱胁迫下小麦光合速率、叶绿素含量及PSⅡ反应显著下降的研究结果,表明碱胁迫对糖类的合成和贮存有明显的负效应,在高pH环境下植物细胞中Na+大量积累造成离子毒害,不仅破坏光合器官影响卡尔文循环,同时对糖酵解途径也产生了严重的抑制作用,这意味着高pH使得植物体本身清除活性氧(ROS)能力明显下降[25]。
GABA作为N代谢中间产物,在pH调节、渗透调节、TCA循环回补以及提高植物抗逆性等方面起着重要作用[26-27]。一般情况下植物在干旱或热胁迫环境中积累大量GABA,但高碱胁迫造成GABA含量明显下降,这暗示着高碱胁迫抑制谷氨酸脱羧酶(glutamate decarboxylase,GDC)活性的同时,阻碍腐胺的降解转化过程[21]。另外,结合丙氨酸和琥珀酸的大量减少,研究结果进一步证明碱胁迫破坏GABA对TCA循环回补作用,加剧碱胁迫对TCA循环的抑制作用。莽草酸代谢途径是产生多种次生代谢产物的重要途径之一,对细胞壁生物合成起重要作用[28]。尽管碱胁迫下莽草酸和奎尼酸大量积累,但苯丙氨酸和酪氨酸含量降低,结合PEP结果表明碱胁迫抑制木质素、苯丙酸类化合物等次生代谢产物,而莽草酸和奎尼酸的增长可能并不是用于合成木质素以及细胞外壁,而更可能是用于细胞内渗透调节。碱胁迫造成参与细胞膜脂代谢产物含量降低,尤其是肌醇大量减少,这表明高pH和大量Na+抑制细胞膜脂代谢过程,进而破坏细胞膜稳定性降低植物抗碱性[29]。
在碱胁迫引起小麦叶片氨基酸含量减少,其主要原因可能是由高pH对氮吸收的抑制造成的[30-31]。研究发现碱胁迫诱导小麦叶片中积累大量有机酸,结合糖类和氨基酸类代谢产物的变化情况,这表明有机酸积累是一个重要调节过程,当碱胁迫超过植物体pH调节能力时,导致Na+大量累积阴离子严重亏缺,植物体被动积累有机酸用于细胞内离子平衡和pH调节(电子附表1)。因此,推测在碱胁迫条件下植物体有机酸积累量以及对碱胁迫强度的反应速度可以用来指示植物抗碱性和碱害程度。
4 结论
与盐胁迫相比,碱胁迫对植物的影响更大。碱胁迫下Na+大量积累和高pH环境破坏细胞膜和跨膜电化学势梯度,抑制叶绿素合成造成叶绿体功能障碍,影响光系统Ⅱ原初光能转换效率、光合作用和CO2同化过程,最终导致植物生长受阻甚至死亡。碱胁迫致使叶片中Na+含量激增,K+含量骤降,同时造成矿质元素和阴离子吸收受阻,进而导致离子严重失衡,推测其与SOS信号系统受到干扰有关。与对照组比较,分别有25和48个代谢物在中度和重度碱胁迫下发生明显改变。碱胁迫下小麦叶片中糖类代谢物含量显著性下降,结合光合特性结果表明碱胁迫显著降低植物对氮代谢的利用。同时碱胁迫引起代谢通路改变,如TCA循环、糖酵解、卡尔文循环、氨基酸代谢和细胞膜脂代谢等,表明碱胁迫明显抑制小麦叶片中多数代谢途径,造成碳水化合物和氨基酸含量降低,消耗大量的能量,但碱胁迫诱导积累大量有机酸。因此,碱胁迫不仅对糖类、氨基酸类、脂肪和蛋白质合成代谢过程造成负面影响,同时限制C-N转变过程影响植物对N素的利用,造成营养匮乏抑制植物生长发育;而有机酸的积累是一个重要调节过程,用于细胞内离子平衡和pH调节。File 1
附表1
附表1不同碱胁迫下小麦叶片提取物中主要代谢物相对含量和变化倍数以及主要代谢通路
File 1 Relative concentration and fold changes of major metabolites and metabolic path way in leaves of wheat seedlings after alkaline stress treatment
| 代谢路径和代谢物名称 Metabolic pathways and metabolites | 处理组相对含量 Relative concentration | 倍性变量 Fold Changes | |||||||
|---|---|---|---|---|---|---|---|---|---|
| CK | AS-M | AS-H | Log2AM/CK | Log2HM/CK | Log2AH/AM | ||||
| 三羧酸循环 TCA cycle | 柠檬酸Citric acid | 31.88 | 25.40 | 11.41 | -0.33 | -1.48* | -1.16* | ||
| 乌头酸Aconitic acid | 1.54 | 1.06 | 0.88 | -0.54 | -0.80 | -0.26 | |||
| α-酮戊二酸α-Ketoglutaric acid | 0.56 | 0.32 | 0.26 | -0.79 | -1.11* | -0.33 | |||
| 琥珀酸Succinic acid | 10.57 | 7.65 | 5.07 | -0.47 | -1.06* | -0.59 | |||
| 延胡索酸Fumaric acid | 3.92 | 1.69 | 1.02 | -1.21* | -1.94* | -0.73 | |||
| 苹果酸Malic acid | 19.61 | 16.30 | 5.86 | -0.27 | -1.74* | -1.48* | |||
| 卡尔文循环 Calvin cycle | 葡萄糖Glucose | 15.86 | 8.46 | 7.88 | -0.91* | -1.01* | -0.10 | ||
| 果糖-6-磷酸Fructose-6-P | 0.54 | 0.35 | 0.27 | -0.63 | -0.99* | -0.36 | |||
| 3-磷酸甘油酸3-PGA | 0.92 | 0.44 | 0.31 | -1.07* | -1.56* | -0.49 | |||
| 糖酵解过程 Glycolysis | 葡萄糖Glucose | 15.86 | 8.46 | 7.88 | -0.91* | -1.01* | -0.10 | ||
| 果糖-6-磷酸Fructose-6-P | 0.54 | 0.35 | 0.27 | -0.63 | -0.99* | -0.36 | |||
| 葡萄糖-6-磷酸Glucose-6-P | 0.75 | 0.49 | 0.23 | -0.62 | -1.72* | -1.10* | |||
| 3-磷酸甘油酸3-PGA | 0.92 | 0.44 | 0.31 | -1.07* | -1.56* | -0.49 | |||
| 丙酮酸Pyruvate | 0.63 | 0.59 | 0.56 | -0.09 | -0.18 | -0.10 | |||
| 磷酸烯醇式丙酮酸PEP | 0.62 | 0.29 | 0.17 | -1.10* | -1.84* | -0.74 | |||
| 莽草酸途径 Shikimic path way | 莽草酸Shikimic acid | 11.96 | 31.37 | 65.58 | 1.39* | 2.46* | 1.06* | ||
| 奎尼酸Quinic acid | 2.54 | 7.15 | 14.22 | 1.49* | 2.49* | 0.99* | |||
| 苯丙氨酸Phenylalanine | 0.49 | 0.42 | 0.24 | -0.23 | -1.05* | -0.82 | |||
| 酪氨酸Tyrosine | 0.19 | 0.13 | 0.06 | -0.52 | -1.55* | -1.03* | |||
| 肉桂酸Cinnamic acid | 0.44 | 0.83 | 0.72 | 0.92 | 0.72 | -0.20 | |||
| 细胞膜脂代谢 Metabolism of plasma membrane | 肌醇Myo-inositol | 19.19 | 18.76 | 8.38 | -0.03 | -1.20* | -1.16* | ||
| 甘氨酸Glycine | 21.16 | 13.17 | 6.47 | -0.68 | -1.71* | -1.03* | |||
| 丝氨酸Serine | 8.21 | 7.22 | 2.56 | -0.19 | -1.68* | -1.49* | |||
| 乙醇胺Ethanolamine | 4.55 | 5.87 | 4.35 | 0.37 | -0.06 | -0.43 | |||
| 转氨循环 GS/GOGAT cycle | 天冬酰胺Asparagine | 0.06 | 0.05 | 0.03 | -0.27 | -1.11* | -0.84 | ||
| 天冬氨酸Aspartic acid | 47.33 | 26.36 | 13.91 | -0.84 | -1.77* | -0.92* | |||
| 谷氨酰胺Glutamine | 0.78 | 0.37 | 0.37 | -1.06* | -1.08* | -0.02 | |||
| GABA途径 GABA path way | γ-氨基丁酸GABA | 61.70 | 46.00 | 28.42 | -0.42 | -1.21* | -0.69 | ||
| 丙氨酸Alanine | 70.92 | 59.28 | 22.86 | -0.26 | -1.63* | -1.37* | |||
| 琥珀酸Succinic acid | 10.57 | 7.65 | 5.07 | -0.47 | -1.06* | -0.59 | |||
| 其他 Other metabolites | 谷氨酸Glutamate | 262.41 | 180.74 | 93.83 | -0.54 | -1.48* | -0.95* | ||
| 缬氨酸Valine | 5.79 | 2.76 | 2.76 | -1.07* | -1.07* | 0.00 | |||
| 苏氨酸Threonine | 9.21 | 7.16 | 4.54 | -0.36 | -1.02* | -0.66 | |||
| 脯氨酸Proline | 1.31 | 0.57 | 0.88 | -1.19* | -0.58 | 0.61 | |||
| 异亮氨酸Isoleucine | 2.89 | 1.42 | 1.44 | -1.02* | -1.00* | 0.02 | |||
| 赖氨酸Lysine | 0.20 | 0.18 | 0.07 | -0.17 | -1.52* | -1.36* | |||
| 亮氨酸Leucine | 0.41 | 0.20 | 0.16 | -1.03* | -1.35* | -0.32 | |||
| 果糖Fructose | 144.82 | 101.22 | 64.24 | -0.52 | -1.17* | -0.66 | |||
| 续附表1 | |||||||||
| 代谢路径和代谢物名称 Metabolic pathways and metabolites | 处理组相对含量 Relative concentration | 倍性变量 Fold Changes | |||||||
| CK | AS-M | AS-H | Log2AM/CK | Log2HM/CK | Log2AH/AM | ||||
| 蔗糖Sucrose | 0.92 | 0.56 | 0.44 | -0.73 | -1.08* | -0.34 | |||
| 塔罗糖Talose | 26.78 | 23.25 | 12.39 | -0.20 | -1.11* | -0.91* | |||
| 蔗果三糖Kestose | 0.40 | 0.29 | 0.23 | -0.47 | -0.77 | -0.31 | |||
| 庚酮糖Heptulose | 0.55 | 0.36 | 0.32 | -0.62 | -0.77 | -0.15 | |||
| 山梨糖醇Sorbitol | 0.58 | 0.39 | 0.31 | -0.57 | -0.90 | -0.33 | |||
| 核糖Ribose | 30.24 | 19.85 | 12.86 | -0.61 | -1.23* | -0.63 | |||
| 木糖Xylose | 1.58 | 1.01 | 1.41 | -0.65 | -0.17 | 0.48 | |||
| 木糖醇Xylitol | 0.42 | 0.22 | 0.18 | -0.96 | -1.21* | -0.25 | |||
| 海藻糖Trehalose | 0.36 | 0.18 | 0.25 | -1.03* | -0.54 | 0.49 | |||
| 槐糖Sophorose | 0.23 | 0.11 | 0.08 | -1.00* | -1.46* | -0.47 | |||
| 来苏糖Lyxose | 0.75 | 0.44 | 0.51 | -0.75 | -0.55 | 0.21 | |||
| 羊毛甾醇Lanosterol | 2.01 | 1.74 | 1.19 | -0.20 | -0.75 | -0.55 | |||
| 半乳糖苷Galactinol | 20.65 | 18.76 | 12.26 | -0.14 | -0.75 | -0.61 | |||
| 棉子糖Raffinose | 13.24 | 12.05 | 5.15 | -0.14 | -1.36* | -1.23* | |||
| 麦芽糖Maltose | 0.37 | 0.17 | 0.08 | -1.07* | -2.16* | -1.09* | |||
| 植醇Phytol | 3.91 | 3.40 | 2.49 | -0.20 | -0.65 | -0.45 | |||
| 龙胆二糖Gentiobiose | 0.28 | 0.14 | 0.16 | -1.02* | -0.76 | 0.25 | |||
| 半乳糖Galactose | 0.19 | 0.12 | 0.08 | -0.68 | -1.17* | -0.49 | |||
| 乳糖Lactose | 0.32 | 0.27 | 0.19 | -0.25 | -0.76 | -0.51 | |||
| 衣康酸Itaconic acid | 46.29 | 64.23 | 56.95 | 0.47 | 0.30 | -0.17 | |||
| 棕榈酸Palmitic acid | 6.46 | 13.29 | 12.41 | 1.04* | 0.94* | -0.10 | |||
| 抗坏血酸Ascorbic acid | 3.07 | 6.40 | 7.13 | 1.06* | 1.22* | 0.16 | |||
| 甘油酸Glyceric acid | 3.11 | 3.88 | 5.07 | 0.32 | 0.71 | 0.39 | |||
| 硬脂酸Stearic acid | 1.66 | 2.99 | 3.76 | 0.85 | 1.19* | 0.33 | |||
| 乙醇酸Glycolic acid | 1.33 | 2.64 | 3.18 | 0.98* | 1.25* | 0.27 | |||
| 苏糖酸Threonic acid | 1.64 | 3.31 | 2.18 | 1.01* | 0.41 | -0.60 | |||
| 亚麻酸Linolenic acid | 1.06 | 3.25 | 1.89 | 1.62* | 0.84 | -0.78 | |||
| 乳酸Lactic acid | 1.02 | 1.64 | 1.62 | 0.68 | 0.66 | -0.01 | |||
| 亚油酸Linoleic acid | 0.05 | 0.12 | 0.14 | 1.28* | 1.50* | 0.22 | |||
| 苯甲酸Benzoic acid | 0.34 | 0.29 | 0.45 | -0.24 | 0.39 | 0.63 | |||
| 油酸Oleic acid | 0.01 | 0.02 | 0.02 | 1.15* | 1.69* | 0.54 | |||
| 花生酸Arachidic acid | 0.16 | 0.39 | 0.56 | 1.31* | 1.84* | 0.53 | |||
| 丙二酸Malonic acid | 1.34 | 1.83 | 2.13 | 0.45 | 0.67 | 0.22 | |||
| 戊酸Valeric acid | 0.04 | 0.07 | 0.14 | 0.76 | 1.66* | 0.90 | |||
| 磷酸盐Phosphate | 10.66 | 38.16 | 31.97 | 1.84* | 1.58* | -0.26 | |||
| 甘油Glycerol | 9.22 | 15.29 | 21.25 | 0.73 | 1.21* | 0.48 | |||
| 双甘油Diglycerol | 1.72 | 1.80 | 1.80 | 0.07 | 0.06 | 0.00 | |||
| 3-磷酸甘油Glycerol-3-phosphate | 4.34 | 9.29 | 13.96 | 1.10* | 1.69* | 0.59 | |||
| 吡啶(嘧啶)Pyridine | 8.71 | 15.52 | 21.72 | 0.83 | 1.32* | 0.49 | |||
新窗口打开
The authors have declared that no competing interests exist.
