0 引言
【研究意义】2015年中国肉鸡产量约为1.3×107 t[1],肉鸡屠宰分割产生的鸡骨架约占鸡肉的25%— 30%,达到3.25×106—3.9×106 t[2]。研究表明,鸡骨是一种优质蛋白资源,其蛋白质含量约为19%,其中胶原蛋白占总蛋白的35%—40%[2]。但目前鸡骨利用方式单一,主要用于加工骨糊、骨粉等低附加值产品[3],而骨蛋白类高附加值产品较少,因此,开发鸡骨原料的高值化利用技术,对于培育鸡肉加工行业新的效益增长点具有重要意义。【前人研究进展】动物的皮、骨中富含胶原蛋白,后者的部分水解产物可以形成食用凝胶[4]。由于胶原蛋白凝胶具有良好的生物相容性和功能特性,广泛应用于灌汤包子、饺子、肉糜型肉品以及甜点、乳品等食品加工,用于提高营养品质、改善组织结构和口感,且需求量逐年增加,造成市场供不应求[5]。目前,制备凝胶的胶原蛋白主要来源于猪皮、牛皮、鱼皮等[4-6],由于骨源食品加工技术匮乏,以可食性动物骨作为凝胶蛋白来源的研究较少。胶原蛋白制备传统方法多采用酸碱工艺,包括原料粉碎、去除非胶原蛋白、脱脂、酸/碱提取、透析、冻干等步骤,工艺复杂、耗时长,加工过程中大量使用酸、碱,且耗水耗能,易造成环境污染和资源浪费[7]。目前已有很多关于胶原蛋白提取和凝胶制备工艺优化的报道。CHEN等[5]采用超高压辅助HCl提取胶原蛋白并制备凝胶,凝胶强度显著提高。WANG等[6]采用胃蛋白酶辅助HCl提取胶原蛋白,提取率显著提高。经过工艺优化,胶原蛋白的提取率和凝胶强度等有所提高,但是传统制备工艺耗时长,大量使用酸、碱等问题仍未得到解决。【本研究切入点】近年来,笔者实验室以可食性骨为原料,创新性地开发出骨蛋白热压抽提方法,即利用热压抽提罐在高温高压条件下使鸡骨蛋白快速溶出,优化了骨蛋白制备工艺,克服传统方法的不足。前期对鸡骨蛋白高效提取研究发现,热压抽提可以有效地促进骨蛋白的迁移与溶出,总蛋白提取率达83.51%,胶原蛋白的提取率达96.81%[8]。热压抽提导致骨蛋白不同程度的降解,诱导胶原蛋白三股螺旋解离,优化并生产验证了130℃提取90 min可以兼顾鸡骨蛋白提取率和产品品质[9-10],但是热提取时间越长,蛋白水解程度越高,凝胶强度越差[11]。【拟解决的关键问题】以鸡骨为研究对象,采用热压抽提的方法在最佳提取温度(130℃)下制备鸡骨蛋白,动态分析不同抽提时间下鸡骨蛋白的二级结构、分子量分布、凝胶强度、色泽等指标的变化,阐明抽提时间对鸡骨蛋白理化特性和凝胶特性的作用效应,优化抽提时间,为骨蛋白用于食用凝胶生产提供工艺参考。1 材料与方法
试验于2015年7—12月在中国农业科学院农产品加工研究所肉品实验室进行。1.1 试验材料
鸡骨架,购于河南鹤壁普勒泰生物科技有限公司,保存于-18℃冰箱中。1.2 主要试剂及仪器
1.2.1 主要试剂 羟脯氨酸标品、一水柠檬酸、氢氧化钠、无水乙酸钠、浓盐酸、对二甲氨基苯甲醛、氯胺T、浓硫酸等试剂,国药集团化学试剂有限公司;细胞色素C(12.5 kDa)、抑肽酶(6.5 kDa)、杆菌肽(1.45 kDa)、乙氨酰氨-乙氨酰氨-精氨酸(451 Da)和乙氨酰氨-乙氨酰氨-乙氨酸(189 Da)标准品,美国Sigma化学试剂公司。1.2.2 主要仪器设备 PG-150破骨机,廊坊市顶天轻工机械有限公司;高温高压提取罐,浙江天联机械有限公司;MASTER-53M手持式折射仪,日本爱宕有限公司;T6-新世纪紫外分光光度计,北京普希通用仪器有限公司;KJELTEC2300型全自动凯氏定氮仪,瑞典Foss集团;CR22 GII高速冷冻离心机,日本Hitachi公司;TA.XT2i Plus质构仪,英国Stable Micro System 公司;CR-400型便携式色差仪,日本柯尼卡美能达公司;FD-1A-50冷冻干燥机,北京博医康实验仪器有限公司。
1.3 试验方法
1.3.1 鸡骨蛋白提取 鸡骨架经破碎、清洗,去除血水和杂质后放入提取罐,按骨渣质量比1﹕1.5加水。升温至(130±0.5)℃,0.175 MPa时恒温,分别在恒温0、20、40、60、90和120 min时取样,并过200目筛以除去鸡骨残渣,采用离心法(16 000×g)去油,所得鸡骨蛋白样品置于-80℃冰箱保存,用于后续分析、检测。1.3.2 总固形物和粗蛋白含量测定 总固形物(total soluble substance,TSS)含量采用MASTER-53M 手持式折射仪直接测定。粗蛋白含量采用半微量凯氏定氮法测定[10]。每组样品平行测定3次。
1.3.3 羟脯氨酸含量测定 羟脯氨酸(Hyroxyproline,Hyp)含量测定参考BERTRAM等[12]的方法并略作修改。取100 mg样品加入5 mL 6 mol·L-1 HCl于110℃下水解24 h。水解液用活性炭吸附后,单层滤纸过滤,用10 mol·L-1和1 mol·L-1 NaOH调滤液pH至6.0,然后用蒸馏水定容至50 mL。取出4 mL定容后溶液加入2 mL氯氨T,混匀,室温放置20 min。然后加入2 mL显色剂,摇匀,60℃水浴20 min。样品用流水冷却5 min,在558 nm下测吸光度。每组样品平行测定3次。
1.3.4 分子量分布测定 参考IRVINE等[13]的方法,采用体积排阻色谱法(SEC)测定鸡骨蛋白的分子量分布,每组样品平行测定3次。色谱条件为:色谱柱,TSK G2000SWXL(30 cm×7.8 mm,5 μm);洗脱液,乙腈/超纯水/三氟乙酸(45/55/0.1,v/v/v);流速,0.6 mL·min-1;柱温,30℃;检测波长,220 nm;上样量,10 μL。以细胞色素C(12.5 kDa)、抑肽酶(6.5 kDa)、杆菌肽(1.45 kDa)、乙氨酰氨-乙氨酰氨-精氨酸(451 Da)和乙氨酰氨-乙氨酰氨-乙氨酸(189 Da)标准品与保留时间拟合直线方程为:Y=-0.26X+6.78,R2=1.00,其中X为保留时间(单位:min),Y为标准品分子量的对数。
1.3.5 傅里叶红外分析 采用傅里叶变换红外光谱仪(fourier transform infrared spectroscopy,FTIR)分析不同抽提时间蛋白质的结构变化。参照李侠等[14]的方法并略作修改,采用多次衰减全反射技术(attenuated total reflection,ATR)进行测量。取相同体积样品置于ATR附件上扫描,采用OMNIC软件记录谱图,并利用仪器的差减软件进行差减去除水的干扰。测定范围4 000—400 cm-1,分辨率4 cm-1,扫描次数100次。利用PeakFit 4.12(SPSS Inc.,Chicago,IL,USA)软件对红外光谱酰胺Ⅰ带(1 700—1 600 cm-1)谱峰进行处理。
1.3.6 凝胶强度测定 凝胶强度测定参考PANG等[15]的方法并略作修改。将鸡骨蛋白溶液冻干后复溶至同一浓度(6.67%,以粗蛋白计),4℃孵育(17±1)h后进行凝胶强度测定,每组样品平行测定3次。仪器采用TA.XT2i Plus质构仪,探头型号P/0.5,测前速度2.0 mm·s-1,测试速度1.0 mm·s-1,测后速度2.0 mm·s-1,压缩比例30%,负荷5 g,测定温度25℃。
1.3.7 凝胶持水性测定 凝胶持水性(water holding capacity,WHC)测定参考ZHOU等[16]的方法并略作修改。量取等体积样品于离心管中,4℃孵育(17±1)h制备凝胶,6 000×g离心15 min(4℃)后去除离出水分,记录空离心管质量及离心前后离心管与凝胶的总质量,每组样品平行测定3次。凝胶持水性按式(1)计算:
WHC(%)=(W2-W)/(W1-W)×100% (1)
式中,W为离心管重量,W1为离心前离心管和蛋白凝胶总重量,W2为离心后离心管和蛋白凝胶总重量。
1.3.8 鸡骨蛋白溶液透明度测定 CBP溶液透明度测定参考刘小玲[17]的方法并略作修改。测定同浓度的鸡骨蛋白溶液在660 nm处的吸光值A,每组样品平行测定3次。根据公式(2)换算为透过率transmittance(T),T越大,溶液的透明度越高。
公式如下:
A= -lgT (2)
1.3.9 凝胶色泽测定 凝胶色泽测定参考王春青等[18]的方法并略作修改。使用便携式色差仪直接测定凝胶表面的亮度值L*、红度值a*和黄度值b*,+a*表示样品偏红,-a*表示偏绿,+b*表示样品偏黄,-b*表示样品偏蓝。每组样品平行测定3次。色差计使用前用白板校准。白度值W计算公式如下:
W=100-[(100-L*)2+a*2+b*2]1/2 (3)
1.4 统计分析
采用SAS 9.2软件进行统计分析,用ANOVA 进行方差分析,Duncan进行显著性检验(P<0.05)。使用Microsoft Excel 2013软件绘图,同一图或表中不同的小写字母表示差异显著(P<0.05)。2 结果
2.1 抽提时间对TSS、粗蛋白含量和粗蛋白提取率的影响
TSS、粗蛋白含量和提取率变化规律如表1所示。随着抽提时间的延长,TSS和粗蛋白含量均显著增加,TSS从开始时的0.97%增加到120 min的5.43%;粗蛋白含量从开始时的0.92%增加到120 min的5.01%(P<0.05)。0—90 min粗蛋白含量增幅较大,90—120 min增幅趋于平缓,与粗蛋白提取率结果一致。说明热压抽提破坏了鸡骨坚硬的结构,蛋白质和少量的可溶性有机化合物不断溶出,并且大部分蛋白在前90 min已经被提取溶出[9]。Table 1
表1
表1热压抽提时间对TSS、粗蛋白含量和粗蛋白提取率的影响
Table 1Effect of hot-pressure extraction time on contents of TSS, crude protein and extraction rate of crude protein
| 抽提时间 Extraction time (min) | 总固形物 TSS (%) | 粗蛋白 Crude protein (%) | 粗蛋白提取率 Yield of crude protein (%) |
|---|---|---|---|
| 0 | 0.97±0.06f | 0.92±0.08f | 13.63±1.13f |
| 20 | 2.80±0.05e | 2.76±0.01e | 41.01±0.12e |
| 40 | 3.97±0.06d | 3.65±0.00d | 54.30±0.07d |
| 60 | 4.73±0.21c | 3.97±0.01c | 59.13±0.14c |
| 90 | 5.10±0.10b | 4.74±0.01b | 70.53±0.12b |
| 120 | 5.43±0.12a | 5.01±0.01a | 74.56±1.11a |
新窗口打开
对相同时间点的TSS和粗蛋白含量进行回归分析得到线性方程Y=0.78X+0.61(其中:X为TSS,Y为粗蛋白含量),方程回归性显著(P<0.05),决定系数R2=0.93,说明该方程拟合性良好。利用此方程可以对热压抽提过程中粗蛋白含量进行预测,实现了鸡骨蛋白生产过程中粗蛋白含量的在线预测,大大节省检测时间和成本。
2.2 抽提时间对羟脯氨酸(Hyp)含量的影响
鸡骨富含胶原蛋白,热压抽提过程中,胶原蛋白变成可溶性水解物溶出,其变化规律与Hyp一致[19]。Hyp含量的变化会影响凝胶强度等凝胶性质[20]。鸡骨蛋白中Hyp变化规律如图1所示。随着抽提时间延长,Hyp含量从0 min的0.08 mg·g-1显著增加到90 min的3.77 mg·g-1(P<0.05),90和120 min的Hyp含量无显著性差异(P>0.05)。结果表明抽提时间会显著影响Hyp含量(P>0.05),抽提时间越长,鸡骨中的胶原蛋白溶出越多,但是随着提取的进行,胶原蛋白溶出速度减缓,表明大部分胶原蛋白已经被提取溶出。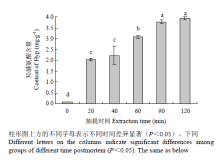 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1热压抽提时间对羟脯氨酸含量的影响
-->Fig.1Effect of hot-pressure extraction time on Hyp content
-->
2.3 抽提时间对分子量分布(MW)的影响
分子量的变化会显著影响凝胶强度、透明度等凝胶性质[20]。表2为不同抽提时间的CBP分子量分布,可以反映蛋白的降解情况。由表2可知,随着提取时间延长(40—120 min),蛋白降解显著,分子量>30 kDa的肽段40 min 时占总蛋白的4.72%,而90 min时被全部降解;分子量在10—30 kDa的组分从40 min的59.82%降低到120 min的13.99%;而分子量<10 kDa的肽段从40 min的35.46%升高到120 min的86.01%。原因在于,随着抽提时间延长,高分子量的蛋白不断溶出,并降解为低分子量多肽和氨基酸。这与YANG等[21]的研究结果一致,YANG等[21]研究发现高温会导致蛋白质降解为小分子蛋白。KIJOWSKI等[2]也指出,鸡骨富含胶原蛋白,加热到胶原蛋白变性温度以上会导致氢键断裂、三股螺旋结构展开,蛋白降解为不同分子量的多肽段。Table 2
表2
表2凝胶分子量分布变化
Table 2Change of the distribution of molecular weight (MW) of gelatin
| 抽提时间 Extraction time (min) | 分子量分布Distribution of molecular weight (%) | ||
|---|---|---|---|
| >30 kDa | 10—30 kDa | <10 kDa | |
| 0 | 0.06±0.00a | 1.96±0.00c | 97.98±0.00a |
| 20 | 0.28±0.05a | 59.90±7.28a | 40.02±7.50c |
| 40 | 4.72±0.99a | 59.82±10.28a | 35.46±9.29c |
| 60 | 4.32±6.10a | 31.71±16.89b | 63.98±10.78b |
| 90 | 0.00±0.00a | 24.35±4.04b | 75.65±4.04bc |
| 120 | 0.00±0.00a | 13.99±2.66bc | 86.01±2.66ab |
新窗口打开
2.4 抽提时间对蛋白质结构的影响
图2为不同时间提取的CBP的红外光谱图。由图2可知,不同抽提时间的谱图趋势相似,但是随着抽提时间延长而有所改变。红外光谱的改变表明蛋白结构发生转变,包括酰胺A带(2 300—3 600 cm-1)[22],酰胺Ⅰ带(1 636—1 661 cm-1),酰胺Ⅱ带(1 549— 1 558 cm-1)和酰胺Ⅲ带(1 200—1 300 cm-1)的变化[23]。MUYONGA 等[24]将1 600—1 700 cm-1归属为酰胺Ⅰ带。HASHIM等[22]将1 550—1 520 cm-1归属为酰胺Ⅱ带,并指出此频率变化与N-H键变形有关。而SUREWICZ等[25]认为酰胺Ⅱ带与存在于脂肪、蛋白质、多糖及磷酸衍生物中的基团振动有关。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2热压抽提时间对蛋白质结构的影响
-->Fig. 2Effect of hot-pressure extraction time on structure of protein
-->
基于以上归属,CBP的FTIR光谱确认1 600— 1 700 cm-1为酰胺Ⅰ带,1 330—1 600 cm-1为酰胺Ⅱ带,1 200—1 300 cm-1为酰胺Ⅲ带(图2)。由图可知,与酰胺Ⅰ带和酰胺Ⅱ带相比,酰胺Ⅲ带强度较弱,这与热压提取鸡骨蛋白导致其结构破坏有关[24]。酰胺Ⅱ带变化可能是因为热处理导致N-H键变形,并且可能与构成骨架的脂肪、蛋白质、多糖和磷酸衍生物中的基团振动相关。
酰胺Ⅰ带(1 600—1 700 cm-1)主要是由C=O的伸缩振动引起,对研究蛋白质二级结构最有价值[14]。通常情况下,将1 615—1 637 cm-1和1 682—1 700 cm-1归属为β-折叠和反平行β-折叠,1 646—1 664 cm-1归属为α-螺旋,1 637—1 645 cm-1归属为无规则卷曲,1 664—1 681 cm-1归属为β-转角[14]。基于以上归属,热压抽提得到的CBP的二级结构主要由α-螺旋 (1 646、1 650和1 651 cm-1)和β-折叠(1 620、1 623 cm-1)组成,β-转角和反平行β-折叠并未观测到(表3)。0—40 min的CBP酰胺Ⅰ带由100%的α-螺旋组成,60—90 min时出现9.9%—17.6%的β-折叠结构,120 min时β-折叠全部降解。该结果与相关报道一致,MUYONGA等[24]研究表明维持鸡骨蛋白二级结构的主要作用力为氢键,热处理导致氢键破坏和蛋白降解,其中胶原蛋白三股螺旋主要分解为完整的α链。此外,ZHANG等[26]研究发现蛋白质的热变性会导致蛋白质的不可逆沉淀及β-折叠结构展开为无序结构。CBP二级结构的以上变化会影响凝胶网络结构形成而影响凝胶特性[27]。
Table 3
表3
表3峰位置和相对百分面积分布
Table 3Component peak location (cm-1) and percent area (in brackets) contribution of total band
| 抽提时间 Extraction time (min) | 峰1 Peak 1 | 峰2 Peak 2 |
|---|---|---|
| 0 | 1650 (100) | ND |
| 20 | 1650 (100) | ND |
| 40 | 1650 (100) | ND |
| 60 | 1620 (9.9) | 1651(90.1) |
| 90 | 1623 (17.6) | 1651(82.4) |
| 120 | 1646 (100) | ND |
新窗口打开
2.5 抽提时间对凝胶强度、持水性(WHC)和CBP溶液透明度的影响
通常认为凝胶强度越大,凝胶质量越好[28]。不同抽提时间的CBP凝胶强度的变化规律如图3-A所示。抽提开始时的鸡骨蛋白并未形成凝胶,20、40和60 min组的凝胶强度无显著性差异(P>0.05),均显著高于90和120 min组。原因可能在于,20—60 min的CBP中高分子量组分比例高于90和120 min组,形成的凝胶网络结构更好[4],故凝胶强度较大,这与EYSTURSKARÐ等[29]的研究结果相似。此外,蛋白质二级结构的变化也会影响凝胶强度[30-31]。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3热压抽提时间对凝胶强度、持水性和CBP溶液透明度的影响
-->Fig.3Effect of hot-pressure extraction time on gel strength, WHC and transparency of CBP solution
-->
WHC指离心过程中凝胶对水的保持能力,WHC越高,表明凝胶对水的保持能力越强,凝胶质量越好。由图3-B可知,不同时间提取的CBP凝胶持水性均大于90%,且无显著性差异(P>0.05),表明不同抽提时间的CBP凝胶都对水有较好的保持能力。这与DE MORAES等[4]的研究结果相似,DE MORAES等[4]研究表明酸性条件下加热温度和时间对凝胶的持水性均没有影响。
制备凝胶的溶液透明度越高,凝胶可接受度越高。不同抽提时间的CBP的透明度变化规律如图3-C所示。随着抽提时间延长(20—120 min),溶液透明度显著升高(P<0.05)。原因可能在于,20 min的CBP中高分子量物质比例较高,溶解性差,降低了CBP透明度,但随着抽提时间延长,大分子物质不断被降解,溶解性变好,故CBP的透明度升高,这和刘小玲[17]的研究结果一致。
2.6 抽提时间对凝胶色泽的影响
由表4可知,抽提时间会显著影响CBP凝胶的色泽(P<0.05)。不同抽提时间的CBP凝胶的L*和W值差异显著(P<0.05);40、60和90 min组的a*值无显著性差异(P>0.05),均低于20和120 min组;20 min组的b*值最大,其他各组差异不显著(P>0.05)。造成凝胶色泽差异的原因主要有两点,一是鸡骨在抽提过程中发生美拉德反应,产生褐色素使CBP颜色加深,且加热时间越长,褐变越严重,CBP颜色越深[10,31];二是将样品调至同一浓度时,浓缩倍数不同,因而颜色不同,二者共同导致凝胶色泽差异显著(P<0.05)。根据优质凝胶的标准,即高亮度、低黄度、高白度[30],综合考虑CBP凝胶的L*、b*和W,40和60 min组的凝胶色泽最佳。Table 4
表4
表4凝胶色泽比较
Table 4Comparison of the color of gelatin
| 抽提时间 Extraction time (min) | 亮度值 L* | 红度值 a* | 黄度值 b* | 白度值 W |
|---|---|---|---|---|
| 0 | — | — | — | — |
| 20 | 61.39±1.22a | 4.66±0.95a | 22.18±2.15a | 55.19±1.55a |
| 40 | 34.83±1.52c | -0.61±0.22c | 0.52±0.77b | 34.82±1.52c |
| 60 | 45.14±1.42b | -1.22±0.19c | 1.91±0.82b | 45.09±1.40b |
| 90 | 31.98±0.67d | -0.65±0.14c | 0.58±0.24b | 31.98±0.67d |
| 120 | 27.89±1.90e | 0.46±0.12b | 2.17±0.64b | 27.86±1.89e |
新窗口打开
2.7 相关性分析
表5为不同抽提时间CBP的Hyp含量、CBP降解程度与凝胶特性的相关性关系。由表5可知,凝胶强度与10—30 kDa的CBP比例极显著正相关,而与<10 kDa的CBP比例极显著负相关(P<0.01),相关系数分别为0.78和-0.82,原因在于10—30 kDa蛋白比例越高,<10 kDa蛋白比例越低,形成的凝胶网络结构越好,凝胶强度越大。透过率与10—30 kDa 的CBP的比例显著负相关,而与<10 kDa的CBP的比例极显著正相关(P<0.01),相关系数分别为-0.70和0.75,原因在于<10 kDa的CBP溶解性优于10—30 kDa的CBP,所以<10 kDa的CBP比例越高,蛋白溶解性越好,溶液透过率较高。WHC与Hyp的含量极显著正相关(P<0.01),相关系数为0.94,原因在于Hyp含量反映了鸡骨蛋白中胶原蛋白的含量,其含量越高,形成氢键数量越多,从而形成致密的凝胶网络束缚水分子的运动。L*与透过率极显著负相关(P<0.01),相关系数为-0.70,因为鸡骨在抽提过程中发生美拉德反应,产生褐色素使CBP颜色加深,且加热时间越长,CBP颜色越深,同时蛋白发生降解,蛋白溶解性越好,溶液透过率较高。Table 5
表5
表5不同抽提时间凝胶各指标间相关性分析
Table 5Correlations among different indices of gelation prepared by different extraction times
| 羟脯氨酸 Hyp | >30 kDa | 10—30 kDa | <10 kDa | 凝胶强度 GS | 透过率 T | 持水性 WHC | 亮度值 L* | 红度值 a* | 黄度值 b* | |
|---|---|---|---|---|---|---|---|---|---|---|
| 羟脯氨酸Hyp | 1 | 0.08 | 0.31 | -0.32 | 0.46 | -0.33 | 0.94** | -0.01 | 0.03 | 0.06 |
| >30 kDa | 1 | -0.08 | -0.04 | 0.31 | -0.35 | 0.21 | -0.05 | -0.29 | -0.26 | |
| 10—30 kDa | 1 | -0.99** | 0.78** | -0.70* | 0.47 | 0.53 | 0.33 | 0.41 | ||
| <10 kDa | 1 | -0.82** | 0.75** | -0.50 | -0.53 | -0.30 | -0.37 | |||
| 凝胶强度GS | 1 | -0.66** | 0.60** | 0.25 | 0.02 | 0.05 | ||||
| 透过率T | 1 | -0.49* | -0.70** | -0.25 | -0.40 | |||||
| 持水性WHC | 1 | -0.28 | -0.39 | -0.36 | ||||||
| 亮度值L* | 1 | 0.78** | 0.90** | |||||||
| 红度值a* | 1 | 0.97** | ||||||||
| 黄度值b* | 1 |
新窗口打开
3 讨论
3.1 抽提时间对TSS、粗蛋白和羟脯氨酸含量的影响
鸡骨中蛋白含量约为19%,其中35%—40%为胶原蛋白。胶原蛋白由三条亚基链构成三股螺旋结构,在常温下结构稳定,溶解性较差。高温高压抽提能够使蛋白结构破坏,胶原蛋白三股螺旋结构解旋为单链而溶于水。WANG等[8]研究表明加热温度越高、时间越长,鸡骨中可溶性物质越多,粗蛋白和羟脯氨酸含量越高。本研究中,随着加热时间延长,TSS、粗蛋白和羟脯氨酸含量均显著增加(P<0.05),与WANG等[8]的研究结果一致。3.2 抽提时间对分子量分布(MW)的影响
鸡骨在抽提过程中,高分子量的蛋白降解为低分子量的蛋白,再降解为多肽、小分子肽和游离氨基酸。有研究表明高温更能促使蛋白质的降解,且加热时间越长,蛋白降解程度越高[8]。YANG等[21]指出长时间加热会导致蛋白质过度降解,高分子量组分比例降低,低分子量组分比例升高。本研究(表2)也发现,随着提取时间延长(40—120 min),蛋白发生显著降解,分子量在10—30 kDa的组分比例降低了45.83%;而分子量<10 kDa的肽段比例升高了50.55%,与上述研究结果相似。3.3 抽提时间对蛋白质二级结构的影响
目前,FTIR广泛用于蛋白质分子结构研究,其酰胺I带(1 600—1 700 cm-1)对羰基的几何振动和氢键结构非常敏感。随着加热温度和时间的改变,蛋白二级结构发生相应变化,反映为谱图形状和强度的变化。卢雁等[32]研究表明随着加热温度的升高,蛋白质α-螺旋含量逐渐减少,β-折叠含量增加。α-螺旋是蛋白质分子内的有序排列,通过分子内氢键维持。在加热条件下其含量降低表明加热导致维持 α-螺旋的氢键作用减弱,蛋白质分子展开程度增加;β-折叠是蛋白质分子间的有序排列,通过分子间氢键维持,加热后其含量增加表明蛋白质分子间氢键作用增强,导致蛋白质分子间聚集程度增加[33]。钟朝辉等[34]研究了加热对鱼鳞胶原蛋白二级结构的影响,结果表明高温使维系胶原蛋白三螺旋结构的氢键破坏,逐渐解螺旋并转变为无规则、转角和折叠结构。本研究中,随着加热时间延长(60—90 min),α-螺旋含量降低,β-折叠含量升高,可能是加热导致α-螺旋解旋并重排为β-折叠;而120 min的β-折叠含量为零,可能是α-螺旋解旋速率越来越快,导致展开后的蛋白质来不及重排成β-折叠结构,同时已经存在的β-折叠被降解。3.4 抽提时间对凝胶特性和溶液透明度的影响
凝胶强度是衡量凝胶质量的重要指标之一,商业凝胶的凝胶强度为100—300 g[35],主要与凝胶来源和凝胶提取方法等因素有关[19,26]。不同物种来源的胶原蛋白分子的结构组成不同、复杂程度不一,其三股螺旋分子间交联度的差异造成热稳定性不同,直接影响凝胶强度等功能特性[36]。通常,来源于猪、牛的凝胶强度为200—240 g,而鱼的凝胶强度差异较大,为0—270 g。此外,凝胶提取的热处理程度也会影响其凝胶强度。CHEN等[5]研究表明过度加热会导致低分子量组分比例升高,凝胶强度减小。DE MORAES等[4]也发现加热时间会影响蛋白质水解程度进而影响蛋白质的凝胶强度。本研究中(图3-A),20、40和60 min组的凝胶强度均高于100 g,优于90和120 min组,与CHEN等[5]研究结果一致。但是,CBP凝胶强度低于猪、牛的凝胶强度,可能是因为CBP是混合蛋白,而文献研究的是高纯度胶原蛋白的凝胶强度;此外,原料种类对其凝胶强度也有影响。董宪兵[10]研究发现,随着抽提时间延长,CBP中高分子量组分溶解性变好,溶液透明度升高,但是会发生轻微的美拉德反应,产生褐色素使CBP颜色变深。DE MORAES等[4]也指出,高温导致蛋白质等富含羰基和氨基的物质发生美拉德反应,从而影响蛋白凝胶的色泽。本研究中不同时间的CBP凝胶色泽差异显著,即与高温下蛋白质的美拉德反应有关。
4 结论
抽提时间对总固形物、粗蛋白含量、羟脯胺酸含量和鸡骨蛋白的降解程度均有显著影响。随着抽提时间延长,总固形物、粗蛋白和羟脯胺酸含量均显著增加,粗蛋白提取率显著升高。高分子量的蛋白随着抽提时间延长不断溶出,并降解为低分子量多肽和氨基酸,提取液透明度显著升高。抽提时间对鸡骨蛋白凝胶特性有显著影响,20、40和60 min组的凝胶强度优于90和120 min组,色泽分析表明40和60 min组的鸡骨蛋白制备的凝胶色泽最佳。综上所述,提取时间为40和60 min的粗蛋白综合品质优于其他各组,因此更适合制备凝胶。The authors have declared that no competing interests exist.
