0 引言
【研究意义】肌原纤维蛋白(myofibrillar proteins,MP)热诱导凝胶形成过程中,蛋白分子由天然状态转变到变性状态,构象改变,分子链伸展,各种基团暴露,相邻多肽链间吸引力和排斥力达到平衡,最终形成稳定的三维网络结构[1]。形成和维持蛋白质结构及其凝胶网状结构的作用力主要有静电相互作用、疏水相互作用、氢键、二硫键等[2]。pH通过影响肌原纤维蛋白氨基酸侧链电荷分布,改变蛋白质分子间的相互作用,影响蛋白质及其热诱导凝胶的非共价键作用力和结构。研究pH对肌原纤维蛋白热凝胶非共价键作用力和结构的影响,探究非共价键作用力对蛋白质及其凝胶结构的控制机理,对阐述凝胶形成机制具有十分重要的意义。【前人研究进展】LIU等[3]通过添加DTT、尿素等化学试剂研究蛋白质间的作用力,发现蛋白质热诱导凝胶形成过程中非共价键的贡献比共价键(二硫键)更大。Zeta电位是带电颗粒表面剪切层的电位,是表征胶体体系稳定性的重要指标,可用于描述胶体(如蛋白)颗粒之间的静电相互作用[4-5]。拉曼光谱根据光子频率变化就可判断出分子中所含有的化学键或功能基团,通过多肽链骨架和氨基酸侧链振动引起拉曼条带强度改变来反映这些基团周围微环境的变化[6-7]。蛋白质中的苯丙氨酸和色氨酸在拉曼光谱中出现的特征峰能够反映微环境中疏水相互作用的变化[8]。酪氨酸残基在拉曼光谱存在的两个谱峰,能反映蛋白凝胶中酪氨酸氢键的变化[7],ZHANG等[2]利用拉曼光谱法研究了压力对肌原纤维蛋白凝胶非共价键作用力的影响。蛋白二级结构是指多肽链的部分氨基酸借助于氢键沿一维方向排列成具有周期性有规则的空间排列,主要包括α-螺旋、β-折叠、β-转角、无规则卷曲等形式[9]。肌原纤维蛋白分子在拉曼光谱1 600—1 700 cm-1附近的条带属于酰胺带I的伸缩振动,是由脂肪族仲酰胺C=O的伸缩振动引起,部分来自Cα-C-N的弯曲振动、C-N的伸缩振动和N-H的面内弯曲振动[6,10]。通过酰胺带I最大峰的波数可以对蛋白质二级结构进行定量分析[10]。CHOI[11]用拉曼光谱法研究了普通荞麦中球蛋白的二级结构。【本研究切入点】氢键等非共价键作用力难以量化测定,直接测量的方法几乎没有。传统研究凝胶作用力的方法是通过添加化学试剂(如SDS、尿素等),测定凝胶特性来推测作用力变化,由于化学试剂同时影响多种作用力,其方法的科学性有待考证。拉曼光谱法从分子水平定性定量分析蛋白质的功能基团直接测定蛋白凝胶作用力和二级结构含量,适用高浓度的蛋白凝胶,并且无损蛋白质结构,不受水的干扰 [12]。【拟解决的关键问题】在不同pH条件下用Zeta电位仪、拉曼光谱仪、粒径仪直接测量肌原纤维蛋白凝胶的静电作用、疏水相互作用、氢键、二级结构含量、蛋白粒径分布的变化,同时用电镜观察凝胶微观结构;探讨凝胶非共价键作用力与结构的关系。1 材料与方法
试验于2015年5—12月在南京财经大学粮油质量检测工程技术研究中心进行。1.1 主要材料与试剂
活AA鸡(40日龄)30只,其中公鸡和母鸡各15只,购于南京青龙山养鸡场,宰杀,取鸡胸肉,于-18℃下储存。试验所用化学试剂均为分析纯。
1.2 主要仪器与设备
DS-1高速组织捣碎机,上海标本模型厂;Avanti J-26XP高效冷冻离心机,美国Beckman Coulter公司;Zeta电位分析仪(Zetasizer Malvern Nano ZS90),英国马尔文公司;动态光散射粒度仪(Mastersizer 2000,Malvern Instruments Ltd.,Worcester shire,UK),英国马尔文公司;LABRAM 800激光拉曼光谱仪,法国JY公司;日本TM 300扫描电镜,日本日立公司。1.3 试验方法
1.3.1 肌原纤维蛋白的提取 鸡胸肉于4℃下解冻20 min,剔除结缔组织和脂肪,切碎后用于提取鸡胸肉肌原纤维蛋白,蛋白提取和浓度测定方法参考文献[13]。4℃下保存。1.3.2 pH处理肌原纤维蛋白热诱导凝胶的制备 用磷酸盐缓冲液(10 mmol·L-1K2HPO4,0.6 mol·L-1 KCI,pH 6.0)溶解肌原纤维蛋白沉淀,分别配制1 mg·mL-1、40 mg·mL-1的肌原纤维蛋白溶液,用1 mol·L-1的NaOH或HCI将蛋白溶液的pH分别调至5.0、5.5、6.0、6.5、7.0,水浴加热至65℃(1℃·min-1)制成凝胶,保温20 min,取出,自然冷却,并在4℃下保存9—16 h,分别用于其非共价键作用力和结构的测定。
1.3.3 静电相互作用的测定 将肌原纤维蛋白凝胶样品注入Zeta电位仪后,盖上塞子,进行电位测试。注意勿留气泡。测试参数:散射角:90°,平衡时间:60 s,测试温度:25℃。每次测定最终电位值都为连续3次测试的平均值。
1.3.4 疏水相互作用、氢键、二级结构的测定 用激光拉曼光谱仪进行测量,激发波长514.5 nm;激光出射功率:10 mW;显微物镜:50倍长焦距;光栅:600;狭缝:200 μm;积分时间:60 s;重复3次,累加得谱。
1.3.5 肌原纤维蛋白粒径分布测定 将肌原纤维蛋白样品缓慢加入Malvern动态光散射粒度仪中,达到测试范围,进行测试[14],每次测定最终粒径分布均为连续3次测试的平均值。
1.3.6 肌原纤维蛋白凝胶微观结构的观察 将制备的肌原纤维蛋白凝胶切块,用2.5%的戊二醛溶液固定2—3 h,pH 7.4的磷酸盐清洗,进行乙醇(50%、70%、90%、95%和100%)梯度脱水,每次20—30 min,再用叔丁醇置换,-70℃冷冻干燥,镀膜后用扫描电镜(SEM)观察微观结构,加速电压15 kV。
1.3.7 统计分析 用SPSS17.0软件进行相关性分析和方差分析,若方差分析效应显著则用Duncan multiple range test进行多重比较(P<0.05)。
2 结果
2.1 pH对肌原纤维蛋白凝胶静电相互作用的影响
如图1所示,随着pH靠近肌原纤维蛋白等电点(等电点约为5.0—5.2[15-16]),肌原纤维蛋白热诱导凝胶Zeta电位绝对值显著降低(P<0.05),在5.0时Zeta电位值为-0.26,电位绝对值最小,在等点电附近,Zeta电位值接近0。中性条件下Zeta电位值为-17.87,电位绝对值最大。蛋白质分子中几乎所有的带电基团都分布在蛋白质分子表面。在蛋白质聚集过程中静电相互作用通常表现为相互斥力,Zeta电位值为负值,表明肌原纤维蛋白呈负电荷。在等电点时,肌原纤维蛋白分子中正电荷和负电荷的数目接近相等,吸引和排斥的静电作用达到平衡,此时的静电相互作用最小,等电点时有利于蛋白质-蛋白质相互作用[17]。靠近中性条件时,氢离子浓度减小,蛋白凝胶表面负电荷增多,Zeta电位值绝对值增大,因此,静电斥力随着pH的增加而增大。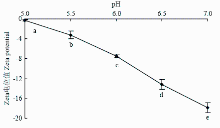 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1pH对肌原纤维蛋白凝胶Zeta电位的影响不同小写字母表示处理间差异显著(P<0.05)。下同
-->Fig. 1Effect of pH on the Zeta potential of myofibrillar protein heat-induced gelDifferent letters indicate significant different (P<0.05). The same as below
-->
2.2 pH对肌原纤维蛋白凝胶疏水相互作用的影响
苯丙氨酸和色氨酸的某些基团在拉曼光谱中出现特征谱带[6],其中将1 003 cm-1处苯丙氨酸环的呼吸振动作为内标(强度不随蛋白质结构改变而发生变化),760 cm-1处色氨酸伸缩振动反映了微环境中疏水相互作用的变化[7]。随着pH远离中性条件7.0,肌原纤维蛋白热诱导凝胶760 cm-1处归一化强度I760/I1003比值逐渐增大(图2),表明蛋白分子间疏水相互作用在pH降低时逐渐增强。在pH 5.0时,I760/I1003比值最大,达到0.927;在pH 7.0时,I760/I1003比值最小,为0.860,pH 5.0、5.5,pH6.0、6.5和pH 7.0这三组比值间差异显著(P<0.05)。离等电点较近时,蛋白分子间减弱的静电斥力有利于疏水相互作用的增强,蛋白间的作用加强,蛋白与水的作用减弱[16]。远离等电点时,肌原纤维蛋白分子负电荷数量增加,静电斥力增大,肌原纤维蛋白分子充分展开,包埋的色氨酸等疏水性氨基酸得以暴露,疏水相互作用减弱,表现为I760/I1003比值的减小,同时蛋白与水的作用增强。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2pH对肌原纤维蛋白凝胶归一化的760 cm-1处条带强度的影响
-->Fig. 2Effect of pH on the normalized intensity of the 760 cm-1 band of myofibrillar protein heat-induced gel
-->
2.3 pH对肌原纤维蛋白凝胶氢键的影响
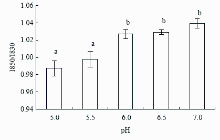
I850/I830可以反映酪氨酸残基苯环上-OH是与溶剂水分子生成氢键(“暴露”式)还是与蛋白质分子其他基团(如-COOH)生成氢键(“埋藏”式)。比值I850/I830≥1.25,说明酪氨酸残基是完全暴露在极性环境或者水环境中,如果I850/I830≤0.5,表明酪氨酸残基处在一个埋藏的疏水环境中或者作为强氢键供体的状态存在。比值在0.5—1.25,则表明酪氨酸残基既有“暴露”式,又有“埋藏”式[2]。肌原纤维蛋白混合凝胶体系中,氢键作用包括了蛋白分子间以及蛋白分子和溶质水之间的氢键作用。如图3所示,I850/I830比值在远离中性条件时呈下降的趋势,在pH 7.0时I850/I830比值最大,为1.039,在pH 5.0时I850/I830比值最小,为0.987。pH 5.0、5.5和pH 6.0、6.5、7.0这两组比值间差异显著(P<0.05)。I850/I830比值在0.5—2.5,说明酪氨酸残基形成的氢键既包括暴露的氢键也包括埋藏的氢键。随着靠近等电点,I850/I830比值减小表明肌原纤维蛋白酪氨酸残基苯环上的-OH基团与水分子生成的氢键逐渐转变为与其他残基(如-COOH)生成的氢键,肌原纤维蛋白肽链分子间的氢键作用增强,蛋白分子与水的氢键作用减弱。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3pH对肌原纤维蛋白凝胶归一化的I850/I830强度随的影响
-->Fig. 3Effect of pH on the normalized intensity of the I850/I830 doublet bands of myofibrillar protein heat-induced gel
-->
远离等电点时,静电斥力增大,蛋白间发生解离,基团与基团间氢键作用被破坏,导致蛋白分子间的氢键减少,肌原纤维蛋白分子展开,同时疏水性氨基酸暴露,疏水相互作用减弱,酪氨酸残基处于一个疏水性微环境中,氢键与水的结合增多,故靠近中性条件是埋藏的肌原纤维蛋白分子间氢键转变为蛋白分子与水分子之间氢键的过程。增大的静电斥力,使得蛋白完全伸展,在蛋白表面给水提供了更多的结合位点,增大水化的表面积[18],故肌原纤维蛋白分子与水的氢键作用增强。
2.4 pH对肌原纤维蛋白及其凝胶二级结构的影响
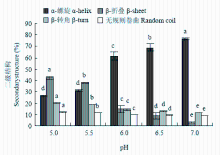
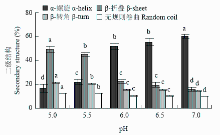
蛋白质二级结构是指在多肽链的某些氨基酸残基周期性的空间排列,包括α-螺旋、β-折叠、β-转角和无规则卷曲结构。拉曼光谱中酰胺带I处振动是与蛋白质二级结构密切相关,包括高α-螺旋含量的酰胺I带振动主要集中在(1 655±5)cm-1处,高β-折叠含量的酰胺I带振动的拉曼光谱条带主要集中在(1 670±5)cm-1,此外,还有1 680 cm-1处β-转角和(1 665±5)cm-1处的无规则卷曲[11]。如图4所示,pH从7.0降到5.5,肌原纤维蛋白α-螺旋的含量从76.79%显著降低到31.16%(P<0.05);pH 5.5—5.0,α-螺旋含量变化不显著(P>0.05);pH 7.0—5.0,肌原纤维蛋白β-折叠含量从2.92%显著增加到42.33%(P<0.05);β-转角和无规则卷曲含量总体呈上升的趋势(P<0.05)。如图5所示,从pH 7.0到pH 6.5,肌原纤维蛋白热诱导凝胶的α-螺旋含量从59.96%降低到55.24%(P<0.05),β-折叠含量从15.83%显著增加到19.44%(P<0.05),β-转角和无规则卷曲含量都显著增长(P<0.05);pH 6.5—6.0,各种结构含量变化都不显著(P>0.05);接近等电点(pH 6.0—5.0),肌原纤维蛋白热诱导凝胶的α-螺旋含量从51.61%降低到16.76%(P<0.05),β-折叠含量从22.23%显著增加到48.93%(P<0.05);β-转角和无规则卷曲含量同样呈上升的趋势(P<0.05)。肌原纤维蛋白及其热凝胶二级结构中α-螺旋含量和β-折叠含量最多,随pH降低,各种结构变化趋势一致,有序结构总体减少,无序结构总体增加,凝胶的α-螺旋含量总体较低于蛋白加热前,β-折叠含量比蛋白加热前较多。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4pH对肌原纤维蛋白二级结构含量的影响
-->Fig. 4Effect of pH on the secondary structure content of myofibrillar protein
-->
α-螺旋结构的稳定主要由单肽链上羰基(C=O)与(N-H)间形成的链内氢键维持[19],β-折叠结构则依赖蛋白质分子肽链间的氢键形成。静电相互作用是影响蛋白质二级结构的重要非共价键作用力之一[20],pH通过影响带电氨基酸和蛋白表面α-羧基、α-氨基末端基团的质子化状态来影响蛋白分子间的相互作用[21]。从二级结构含量变化上来看,靠近等电点,蛋白负电荷减少,静电斥力减小,导致蛋白分子内的氢键减少,氢键与水的结合减弱,分子间的氢键增多,对应的是α-螺旋含量减少,β-折叠含量增多。静电斥力的减弱使得蛋白分子内氢键的增多是α-螺旋含量减少的原因[22]。加热会使α-螺旋结构解开[23],埋藏的疏水性氨基酸得以暴露,导致肌原纤维蛋白间疏水相互作用的变化,升温过程中α-螺旋逐渐减少,β-折叠逐渐增加[24-25],故肌原纤维蛋白凝胶的α-螺旋含量总体比蛋白加热前低,β-折叠含量则比蛋白加热前多。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5pH对肌原纤维蛋白热诱导凝胶二级结构含量的影响
-->Fig. 5Effect of pH on the secondary structure content of myofibrillar protein heat-induced gel
-->
2.5 pH对肌原纤维蛋白粒径分布的影响
D10、D50、D90分别表示肌原纤维蛋白粒径累计值达到体积10%、50%、90%时的粒径大小,D50反应肌原纤维蛋白的平均粒径大小。如图6所示,肌原纤维蛋白的粒径大小分布在0—3 500 μm,90%的颗粒大小分布在1 000 μm以下,50%的颗粒大小分布在300 μm以下,10%的颗粒大小在50 μm以下。由表1可知,随着pH的降低,D10从13.4 μm上升到48.4 μm,D50从38 μm上升到253 μm,pH 5.0,pH 5.5、6.0和pH 6.5、7.0这三组间差异显著(P<0.05)。D90从236 μm上升到805 μm,pH 5.0,pH 5.5、6.0,pH 6.5和pH 7.0这4组差异显著(P<0.05)。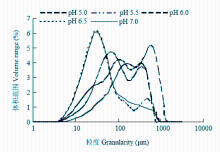 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6肌原纤维蛋白粒径分布随pH的变化
-->Fig. 6Effect of pH on the particle size distribution of myofibrillar protein
-->
Table 1
表1
表1pH对肌原纤维蛋白粒径大小的影响
Table 1Effect of pH on myofibrillar protein particle size
| 粒径大小 Particle size (μm) | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 |
|---|---|---|---|---|---|
| D10 | 48.4±1.49a | 26.4±1.42b | 26.2±1.51b | 13.3±1.32c | 13.4±0.3c |
| D50 | 253±8a | 97.5±7.47b | 97±10.02b | 37.4±4.07c | 38±3.60c |
| D90 | 805±17.05a | 446±20.52b | 429±15.62b | 307±14.93c | 236±18.52d |
新窗口打开
当pH接近等电点时蛋白质分子会因增大的疏水相互作用而形成随机聚合物,随着pH增大,增大的静电斥力会阻止蛋白间的随机聚集,导致形成线性多聚体[26]。蛋白质粒径变化主要由蛋白质分子内的交联和聚集引起[27]。靠近等电点附近时,表面净电荷最少,静电斥力最小,蛋白发生解聚,充分伸展,结构变得无序,疏水基团等活性残基的暴露,非共价作用力形成,蛋白质之间的作用最强,蛋白聚集速度最快,形成较大的聚集体,此时粒径最大。靠近中性时,静电斥力增大,蛋白间结合的能力减弱,不易发生聚集,此时粒径最小。
2.6 pH对肌原纤维蛋白凝胶微观结构的影响
肌原纤维蛋白凝胶微观结构如图7所示,在pH 5.0和5.5时,肌原纤维蛋白凝胶微观结构中有较多球状或棒状的聚集块,即不溶解的肌原纤维蛋白,pH 5.0时多孔结构不明显,pH 5.5时出现多孔结构,但多孔数量较少,凝胶网状结构比较无序、致密;靠近中性条件时,凝胶网络结构趋向有序和有层次,此时形成多孔和较大孔径的三维网络结构,不溶解的棒状结构消失,在pH 7.0时,网状结构中的孔径达到最大。在净电荷数量不多时,排斥的静电相互作用和吸引的疏水相互作用,分子间的氢键保持较好的平衡,易于形成有序的凝胶网络结构[28]。在pH 7.0时,肌原纤维蛋白质分子表面存在较多的负电荷,静电排斥力占主导地位,因而不易发生聚集和交联[29],此时形成的凝胶网状结构凝胶孔径较大,结构有序。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7pH对肌原纤维蛋白凝胶微观结构的影响
-->Fig. 7Effect of pH on the microstructures of myofibrillar protein heat-induced gel
-->
2.7 相关性分析
由表2可见,pH与凝胶的静电相互作用、疏水相互作用呈极显著负相关(P<0.01),与氢键、α-螺旋含量呈显著正相关(P<0.05),与β-折叠、β-转角和无规则卷曲含量显著负相关(P<0.05)。表明pH显著影响静电斥力、疏水相互作用、分子间氢键和二级结构含量。静电相互作用、疏水相互作用与凝胶α-螺旋含量显著负相关(P<0.05),与凝胶β-折叠、β-转角和无规则卷曲含量显著正相关(P<0.05)。氢键与凝胶α-螺旋含量极显著正相关(P<0.05),与凝胶β-折叠、β-转角和无规则卷曲含量极显著负相关(P<0.01),表明非共价键作用力显著影响二级结构含量。Table 2
表2
表2pH与肌原纤维蛋白凝胶非共价键作用力、二级结构之间的相关性
Table 2Correlation of pH, non-covalent forces, secondary structure
| 静电相互作用 Electrostatic interaction | 氢键 Hydrogen bonding | 疏水相互作用 Hydrophobic interaction | α-螺旋 α-helix | β-折叠 β-sheet | β-转角 β-turn | 无规则卷曲 Random coil | |
|---|---|---|---|---|---|---|---|
| pH | -0.994** | 0.958* | -0.989** | 0.939* | -0.939* | -0.939* | -0.939* |
| 静电相互作用 Electrostatic interaction | -0.936* | 0.984** | -0.921* | 0.921* | 0.921* | 0.921* | |
| 氢键 Hydrogen bonding | -0.961** | 0.993** | -0.993** | -0.993** | -0.993** | ||
| 疏水相互作用 Hydrophobic interaction | -0.939* | 0.939* | 0.939* | 0.939* | |||
| α-螺旋α-helix | -1.000** | -1.000** | -1.000** | ||||
| β-折叠β-sheet | 1.000** | 1.000** | |||||
| β-转角 β-turn | 1.000** |
新窗口打开
3 讨论
肌原纤维蛋白聚集和交联形成的热诱导凝胶网络结构是蛋白质分子中引力和斥力平衡的结果,斥力由蛋白表面电荷提供,而引力是由蛋白受热解开暴露出的功能基团形成[30]。靠近等电点时,蛋白分子中正电荷和负电荷的数目接近相等,吸引和排斥的静电作用达到平衡,此时的静电相互作用最小,蛋白多肽链结构中的非共价键平衡被打破,减弱的静电斥力促进疏水相互作用的增强,并减少蛋白表面的氢键结合位点,导致蛋白分子内的氢键减少,蛋白与蛋白之间的作用增强,蛋白与水的作用减弱[16]。靠近中性条件时,氢离子浓度减小,蛋白表面负电荷增多,此时的静电斥力达到最大,肌原纤维蛋白分子充分伸展,包埋的色氨酸等疏水性氨基酸得以暴露,表面疏水性增大,疏水相互作用减弱,暴露出的酪氨酸残基处于一个疏水性微环境中,蛋白与溶质水结合形成的氢键数量增多。LIU等[22]通过圆二色谱(circular dichroism,CD)研究猪肉肌球蛋白二级结构时发现,随着pH从7.0向等电点靠近,α-螺旋结构含量减少,而β-折叠含量增多。费英等[16]研究发现随着pH偏离肌原纤维蛋白等电点范围(约5—5.2),向中性条件靠近时,肌原纤维蛋白的α-螺旋呈现增多的趋势。本试验中随着pH从7.0接近等电点,肌原纤维蛋白及其凝胶的α-螺旋含量都逐渐减少,β-折叠含量显著增多,凝胶的α-螺旋含量相比蛋白加热前要少,β-折叠含量则相比要多。WANG等[31]研究了肌球蛋白热凝胶形成与其二级结构含量变化之间的关系,发现蛋白凝胶形成过程中,在55℃时肌球蛋白的伸展导致α-螺旋的减少,在65℃时蛋白分子间氢键增多导致β-折叠结构的增加。在相同pH条件下,加热导致α-螺旋含量的降低,β-折叠含量的增加。β-折叠结构形成是蛋白分子聚集和交联的前提,α-螺旋和无规则结构转化为β-折叠,β-折叠含量达到一定临界水平才会形成凝胶网络,平行或反平行β-折叠分子间的氢键使得凝胶网络更加稳定[32]。加热使得α-螺旋结构解开,而后通过分子间氢键作用,暴露的疏水基团之间的疏水作用形成了β-折叠结构或β-转角和无规则卷曲结构。故本试验中随着pH降低,蛋白和凝胶中的有序结构总体减少,无序结构总体增加。在同一pH条件下,肌原纤维蛋白凝胶相比蛋白中的α-螺旋含量较少,而β-折叠较多。杨玉玲等[25]通过CD法研究了从30℃加热到80℃时肌原纤维蛋白二级结构的变化情况,发现其α-螺旋含量显著下降,β-折叠含量显著提高,与本研究结论一致。
静电相互作用、疏水相互作用、氢键与二级结构含量都呈显著相关(P<0.05),表明非共价作用力显著影响肌原纤维蛋白二级结构。α-螺旋结构由蛋白分子内氢键形成,β-折叠结构由蛋白分子间的氢键形成。疏水相互作用增大使蛋白间作用加强,破坏了维持α-螺旋结构稳定的肽链内部氢键,使α-螺旋结构解开或向其他构象转化[33]。靠近等电点,肌原纤维蛋白负电荷减少,静电斥力减小,导致蛋白分子内的氢键减少,氢键与水的结合减少,α-螺旋含量减少,分子间的氢键增多,疏水相互作用形成的β-折叠含量或β-转角和无规则卷曲结构相继增多。静电斥力减小,使得蛋白分子内氢键减少是α-螺旋含量减少的原因,分子间的氢键增多是β-折叠结构增多的原因。
加热时,折叠的肌原纤维蛋白分子受热变性,侧链结合键断开使得蛋白伸展,活性基团暴露(如疏水残基、氢键结合位点等),同时蛋白质分子构象也发生改变,随着温度升高,蛋白质分子通过活性基团的非共价键作用,发生交联和聚集形成大的胶凝体,进而构建复杂的三维网络结构。凝胶网络结构取决于蛋白伸展和聚集的相对快慢,当蛋白的伸展快于聚集,此时蛋白分子能充分展开、加热使蛋白缓慢聚集,形成有序、细致的凝胶;反之,则形成粗糙无序的凝胶结构[34]。费英等[16]通过SEM观察发现猪肉肌球蛋白在等电点时形成粗糙、无序的凝胶网络结构,在pH 7.0时形成致密、有序的凝胶网络结构。肌原纤维蛋白中疏水性氨基酸暴露与包埋引起蛋白质间疏水相互作用变化是粒径改变的主要原因[33]。本试验中疏水作用力的改变是由静电斥力的改变引起。等电点时,静电斥力最小,疏水相互作用最强,蛋白聚集发生在伸展之前,此时蛋白分子聚集速率最快,形成较大蛋白聚集颗粒,加热形成的凝胶网络结构粗糙、紧密,胶孔不明显,同时有大量球状或棒状的聚集块存在。在靠近中性时,较大的静电斥力使蛋白分子间保持分离状态,蛋白分子充分展开,不易聚集,蛋白颗粒较小;加热使得蛋白缓慢聚集,变性链定向且有序,球状或棒状的聚集块消失,使得凝胶微观结构有序,凝胶孔径最大、数量最多。凝胶三维网络结构影响肉制品的功能特性,韩敏义等[18]认为在中性条件时形成的凝胶孔径增大是其保水性上升的主要原因。
4 结论
pH显著改变肌原纤维蛋白凝胶的静电相互作用、疏水相互作用、氢键和二级结构含量。在pH由中性靠近等电点时,凝胶的静电斥力减小,疏水相互作用增大,分子间氢键作用增大,导致其α-螺旋含量减小,β-折叠含量增多。这也是凝胶微观结构由有序趋于无序,凝胶孔径逐渐减小的原因。因此,肌原纤维蛋白凝胶非共价键作用力可决定凝胶二级结构和微观结构。The authors have declared that no competing interests exist.
