0 引言
【研究意义】叶片形态、大小和颜色直接决定了群体光能利用效率,进而影响作物的产量和品质,受到育种和分子生物学家的广泛关注[1]。剑叶是水稻最重要的功能叶,叶片大小和形态与单株产量、单穗重、穗粒数均呈极显著正相关,同时,剑叶叶型也是水稻理想株型的重要构成部分[2-3]。因此,阐明剑叶发育的分子机理对水稻生产具有重要意义。【前人研究进展】目前,利用突变体已在水稻中克隆了一系列调控叶片大小和形态发育的基因,如窄叶基因NAL1[4]、NAL2/NAL3[5]、NAL7[6],窄卷叶基因NRL1[7-8],卷叶基因CFL1[9]、SRL1[10]和RL14[11]等,为阐释水稻叶片发育的分子机理奠定了基础。然而,这些突变体多表现为阶段性或全生育期所有叶片发育缺陷,剑叶特异异常发育的突变体还鲜有报道。目前普遍认为剑叶发育属于复杂性状,已利用F2分离群体、双单倍体(DH)、重组自交系(RILs)和单片段代换系(CSSLs)等材料,在水稻12条染色体上定位了系列控制剑叶大小的QTL。YAN等[12]利用IR64/Azucena衍生DH群体在第4染色体上定位到一个控制剑叶大小的QTL。KOBAYASHI等[13]利用Milyang23/Akihikari组合衍生的RIL群体(191个家系)定位到7个控制剑叶长度和5个控制剑叶宽度的QTL。近来,BIAN等[14]利用CSSLs群体鉴定了4个控制水稻剑叶宽度、1个控制剑叶面积和2个控制剑叶角度的QTL;ZHANG等[3]则利用RIL群体在海南和杭州两地种植,检测到9个控制剑叶长度和14个控制剑叶宽度的QTL,其中仅7个为先前鉴定的QTL;CHEN等[15]利用RIL群体也鉴定到5个控制剑叶叶宽发育的QTL,并认为主效QTL qFLW4是NAL1的同义突变,其通过选择性剪切调控剑叶宽度的发育。【本研究切入点】尽管目前已经鉴定到大量控制剑叶发育的QTL,但这些研究主要集中在叶片大小上,对剑叶形态发育还鲜有报道。利用EMS诱变籼型水稻恢复系缙恢10号,从其后代鉴定到一个矮化,剑叶基部特异卷曲突变体,暂命名为dcfl1(dwarf and curled flag leaf 1)。【拟解决的关键问题】本研究对突变体dcfl1进行了形态鉴定、细胞学观察和基因精细定位等研究,为DCFL1的克隆和功能研究奠定了基础,有利于水稻剑叶形态发育的分子机理的阐释。此外,剑叶基部卷曲导致叶片直立,有利于群体的通透性,dcfl1在水稻育种中也具有重要的应用价值,是一类新型种质资源。1 材料与方法
1.1 试验材料
突变体dcfl1来自西南大学水稻所培育的晚籼恢复系缙恢10号EMS诱变库,经过多世代连续种植,突变性状已稳定遗传。配置西农1A/ dcfl1杂交组合,调查西农1A、dcfl1及其杂交组合F1和F2的株高及剑叶形态,进行遗传分析,利用F2群体隐性单株进行基因定位。西农1A是西南大学水稻所选育的不育系,整个生育期株高及叶片均正常。1.2 主要农艺性状鉴定
田间小区种植dcfl1和野生型缙恢10号,成熟期分别测量10株材料的株高和节间长并调查穗长、有效穗数、穗粒数、穗实粒数、结实率和千粒重等主要农艺性状。1.3 光合色素含量测定
开花期,参照文献[16]描述的方法测定dcfl1和野生型的光合色素含量,测定部位为剑叶、倒2叶和倒3叶的叶片中部。1.4 石蜡切片分析
孕穗期和抽穗期分别选取未全展的剑叶基部和全展剑叶基部,根据文献[17]略有改动。用FAA固定液固定后,依次进行乙醇脱水、二甲苯透明、石蜡包埋、切片、番红固绿染色等步骤。并在体视镜下观察叶片形态。1.5 扫描电镜观察
田间种植三叶期秧苗,移至扫描电镜室,利用日立SU350型扫描电镜在-20℃冷冻条件下观察第二片叶的叶鞘内表皮细胞。1.6 DNA的提取
在西农1A/ dcfl1的F2群体中分别选取正常和突变单株各10株,构成正常基因池和突变基因池。采取改良的CTAB法[18]提取基因池DNA,采用碱煮法[19]提取定位群体单株基因组DNA。1.7 SSR分析
RM系列SSR引物来源于http://www.gramene.org/网站。根据缙恢10号和西农1A的DNA序列差异,利用Vector 10软件设计InDel标记。SSR引物及InDel标记均由上海英俊生物公司合成。PCR反应总体积12.5 μL,包括1.25 μL的10×PCR缓冲液、0.65 μL的25 mmol·L-1 MgC12、0.5 μL 2.5 mmol·L-1 dNTPs、8.0 μL的ddH2O、1.0 μL的10 μmol·L-1引物、1.0 μL的模板DNA和0.1 μL的5 U·μL-1 Taq酶。PCR反应程序为94℃ 5 min;94℃ 20 s,55℃ 20 s,72℃ 20 s,35个循环; 72℃ 10 min。PCR产物用10%的非变性聚丙烯酰胺凝胶电泳后,0.1%AgNO3染色10 min,去离子水漂洗2次,1%质量浓度的氢氧化钠和0.1%甲醛混合液显色,观察照相。1.8 遗传图谱构建
西农1A/dcfl1杂交组合的F2群体中,具有西农1A带型的单株记为A,具有dcfl1带型的单株记为B,具有F1杂合体带型的单株记为H。利用公式[(H+2A)/2n]×100%计算遗传重组率,其中,H代表定位群体中杂合体带型单株的数量,A代表正常株带型单株的数量,n表示F2群体隐性单株总株数。2 结果
2.1 dcfl1的形态鉴定
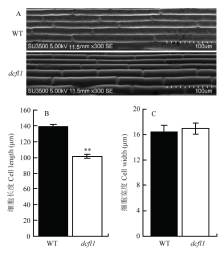
突变体dcfl1整个生育期都表现出矮化性状。播种后5 d的dcfl1籽苗地上部长度只有野生型的一半,二叶期也明显矮于野生型。dcfl1的倒1节间、倒2节间和穗长显著短于野生型,进而导致株高半矮化(图1)。扫描电镜观察野生型和dcfl1叶鞘内表皮细胞,发现dcfl1的细胞长度明显比野生型短,达到了极显著水平,而细胞宽度并无显著差异(图2),暗示突变体的矮化性状可能是由于细胞长度变短而导致的。农艺性状分析(表1)发现,dcfl1的有效穗数为14.24,极显著高于野生型的11.62,穗粒数、实粒数、结实率和千粒重等则无显著变化。此外,dcfl1的叶片呈深绿色(图1-D),光合色素测定表明剑叶、倒2叶和倒3叶的叶绿素a含量均极显著增加,叶绿素b含量无显著变化,进而导致dcfl1的叶绿素a/b值极显著增加;dcfl1的类胡萝卜素含量虽略有升高,但仅剑叶中的含量极显著高于野生型。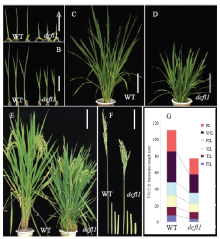 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1突变体dcfl1和野生型(WT)缙恢10号形态鉴定
A:播种5 d后野生型WT与突变体dcfl1;B:两叶期野生型WT与突变体dcfl1;C:分蘖期野生型植株;D:分蘖期突变体dcfl1植株;E:灌浆期野生型(左)和突变体(右)的植株;F:野生型(左)和突变体(右)各节间长;G:野生型和突变体的节间比较。A和B中,Bar=2 cm;C、D、E和F中,Bar=10 cm
-->Fig. 1Morphology identification of the dcfl1 and the wild type
A: WT (left) and dcfl1(right) seedlings at five-day-old; B: WT (left) and dcfl1(right) at two leaf stage; C: Plant phenotype of WT at the tillering stage; D: Plant phenotype of dcfl1 mutant at the tillering stage; E: Plant phenotype of WT (left) and dcfl1 (right) at the filling stage; F: Internodes length of the WT (left) and the dcfl1 (right); G: Comparison of the internodes length of the WT (left) and the dcfl1 (right). A and B, Bar=2 cm; C-F, Bar=10 cm
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2突变体dcfl1和野生型(WT)缙恢10号细胞大小比较
A:野生型WT(上)和突变体dcfl1(下)的第二叶叶鞘表皮扫描电镜图;B和C:野生型WT与突变体dcfl1的细胞长度(B)和宽度(C)统计图;**:在P=0.01水平上差异显著
-->Fig. 2Comparison of cell length and width between the dcfl1 and the wild type
A: SEM images of the second leaf sheath surface of WT (top) and dcfl1 (bottom); B, C: Statistical chart of cell length and width of the WT and dcfl1; **: Indicated the significant difference at the level of P=0.01
-->
Table 1
表1
表1突变体dcfl1与野生型的农艺性状
Table 1Agronomic traits of dcfl1 mutant and the wild type
| 性状 Trait | 材料 Material | |
|---|---|---|
| WT | dcfl1 | |
| 有效穗 Effective panicle | 11.62±1.31 | 14.24±0.98** |
| 穗粒数 Seed number per panicle | 183.71±17.22 | 174.49±15.64 |
| 穗实粒数 Filled seed setting number | 146.26±12.82 | 138.63±13.41 |
| 结实率 Seed setting rate (%) | 79.59±2.99 | 79.47±2.56 |
| 千粒重 1000-grain weight (g) | 27.19±0.81 | 26.45±0.67 |
新窗口打开
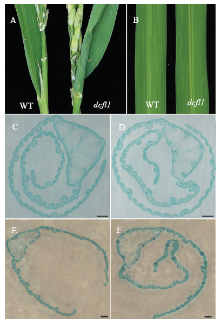
抽穗期dcfl1剑叶的叶片和叶鞘连接处硬化,叶基部展开受阻,半边叶片向内卷曲(图3-A),而剑叶上部和中部无卷曲现象(图3-B)。为进一步观察剑叶基部形态,将未展开的剑叶和全展开时期的剑叶基部进行石蜡切片。发现在剑叶发育前期,野生型的剑叶有规律地向内卷曲排列(图3-C),而dcfl1的内卷叶排列不规则(图3-D)。剑叶全展开后,野生型的剑叶基部呈向外展开状(图3-E),而dcfl1的剑叶基部展开受阻,一半叶片呈向外展开状,但内卷叶始终无法向外展开(图3-F),从而形成了剑叶基部半边叶片向内卷曲这一突变表型。尽管目前已经报道了许多矮化突变体,但剑叶基部特异卷曲的水稻矮化突变体还没有报道。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3突变体dcfl1和野生型(WT)缙恢10号的剑叶形态
A:抽穗期野生型WT和突变体dcfl1剑叶基部;B:抽穗期野生型WT和突变体dcfl1剑叶中部;C—D:孕穗期野生型WT(C)和突变体dcfl1(D)未展开剑叶基部石蜡切片;E—F:抽穗期野生型WT(E)和突变体dcfl1(F)全展剑叶基部石蜡切片。C和D中,Bar=200 μm;E和F中,Bar=1 mm
-->Fig. 3Flag leaf phenotype of the dcfl1 and the wild type
A: The flag leaf base of the WT (left) and dcfl1 (right) at the heading stage; B: The middle of flag leaf of the WT (left) and dcfl1 (right) at the heading stage; C-D: Cross section of unexpanded flag leaf base of the WT (C) and the dcfl1 (D) at the booting stage; E-F: Cross section of flag leaf base of the WT (C) and the dcfl1 (D) at the heading stage. C and D, Bar=200 μm; E and F, Bar=1 mm
-->
2.2 遗传分析
西农1A/dcfl1杂交组合的 F1代植株剑叶基部均无卷曲现象,且株高正常。F2群体中分离出正常和突变2种类型,正常型1 940株,突变型620株,突变型植株也表现为剑叶基部卷曲和矮化现象,与dcfl1类似,表明剑叶基部卷曲和矮化是1对共分离性状。χ2测验显示正常植株与突变植株的分离比符合3:1(χ2=0.79<χ20.05=3.84),暗示dcfl1的突变性状受1对隐性核基因控制。2.3 基因定位
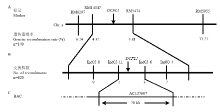
利用平均分布在水稻12条染色体上、在西农1A和野生型缙恢10号间呈多态性的96对SSR标记筛选正常基因池和突变基因池,发现第3染色体上的SSR标记RM6297、RM14347、RM5474和RM5955在基因池间呈现多态性,暗示可能与DCFL1连锁。利用140个F2隐性单株进行验证,确定了连锁关系并将DCFL1初步限定在RM14347和RM5474之间,遗传距离分别为4.32和3.81 cM。为进一步确定DCFL1的物理位置,在DCFL1初步定位区间内设计开发了20对InDel标记,多态性筛选发现4对在亲本之间具有多态性,分别命名为Ind03-8、Ind03-11、Ind03-6和Ind03-4(表2)。利用这些多态性标记对620株西农1A/dcfl1杂交组合的F2 隐性单株进行分析,结果表明,Ind03-8、Ind03-11、Ind03-6和Ind03-4的交换株分别为9、2、3和7个,且前2个标记的交换株不同于后者,从而将DCFL1精细定位在InDel标记Ind03-11和Ind03-6之间,物理距离约为78 kb(图4)。
Table 2
表2
表2基因定位InDel引物
Table 2Primers of InDel markers for gene mapping
| 标记 Markers | 正向序列 Forward-primers (5′-3′) | 反向序列 Reverse-primers (5′-3′) |
|---|---|---|
| Ind03-8 | GAGTATCAGACGATCAGACACCAC | CATTTGCCGTCGAATTGAT |
| Ind03-11 | GTAGAGTATTTGAAAGAGCATCTCAT | GGCATGAATCAACACGCTAA |
| Ind03-6 | GCTATATTCAATGGCGGATACA | TGCCGTCGTTAGAGCCTG |
| Ind03-4 | TTAACAATATCCAAGCACTATGAATT | AGCTACTGACCATGTGAGCCT |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4DCFL1在水稻第3染色体上的分子定位
-->Fig. 4Molecular mapping of DCFL1 gene on rice chromosome 3
-->
根据Gramene(http://ensembl.gramene.org/ Oryza_ sativa/Info/Index)和Rice genome annotation project(http://rice.plantbiology.msu.edu/)提供的信息,发现在DCFL1精细定位区间内,包含15个注释基因(表3),5个编码逆转录转座子蛋白,6个编码表达蛋白,4个为功能基因,分别编码细胞色素P450蛋白、60S核糖体蛋白L21-2、β-淀粉酶和RNA基序识别蛋白。
Table 3
表3
表3定位区间内注释基因
Table 3Annotated genes of the gene mapping range
| 注释基因 Annotated genes | 预测功能 Functional prediction |
|---|---|
| LOC_Os03g04680 | 细胞色素 P450 Cytochrome P450, putative, expressed |
| OC_Os03g04690 | 表达蛋白 Expressed protein |
| LOC_Os03g04700 | 逆转录转座子蛋白 Retrotransposon, putative, centromere-specific, expressed |
| LOC_Os03g04710 | 表达蛋白 Expressed protein |
| LOC_Os03g04720 | 逆转录转座子蛋白 Retrotransposon protein, putative, unclassified, expressed |
| LOC_Os03g04740 | 表达蛋白 Expressed protein |
| LOC_Os03g04750 | 60S核糖体蛋白L21-2 60S ribosomal protein L21-2, putative, expressed |
| LOC_Os03g04760 | 表达蛋白 Expressed protein |
| LOC_Os03g04770 | β-淀粉酶 Beta-amylase, putative, expressed |
| LOC_Os03g04780 | RNA基序识别蛋白 RNA recognition motif containing protein, putative, expressed |
| LOC_Os03g04790 | 逆转录转座子蛋白 Retrotransposon protein, putative, unclassified, expressed |
| LOC_Os03g04800 | 逆转录转座子蛋白 Retrotransposon protein, putative, Ty3-gypsy subclass, expressed |
| LOC_Os03g04810 | 逆转录转座子蛋白 Retrotransposon protein, putative, Ty3-gypsy subclass, expressed |
| LOC_Os03g04820 | 表达蛋白 Expressed protein |
| LOC_Os03g04830 | 表达蛋白 Expressed protein |
新窗口打开
3 讨论
在水稻生产中,叶片适度卷曲有利于叶的挺直,从而改善了群体结构、提高了光能利用率,在水稻高产育种中具有重要的应用价值。因此,揭示水稻叶片卷曲的遗传机制不仅有利于叶片发育的分子机理阐释,也为水稻株型育种提供了基础材料和理论支撑。目前,在水稻中至少报道了20多份卷叶突变体,这些突变体的形成多受植物叶片极性建成、泡状细胞大小和数量变化以及环境因素的影响。葱状卷曲突变体sll1[20]是由于叶片远轴面厚壁组织细胞发育异常而表现出卷曲。位于第3染色体上的突变体srl2[21]表现出叶片半卷,叶片变窄,株高降低。类似于sll1,srl2也是由于远轴面厚壁组织细胞异常导致叶片卷曲。突变体adl1[22]表现为下表皮泡状细胞异位发育,从而导致叶片向远轴面卷曲。另一个外卷突变体oul1[23]来源于水稻最外层细胞特异基因Roc5的敲除,表现出近轴侧泡状细胞体积变大而引起叶片外卷。SRL1编码糖基磷脂酰肌醇固定蛋白,调控叶片上表皮泡状细胞数量从而控制叶片卷曲[10]。突变体rl14[11]卷叶表型是由于近轴面泡状细胞萎缩引起,RL14通过调控次生细胞壁组分合成从而影响叶片水分运输,并进一步影响泡状细胞形态。环境诱导型卷叶突变体rl15(t)叶片卷曲行为受环境诱导,湿度是诱导突变体卷曲的主要因素[25]。值得注意的是突变体cfl1[9],由于剑叶卷曲,所以该突变体被命名为curly flag leaf1,但其他叶片也受到影响,因此,cfl1也属于所有叶片全卷突变体。此外,rl12(t)叶片卷曲特性随着发育进程而发生变化,卷曲表型主要发生在叶片中上部1/3处,中下部正常,剑叶亦是如此[24]。本文报道的dcfl1突变体,仅剑叶基部卷曲,明显不同于已报道的水稻卷叶突变体,也不同于剑叶发育缺陷相关突变体,因此,dcfl1是一类新型剑叶基部特异卷曲突变体。目前报道的叶片发育调控基因,多具有“一因多效”性。如,Ghd7调控抽穗期和产量性状,同时也影响剑叶的叶面积[26-27];dtl1是一个矮化突变体,同时也表现叶片卷曲、分蘖减少和不育等性状[28]。dcf1并不是传统的叶卷曲突变体,只是剑叶基部特异卷曲,剑叶中上部和其他叶片均正常,因此它的育性并没有受影响。另外,尽管dcfl1的穗长变短了,但dcfl1的穗型更紧凑,使dcfl1穗粒数无明显变化,而且有效穗增加了,从而暗示该突变体的产量有所提高。突变体dcfl1除剑叶特异卷曲外,还表现植株的矮化和叶片颜色深绿。这可能是由于DCFL1的多效性造成的,引起这些突变表型的原因还有待进一步研究。
利用SSR等分子标记最终将DCFL1定位在第3染色体InDel标记Ind03-11和Ind03-6之间78 kb物理距离内,包含15个注释基因,其中4个为功能基因。细胞色素P450编码基因已克隆,可能通过脂类代谢途径调控细胞伸长,其突变体oscyp96b4主要表现为植株半矮化和育性降低。它的矮化表型并不受激素的调控,而是通过转录剂量的方式来降低水稻株高[29]。ZHANG等[30]鉴定到一个oscyp96b4的等位突变体sd37,除全生育期植株矮化外,还表现稻穗和花轴变短,籽粒变小。另一个等位突变体dss1萌发以及早期生长均延迟,它的矮化表型也不受外源激素影响。但内源ABA的积累和GA的缺陷可能是dss1矮化的原因,而且其耐旱性增强[31]。此外,WANG等[32]鉴定了oscyp96b4第三个等位突变体bsh1,其表现出株高、千粒重以及每株产量均显著降低,叶鞘角质层蜡质含量降低,暗示BSH1可能参与蜡质生物合成。其他3个基因则没有克隆:β-淀粉酶是一个非生物胁迫蛋白,响应磷和钾的缺失[33-34];60S核糖体蛋白L21-2编码基因在不育系和保持系之间具有表达差异[35];RNA基序识别蛋白则尚没有描述。从表型和定位结果推测,DCFL1可能是一个调控剑叶发育的新基因。
4 结论
EMS诱变获得一个矮化和剑叶基部卷曲的新型水稻突变体dcfl1,其表现为分蘖数增多、叶色深绿。产量性状除有效穗极显著升高外,其他无明显变化。dcfl1的叶绿素a含量极显著高于野生型,导致叶绿素a/b比值极显著增加。剑叶基部卷曲和植株矮化受同1对隐性核基因调控,利用西农1A和dcfl1杂交组合的F2分离群体,最终将DCFL1定位在水稻第3染色体InDel标记Ind03-11和Ind03-6之间78 kb的物理距离内,包含15个注释基因。The authors have declared that no competing interests exist.
