0 引言
【研究意义】天然色素具有安全、营养、多功能性的特点。目前所研究的天然色素主要以红、黄色调为主,如利用红曲菌生产红色素、利用Phaffia rhodozyma酵母、Micrococcus roseus、Brevibacterium linens等菌生产类胡萝卜素[1-4]。天然蓝色素是天然色素中的稀缺色素。紫色杆菌素(violacein,Vio)是微生物的次级代谢产物,属于吲哚类衍生物,为天然色素,对丝绸、棉、毛等天然原料具有良好着色效果;它除了着色功能,同时兼具抑菌、杀锥虫、抗病毒(疱疹病毒、脊髓灰质炎病毒)以及抑制癌细胞(大细胞肺瘤、结肠癌等)增殖的作用[5-11]。BROMBERG等[12]发现埃希氏腹水瘤对紫色杆菌素的敏感性是正常淋巴细胞对紫色杆菌素的两倍。紫色杆菌素可使细胞短时间内产生大量活性氧簇(ROS),降低体内谷胱甘肽(GSH)水平,进而对埃希氏腹水瘤细胞产生一定的抑制作用。KODACH等[13]认为紫色杆菌素可增加5-Fu对细胞的毒性,诱导细胞发生程序性死亡,抑制Akt磷酸化作用,终止信号转导。紫色杆菌素对结肠癌细胞的治疗很有前景。【前人研究进展】产紫色杆菌素(violacein,Vio)的细菌来源较为广泛,包括海洋、淡水、冰川及土壤等。产紫色杆菌素的细菌种类也较多,如Collimonas、Duganella、Janthinobacterium、Microbulbifer sp.、Pseudoalteromonas [10,11,14-20]。笔者实验室从山羊乳中分离获得一株高产紫色杆菌素的Janthinobacterium lividum ZSJ。经发酵条件优化后,Vio产量最高可达2.87 g·L-1[5]。研究认为紫色杆菌素对结肠癌细胞凋亡过程的活性氧簇物(reactiveoxygenspecies,ROS)的产生有很大的影响。CARVALHO等[21]认为由紫色杆菌素诱导所产生的活性氧簇物是导致线粒体膜发生崩溃的关键因子。活性氧簇物导致Caco-2细胞中Caspase3的激活、细胞色素C和钙释放至细胞质中。但紫色杆菌素不能增加HT29细胞内的活性氧簇物的含量,紫色杆菌素对不同的细胞具有特异性。MENEZES等[14]对比了紫色杆菌素对9种人类癌细胞的抑制作用,发现紫色杆菌素对不同的细胞抑制程度不同,对NCI/ADR-RES细胞具有选择抑制性。紫色杆菌素可以引起HL60细胞发生凋亡,但对人的正常淋巴细胞和单核细胞没有影响[7]。【本研究切入点】目前对紫色杆菌素抑癌的研究主要聚焦于对具体通路(如调亡通路)的研究:如何引起细胞凋亡,对凋亡因子(caspase-2、caspase-9、caspase-3等)以及凋亡诱导因素(ROS)的分析[10-11,20]。而利用高通量筛选技术全面解析紫色杆菌素作用机制的研究较少。蛋白质组学是对机体、组织或细胞的全部蛋白质的表达水平、蛋白修饰与功能、蛋白之间相互作用等进行高通量的筛选和分析。相比于传统单个蛋白的研究,蛋白组学研究更能够准确反映机体的状态和揭示新的作用途径。【拟解决的关键问题】从不同剂量处理的癌细胞中蛋白质的生物学差异出发,利用高通量的iTRAQ技术联合质谱鉴定的蛋白质组学策略,分析与鉴定差异表达蛋白;并通过GO分析、KEGG代谢通路分析,全面解析紫色杆菌素的作用途径,为揭示紫色杆菌素的作用机制提供新的思路和理论依据。1 材料与方法
试验于2014年在中国农业科学院农产品加工研究所和北京蛋白质组研究中心进行。1.1 试验材料与设计
HT29细胞购自北京协和细胞资源中心;DMEM培养基、F12培养基、胎牛血清等购自美国Gibco-BRL公司;冻存管、培养皿、24孔板购自美国Corning公司;青链霉素、二甲基亚砜(DMSO)、胰蛋白酶、四氮甲基偶氮唑盐(MTT)、蛋白酶抑制剂、色谱级乙腈、色谱级乙醇、丙酮、尿素等购自美国Sigma公司;5-氟尿嘧啶(5-Fu)购自上海晶纯生化科技。将不同剂量的紫色杆菌素与HT29细胞共同孵育24、48、72 h,采用MTT分析其存活率,同时设置不同剂量的5-Fu为阳性对照;以透射电镜于8 000×观察作用后的细胞结构的变化。在此基础上,以1 mg·L-1紫色杆菌素为低剂量处理,30 mg·L-1紫色杆菌素为高剂量处理,分别作用HT29细胞48 h,同时设置5-Fu为阳性药物作用于HT29。作用完毕,收集细胞,裂解、酶解。采用iTRAQ试剂盒标记蛋白,通过反相液相色谱联合质谱技术对提取的蛋白进行蛋白组学分析,这部分试验在北京蛋白质组研究中心进行。
1.2 方法
1.2.1 细胞培养 取对数生长期的HT29细胞接种于培养皿中,用含5%胎牛血清的DMEM/F12完全培养液培养,于37℃、5%CO2培养箱中培养3—5 d。每3 d用0.25%胰蛋白酶消化传代一次。正常生长状态下的HT29细胞为上皮样,单层贴壁生长。1.2.2 细胞活力测定—MTT法 取对数生长期的细胞,调至其密度为1×104/mL。将其接种于96孔板中,每孔加入细胞悬液200 μL,置于5% CO2、37℃条件下进行培养。待80%细胞融合后,按试验分组进行培养。培养结束后,每孔加入10 μL MTT(5 mg·mL-1),孵育4 h,弃去培养液,每孔加入150 μL DMSO,振荡5 min使结晶物充分溶解,在酶标仪上以波长490 nm处测定A值。设5-Fu为阳性药物对照。
1.2.3 培养细胞电镜样品的制备 利用透射电子显微镜观察细胞的超微结构。
取对数生长期的细胞,调至细胞密度为1×104/mL接种于24孔板中,培养条件同1.2.1。待80%细胞融合后,分别以0.1 mg·L-1、1 mg·L-1、10 mg·L-1和30 mg·L-1不同剂量的紫色杆菌素作用于HT29细胞24 h。
培养结束后,用细胞刮收集细胞,与培养液一起1 500 r/min离心5 min,弃上清,采用2.5%戊二醛固定液固定细胞团块2—4 h,0.1 moL·L-1 PBS洗涤3次,1%锇酸固定1 h,0.1 moL·L-1 PBS洗涤3次,梯度浓度酒精、丙酮脱水,618环氧树脂浸透包埋,超薄切片,醋酸铀及枸橼酸铅染色,于透射电镜(H7500,日本)下观察及拍照。
1.2.4 蛋白组学测定
1.2.4.1 细胞样品制备、裂解及蛋白提取 取对数生长期的细胞,调至其密度为1×104 /mL。将其接种于24孔板中,培养条件同1.2.1。待细胞单层贴壁后,分别采用高剂量(30 mg·L-1)、低剂量(1 mg·L-1)的紫色杆菌素作用于铺板的细胞48 h。
培养结束后,采用胰酶消化细胞,离心,PBS洗涤两次,收集沉淀。加入尿素和蛋白酶抑制剂溶液,冰水浴超声波破碎(2 S、2 S,1 min,22%)。离心收集上清,加入4倍体积的预冷丙酮沉淀,离心收集沉淀。再加入复溶剂和0.1%SDS,超声(2 S、2 S,1 min,22%),离心收集上清。采用Bradford法进行蛋白质定量。
1.2.4.2 蛋白质还原、封闭及消化 蛋白质还原烷基化:每组样品各取75 μg,用复溶buffer补足体积至20 μL,加入2 μL还原剂,60℃孵育1 h,冷却,加入半胱甘酸1 μL,室温避光孵育10 min。
蛋白质的消化:每个样品管加入2 μL 0.5 μg·μL-1胰蛋白酶,37℃过夜;次日补加2 μL 0.5 μg·μL-1胰蛋白酶,37℃孵育2 h。
1.2.4.3 肽段的 iTraq标记 采用iTraq4试剂盒(iTR AQ 4 plex,AB SCIEX)对不同样品进行不同大小的同位素标记(表1)。
Table 1
表1
表1同位素标记
Table 1Isotope labeling
| 编号 No. | 空白Blank | 5-氟尿嘧啶 5-Fu (10 mg·L-1) | 低剂量紫色杆菌素 Vio (1 mg·L-1) | 高剂量紫色杆菌素 Vio (30 mg·L-1) |
|---|---|---|---|---|
| 同位素 Isotope | 114 | 115 | 116 | 117 |
新窗口打开
1)将标记试剂平衡至室温;
2)每管标记试剂中加入70 μL色谱级乙醇,旋涡振荡1 min,离心甩至管底;
3)将混好的标记试剂加入到肽段中,不同样品用不同大小的同位素标记;
4)混匀后,甩至管底,室温静置2 h;
5)真空抽干标记;
6)4℃保存。
1.2.4.4 质谱测定 质谱鉴定所用仪器为美国AB SCIEX公司的AB Sciex Triple TOF 5600 -液相色谱高分辨串联质谱仪。采用正离子模式和自动获取数据的模式进行数据采集;PMF的质谱扫描范围:一级采集质量范围为350—1 250 Da,二级采集质量范围为100— 1 500 Da。离子源电压为2 500 v。富集柱为C18,5 μm,20 mm Length;分离柱为C18,3 μm,150 mm Length。流动相:A,1.9% ACN+98% H2O+0.1% FA;B,98% ACN+1.9% H2O+0.1% FA,流速为330 nL·min-1。
搜索参数如下:数据库为NCBI.Human.protein- 20130701;酶为胰蛋白酶;搜索引擎:AB官方ProteinPilot™Software Beta(4.5);一级误差:10 ppm,二级误差:20 ppm。
1.2.4.5 数据分析 原始文件(mgf)用Proteomics Tools分析软件抽提肽段报告离子峰定量信息,分别以S1(115)、S2(116)、S3(117)为内参对信号强度进行归一化分析处理,采用软件计算各肽段比值的加权平均值作为蛋白质定量结果,将定量及鉴定结果进行合并处理,将差异表达蛋白进行生物信息学分析(GO分析、KEGG代谢通路分析)。
2 结果
2.1 紫色杆菌素对HT29细胞活力的影响
以不同浓度的紫色杆菌素作用HT29细胞一定时间,同时设置5-Fu为阳性对照,对比分析24、48、72 h紫色杆菌素对细胞活性的影响。图1显示紫色杆菌素对HT29细胞生长有明显的抑制作用。紫色杆菌素浓度为5mg·L-1时,抑制率超过50%;浓度为10 mg·L-1及30 mg·L-1时,抑制效果更加明显,抑制率达61.37%、70.23%。阳性药物对照组,5-Fu浓度为5 mg·L-1时,其24、48、72 h的抑制率分别为16.5%、21.8%和34.24%。空白组的抑制率为1.938%。紫色杆菌素对HT29的抑制效果明显优于5-Fu。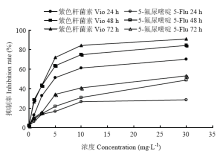 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1紫色杆菌素对HT29细胞活性的影响
-->Fig. 1Effects of violacein on the inhibition rate against HT29
-->
2.2 细胞扫描电镜观察超微结构
药物作用时间、剂量以及所用细胞的种类都会影响细胞的机构变化。有研究报道,相比于Caco2细胞,HT29细胞对于紫色杆菌素的耐受力更大[18-19]。MTT结果表明,相比于同剂量的阳性药物5-Fu,紫色杆菌素对HT29的抑制作用更加明显。在此基础上,分别以0.1、1、10和30 mg·L-1不同剂量的紫色杆菌素作用于HT29细胞24 h,采用透射电镜观察紫色杆菌素对细胞超微结构的影响。对照组培养的HT29细胞染色质均匀分布,有核仁,细胞膜完整,线粒体均匀分布在细胞质中。0.1 mg·L-1、1 mg·L-1剂量组的细胞出现线粒体空泡化现象及质膜出泡现象。随着剂量的增加,细胞变圆,胞浆浓缩。细胞内出现少量大小不等的空泡,泡内容物的电子密度与基质相似。细胞核不规则,染色质边集、浓缩,呈断裂状。部分线粒体肿胀,吞噬体颗粒增多。10 mg·L-1剂量组的空泡化现象较多,质膜出现破碎。30 mg·L-1剂量组出现细胞膜消失,染色质边集,细胞器形成碎片(图2)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同剂量紫色杆菌作用HT29超微结构比较(8000×)
(a)对照组:胞膜完整,线粒体分布在细胞质中,胞质偶见空泡;(b)0.1 mg·L-1剂量组:箭头A、B表示线粒体出现空泡化,线粒体密度不均一;(c)1 mg·L-1剂量组:箭头C表示质膜出泡;箭头D表示线粒体空泡化;(d)10 mg·L-1剂量组:箭头E表示质膜破碎,箭头F表示质膜凹陷。胞内空泡化明显增多;(e)30 mg·L-1剂量组:细胞膜消失,染色质边集
-->Fig. 2Comparison of cell ultrastructure treated by multiple dosage of violacein for 24 h
(a) Control cells: Plasma membranes were well preserved with no visible membrane damage, such as breakage or pitting. Mitochondrion was distributed in the cytoplasm. A few vacuoles could be detected. (b) Cells treated with 0.1 mg·L-1 violacein: Mitochondrial changes can be characterized by loss of matrix density (arrows A and B). Vacuole formation was found in the mitochondrion. (c) Cells treated with 1 mg·L-1 violacein: Arrow C in C shows membrane blebbing. Membrane breakage or pitting could be detected. Arrow D showed mitochondrial vacuolation. (d) Cells treated with 10 mg·L-1 violacein: Membrane breakage (arrow E) or pitting (arrow F) was quite obvious after violacein treatment. Vesicle formation and abundant vacuoles appeared. (e) Cells treated with 30 mg·L-1 violacein: Compaction and margination of nuclear chromatin and disappearance of cell membrane
-->
2.3 差异蛋白质组学分析
蛋白质组学是从系统生物学的角度研究蛋白质的各种性质,包括序列、表达水平、修饰状态、亚细胞分布、活性结构以及蛋白质之间的相互作用,从而揭示基因的功能,最终解释遗传和环境是如何通过相互作用控制细胞的功能。基于MTT及透射电镜下观察结果,本研究采用紫色杆菌素低剂量(1 mg·L-1)、高剂量(30 mg·L-1)分别作用HT29细胞,并设定一个阳性对照处理(5-Fu),尝试通过蛋白质组学技术从系统生物学角度探索紫色杆菌素抑制癌细胞代谢通路及作用机制。2.3.1 差异蛋白整体分析 所有串级谱图通过搜索引擎进行NCBI.Human.protein-20130701人种属数据库检索。使用获得置信度在0.95以上的蛋白结果,共发现鉴定4 258个蛋白。本试验将各标记组丰度差异大于2.0(P<0.05)作为差异蛋白的筛选标准,筛选出差异蛋白为757个。其中高剂量组处理的差异蛋白数492个,低剂量组处理的差异蛋白数112个,阳性对照组的差异蛋白数336个(表2)。差异蛋白筛选情况及组分间蛋白质分布(proteinpilot软件计算)情况均显示:高剂量Vio处理细胞比5-Fu处理出现的差异蛋白更多,且高剂量组比低剂量组的差异蛋白变化更显著。
Table 2
表2
表2差异蛋白筛选情况
Table 2Comparison of differential protein among three treatments
| 处理 Treatment | 差异蛋白数 Total number of differential protein | 占鉴定出蛋白(4258)的百分比 Percent of differential protein(total identified protein 4258) | 上调蛋白数(占差异蛋白的%) Total number of up-regulation protein (percent of differential protein) | 下调蛋白数(占差异蛋白的%) Total number of down-regulation protein (percent of differential protein) |
|---|---|---|---|---|
| 紫色杆菌素 Vio (30 mg·L-1) | 492 | 11.60% | 85(17.28) | 407(82.72) |
| 紫色杆菌素 Vio (1 mg·L-1) | 112 | 2.64% | 72(64.29) | 40(35.71) |
| 5-氟尿嘧啶 5-Fu | 336 | 7.92% | 140(41.67) | 196(58.33) |
新窗口打开
2.3.2 差异蛋白基因本体论(GO)分析 根据NCBI数据库中蛋白质的信息和注释,对鉴定得到的差异蛋白谱进行GO分析(图3—5、表3)。从蛋白生物学途径(Process)、蛋白成分分布(Component)和蛋白功能(Function)3个方面进行富集分析。对差异蛋白的生物学途径(Process)富集分析(图3)表明,差异蛋白主要表现为下调,低剂量和高剂量紫色杆菌素差异蛋白富集情况仅有部分相同,紫色杆菌素剂量的高低对蛋白表达有显著影响。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3差异蛋白生物学途径富集分析
a:5-Fu处理;b:紫色杆菌素低剂量处理;c:紫色杆菌素高剂量处理。黑色:下调,白色:上调。下同
-->Fig. 3Process classification of differential proteins
a: 5-Fu treatment; b: Low dose of Vio treatment; c: High dose of Vio treatment. Black: Down, White: Up. The same as below
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4差异蛋白组分分布富集分析
-->Fig. 4Component classification of differential proteins
-->
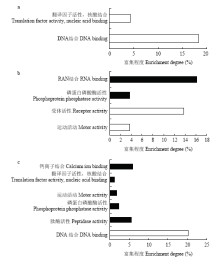 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5差异蛋白的分子功能富集分析
-->Fig. 5Functional classification of differential proteins
-->
Table 3
表3
表3差异蛋白富集分析(GO分析)
Table 3Gene ontology of significantly differential protein
| 不同处理组Treatment | 差异蛋白生物学途径富集 Process | 差异蛋白分布富集 Component | 差异蛋白功能富集 Function | |
|---|---|---|---|---|
| 5-氟尿嘧啶 5-Fu | 上调 Up | DNA代谢过程和蛋白质转运 DNA metabolic process and protein transport | 胞内细胞器和核染色体 Intracellular organelle and chromosome | DNA结合功能 DNA Binding |
| 下调 Down | 翻译过程和转录过程 Translation and transcription | 胞浆部分 Cytoplasmic part | — | |
| 紫色杆菌素 Vio (1 mg·L-1) | 上调 Up | 信号转导 Signal transduction | 质膜、核染色体 Plasma membrane and nuclear chromosome | 受体活性 Receptor activity |
| 下调 Down | DNA代谢过程和细胞骨架组织 DNA metabolic process and cytoskeleton organization | 细胞质 Cytoplasm | RNA结合功能 RNA binding | |
| 紫色杆菌素 Vio (30 mg·L-1) | 上调 Up | 信号转导过程 Signal transduction | 质膜 Plasma membrane | DNA结合功能 DNA binding |
| 下调 Down | 蛋白质修饰过程和蛋白质蛋白质转运 Protein modification process and protein transport | 细胞质、核染色体 Cytoplasm and nuclear chromosome | 钙离子结合和肽酶活性 Calcium ion binding and peptidase activity | |
新窗口打开
对差异蛋白的组分分布(Component)富集分析(图4)表明,紫色杆菌素作用于细胞的差异蛋白主要表现为下调,阳性药物组的差异蛋白主要位于胞内细胞器及核酸上;紫色杆菌素组的差异蛋白主要位于在细胞质上,其高剂量组和低剂量组的差异蛋白总体分布大致相同。
对差异蛋白的功能(Function)富集分析(图5)表明,差异蛋白主要集中在结合功能方面,紫色杆菌素对具有结合功能的蛋白质表达有影响,低剂量的紫色杆菌素主要影响具有结合RNA功能的蛋白。
2.3.3 差异蛋白的信号通路(pathway)分析 代谢通路分析显示差异蛋白在KEGG ORTHOLOGY共参与了50个代谢通路。属于KEGG ORTHOLOGY的6个标准类别中的5个类别。具体如下:参与代谢(metabolism)类别的有24个代谢通路,参与人类疾病(human diseases)的有7个代谢通路,参与有机体系统(organismal systems)类别的有1个代谢通路,参与细胞过程(cellular processes)类别的有6个代谢通路,参与遗传信息处理(genetic information processing)类别的有12个代谢通路,参与环境信息处理(environmental information processing)类别的有0个代谢通路。
本研究的目的就是探索紫色杆菌素通过何种代谢途径对HT29细胞产生抑制作用。因此,对代谢类别的信号通路进行进一步分析。在所鉴定的757个差异蛋白中,共有165个差异表达蛋白参与代谢(metabolism)类别中的24个代谢通路。分析显示,多个蛋白可同时参与同一信号通路,同一蛋白也可对多条信号通路起作用。差异蛋白对其中的10条信号通路具有显著影响(P<0.05),具体为核糖体途径、剪接体途径、三羧酸循环途径、糖异生途径、亨廷顿氏病途径、氨酰tRNA生物合成和RNA降解途径等(表4)。除了亨廷顿氏病途径(与疾病类别有关),其余9条皆属于代谢类(metabolism)途径。
Table 4
表4
表4蛋白参与信号通路KEGG分析
Table 4KEGG analysis of proteins involved in signaling pathways
| 序号 Number | 途径 Pathway | Pathway ID |
|---|---|---|
| 1 | 核糖体 Ribosome | hsa03010 |
| 2 | 剪接体 Spliceosome | hsa03040 |
| 3 | 蛋白酶体 Proteasome | hsa03050 |
| 4 | 三羧酸循环 Citrate cycle (TCA cycle) | hsa00020 |
| 5 | 糖酵解 Glycolysis/Gluconeogenesis | hsa00010 |
| 6 | 亨廷顿氏病 Huntington’s disease | hsa05016 |
| 7 | 氨酰-tRNA合成酶 Aminoacyl-tRNA biosynthesis | hsa00970 |
| 8 | 缬氨酸,亮氨酸和异亮氨酸降解 Valine, leucine and isoleucine degradation | hsa00280 |
| 9 | 氨基糖和核苷酸糖代谢 Amino sugar and nucleotide sugar metabolism | hsa00520 |
| 10 | RNA降解 RNA degradation | hsa03018 |
新窗口打开
3 讨论
前人研究显示紫色杆菌素可引起很多肿瘤细胞系的凋亡[6,20-24]。针对紫色杆菌素作用于Caco-2细胞和HT29细胞的研究显示,紫色杆菌素可引起Caco-2细胞产生大量活性氧簇,激活Caspase-3,释放细胞色素C、钙到细胞质,从而导致细胞凋亡。由紫色杆菌素诱导细胞产生的活性氧簇是导致线粒体膜崩溃的关键因子。研究还表明,紫色杆菌素不能提高HT29细胞内的活性氧簇水平。因此,研究者认为紫色杆菌素对不同的细胞有不同的作用途径[20-21]。本研究将紫色杆菌素作用于HT29细胞,同时设置5-Fu为阳性对照。5-Fu主要通过影响DNA的合成,干扰蛋白质进而达到抑癌的作用。当抑制率为50%时,紫色杆菌素的作用剂量仅为5-Fu的1/6。但Hoechst33342/PI染色显示,与对照组相比,细胞凋亡没有发生。透射电镜下观察均显示,紫色杆菌素作用后的细胞呈现空泡结构,并表现时间剂量效应。随着浓度增大,逐渐出现质膜破碎、凹陷。当浓度达到30 mg·L-1,细胞出现染色质边集效应,细胞膜消失。这与前人的研究和假设相一致。本研究也认为紫色杆菌素不是通过凋亡的途径作用于HT29细胞,需要采用别的方法对其进行更深入的研究。蛋白质组学(Proteomics)是一门以全面的蛋白质性质研究为基础,在蛋白质水平对疾病机理、细胞模式、功能联系及基因调控等方面进行探索的科学[25-27]。通过对疾病状态和正常状态的蛋白质谱表达差异进行比较和分析,开发新的药物作用靶点,探索和深入认知其内在机制。有研究利用二维电泳或液相色谱串联质谱技术分析外界胁迫条件下(如砷胁迫、金属铁离子胁迫、pH胁迫或饥饿胁迫)产紫色杆菌素的Chromobacterium violaceum菌体内的蛋白质组学的变化[28-30],发现菌体内的差异蛋白参与了响应氧化应激、DNA修复、脂肪代谢等途径。外界胁迫条件可导致菌体内与生物合成途径、分子回收、能源生产有关的受体、转运蛋白的表达发生变化,但利用蛋白组学技术研究紫色杆菌素如何作用于癌细胞的研究还鲜有报道。
本研究采用的是反相高效液相色谱(HP-RPLC)分离模式来分离蛋白质。这在很大程度上克服了2DE 的局限性,避免低丰度蛋白的丢失,其与质谱的联用是目前蛋白质组学研究广为采用的技术。相比于2DE,可更准确、灵敏地鉴定出更多蛋白。
4 结论
紫色杆菌素对HT29细胞的抑制作用呈时间、剂量依赖性。相比于阳性药物5-Fu,紫色杆菌素的抑制效果更明显。在抑制率为50%时,紫色杆菌素的剂量仅为5-Fu剂量的1/6。透射电镜显示,随着Vio剂量增大,细胞内部线粒体出现空泡结构,质膜出泡;当浓度为30 mg·L-1时,细胞膜消失,染色质边集。利用iTRAQ标记不同处理组的蛋白,通过反向色谱进行肽段分离,结合高分辨串联质谱分析,通过数据库搜索、鉴定出757个差异蛋白。KEGG分析显示,差异蛋白显著影响10条信号通路,主要为核糖体循环途径、三羧酸循环途径和RNA降解途径等。据此推测,紫色杆菌素通过影响细胞生命活动中的蛋白转录和翻译水平进而发挥抑制作用。The authors have declared that no competing interests exist.
