0 引言
【研究意义】中国耕地数量有限,粮棉争地矛盾突出,培育生长发育期相对较短的短季棉已成为中国棉花育种的重要研究方向[1]。花发育与棉花早熟性密切相关[2],开花时间直接决定了熟性的早晚[3]。因此,研究陆地棉开花相关基因的表达和功能,明确其在开花调控网络中的角色,对于研究棉花花芽分化的规律、推动棉花种质资源创新具有至关重要的意义。【前人研究进展】开花的过程不仅与环境信号如日照时间、光强度、环境温度等有关,还与植株的内源激素及年龄有关[4]。同时研究表明,开花基因在高等植物之间具有很高的保守性[5]。MELZER等[6]利用差减杂交和差异显示的方法,从长日照植物白芥的顶芽中得到一个开花特异基因pSFD5.04(SaFPF1),长日照诱导之后该基因表达量迅速升高并缓慢降低。随后在拟南芥中克隆得到同源基因,发现无论日照长短,此基因过表达都会使拟南芥提前开花,因此命名为Arabidopsis thaliana flowering promoting factor 1(AtFPF1)[7],随后证实AtFPF1通过赤霉素(GA)途径调节拟南芥开花时间[8]。FPF1可以下调晶体蛋白基因ACD31.2,而该基因也会受GA成花诱导的负调控[9]。在温带禾谷类作物中,FPF1不仅能在春化途径中响应低温,并且能响应日照长度,参与光周期调控的花芽分化[10]。在杂交白杨中异源表达FPF1,白杨开花时间无明显变化,但是SOC1/TM3类基因Populus tremuloides MADS-box 5(PTM5)显著上调,木材密度降低[11]。在水稻中异源表达FPF1,发现转基因水稻抽穗时间提前[12],但过表达其同源基因Oryza sativa Root Architecture Associated 1(OsRAA1),抽穗时间无显著变化且不定根形成增多,初生根生长受到抑制,与生长素处理的表型类似[13]。随后的研究表明OsRAA1是一个细胞循环抑制子,其泛素化降解对于细胞分裂从中期到后期的转变是必须的,正是这个转变影响根系的生长和发育[14]。在黄花蒿的研究中发现,FPF1异源表达株系中青蒿素含量无显著变化,但开花时间提前约20 d[15]。将FPF1转化到甘蓝型油菜中,转基因株系表现出明显的提前开花性状,且经赤霉素(GA)处理后的转基因株系较未处理的转基因株系开花时间更早[16]。此外,一系列研究表明FPF1在大麦、小麦、菊花、萝卜中与花发育密切相关[10,17-18]。【本研究切入点】陆地棉开花促进因子基因家族的6个成员中,已经证实GhFPF1、GhFLP1都能使拟南芥开花提前。GhFPF1参与避荫反应调控[19],使拟南芥莲座叶和茎生叶减少,叶绿素含量降低[20]。GhFLP1也能促进拟南芥开花,并能响应水杨酸(SA)和GA调控[21],而GhFLP2、GhFLP3、GhFLP4和GhFLP5 4个成员的表达模式及功能尚未明确,不能确定该家族基因在功能上是否存在分化或冗余。【拟解决的关键问题】本研究从陆地棉中棉所50(CCRI50)中克隆了一个开花促进因子基因家族成员GhFLP5,对其进行表达分析,并通过转基因拟南芥验证其在开花过程中的功能。1 材料与方法
1.1 试验材料
所用陆地棉品种为CCRI50及鲁棉研28(Lu28)。拟南芥为哥伦比亚野生型背景。试验所用到的酶、pMD18-T载体、反转录试剂盒及荧光定量试剂盒均购自TaKaRa公司,大肠杆菌感受态DH5α购自北京全式金公司,质粒提取试剂盒购自Magen生物公司,胶回收试剂盒购自Omega Bio-Tek公司,pBI121载体及农杆菌LBA4404由棉花生物学国家重点实验室保存。
1.2 材料处理及取样
GhFLP5优势表达部位及优势表达时期的分析所用材料为CCRI50和Lu28,于夏播期种植于中国农业科学院棉花研究所白壁试验田,大田管理。于一叶期到六叶期取长势均匀的棉花的根、茎、新叶、顶芽,并于成熟期取6 mm大小的蕾、开花当天的花瓣、雄蕊、雌蕊以及生长5 d的纤维,取样后快速放入液氮中冷冻并存于-80℃冰箱中备用。激素处理所用材料为CCRI50,室内种植条件为14 h光照/10 h黑暗,温度为26℃。于二叶一心期叶面喷施激素,以清水为对照,喷施至叶面有水珠滴落。所用SA浓度为200 μmol·L-1,ABA 和JA浓度为100 μmol·L-1。拟南芥种植条件为16 h光照/8 h黑暗,温度22℃,相对湿度55%[22]。取生长18 d的拟南芥的地上部分,分析转基因拟南芥内源基因表达量变化。1.3 GhFLP5的克隆
以拟南芥AtFPF1的蛋白序列为参比序列,在中棉所陆地棉数据库(http://cgp.genomics.org.cn/page/ species/index.jsp)中检索,共得到6条相似性比较高的表达片段。根据NCBI上已经发布的GhFLP5序列设计引物,并以CCRI50的cDNA为模板进行扩增,将得到的片段切胶回收之后连接TaKaRa公司的pMD18-T载体,得到重组质粒转化大肠杆菌DH5α,将新鲜菌液送样至金唯智生物科技有限公司进行测序,并保存测序正确的单克隆菌液以供后续试验使用。1.4 GhFLP5的生物信息学分析
所用到的氨基酸序列下载自NCBI网站,多重序列比对使用ClustalX2软件,进化树的构建使用MEGA6.06最大似然方法。利用ExPASy网站上的Compute pI/Mw(http://web.expasy.org/compute_pi/)对其蛋白质的理化性质进行预测和分析,并用NCBI的CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/ cdd.shtml)数据库对其结构域进行预测。1.5 基因的定量表达分析
RNA提取使用天根多糖多酚RNA提取试剂盒,所使用的RNA的质量必须保证OD260/280为1.8—2.1,OD260/230大于1.8。反转录使用TaKaRa RR047A试剂盒,使用gDNA Eraser消化总RNA中残留的基因组DNA后进行15 min的反转录反应合成cDNA。荧光定量使用SYBR Green分析法,所用试剂盒为TaKaRa RR420A,所用仪器为Applied Biosystems 7500实时定量PCR仪。陆地棉中以HISTONE 3(GhHis3)为内参,拟南芥中以UBIQUITIN 5(AtUBQ5)为内参。所用引物见附表1。1.6 植物表达载体的构建
扩增T-A克隆的测序正确的阳性菌液,提取重组质粒为模板,用PCR的方法分别将XbaⅠ和SacⅠ位点引入到GhFLP5编码区片段的5′端和3′端。然后用SacⅠ和XbaⅠ酶消化得到的含有酶切位点的PCR产物片段和pBI121载体,并将得到的产物胶回收。采用T4连接酶16℃过夜连接,转化大肠杆菌DH5α,送公司测序。将测序正确的重组表达载体转化农杆菌。1.7 拟南芥的遗传转化及阳性筛选
用农杆菌蘸花法转化拟南芥。扩摇农杆菌菌液至OD600=1.2—1.6。5 000 r/min离心10 min收集菌体,用含有0.02% Silwet L-77的1/2 MS渗透液重悬菌液至OD600=0.9。将已经剪去结荚角果的拟南芥花序蘸入转化介质中约45 s,然后于暗中培养24 h[23]。得到的种子为T0代种子。将种子播种于含有卡那霉素的1/2 MS培养基上,具体做法为:在超净台内,先用0.1%的HgCl2消毒3 min,然后用75%的酒精消毒3 min,再用灭菌水清洗4—5次,于滤纸上风干后将种子播种在含抗生素的固体培养基上。放置在4℃冰箱中春化48 —72 h,取出后放在培养箱中,16 h光照条件下培养,待真叶长出后移栽到土壤中。生长两周后取样提取DNA进行PCR检测,鉴定引物上游靶定在35S启动子上,下游靶定在外源基因GhFLP5上。收获阳性株种子,直至纯合世代。
2 结果
2.1 陆地棉GhFLP5的序列分析
GhFLP5位于陆地棉Dt亚组第10染色体上,开放阅读框长300 bp,无内含子,编码氨基酸长度为99 aa。经ExPASy网站预测可知,其编码蛋白质为11.4 kD,等电点为8.04。根据NCBI的Protein数据库和Nucleotide数据库中已提交的不同物种的FPF的序列并考虑物种间亲缘关系的远近,选取玉米、水稻、大豆、毛果杨、白芥、拟南芥、苜蓿等物种的FPF蛋白序列与陆地棉的FPF蛋白序列进行多重比对(图1-a),不同物种的开花促进因子家族的蛋白质的序列一致性较高,从氨基末端到羧基末端共有3个比较保守的区域,分别为-MSFVWVFKNGV-、-LGWERYYG-和-MYDIVVKNPN-。利用MEGA6构建进化树(图1-b),GhFLP5与大豆、苜蓿和毛果杨的开花促进因子同源性较高。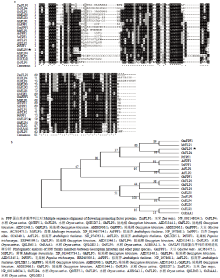 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1氨基酸序列比对及进化树分析
-->Fig. 1Multiple alignment and phylogenetic comparison of GhFLP5 between different species
-->
2.2 GhFLP5的时空表达模式分析
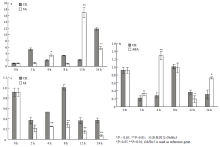
根据已有的研究表明,三叶期是棉花生长的关键时期。早熟品种如中棉所36(CCRI36)等,二叶期花原基开始伸长,在三叶期已分化出4—5个果枝原基,而晚熟品种如TM-1在三叶期才开始进行花芽分化[24]。为研究GhFLP5的表达特性,分别以早熟品种CCRI50和晚熟品种Lu28为试验材料,检测GhFLP5在三叶期的根、茎、叶、顶芽,成熟期的蕾,开花当天的雄蕊、雌蕊、花瓣和5 d的纤维中的表达量(图2-a)。GhFLP5组织表达特异性很强,在叶片中表达量较高,而在其他部位略有表达甚至检测不到。早熟品种CCRI50叶片中的表达量显著高于晚熟品种Lu28。由GhFLP5的优势表达部位可知,在幼苗期GhFLP5主要是在叶片中表达。为研究GhFLP5的时间表达模式,分别取一叶期到六叶期的倒一叶叶片,提取其总RNA,进行荧光定量检测(图2-b)。早熟品种CCRI50中,GhFLP5的表达从一叶期开始上升,在三叶期表达量达到高峰而后降低。晚熟品种Lu28中,GhFLP5的表达在三叶期较低而在四叶期达到高峰,这与前人关于棉花花芽分化理论的研究结果一致[24],表明在陆地棉的生长过程中,GhFLP5很有可能与其花原基发育相关。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2GhFLP5的时空表达模式分析
-->Fig.2Temporal and spatial expression patterns of GhFLP5
-->
2.3 GhFLP5的启动子分析及其对外源激素的应答
从中棉所陆地棉基因组数据库中调取GhFLP5起始密码子上游1 500 bp的序列,并利用PlantCARE数据库对其顺式作用元件进行了预测(表1)。该基因启动子主要存在两大类顺式作用元件,一类是光响应元件和生物钟元件;一类是胁迫响应元件,如与胁迫相关的脱落酸响应元件、干旱响应元件等。已知ABA、JA和SA都是与植物胁迫响应相关的激素[25-26]。因此,通过在棉花二叶期喷施外源激素研究GhFLP5的应答。喷施SA、ABA及JA24 h内对GhFLP5表达量进行研究(图3-a—图3-c)。经SA处理后,2 h后GhFLP5的表达量出现一个小高峰,12 h后到达峰值,表达量约是对照组中GhFLP5表达量的10倍。经ABA处理4 h后处理组中的GhFLP5表达量达到最大值,而对照组则是在8 h后达到高峰而后降低。经JA处理后,GhFLP5的表达量降低,显著低于对照组。以上结果表明,GhFLP5可以响应SA、ABA、JA这3种外源激素。SA和ABA都可以促进陆地棉中GhFLP5的表达,而JA对GhFLP5的转录起抑制作用。Table 1
表1
表1陆地棉GhFLP5启动子顺式作用元件预测
Table 1Predicted cis-acting elements on the promoter of GhFLP5
| 元件 Element | 来源 Origin | 位置 Locus | 序列 Sequences | 功能注释 Function annotation |
|---|---|---|---|---|
| ABRE | 拟南芥 Arabidopsis thaliana | -954 | CACGTG | 脱落酸响应元件 Abscisic acid responsive element |
| ACE | 欧洲香芹 Petroselinum hortense | +955 | ACGTGGA | 光响应元件 Light responsive element |
| BoxⅠ | 豌豆 Pisum sativum | +1040 | TTTCAAA | 光响应元件 Light responsive element |
| Sp1 | 玉米 Zea mays | -877 | CC(G/A)CCC | 光响应元件 Light responsive element |
| Sp1 | 玉米 Zea mays | +1414 | CC(G/A)CCC | 光响应元件 Light responsive element |
| GA-motif | 向日葵 Helianthus annuus | +459 | AAAGATGA | 光响应元件 Part of a light responsive element |
| I-box | 菊花 Flaveria trinervia | -1329 | GATATGG | 光响应元件 Part of light responsice element |
| LAMP-element | 菠菜 Spinacia oleracea | +1284 | CCAAAACCA | 光响应元件 Part of a light responsive element |
| G-box | 马铃薯 Solanum tuberosum | -382 | CACATGG | 脱落酸响应元件 Abscisic acid responsive element |
| G-box | 拟南芥 Arabidopsis thaliana | -954 | CACGTG | 脱落酸响应元件 Abscisic acid responsive element |
| G-box | 马铃薯 Solanum tuberosum | -392 | CACATGG | 脱落酸响应元件 Abscisic acid responsive element |
| circadian | 番茄 Lycopersicon esculentum | +110 | CAANNNNATC | 生物钟元件 Circadian control element |
| circadian | 番茄 Lycopersicon esculentum | -336 | CAANNNNATC | 生物钟元件 Circadian control element |
| MBS | 拟南芥 Arabidopsis thaliana | +243 | CAACTG | 干旱诱导的MYB转录因子结合位点 MYB binding site involved in drought inducibility |
| TC-rich repeats | 烟草 Nicotiana tabacum | -109 | ATTTTCTTCA | 防御和应激反应的顺式作用元件 Cis-acting element involved in defense and stress responsiveness |
| TC-rich repeats | 烟草 Nicotiana tabacum | -253 | ATTTTCTTCA | 防御和应激反应的顺式作用元件 Cis-acting element involved in defense and stress responsiveness |
| ARE | 玉米 Zea mays | -1178 | TGGTTT | 厌氧诱导的顺式作用元件 Cis-acting regulatory element essential for the anaerobic induction |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3叶面喷施水杨酸(a)、脱落酸(b)、茉莉酸(c)后24 h内GhFLP5表达量变化
-->Fig. 3GhFLP5 expression profiles in the first 24 hours after the leaves were treated with salicylic acid (a), abscisic acid (b) and jasmonic acid (c)
-->
2.4 GhFLP5在拟南芥中的功能验证
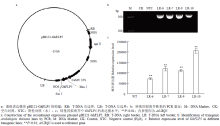
为进一步研究GhFLP5的功能,构建植物表达载体(图4-a),用含有重组质粒的农杆菌转化拟南芥,将培养基上筛选得到的幼苗移栽到土壤中,提取DNA鉴定阳性株(图4-b)。在纯合世代分别提取各个株系的RNA,检测发现转基因拟南芥中GhFLP5高调表达(图4-c)。在长日照条件下同时种植野生型拟南芥和转基因拟南芥,观察二者生长状况(图5),异源表达株系呈现明显的早花表型。转基因拟南芥在播种16 d后开始抽薹,平均抽薹时间在17 d左右,极显著地低于野生型的26 d。35S::GhFLP5株系的开花时间在22 d左右,而野生型的开花时间为29 d,差异达到极显著水平,同时,其莲座叶数目也显著减少(表2)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4植物表达载体构建及转基因拟南芥的阳性鉴定
-->Fig. 4Construction of the expression plasmid and identification of positive transgenic Arabidopsis thaliana lines
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5异源表达GhFLP5的拟南芥开花时间提前
-->Fig. 5The Arabidopsis heterelogous-expressing GhFLP5 bolts and blooms earlier than the wild type
-->
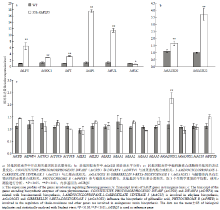
为了深入研究异源表达GhFLP5促进拟南芥开花的分子机制,取生长18 d的拟南芥的地上部分,提取RNA,检测拟南芥一些内源基因的表达。在组成型表达GhFLP5的转基因株系中,开花促进基因LEAFY(AtLFY)、SUPPRESSOR OF OVEREXPRESSION OF CONSTANS(AtSOC1)、FLOWERING LOCUS T(AtFT)、APETALA1(AtAP1)和FRUITFULL(AtFUL)的表达量都有所上调,尤其是AtAP1,表达量超过野生型中的16倍(图6-a)。而开花抑制因子FLOWERING LOCUS C(AtFLC)的表达则被抑制(图6-a),这也与在拟南芥中组成型表达GhFLP5正调控开花时间的
表型相符。
同时,根据已有的报道对调控拟南芥开花时间的激素的生物合成酶的编码基因进行了检测,包括乙烯(ETH)、GA、油菜素内酯(BR)、生长素(IAA)的合成基因,发现只有GIBBERELLIN 20-OXIDASE 1(GA20OX1)的表达量上调超过两倍,其余基因的表达均无显著差异(图6-c)。虽然生长素合成基因的表达量无显著差异,生长素应答基因SMALL AUXIN UPREGULATED 20(AtSAUR20)和SMALL AUXIN UPREGULATED 22(AtSAUR22)在异源表达GhFLP5的转基因株系中表达量要显著高于野生型(图6-b)。
Table 2
表2
表2野生型和转基因拟南芥抽薹、开花时间及莲座叶数目统计
Table 2Bolting time, flowering time and the number of rosette leaves of wild and transgenic plants
| 材料 Materials | 抽薹时间 Bolting time (d) | 开花时间 Flowering time (d) | 莲座叶数 Number of rosette leaves |
|---|---|---|---|
| WT | 26.05±1.39 | 29.1±1.17 | 10.31±0.73 |
| LR-6 | 17.95±0.95** | 21.85±0.67** | 7.22±0.56** |
| LR-7 | 17.35±0.88** | 22.05±0.76** | 7.54±1.21** |
| LR-9 | 17.5±1.32** | 21.8±1.06** | 7.39±0.87** |
| LR-10 | 19.1±1.25** | 22.55±0.99** | 7.98±0.32** |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6转基因拟南芥中开花及激素合成相关基因表达量变化
-->Fig.6The transcript analysis of some genes related to blooming and phytohormones biosynthesis in transgenic lines
-->
3 讨论
开花是陆地棉的重要农艺性状之一。花期的早晚影响产量的高低,也影响品种的区域适应性。虽然开花是一个由多基因控制的数量性状,经典遗传学研究也表明许多开花相关的基因符合孟德尔遗传定律[27]。陆地棉全基因组测序的完成对深入研究开花的遗传控制具有重要的意义和推动作用。从陆地棉基因组数据库中共检索到6个开花促进因子基因家族成员,本研究克隆了GhFLP5,其功能研究结果表明,GhFLP5可以响应外源激素SA、ABA、JA处理,异源表达GhFLP5使拟南芥提前开花,且转基因株系中成花基因AtAP1表达量升高达16倍,生长素应答基因AtSAUR20和AtSAUR22,赤霉素合成相关基因GA20OX1的表达也显著上调。ABA是调节干旱胁迫的关键激素,它可以促进GIGANTEA(GI)、FT、TWIN SISTER OF FT(TSF)的表达而促进开花[28],也可以激活FLC的表达而抑制开花[29]。SA是与植物胁迫相关的重要激素,也是诱导开花的常用化学试剂[30]。它不仅能参与光周期途径通过GI调节植物花期,也可以通过FVE在自主途径中促进开花[31]。JA是高等植物中的天然生长调节剂,它在植物衰老、根系发育、花粉开裂和防御反应中都发挥重要作用[32],同时它也可以通过负向调控成花素基因FT的表达延迟植物开花[33]。本研究表明GhFLP5可以响应ABA和SA诱导而高调表达,也会被JA抑制,这都与35S:GhFLP5拟南芥提前开花的表型一致。
AP1是植物中特有的MADS-box基因,它不仅是花序分生组织特征基因,与LFY和CAULIFLOWER(CAL)共同促进花序分生组织的形成,也是花器官形态特征基因,调节花瓣和萼片的发育[34]。AP1可以抑制下游的生长素合成基因LONELY GUY1(LOG1)的表达,并上调生长素降解基因CYTOKININ OXIDASE/DEHYDROGENASE3(CKX3)的表达[35]。35S::GhFLP5株系中,生长素合成基因IAAs和YUCs的表达量无显著变化,但生长素应答基因AtSAUR20和AtSAUR22表达量显著升高。已有报道证明二者都参与调节细胞伸长,表达量升高可以增强IAA在植物体内的运输,过表达会增强拟南芥对生长素的耐受性[36],这说明GhFLP5很有可能是通过生长素的调节途径控制拟南芥的开花转变。GA20OX1是催化合成具有生物活性的赤霉素的关键基因,其表达量的升高也暗示了GhFLP5的调控可能结合了双子叶植物拟南芥和单子叶植物水稻中的双重作用,同时通过IAA和GA影响植物的生长发育。
除了AtFPF1,拟南芥中还存在FPF1-LIKE PROTEIN 1(AtFLP1)和FPF1-LIKE PROTEIN 2(AtFLP2)2个同源基因,其编码蛋白与AtFPF1具有92%和80%的同源性。这两个基因过表达都能使拟南芥开花提前,但与AtFPF1在顶芽中表达不同,AtFLP1主要在根和花中表达,AtFLP2则主要在萼片中表达[37]。陆地棉GhFLP1也能促进拟南芥开花,但其主要在棉花的花器官中表达且受外施GA调控[21]。此外,虽然35S::GhFLP5拟南芥早花表型明显,但与GhFPF1影响植物避荫反应[20]不同,AtPHYB的表达量并无显著变化,说明该家族的基因在表达和功能上都出现了一定的分化。
4 结论
从CCRI50中成功克隆GhFLP5,其位于Dt亚组第10染色体上,全长300 bp,无内含子。其表达具有强烈的组织特异性,在叶片中优势表达,且在早熟陆地棉品种中表达量高峰早于晚熟陆地棉品种。GhFLP5在叶片中的表达受到SA和ABA的诱导之后表达量上升,而外施JA会抑制GhFLP5的表达。在拟南芥中异源表达该基因,拟南芥呈现明显的早花表型,推测可能通过IAA和GA途径调节植物开花转型。Supplementary Table 1
附表1
附表1引物序列
Supplementary Table 1Primers used in this study
| 引物 Primers | 序列 Sequences (5’-3’) | 用途 Usage |
|---|---|---|
| GhFLP5-F | CTCACCACCAACAACCTACAG | 克隆 Cloning |
| GhFLP5-R | ATAAAAGCAGCCTCAGAAACG | 克隆 Cloning |
| GhFLP5E-F | GCTCTAGACTCACCACCAACAACCTACAG | 克隆 Cloning |
| GhFLP5E-R | CGAGCTCATAAAAGCAGCCTCAGAAACG | 克隆 Cloning |
| GhFLP5S-F | GAAAGCAGTCCGAAGAGAAGG | qRT-PCR |
| GhFLP5S-R | TGTGGTATTGATAGAAGTCAGGGTC | qRT-PCR |
| GhHis3-F | GAAGCCTCATCGATACCGTC | qRT-PCR |
| GhHis3-R | CTACCACTACCATCATGGC | qRT-PCR |
| AtLFY-F | GGATCCTGAAGGTTTCACGAG | qRT-PCR |
| AtLFY-R | GCCGCCGTGTAGAAACGTA | qRT-PCR |
| AtSOC1-F | TGAGGCATACTAAGGATCGAG | qRT-PCR |
| AtSOC1-R | GCGTCTCTACTTCAGAACTTGGGC | qRT-PCR |
| AtFT-F | GTAAGCAGAGTTGTTGGAGACG | qRT-PCR |
| AtFT-R | TCTTGGCTTGTTTTGAACCT | qRT-PCR |
| AtAP1-F | GAAGGCCATCAGGAGCAAA | qRT-PCR |
| AtAP1-R | ACTGCTCCTGTTGAGCCCTA | qRT-PCR |
| AtFUL-F | TTGCAAGATCACAACAATTCGCTTCT | qRT-PCR |
| AtFUL-R | GAGAGTTTGGTTCCGTCAACGACGAT | qRT-PCR |
| AtFLC-F | AACGTCGCAACGGTCTCATC | qRT-PCR |
| AtFLC-R | TCAAGGATCTTGACCAGGTTATCG | qRT-PCR |
| AtCPD-F | AGGGAGGAGGAGGAAGAAGG | qRT-PCR |
| AtCPD-R | GCGACAAGTAAAGCCACCAA | qRT-PCR |
| AtACS5-F | CGGGTTGGTTTAGGGTTTGT | qRT-PCR |
| AtACS5-R | CCCGGAAAACCCAGTTAGAG | qRT-PCR |
| AtPHYB-F | GTTTCCGGATCATCGGTTACAG | qRT-PCR |
| AtPHYB-R | TCGAGCTCGAAGAAGTGAACA | qRT-PCR |
| AtDWF4-F | CGGTGATCTCAGCCGTACAT’ | qRT-PCR |
| AtDWF4-R | CCCACGTCGAAAAACTACCA | qRT-PCR |
| AtYUC3-F | GTTTCAAAACCTCATCCCCG | qRT-PCR |
| AtYUC3-R | GCAATGCAGTTAGCTCGCTC | qRT-PCR |
| AtYUC6-F | CTACGCTCGGAGGTTTGACA | qRT-PCR |
| AtYUC6-R | ACTCCGTCGTGCCTTCTTCT | qRT-PCR |
| AtYUC8-F | GACTGCTCGGTTCGATGAGA | qRT-PCR |
| AtYUC8-R | TGAATCACCTCACCGGAAAA | qRT-PCR |
| AtILR1-F | TCGCGGGATGCTTCATTCAG | qRT-PCR |
| AtILR1-R | CTTCACTCCAAGCGAGTCAAG | qRT-PCR |
| 续附表1 | ||
| 引物 Primers | 序列 Sequences (5’-3’) | 用途 Usage |
| AtILR3-F | GCCTGTTCAGCAACCTATTGG | qRT-PCR |
| AtILR3-R | TAGTGGCAGAGGATGATTCACA | qRT-PCR |
| AtIAR3-F | TGGGTATGTTGGAACTGGTCATG | qRT-PCR |
| AtIAR3-R | CCGAGAAGCATCGTAGTGTGA | qRT-PCR |
| AtIAA2-F | AGAATCTACACCTCCTACCAAAA | qRT-PCR |
| AtIAA2-R | CACGTAGCTCACACTGTTGTTG | qRT-PCR |
| AtIAA3-F | CAAAGATGGTGATTGGATGCT | qRT-PCR |
| AtIAA3-R | TGATCCTTAGTCTCTTGCACGTA | qRT-PCR |
| AtIAA5-F | TGAAGACAAAGATGGAGATTGG | qRT-PCR |
| AtIAA5-R | GCACGATCCAAGGAACATTT | qRT-PCR |
| AtGA20OX1-F | TAGTGACGCCACCGAGAGAG | qRT-PCR |
| AtGA20OX1-R | TAGATGGGTTTGGTGAGCCA | qRT-PCR |
| AtGA3OX1-F | GGGTTAACCAAACCAGAGCC | qRT-PCR |
| AtGA3OX1-R | CGATTCAACGGGACTAACCA | qRT-PCR |
| AtUBQ5-F | CGTTGCCTCAAAAGATGCAGATC | qRT-PCR |
| AtUBQ5-R | ACATTGTCGATGGTGTCGGATG | qRT-PCR |
| IGhFLP5-F | GACGCACAATCCCACTATCC | 鉴定 Identification |
| IGhFLP5-R | ATAAAAGCAGCCTCAGAAACG | 鉴定 Identification |
新窗口打开
The authors have declared that no competing interests exist.
