0 引言
【研究意义】飞蝗(Locusta migratoria)是世界范围内农业生产的重大害虫,中国长期以来对蝗虫的治理主要依靠化学防治,由于常年施用农药,使飞蝗产生抗药性,同时导致农业环境污染[1-2]。因此,研发环境友好型杀虫剂是植物保护领域的研究热点。几丁质(chitin)是β-1,4糖苷键连接的N-乙酰-D-氨基葡萄糖,对昆虫表皮形态维持起着重要作用[3]。飞蝗的生长发育经历周期性蜕皮发育,几丁质代谢相关酶系在这一过程中发挥着关键作用,几丁质脱乙酰基酶(chitin deacetylase,CDA)催化几丁质转化为壳聚糖,是几丁质代谢系统的关键酶[4]。由于人类和高等动物不具备这一代谢系统,因此,基于CDAs的研究有望成为飞蝗防治的新型分子靶标。【前人研究进展】CDAs是糖酯酶4家族(CE4)的一类修饰酶,可将几丁质的乙酰基脱去,形成壳聚糖,壳聚糖的氨基可提供与其他表皮蛋白和围食膜蛋白相结合的位点[5]。根据功能域的不同将CDAs分为5类,第1类(CDA1和CDA2)和第2类(CDA3)均含有3个功能域:即几丁质结合域(ChBD)、低密度脂蛋白受体(LDLa)和催化域(CDA),第3类(CDA4)和第4类(CDA5)含有2个功能域:即ChBD和CDA,第5类(CDA6、7、8、9)仅含有CDA功能域[6-7]。目前已鉴定的CDAs具有3种功能。其一为参与围食膜的形成。在拟尺蠖(Trichoplusia ni)中肠cDNA文库中首次鉴定出CDA蛋白,发现其与中肠围食膜形成相关[8]。在蓓带夜蛾(Mamestra configurata)的围食膜中鉴定出CDA1,发现其在幼虫期表达[9]。CAMPBELL等[10]采用电泳和质谱分析法从棉铃虫(Helicoverpa armigera)围食膜中鉴定获得CDA蛋白,推测其可能参与毒素拦截;ZHONG等[11]采用蛋白组学结合二维电泳方法在家蚕(Bombyx mori)围食膜中鉴定出BmCDA7,但其分子功能尚不明确;SANDOVAL-MOJICA等[12]发现在北美散白蚁(Reticulitermes flavipes)中RfCDA2特异性地结合在围食膜上。其二为参与表皮几丁质片层结构的形成。如果蝇(Drosophila melanogaster)的DmCDA1(Serp)和DmCDA2(Verm)参与幼虫表皮几丁质片层结构的形成[13]。赤拟谷盗(Tribolium castaneum)中TcCDA1和TcCDA2在表皮中特异表达,且在蜕皮中起着重要作用[6]。干扰云杉卷叶蛾(Choristoneura fumiferana)CfCDA2和褐飞虱(Nilaparvata lugens)的NlCDA1和NlCDA2均可影响虫体正常蜕皮[14-15]。飞蝗的LmCDA2参与5龄若虫表皮几丁质的排列且LmCDA2具有几丁质脱乙酰酶活力[16-17]。美国白蛾(Hyphantria cunea)鉴定出HcCDA1和HcCDA2均具有催化活性[18],中华稻蝗(Oxya chinensis)的OcCDA1和OcCDA2对其蜕皮起着重要作用[19-20]。此外,果蝇中2个CDA酶对胚胎期气管的形成和延伸具有重要作用[21-22]。【本研究切入点】目前国内外对昆虫中第1类CDAs生物学功能有较为系统的研究报道,而对第3和第4类CDAs的研究较少,同时,研究发现这两类CDAs在不同昆虫间其分子特性和生理功能存在差异,如赤拟谷盗的TcCDA4和TcCDA5在表皮中特异表达,但不影响其蜕皮和正常发育[6]。稻纵卷叶螟(Cnaphalocrocis medinalis)的CmCDA4在头部表达最高,CmCDA5在表皮中表达最高,推测CmCDA5可能参与几丁质代谢[23]。褐飞虱的NlCDA4对其生长发育具有重要作用,当该基因沉默后,虫体出现难以脱去旧表皮最终导致死亡的表型[15]。此外,蜱螨目肩胛硬蜱(Ixodes scapularis)的IsCDA5表达被沉默后虽无可见表型,但其肠道中病原菌伯氏包柔螺旋体(Borrelia burgdorferi)数量显著增加。推测CDAs增加了围食膜的孔径,使病原体更容易侵入[24]。飞蝗第3和第4类CDAs的功能尚未见报道。【拟解决的关键问题】获得飞蝗LmCDA4和LmCDA5全长cDNA序列,采用RNA干扰技术研究其对飞蝗表皮的影响,探索LmCDA4和LmCDA5的生物学功能,为进一步筛选杀虫剂新靶标提供理论依据。1 材料与方法
试验于2015—2016年在山西大学应用生物学研究所完成。1.1 材料
供试昆虫:飞蝗卵块购于河北沧州蝗虫养殖基地,将其置于人工气候箱中孵育,设置温度为(30±2)℃,相对湿度为60%,光周期为L:D=14 h:10 h。待其孵化为1龄若虫后,将其转移至纱笼中放于人工气候培养箱中继续培养,每天饲喂足量新鲜麦苗,待其长至3龄若虫后,添加足量麦麸。直至其蜕皮为5龄若虫时开展后续试验。试验试剂:总RNA提取所需试剂RNAisoTM Plus、cDNA第1链合成所需试剂Revert AidTM HMinus M-MuLV反转录酶和5×reaction buffer、dNTP mix和RNAase inhibitor、RT-qPCR所需试剂SYBR PremixEx TaqTM II和荧光染料ROX均购于日本TaKaRa公司;PCR扩增所需试剂2×Taq PCR MasterMix购于天根生物公司;Wizard® SV Gel、 PCR Clean-Up System、RNAi双链RNA(dsRNA)合成所需试剂T7 RiboMAXTM Express RNAi System购于Promega公司。氯仿、异戊醇和75%无水乙醇均为国产分析醇。
1.2 飞蝗LmCDA4和LmCDA5的cDNA序列鉴定
1.2.1 飞蝗LmCDA4和LmCDA5的cDNA序列获得 将关键词“chitin deacetylase”输入飞蝗转录组数据库中,采用sequencher软件将搜索获得序列进行拼接,获得LmCDA4、LmCDA5a和LmCDA5b的cDNA序列。采用Expasy translate在线软件将其翻译为氨基酸,采用NCBI网站的blastP和SMART工具对其进行功能域预测。将LmCDA5a和LmCDA5b的序列部分氨基酸去掉,采用GeneDoc生物软件将LmCDA4、TcCDA4、TcCDA5a和LmCDA5b的氨基酸序列进行比对,并对其功能域进行标记。1.2.2 飞蝗LmCDA4和LmCDA5基因结构及聚类分析 采用NCBI的Blastn工具,将已鉴定的LmCDA4、LmCDA5a和LmCDA5b的cDNA序列与飞蝗基因组序列进行比对,AG-GT原则分析其内含子和外显子。采用Adobe Illustrator CS6绘制基因结构图。采用NCBI搜索获得其他昆虫CDAs氨基酸序列,Clustal X软件对其进行比对,MEGA 5.02对其进行neighbor-joining(NJ)聚类分析。
1.3 飞蝗LmCDA4和LmCDA5的组织部位和发育日龄表达分析
1.3.1 飞蝗LmCDA4和LmCDA5的引物设计 基于飞蝗转录组数据库获得LmCDA4和LmCDA5a和LmCDA5b全长cDNA序列,采用Primer 5.0软件分别在LmCDA4及LmCDA5a和LmCDA5b的公共区域设计表达引物和干扰引物,委托上海生工生物股份有限公司合成(表1)。Table 1
表1
表1本研究所用的表达引物和双链合成引物
Table 1Primers for mRNA expression and dsRNA synthesis in this study
| 基因 Gene | 引物用途 Application of primers | 引物序列 Primer sequence (5′-3′) | 产物 Product (bp) |
|---|---|---|---|
| β-actin | mRNA表达引物 Primers for mRNA expression | F: CGAAGCACAGTCAAAGAGAGGTA R: GCTTCAGTCAAGAGAACAGGATG | 156 |
| LmCDA4 | F: CATTGTCCTTACCTTGATCAGTGTG R: GTCACAAACCATACATCTGGGAGT | 215 | |
| LmCDA5 | F: GCAATGGATGATGTCTGGCTG R: CAGATTTGTGCCAGAGGTTGC | 166 | |
| dsGFP | RNA干扰引物 Primer for RNAi | F: taatacgactcactatagggGTGGAGAGGGTGAAGG R: taatacgactcactatagggGGGCAGATTGTGTGGAC | 571 |
| dsLmCDA4 | F: taatacgactcactatagggCATGCCGCAGATTCTATCAA R: taatacgactcactatagggAGGGAGCTCTCATTCCCACT | 591 | |
| dsLmCDA5 | F: taatacgactcactatagggGAAAAGGGCAGGAAGAATCC R: taatacgactcactatagggTTGCTACATGCATCACCCAT | 500 |
新窗口打开
1.3.2 不同组织部位cDNA模板制备 收集30头5龄第6天飞蝗若虫,使用解剖刀在解剖镜下快速将7个组织部位(表皮、前肠、中肠、胃盲囊、后肠、马氏管和脂肪体)置于冰盒上解剖,冻存于液氮中,参照TaKaRa公司提取RNA说明书,提取总RNA,采用琼脂糖胶检测其完整性,采用NanoDrop2000进行浓度测量。以1 µg RNA为模板,采用Revert AidTM HMinus M-MuLV反转录酶获得cDNA第1链。10头虫体为1个生物学重复,共设3个生物学重复。
1.3.3 不同发育日龄表皮cDNA模板制备 收集63头5龄飞蝗若虫用于CDAs在不同发育日龄的表达检测,使用解剖刀在显微镜下快速将不同日龄若虫的表皮置于冰盒上解剖取出,冻存于液氮中。提取总RNA和合成cDNA第1链的方法同1.3.2。每3头虫体为1个生物学重复,共设3个生物学重复。
1.3.4 LmCDA4和LmCDA5表达量的检测 采用RT-qPCR检测LmCDA4和LmCDA5在不同组织和发育日龄的表达。将1.3.2和1.3.3合成的cDNA模板稀释20倍,采用表达引物进行RT-qPCR扩增。体系为SYBR PremixEx TaqTM II 10 μL,模板2 μL,上游和下游表达引物分别为0.8 μL,ROX 0.4 μL。程序为95℃ 30 s,95℃ 5 s、60℃ 31 s共40个循环,加熔解曲线95℃ 15 s、60℃ 1 min、95℃ 15 s。采用ABI Prism 7300 SDS 1.1软件进行数据收集。采用2-△△Ct法进行数据分析。采用SPSS软件Turkey分析进行显著性差异分析。设置3个生物学重复和2个技术重复。β-actin为内参基因[25]。
1.4 飞蝗LmCDA4和LmCDA5的生物学功能
1.4.1 双链RNA(dsRNA)合成 采用RNA干扰引物进行PCR扩增。体系为2×Taq PCR MasterMix 12.5 μL,无菌去离子水10.5 μL,上下游dsRNA合成引物各0.5 μL,表皮cDNA模板1 μL。使用Wizard® SV Gel and PCR Clean-Up System试剂盒对PCR产物进行纯化。采用琼脂糖凝胶检测检测目的条带,使用NanoDrop 2000(Thermo scientific)对其进行定量,使终浓度达到0.25 μg·μL-1,参照T7 RiboMAXTM Express RNAi System试剂盒说明书合成dsLmCDA4和dsLmCDA5,以绿色荧光蛋白(green fluorescent protein,GFP)为对照。使用NanoDrop 2000进行定量,使其终浓度达到2 μg·μL-1,保存于-80℃超低温冰箱备用。1.4.2 干扰效率检测和表型观察 选取大小一致,生长状况良好的5龄第2天飞蝗若虫78头进行干扰效率检测和表型观察。采用25 μL微量进样器将6 μg dsGFP、dsLmCDA4和dsLmCDA5分别注射入飞蝗2—3腹节节间膜处。处理组和对照组分别设置3个生物学重复,每个重复3头虫体。将注射dsRNA的试虫放于人工气候箱中继续饲养,待24 h后分别将对照组和处理组各9头虫体冻存于-80℃冰箱中,参照1.3.2方法提取RNA并反转录为第1链cDNA。3头试虫为1个重复,共设置3个生物学重复。采用RT-qPCR检测目的基因表达情况,检测方法参照1.3.4。剩余60头试虫放于培养箱中继续饲喂,每天观察记录其发育情况。
1.4.3 几丁质含量测定 选取5龄第2天飞蝗若虫共90头随机分为3组,分别注射dsGFP、dsLmCDA4和dsLmCDA5,每组注射30头虫,至5龄第7天时将其腹部表皮解剖取出,置于90℃干燥箱中烘干,待其达到恒重后,参考ZHANG等[26]方法测定几丁质含量。对照组和处理组分别设置10组,每组含有3头虫,设置3个技术重复。
1.4.4 透射电镜观察 选取15头5龄第2天若虫,将其平均分为3组,分别注射dsGFP、dsLmCDA4和dsLmCDA5,待其蜕皮死亡后,将其表皮快速解剖取出,固定于3%戊二醛中,参照LIU等[27]方法进行透射电镜样品制备及观察。
2 结果
2.1 飞蝗LmCDA4和LmCDA5 的cDNA序列分析
基于飞蝗转录组数据库搜索获得几丁质脱乙酰基酶4和5基因的全长cDNA序列,其中LmCDA5包含2个剪切子,分别将其命名为LmCDA5a和LmCDA5b。基因结构图显示,LmCDA4包含10个外显子和9个内含子,LmCDA5a和LmCDA5b均包含20个外显子和19个内含子,且其在第15个外显子处序列存在差异,将其命名为E15a和E15b(图1-A)。功能域分析表明,LmCDA4开放阅读框为1 449 bp,编码483个氨基酸。LmCDA5a和LmCDA5b开放阅读框均为3 300 bp,编码1 100个氨基酸。其均具有信号肽、几丁质结合域(ChBD)和几丁质脱乙酰基催化域(CDA)(图1-B)。与赤拟谷盗TcCDA4、TcCDA5a和TcCDA5b序列比对结果表明,LmCDA5a和LmCDA5b的差异区域与TcCDA5a和TcCDA5b的差异区域位置一致。其均含有几丁质结合域(ChBD)特征序列(6个cys),几丁质脱乙酰基催化域(CDA)均具有5个特征序列,分别为TFD[D/G]、[H/E]××S[H/L]、RAP[Y/F]、[F/Y] [I/T]YDS和LDYK××H(图1-C)。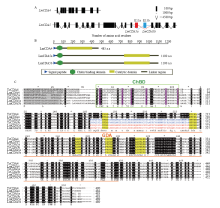 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1飞蝗LmCDA4、LmCDA5a和LmCDA5b基因结构、推导功能域和氨基酸序列比对
A:黑色实心框和线段为LmCDA5a和LmCDA5b共有外显子和内含子。红色和蓝色实心框和线段分别为LmCDA5a和LmCDA5b特有外显子,分别为E15a和E15b Black solid boxes and lines indicated the common exons and introns. Red and blue solid boxes and linses presented the specific exon and introns, named E15a and E15b;B:蓝色三角形为信号肽,绿色六边形为几丁质结合域,黄色框为催化功能域。数字代表氨基酸长度 Blue triangles showed the signal peptides, the green hexagon represented chitin-binding domains and yellow boxes represented catalytic domains. Numbers showed the length of amino acid;C:灰色阴影为信号肽区域,绿色框为几丁质结合区(ChBD),紫色阴影为几丁质结合域(ChBD)特征氨基酸(cys),橘色下划线为几丁质脱乙酰基酶催化域(CDA),黄色阴影为催化区域保守序列。蓝色和红色分别为赤拟谷盗和飞蝗CDA5a和CDA5b的差异序列,//表示CDA5没有显示的氨基酸序列
-->Fig. 1The genome structure, deduced domain architectures and alignment of amino acid of LmCDA4, LmCDA5a and LmCDA5b in L. migratoria
The signal peptide was shaded with gray, chitin binding domain (ChBD) was marked with green box, the signature amino acids of ChBD domain were shaded with purple, chitin deacetylase catalyticdomains (CDA) were underlined with orange line, the conserved signature motifs were marked with yellow shadow. The specific amino acids of CDA5a and CDA5b in T. castaneum and L. migratoria were marked with blue and red. // indicated additional amino acids of CDA5 not shown
-->
2.2 飞蝗与其他已知昆虫CDAs的聚类分析
将飞蝗LmCDA4、LmCDA5a和LmCDA5b与赤拟谷盗、果蝇、冈比亚按蚊(Anopheles gambiae)、家蚕、稻蝗和云杉卷叶蛾的CDAs构建NJ系统进化树(图2)。结果表明,LmCDA4以较高的置信度与果蝇DmCDA4及赤拟谷盗TcCDA4聚为一支。同时LmCDA5a和LmCDA5b与赤拟谷盗和果蝇CDA5s聚为一支。基于其所含功能域不同,CDAs可分为5类,LmCDA4属于第Ⅲ类,LmCDA5a和LmCDA5b属于第Ⅳ类。第Ⅲ和第Ⅳ类仅含有几丁质结合域(ChBD)和几丁质脱乙酰基酶催化域(CDA)。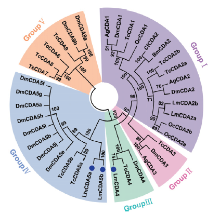 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同昆虫CDAs聚类分析
Dm:果蝇D. melanogaster;Ag:冈比亚按蚊A. gambiae;Tc:赤拟谷盗T. castaneum;Bm:家蚕B. mori;Cf:云杉卷叶蛾C. fumiferana;Oc:中华稻蝗O. chinensis;Lm:飞蝗L. migratoria。不同阴影代表不同分组。蓝色实心圆为LmCDA4、LmCDA5a和LmCDA5b氨基酸序列
-->Fig. 2The phylogenetic analysis of CDAs from different insects
Different shadows showed the different groups. The amino acids of LmCDA4, LmCDA5a and LmCDA5b were marked with blue solid circles
-->
2.3 飞蝗LmCDA4和LmCDA5的组织部位和发育日龄表达特性
组织部位表达图谱显示,飞蝗LmCDA4在前肠表达最高,在表皮和后肠次之,而LmCDA5在前肠表达最高,在表皮、后肠和脂肪体表达较高(图3-A)。发育日龄表达图谱显示,LmCDA4和LmCDA5均在蜕皮后表达较高。即5龄第1、2天表达较高,之后呈现逐渐降低趋势(图3-B)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3LmCDA4和LmCDA5在飞蝗5龄不同组织部位和表皮不同发育日龄的表达
IN:表皮Integument;FG:前肠Foregut;MG:中肠Midgut;GC:胃盲囊Gastric caeca;HG:后肠Hindgut;MT:马氏管Malpighian tubules;FB:脂肪体Fat body。N5:5龄若虫,D1—D7:第1—7天。β-actin为内参对照,柱上不同字母表示样品间存在显著差异(P<0.05) β-actin was the reference. Different letters on the columns meant significant difference (P<0.05)
-->Fig. 3The relative expression of LmCDA4 and LmCDA5 in different tissues and days of integument
-->
2.4 飞蝗LmCDA4和LmCDA5沉默效率检测和表型观察
注射dsGFP、dsLmCDA4和dsLCDA5 24 h后,采用RT-qPCR分别检测LmCDA4和LmCDA5的相对表达量(图4-A)。与对照相比,注射dsRNA后,靶基因的表达均显著降低。即注射dsLmCDA4后,LmCDA4相对表达量降低了98.1%。注射dsLmCDA5后,LmCDA5相对表达量降低了95.6%。表型观察表明,注射dsLmCDA4和dsLmCDA5的虫体均可成功蜕皮发育至成虫。对其几丁质含量进行检测。结果表明(图4-B),与对照相比,注射dsRNA后,其几丁质含量均未出现显著差异。进一步将其腹部表皮解剖下来,进行透射电镜观察(图4-C),结果表明注射dsGFP组其腹部原表皮呈现层状结构排列。注射dsLmCDA4和dsLmCDA5并未影响其原表皮层状结构排列。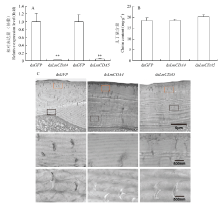 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4注射dsGFP、dsLmCDA4和dsLmCDA5后沉默效率、几丁质含量和透射电镜观察
A:柱形图上的**表示处理组和对照组之间存在极显著差异(P<0.01) Two asterisk on the columns indicated markedly significant difference between the control and dsLmCDA4 or dsLmCDA5 injection (P<0.01);C:黄色框表示与上表皮相邻的原表皮,黑色框表示与表皮细胞相邻的原表皮。标尺为5 μm和500 nm Yellow boxes indicated the area of procuticle next to epicuticle, black boxes indicated the procuticle next to the epidermal cell. Scale bars were 5 μm and 500 nm
-->Fig. 4The silence efficiency, chitin content and TEM observation after dsGFP, dsLmCDA4 and dsLmCDA5 injection
-->
3 讨论
几丁质脱乙酰基酶CDAs存在于多种昆虫中。其作为一种修饰酶系,可以催化几丁质转化为去乙酰基几丁质[28]。目前在赤拟谷盗中鉴定出9条CDAs序列,根据其所含的功能域不同,将其分为5类,其中第3类和第4类含有几丁质结合域和催化域[7]。本研究基于飞蝗转录组数据库,获得3条序列,经功能域分析,发现其均含有几丁质结合域和催化域,故认为其可能是第3类或第4类CDAs。进一步与其他昆虫的CDAs进行氨基酸比对,发现LmCDA4和LmCDA5分别以较高的置信度与其他昆虫的CDA4和CDA5聚为一支,故将其命名为LmCDA4和LmCDA5。赤拟谷盗的TcCDA5具有2个剪切子,分别为TcCDA5a和TcCDA5b[6-7]。为明确LmCDA5的2条序列是否为不同剪切子,将其与赤拟谷盗TcCDA5a和TcCDA5b进行了氨基酸序列比对,发现LmCDA5的差异区域与赤拟谷盗TcCDA5的差异区域位置一致,故将其命名为LmCDA5a和LmCDA5b。不同昆虫中CDA4和CDA5在不同组织部位和不同发育阶段的表达具有多样性。NlCDA4在褐飞虱的表皮中表达较高,且其在蜕皮前后表达较高[15]。赤拟谷盗TcCDA4和TcCDA5均在表皮中表达最高,TcCDA4在除蛹期外其他龄期均有表达,TcCDA5在整个发育龄期均有表达[6]。稻纵卷叶螟CmCDA4在头部表达较高,且其在成虫期表达显著高于幼虫期,CmCDA5在表皮中高表达,其龄期表达与CmCDA4表达模式相反,即其在幼虫期的表达显著高于成虫期[23]。本研究发现,飞蝗LmCDA4和LmCDA5均在前肠表达最高,在表皮和后肠表达较高。此外,LmCDA5在脂肪体表达较高。与表皮来源相同,昆虫前肠和后肠均由外胚层内陷形成[29]。前人报道果蝇气管DmCDA1来源于脂肪体,后经血淋巴将其转移到气管细胞中,最终经胞吞作用,将其运输到气管腔中[30],故推测飞蝗LmCDA5与脂肪体相关,但是否其来源于脂肪体,还需进一步验证。LmCDA4和LmCDA5均在蜕皮前后表达较高,推测其可能参与飞蝗表皮的生长发育。
几丁质去乙酰基酶(EC 3.5.1.41)是碳水化合物酯酶4家族成员之一。CDA能够催化几丁质β-1,4糖苷键连接的N-乙酰基葡糖胺的乙酰胺基水解,形成脱乙酰几丁质(或称聚葡萄糖胺,壳聚糖)[28]。研究表明,同一昆虫CDAs的功能有所差异。赤拟谷盗中TcCDA1和TcCDA2的dsRNA进入虫体后,出现蜕皮致死的表型,但沉默TcCDA3、TcCDA4和TcCDA5后并未出现致死表型[6]。褐飞虱NlCDA1、NlCDA2和NlCDA4的dsRNA注射进入虫体后,出现蜕皮致死的表型,但沉默NlCDA3并不影响其正常生长发育[15]。笔者实验室前期研究发现,飞蝗中LmCDA2负责几丁质排列,将其沉默后,虫体难以从旧表皮中蜕出,最终导致死亡,电镜观察表明几丁质片层结构消失,几丁质层变得疏松导致原表皮层厚度增加,但并未影响几丁质的含量[16],本文将已鉴定的LmCDA4和LmCDA5的dsRNA注射入虫体后,发现其均可成功发育至成虫,未影响几丁质含量和表皮几丁质排列,表明飞蝗不同CDAs功能上存在差异。根据CDAs所含功能域不同,将CDAs分为5类,其中CDA1和CDA2属于第Ⅰ类,负责昆虫蜕皮和表皮结构的完整性,包含几丁质结合域(ChBD)、低密度脂蛋白受体域(LDLa)和催化域(CDA),而CDA4和CDA5分别属于第Ⅲ和Ⅳ类,均不含LDLa功能域,哺乳动物中多个LDLa串联形式在一起,结合并且转运脂蛋白进入细胞中,从而参与胆固醇的代谢[7]。昆虫仅有1个LDLa功能域,可能参与脂蛋白的运输,脂蛋白是上表皮的重要组成成分,由于CDA1和CDA2含有LDLa功能域,基因沉默后导致昆虫蜕皮困难最终死亡,而CDA4和CDA5均不含有LDLa功能域,推测其不参与这一运输过程,故不影响昆虫蜕皮,这与赤拟谷盗CDA4和CDA5相一致,目前对其生物学功能及其机理还需要进一步研究。此外,赤拟谷盗TcCDA1和TcCDA2以及云杉卷叶蛾CfCDA2出现蜕皮致死的原因推测可能由于dsCDA1和dsCDA2引起几丁质脱乙酰度发生改变[4,14],本文中LmCDA4和LmCDA5不影响飞蝗正常蜕皮,是否影响脱乙酰度还需要进一步验证。综合分析表明,CDA4和CDA5在不同昆虫中均不影响正常蜕皮。本研究结果丰富了飞蝗CDAs家族的生物学功能研究内容,为基于几丁质代谢关键靶标基因筛选提供了理论和实践依据。
4 结论
获得飞蝗几丁质脱乙酰基酶4和5基因的全长cDNA序列,LmCDA5具有2个剪切子,分别命名为LmCDA5a和LmCDA5b。LmCDA4和LmCDA5均在5龄若虫的表皮、前肠和后肠中表达量较高,且其均在蜕皮后的表达显著高于其他时期。RNA干扰可有效沉默靶基因的表达,注射dsLmCDA4 和dsLmCDA5的试虫可正常蜕皮发育,无可见表型,几丁质含量和电镜结果也表明未影响表皮几丁质含量和原表皮片层结构。The authors have declared that no competing interests exist.
