0 引言
【研究意义】花色素苷是植物体内的一类次生代谢物质,不仅能够帮助植物自身免受紫外线灼伤和抵御病虫害,还可以吸引昆虫为其授粉。同时,食用富含花色素苷物质的果实对人体健康也有保护和促进作用[1-2],大量的体外研究表明,花色素苷通过其较强的自由基清除作用,而表现出抗炎[3]、保护心血管[4]、抗肿瘤[5]等多种生物活性。红肉桃是桃中富含花色素苷的一种重要类型,其花色素苷含量远高于白肉桃和黄肉桃[6]。CEVALLOS-CASALS等[7]研究发现,红肉桃种质的抗氧化能力与花色素苷含量的相关性达到显著水平。沈志军等[8]通过相关性分析发现,抗氧化能力指标(relative antiradical capacity,RAC;ferric reducing ability of plasma,FRAP)在果皮、果肉和全果中与花色素苷含量的相关性均达到显著水平。因此,随着消费者对果品类型多样化和保健功能关注度的不断增强,富含花色素苷的红肉桃逐渐成为当前国内外功能性水果开发研究的热点[9-10]。【前人研究进展】人们普遍认为红肉桃的果实在成熟期时才大量积累红色素[11-13]。但CHAPARRO等[14]和WERNER等[15]在研究加拿大红肉种质‘Harrow Blood’时发现其果实花色素苷是在花后45—50 d开始积累,而成熟前有所下降。SHEN等[16]研究了中国红肉品种‘WuYueXian’,认为‘WuYueXian’的红肉性状确实不同于‘Harrow Blood’等资源,其花色素苷含量在果实成熟前迅速增加。ZHOU[17]等研究红肉品种‘大红袍’时,同样得出花色素苷是在成熟前10 d开始积累,成熟时达到最大。花色素苷的生物合成是植物类黄酮合成途径的一个重要分支,在拟南芥、矮牵牛、玉米等模式植物中该合成通路已研究的较为清楚。对于该过程中调节结构基因的关键酶,研究者[18-19]认为苯丙氨酸解氨酶(PAL)只是催化合成花色素苷的前提物质,当前体物质充足时,花色素苷的积累将不随PAL活性的变化而变化。LISTER等[20]报道则指出苯基苯乙烯酮黄烷酮异构酶(CHI)活性的上升与苹果果皮中花色素苷含量的增加相一致,然而也有****认为CHI在着色初期保持高活性,催化生成黄烷酮,在为花色素苷合成提供足够的底物后,其活性逐渐下降,并没有随花色素苷的积累而保持在较高水平[21]。部分****[22-23]的研究表明,UFGT只是在果实接近成熟的转色期表达,表达的强度与花色素苷合成呈正相关,且该基因只在红色果皮中特异表达,在根、芽、种子等部位不表达[24],以上研究结果说明UFGT是苹果果皮红色的关键基因之一。除了结构基因外,也有研究表明植物器官的红色发育及花色素苷代谢与MYB转录因子有关,苹果方面的研究[25]认为MYB10转录因子通过调控DFR和UFGT的转录进而调控花色素苷的合成,而且MYB10具有与bHLH互作的结构功能域,两者形成转录蛋白复合体共同调控花色素苷的代谢[26]。因此,花色素苷合成的调控通路是十分复杂的,不同植株甚至是果实的不同发育阶段、不同组织部位,其调控花色素苷合成的能力存在差异。【本研究切入点】目前关于红肉桃种质的花色素苷积累模式的研究主要集中在‘Harrrow Blood’[15]和‘WuYueXian’[16]两个红肉桃品种,对中国其他的红肉桃资源[27-30]研究较少。【拟解决的关键问题】利用pH示差法和qRT-PCR技术分别检测中国红肉桃发育过程中花色素苷积累动态和相关基因的表达变化,明确中国红肉桃种质资源花色素苷的积累类型,并从花色素苷积累与合成相关基因的表达层面解析不同类型的调控模式,为红肉桃基因发掘和新品种培育提供参考。1 材料与方法
试验于2016年在中国农业科学院郑州果树研究所进行。1.1 试材及其取样
以中国农业科学院郑州果树研究所国家果树种质资源郑州桃圃的8份红肉桃和1份白肉桃作为试验材料(表1)。Table 1
表1
表19份桃种质果实的采样时期
Table 1The sampling date of 9 peach accessions
| 种质 Accession | 果肉颜色 Flesh color | 花后天数 Days after full bloom (d) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 | S11 | S12 | S13 | S14 | S15 | ||
| 郑引82-9 Zheng Yin 82-9 | 红 Red | 31 | 41 | 51 | 61 | 65 | 72 | 75 | 79 | |||||||
| 红桃 Hong Tao | 红 Red | 31 | 41 | 51 | 61 | 72 | 79 | 89 | 91 | |||||||
| 大红袍 Da Hong Pao | 红 Red | 31 | 41 | 51 | 61 | 72 | 79 | 89 | 94 | 98 | ||||||
| 哈露红 Harrow Blood | 红 Red | 41 | 51 | 61 | 72 | 89 | 108 | 128 | 147 | 155 | ||||||
| 黑布袋 Hei Bu Dai | 红 Red | 31 | 41 | 51 | 61 | 72 | 79 | 89 | 98 | 108 | ||||||
| 天津水蜜 Tianjin Shui Mi | 红 Red | 31 | 41 | 51 | 61 | 72 | 79 | 89 | 94 | 98 | 108 | |||||
| 郑白5-2 Zheng Bai 5-2 | 白 White | 31 | 41 | 51 | 61 | 72 | 79 | 89 | 98 | 108 | 118 | 128 | ||||
| 乌黑鸡肉桃 Wu Hei Ji Rou Tao | 红 Red | 31 | 41 | 51 | 61 | 72 | 79 | 89 | 98 | 108 | 118 | 128 | 138 | 147 | ||
| 大果黑桃 Da Guo Hei Tao | 红 Red | 31 | 41 | 51 | 61 | 72 | 79 | 89 | 98 | 108 | 118 | 128 | 138 | 147 | 155 | 162 |
新窗口打开
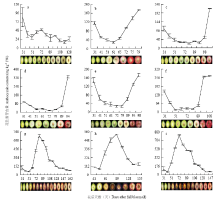 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同红肉桃果实发育期果肉颜色和总花色素苷含量的动态变化
a:郑白5-2;b:郑引82-9;c:天津水蜜;d:红桃;e:大红袍;f:黑布袋;g:大果黑桃;h:哈露红;i:乌黑鸡肉桃 a: Zheng Bai 5-2; b: Zheng Yin 82-9; c: Tianjin Shui Mi; d: Hong Tao; e: Da Hong Pao; f: Hei Bu Dai; g: Da Guo Hei Tao; h: Harrow Blood; i: Wu Hei Ji Rou Tao. 误差用标准差表示 Earror bars show the SE of the mean
-->Fig. 1Changes of color in the mesocarp and anthocyanin content of peach during fruit development (mg∙kg-1 FW)
-->
选取树势一致的植株,于2016年4—8月期间,选择大小均匀、果形正常、无病虫害的果实,分别在盛花后一个月开始样品的采集,以后每隔10 d左右采集一次(果实转色时期密集采样)。每份种质随机采取5个果实,削去表皮,取中果皮果肉,液氮速冻,保存至-80℃冰箱备用。9份种质果实采样时期见表1。
1.2 总花色素苷提取及测定
取冷冻保存的果肉样品加液氮并用冷冻研磨机研磨成均匀的粉末,然后取5 g研磨好的果肉粉末,分3次加入8 mL 2%甲酸甲醇,充分混匀后,超声仪提取20 min(常温,40 Hz,100 W),摇床振荡20 min(常温,250 r/min),离心8 min(常温,9 600 r/min),将上清液转到50 mL离心管内,重复提取3次,合并提取液,再次离心(常温,9 600 r/min),最后将所有上清液转到25 mL棕色容量瓶并用2%甲酸甲醇定容,待测。每个样品重复3次。参照孙婧超等[31]的方法并加以改良,取1 mL上述提取液于两支10 mL试管中,分别加入9 mL 0.2 mol∙L-1 KCl(pH 1.0)和0.2 mol∙L-1 CH3CO2Na·3H2O(pH 4.5)缓冲液避光平衡20 min后,以2%甲酸甲醇为空白对照,分别于分光光度计510 nm和700 nm下在30 min内测定所有样品吸光度A。
稀释后样品吸光度ΔA按下式进行计算:
ΔA=(A510-A700) pH 1.0-(A510-A700) pH 4.5。
样品花色素苷含量按下式计算:
提取液花色素苷浓度W (mg∙L-1) = [(ΔA × MW) / (ε × 1)] × Df × 1000;
果肉样品花色素苷含量 (mg∙kg-1) = W × 25 / 5。
式中,MW:矢车菊素-3-葡萄糖苷的相对分子质量(449 mg∙mol-1);ε:矢车菊素-3-葡萄糖苷的摩尔消光系数(29 600 L·mol-1·cm-1);Df:稀释因子(样品总的稀释倍数)。
1.3 总RNA的提取及qRT- PCR检测
分别取若干样品,研磨成粉末状,用改良的CTAB法提取样品的总RNA,参照TaKaRa公司DNaseⅠ操作说明消化DNA,琼脂糖凝胶电泳检测其完整性,并用核酸蛋白仪检测RNA浓度和纯度。采用ReverTra qPCR RT(TOYOBO,上海)试剂盒进行反转录,用ddH2O稀释5倍,保存于 -20℃冰箱,备用。引物(表2)由苏州金唯智生物科技有限公司合成,qRT-PCR反应采用ABI公司的Power SYBR Green PCR Master Mix在ViiATM 7 Real-time PCR System(Roche,China)上进行。反应体系20 μL,包括:10 μL的SYBR Green PCR Master Mix、2 μL稀释的cDNA、0.3 μL上游引物 (10 μmoL∙L-1)、0.3 μL下游引物(10 μmoL∙L-1),ddH2O补至20 μL。每个样品3个重复,反应程序如下:95℃ 5 min;95℃ 15 s,60℃ 15 s,72℃ 15 s,40个循环。Table 2
表2
表2荧光定量PCR所用基因的引物序列
Table 2Sequences of primers used for qRT-PCR analysis
| 基因 Genes | 蔷薇科数据库基因编号 GDR accession no. | 正向引物 Forward primers (5′-3′) | 反向引物 Reverse primers (5′-3′) | 参考文献 Reference | |
|---|---|---|---|---|---|
| 结构基因 Biosynthetic genes | PpPAL | ppa002099m | CAGAGCAGCACAACCAAGACG | CTCCAAATGCCTCAAATCAATG | [17] |
| PpCHS | ppa006888m | AACAAGGGTGCTCGTGTTCTC | GCTGCACCATCACCGAATAAG | ||
| PpCHI | ppa011276m | TTGGCGTGTACTTGGAGGAT | TTCTCAAATGGACCTGTAACGA | ||
| PpF3H | ppa007636m | GGACTGGACACAGAGGCATTG | GTAATTGTGCCTGGGTCAGTGT | ||
| PpF3'H | ppa004433m | CTCTCGCTCAAAGAGGATGCT | CCATTCCACTGTGCTTGATGAC | ||
| PpDFR | ppa008069m | CTTGTGATTGGCCCATTTCTC | GTCGTCCAAGTGAACGAACTG | ||
| PpLDOX | ppa007738m | TACCCTGAGGACAAGCGTGAC | ATCCCAACCCAAGTGACAGC | ||
| PpUFGT | ppa005162m | GTCCTAGCCCATGCTTCAGTC | GATCTCCAACACGTCCTCCAC | ||
| PpGST | ppa011307m | TTTGGTCAAGTTCCAGCAGTAG | CAGGGTTGTTCCCAATAGGTT | ||
| 调节基因 Regulatory genes | PpMYB10.1 | ppa026640m | GAAATGATTGGTGGGAAACC | GTCCTTCTTCTGAAACATTGGT | [17] |
| PpbHLH3 | ppa002884m | TTGAGACGACAGTTGTCCAGTC | ATTCACATTCTCCTTCACCTTG | ||
| PpWD40 | ppa008187m | CCCAGCCTGATACCCCTTTGCT | GTCGGCGAACGGATATCCAAAAT | [34] | |
| PpBL | ppa022238m | TTCCCAAACAGTGCAAGACAG | CCATCAAGTTCAACGAGTTCAAG | [17] | |
| 内参基因 Reference gene | TEF2 | Ppa001368m | GGTGTGACGATGAAGAGTGATG | TGAAGGAGAGGGAAGGTGAAAG | [17,32] |
新窗口打开
1.4 统计分析
以TEF2为内参基因[32],采用2-△△CT法[33]计算花色素苷合成酶基因的相对表达量[17,34],使用Excel 2010进行数据统计,并制作趋势图。利用R 3.3.1中的‘ggplot’软件绘制热图。2 结果
2.1 桃种质果实发育期果肉颜色和总花色素苷含量
从图1可以看出,在整个发育阶段白肉桃‘郑白5-2’果肉颜色由青变白,至成熟时果实也未着 色;而所有红肉桃果肉颜色都呈现由绿逐渐转红,但不同品种的转色期则存在差异,如‘郑引82-9’‘天津水蜜’‘红桃’‘大红袍’和‘黑布袋’在果实临近成熟时红色逐渐加深至成熟时达到最红,在着色部位上表现为果肉全红或近表皮果肉呈圈红。而‘大果黑桃’‘哈露红’和‘乌黑鸡肉桃’的果肉颜色在花后60—120 d(即硬核期)时逐渐变红至黑红色,随着果实成熟色泽又变浅,果肉的着色部位集中在中果皮和近表皮果肉上,而近核处果肉不着色。由于桃果肉的红色主要决定于果实中花色素苷的含量[35],因此,本研究采用pH示差法测定了桃不同发育阶段果肉中花色素苷的含量,作为果肉颜色变化的参考。由图1可知,8份红肉桃种质的花色素苷在整个生育期有2个合成高峰,第1个高峰均开始于盛花期后,盛花后约30 d达最大值,第2个高峰则在不同的红肉桃种质中出现的时期不同。具体为:‘郑引82-9’‘天津水蜜’‘红桃’‘大红袍’和‘黑布袋’分别在其盛花后65 d、98 d、89 d、89 d和89 d花色素苷含量逐渐上升,至成熟时达到第2个合成高峰;‘大果黑桃’‘哈露红’和‘乌黑鸡肉桃’的果肉花色素苷分别在盛花后61 d、61 d和51 d开始升高,至盛花后79 d、89 d和72 d达到第2个合成高峰,之后,随着果实成熟其花色素苷含量有所下降。
综上所述,根据不同红肉桃花色素苷含量在第1个合成高峰后的趋势与果肉着红色的动态变化可以把红肉桃分为两类:一类是成熟期积累型,具体表现为在果实接近成熟时果肉开始着红色,至成熟时花色素苷含量达到最大;二是发育中期积累型,该类果实在盛花后约50 d开始着红色并不断加深,接近成熟时又变浅,花色素苷含量也呈下降的趋势。
2.2 桃种质果实发育期果肉花色素苷合成结构基因的表达分析
由图2可知,对照‘郑白5-2’的PpPAL、PpCHS、PpCHI、PpF3H、PpF3’H、PpDFR和PpLDOX在果实发育前期表达量较高,这与其花后51 d前果实中较高的花色素苷含量是一致的(图1-a);PpUFGT在‘郑白5-2’的果实发育中期表达,而PpGST在整个果实发育期均不表达。对于成熟期积累型的5份种质来说,基因PpPAL、PpF3’H、PpDFR和PpLDOX在除‘天津水蜜’之外的4份种质的果实发育后期表达逐渐升高;而PpCHI和PpF3H只在‘郑引82-9’‘大红袍’和‘黑布袋’的果实发育后期有高的表达;仅有基因PpCHS、PpUFGT和PpGST的表达模式与5份红肉桃种质的果实着色规律和花色素苷积累基本一致,即在果实成熟期表达量较高,是该类红肉桃种质花色素苷合成的关键结构基因。而在属于发育中期积累型的3份种质中,9个结构基因均在果实发育的中前期表达水平最高,随后呈下降趋势。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2两种红肉桃类型关键基因的相对表达量
-->Fig. 2Relative expression of key genes in two red peach accessions
-->
2.3 桃种质果实发育期果肉花色素苷合成调节基因的表达分析
为鉴定不同红肉桃种质的花色素苷合成是否受到转录调节,选择在桃上已有报道的花色素苷合成调控转录因子PpMYB10.1[17]、PpHLH3[36]、PpWD40[34]和BL[17],测定其在果实发育过程中的表达变化。由图2可知,在5份成熟期积累型红肉桃种质中,只有PpMYB10.1的表达与PpCHS、PpUFGT和PpGST的表达趋势一致,而PpbHLH3、PpWD40和PpBL仅在‘天津水蜜’‘大红袍’和‘红桃’果实发育前期的某个时期有高表达,与关键结构基因的表达相关性不强。在3份发育中期积累型种质中,同样只有PpMYB10.1与关键结构基因表达一致,而PpbHLH3在‘大果黑桃’的后期、‘乌黑鸡肉桃’和‘哈露红’的前期表达量较高,PpWD40在‘乌黑鸡肉桃’和‘哈露红’的果实发育前期同样高表达,PpBL在3份红肉桃种质果肉中均未检测到表达。
2.4 不同类型红肉桃花色素苷含量及其相关基因表达量的比较
为了比较不同红肉桃类型种质花色素苷和关键基因绝对含量的差异,如图3所示,选择‘天津水蜜’和‘大果黑桃’分别作为成熟时期积累型和发育中期积累型的代表品种,仍选择‘郑白5-2’为对照种质,其中S1—S3为3个品种的果实发育前期,S4—S6、S4—S10和S4—S7分别为‘天津水蜜’‘大果黑桃’和‘郑白5-2’的果实发育中期(硬核期),S7—S10、S11—S15和S8—S11分别为‘天津水蜜’‘大果黑桃’和‘郑白5-2’的果实发育后期。结果显示,中期积累型种质‘大果黑桃’在花色素苷合成达到峰值时的含量为690.76 mg·kg-1,而成熟期积累型种质‘天津水蜜’在果实发育后期花色素苷合成达到峰值时的含量为216.07 mg·kg-1,仅相当于‘大果黑桃’花色素苷峰值的1/3。在果实发育后期,虽然‘大果黑桃’花色素苷含量下降至79.40 mg·kg-1,低于同期的‘天津水蜜’,但仍高于白肉桃‘郑白5-2’。关键基因PpCHS、PpUFGT和PpMYB0.1在中期积累型种质‘大果黑桃’花后61 d高表达,而成熟期积累型种质‘天津水蜜’在果实发育后期表达量同样达到最大。并且在果实发育后期,虽然‘大果黑桃’PpCHS、PpUFGT和PpMYB0.1表达量下降,并低于同期的‘天津水蜜’,但仍高于白肉桃‘郑白5-2’。说明‘天津水蜜’和‘大果黑桃’关键基因的表达量规律与其花色素苷合成规律具有一致性。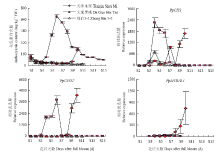 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3两种红肉类型代表品种花色素苷合成关键基因的表达量与其果实花色素苷含量关系的比较
-->Fig. 3Comparison of the relationship between expression levels of anthocyanin biosynthesis key genes and anthocyanin content in fruits of two red-flesh peach cultivars
-->
3 讨论
3.1 红肉桃果肉花色素苷积累的动态变化
CHAPARRO等[14]和WERNER等[15]研究了法国品种‘Harrow Blood’的果肉花色素苷合成规律,认为它与果实发育后期迅速积累花色素苷的种质‘Red English’和‘Indian Blood’不一样,属于发育中期积累型(花后45—50 d)。SHEN等[16]对中国古老的红肉桃资源‘WuYueXian’果肉花色素苷进行测定,发现其花色素苷在果实成熟前期大量积累,属于成熟期积累型。在本研究中,选取了8份具有代表性的红肉桃种质探索红肉桃资源的着色类型,检测结果发现红肉桃果肉花色素苷合成有2个高峰,第1个出现在幼果期,第2个高峰期出现在果实发育中期或者成熟期,该时期随红肉桃种质的不同而不同。根据第2个时期出现的早晚将8份种质分为成熟期积累型(如‘郑引82-9’‘天津水蜜’‘大红袍’‘黑布袋’和‘红桃’)和发育中期积累型(如‘大果黑桃’‘乌黑鸡肉桃’和‘哈露红’)。虽然发育中期积累型种质花色素苷含量在果实成熟期下降,但果肉仍为红色,仍属于红肉桃类型。在对本研究供试材料的花色素苷进行测定时,发现幼果期花色素苷合成也有1个高峰,该结果与章秋平等[37]在红肉桃品种‘天津水蜜’盛花后25 d果肉中发现的花色素苷合成高峰是一致的。在苹果上,鞠志国等[38]同样认为,苹果果皮中花色素苷在幼果期和成熟期各有1个合成高峰,然而,通过直接观察果肉横切面,笔者却并未在幼果期的果肉中看到明显的红色。分析原因,可能与果实发育早期果肉中存在大量的多酚物质从而干扰了花色素苷的测定有关。在果实发育早期,酚酸类、黄烷3-醇和黄酮醇大量积累,随着果实成熟期含量不断下降[39-40],其对花色素苷测定的影响也将逐渐降低。
3.2 PpCHS和PpUFGT是桃果肉花色素苷合成的关键结构基因
在桃果肉花色素苷代谢通路中,JIAO等[41]通过对红肉桃‘Beijingyixianhong’和‘Heiyoutao’果实进行套袋试验发现,PpCHS和PpUFGT的表达在去袋后的第3天上调,认为这2个基因是调控花色素苷合成的关键基因。而RAVAGLIA[34]的研究却发现,在油桃‘Stark Red Gold’果肉中仅PpUFGT的表达与花色素苷的积累相关,与BOSS等[42]和KOBAYASHI等[43]研究结果一致。在本研究中,从8份花色素苷积累模型不同的红肉桃中发现PpCHS、PpUFGT和PpGST与果肉花色素苷的积累相关性较强,即这3种基因可能是红肉桃种质花色素苷合成的关键基因。其中,虽然PpGST与红色形成有关,但由于其与花色素苷的转运有关,因此并不是严格意义上的花色素苷合成结构基因[44]。3.3 PpMYB10.1在桃果肉花色素苷合成中起到重要作用
对红肉性状进行连锁分析从而定位数量性状位点(Quantitative trait locus,QTLs),是准确鉴定不同红肉品种花色素苷合成关键调节基因的基础。LIN- WANG等[45]根据苹果MYB10克隆了桃PpMYB10,认为第3 连锁群上红肉性状QTLs区段的主效基因就是PpMYB10。GILLEN等[46]利用加拿大的一份红肉桃品种‘Harrow Blood’(在本研究中为‘哈露红’)的杂交群体,将红肉隐性基因bf定位在第4连锁群顶端,但未进行关键基因的预测。ZHOU等[17]利用‘大红袍’的杂交群体,将第5 连锁群红肉性状QTLs加密到200 kb 的范围内;并在该区间中发现一个BL(命名为NAC)在红肉和白肉品种中表达差异显著,认为是控制红肉性状的候选基因;随后的瞬时转化烟草和桃果肉试验证实该基因可通过调控位于第3连锁群上的PpMYB10.1影响花色素苷的合成。综上所述,PpMYB10.1在不同来源的红肉种质中均有作用,有时是直接有时是间接。在本研究中,也发现仅PpMYB10.1的表达与8份红肉种质花色素苷的积累趋势一致,而PpBL仅在‘郑引82-9’和‘黑布袋’这2份成熟期积累型种质的发育后期有表达,而发育中期积累型的种质中,未检测到PpBL的表达。该结果同样说明PpMYB10.1在调控花色素苷合成的通路中起到了直接或间接的作用。然而,通过表达分析仅能说明该基因是重要的,究竟该基因是否为导致表型出现差异的直接原因,仍需要结合连锁分析和DNA序列差异进行解析。3.4 两类红肉桃品种的遗传背景分析
为了探究两类红肉桃种质花色素苷合成通路的差异是否与其具有不同的遗传背景有关,查阅了前人对供试红肉桃品种遗传背景分析的有关文献。CAO等[47]基于53对全基因组简单重复序列(simple sequence repeat, SSR)标记对来自6个不同区域的104份种质构建系统发育树,分析中国桃种质的多样性,可将104份种质分为5个群,在本研究所用的8份红肉桃仅有5份种质包含其中,分别为‘天津水蜜’‘黑布袋’‘大果黑桃’‘乌黑鸡肉桃’和‘大红袍’,前4份种质亲缘关系较近,‘大红袍’与它们亲缘关系较远。LI等[48]基于48个多态性高的SSR标记对来自东方和西方的653份种质构建系统发育树,发现‘天津水蜜’与‘乌黑鸡肉桃’亲缘关系较近,其次是‘哈露红’,它们与‘大红袍’的亲缘关系较远,本研究所用的其他种质未知。MICHELETTI 等[49]收集了来自世界各地共1 580份桃种质,基于4 271个单核苷酸多态性(Single Nucleotide Polymorphism,SNP)构建系统发育树,发现‘天津水蜜’与‘乌黑鸡肉桃’亲缘关系较近,其次是‘大红袍’,它们与‘哈露红’的亲缘关系较远,本研究中的其他种质也未涉及到。综上所述,在已有遗传多样性或群体结构分析的研究中,‘天津水蜜’与‘乌黑鸡肉桃’亲缘关系较近,而与‘大红袍’亲缘关系较远。然而,在本研究中,‘天津水蜜’与‘大红袍’表现为花色素苷成熟期积累型,‘乌黑鸡肉桃’却表现为发育中期积累型。因此,通过全基因组分析的遗传多样性或种群结构与通过特定性状调控通路的相似性分析结果间并无绝对的联系。4 结论
根据桃果肉着色和花色素苷含量的动态变化,8份红肉桃可分为两类:一类为成熟期积累型,如‘郑引82-9’‘大红袍’‘黑布袋’‘红桃’和‘天津水蜜’;一类为发育中期积累型,如‘哈露红’‘大果黑桃’和‘乌黑鸡肉桃’。PpCHS和PpUFGT是花色素苷成熟期积累型种质的关键结构基因,而PpMYB10.1在供试的所有红肉桃种质花色素苷合成中起到关键调控作用。The authors have declared that no competing interests exist.
