0 引言
【研究意义】碱性磷酸酶(alkaline phosphatase,ALP,EC 3.1.3.1)是动植物和微生物体内广泛存在的一类高度保守的磷酸水解酶。它催化磷酸单酯的水解,生成无机磷酸和相应的产物,还可以催化磷酸基团在不同底物间的转移,因此在生物体内对磷酸基团的转移和代谢发挥着重要的调控作用。昆虫ALP与昆虫发育、神经传导、激素合成、物质代谢、滞育和社会型昆虫亚种形成等方面密切相关,在农林害虫生物防控领域具有重要的研究价值和应用前景。家蚕(Bombyx mori)是重要的经济昆虫,同时也是鳞翅目昆虫研究的模式物种。研究家蚕ALP的结构和性质,有助于更好地理解ALP对昆虫代谢调控的分子机制,并为害虫的生物防控和资源昆虫饲养提供借鉴。【前人研究进展】早在20世纪40年代,NAKAMURA[1]就利用组织化学的方法在家蚕中肠鉴定了ALP。随后,相继在黑腹果蝇(Drosophila melanogaster)、沙漠蝗(Schistocerca gregaria)和黑小按蚊(Anopheles atroparvus)体内鉴定了ALP的同工酶[2]。随着研究的深入,不同组织来源的ALP同工酶分别在鳞翅目、同翅目、双翅目、膜翅目和直翅目等昆虫中被发现。在美洲大蠊(Periplaneta american)的头部发现了两种ALP同工酶,可能参与了神经传导[3]。黑腹果蝇ALP位于头部的神经元中,可能调控了细胞内钙离子跨膜运输和神经细胞的分化和增殖[4]。烟粉虱(Bemisia tabaci)ALP存在于唾液腺中,帮助分泌胶状唾液以形成唾液鞘,还能通过导管分泌到唾液中,参与食物的体外消化[5]。家蚕ALP最早发现于中肠,可能参与了肠道壁膜上葡萄糖和脂肪酸的运输[6]。家蚕中肠中至少存在两种ALP同工酶:一种是与膜结合的ALP(m-ALP),通过GPI锚定在膜上参与营养物质的消化吸收;一种是可溶性ALP(s-ALP),位于杯状细胞内腔,参与离子平衡调控[7-14]。此外,在铜绿蝇(Lucilia cuprina)、金色果蝇(Drosophila auraria)、印度竹节虫(Carausius morosus)和西方蜜蜂(Apis mellifera)的肠道上皮细胞也鉴定到了ALP,可能与糖原和油脂吸收相关[15-19]。科罗拉多马铃薯甲虫(Leptinotarsa decemlineata)中肠m-ALP和s-ALP的活性与取食和滞育有关[20]。烟草天蛾(Manduca sexta)和烟芽夜蛾(Heliothis virescens)肠道中的ALP可能与Bacillus thuringiensis(Bt)毒剂抗性有关[21-22]。除此之外,ALP还广泛存在于昆虫马氏管、表皮和血淋巴、脂肪体、生殖系统、附肢等不同的组织中,甚至在家蚕的丝腺、美洲大蠊的胃液和蚂蚁的毒液中也发现了ALP[23-25]。哺乳动物的ALP一般由两个相似或相同的亚基组成二聚体[26],而家蚕、烟草天蛾、蝗虫和埃及伊蚊(Aedes aegypti)ALP均为单亚基[13,21,27-28]。ALP是一种金属酶,其构象和酶活维持需要镁离子和锌离子的存在。EDTA可以显著地抑制家蚕中肠ALP酶活性,而镁离子和锌离子可以帮助其部分恢复活性[29]。重金属离子Cd2+、Pb2+和脲强烈地抑制白蜡虫(Ericerus pela)ALP的酶活,同样Zn2+和Cu2+也表现为抑制作用,而Ca2+、Mg2+、Mn2+、Co2+和Ni2+则对该酶表现出激活效应[30]。丝氨酸、赖氨酸、色氨酸和部分二硫键可能是白蜡虫ALP维持其催化活性的必需功能基团[31]。家蚕中肠m-ALP和s-ALP的最适pH分别为10.9和9.8,与其肠道消化液的生理环境基本一致[13]。m-ALP在pH 10.0—12.0之间非常稳定且具有较高活性,可以抵抗消化液中蛋白酶的作用而s-ALP则不能[8-9],暗示了m-ALP可能在家蚕中肠内腔发挥作用。烟粉虱唾液ALP的最适pH为10.4,在植物韧皮部汁液(pH约7.0)仍然具有活性[5]。烟粉虱和温室白粉虱(Trialeurodes vaporaiorum)不同发育时期体内ALP最适pH均为7.8[32]。沙漠蝗中肠和附肢ALP最适pH分别为7.4和6.5[27,33],表明同种昆虫不同部位的ALP性质可能并不相同。沙漠蝗、蚊和烟粉虱ALP的最适温度分别为40、37和47℃[32-34],表明不同昆虫ALP在体内的活性存在一定的差异。果蝇ALP酶活对热较敏感[35],烟粉虱唾液ALP在pH 6.5时对热稳定,在最适pH附近其活性很快丧失[5]。不同虫态烟粉虱和白粉虱的ALP最适温度均为47℃,但在27—67℃范围内烟粉虱ALP比白粉虱ALP活性更稳定,二者热稳定性的差异可能反映了其竞争力的不同[32]。对于同一昆虫,不同ALP同工酶的热稳定性也不相同,如地中海实蝇(Ceratitis capitata)ALP1和ALP2,前者要比后者有更好的热稳定性[36]。【本研究切入点】ALP活性可以反映家蚕的生理状况和经济价值[37]。增加ALP活性可以提高晚秋季节蚕茧的质量[38]。家蚕中肠内已经鉴定发现m-ALP和s-ALP两种同工酶[12-13],随后发现m-ALP基因具有多态性,s-ALP可以转录成2.0和2.4 kb两种mRNA[39]。m-ALP和s-ALP基因结构高度保守,二者顺序定位于基因组一小段区域,推测可能起源于一个共同的基因[40]。李长春等[41]从家蚕肠液纯化获得一种等电点为4.7的ALP同工酶,该酶不同于之前鉴定的m-ALP和s-ALP,表明ALP同工酶之间性质存在一定的差异。笔者实验室从家蚕基因组数据库中检索到一个家蚕中肠高量表达的ALP,基因编号为BGIBMGA041304,将其命名为BmALP,其序列与其他已知的ALP序列高度保守,然而目前对该蛋白的结构和性质了解甚少。研究ALP同工酶的结构和性质,有助于更好地揭示ALP对家蚕生命活动调控的分子机理。【拟解决的关键问题】从家蚕中肠克隆BmALP,构建原核表达载体,表达纯化获得BmALP蛋白,研究其结构和酶学性质,从而为深入揭示其生理功能打下基础。1 材料与方法
试验于2014年5月至2016年5月在西南大学家蚕基因组生物学国家重点实验室完成。1.1 材料和试剂
试验所用家蚕品种为大造,PCR模板为5龄3 d家蚕中肠组织cDNA,均由西南大学家蚕基因组生物学国家重点实验室提供。美国西南医学中心张学武教授馈赠表达载体pSKB2、ppSUMO和pET32M.3C[42]。E. coli DH5α和Origami B (DE3)细胞分别购自北京全式金生物技术有限公司和北京天恩泽基因科技有限公司。BamH I、Hind III和T4 DNA连接酶购自New England Biolabs和TaKaRa公司。其他分子生物学试剂盒和试剂等购自生工生物工程(上海)股份有限公司。1.2 生物信息学分析
通过比对分析家蚕基因组数据库SilkDB(http:// www.silkdb.org/)和PubMed(http://www.ncbi.nlm. nih.gov/pubmed/)获取BmALP染色体定位、基因结构和cDNA序列,利用在线工具Protparam (http://web. expasy.org/protparam/)分析BmALP蛋白基本性质包括氨基酸组成、分子量、等电点和疏水性等信息,预测其二级结构和三级结构。分别利用PrediSi (http://www.predisi.de/)和SMART (http://smart. embl-heidelberg.de/)预测信号肽和结构域。通过PubMed进行同源序列比对分析,利用MEGA[43]构建蛋白同源比对分子进化树。1.3 表达载体构建
根据预测,BmALP 5′末端存在一段51 bp编码信号肽的碱基序列。不考虑编码信号肽的DNA碱基,根据其cDNA序列,分别设计了正反向引物:5′-CG GGATCCCGTCGATATGGATTAGATAAGGA-3′和5′-CCAAGCTTTTAAGTAGTTGAATGTGGTGAATG-3′,其中下划线部分分别表示BamH I和Hind III酶切位点。以5龄3 d家蚕中肠组织cDNA为模板,通过PCR扩增获得BmALP基因编码序列,进行1%琼脂糖凝胶电泳分析。将该片段切胶回收后分别与pSKB2、ppSUMO和pET32M.3C载体同时进行BamH I和Hind III双酶切,然后利用T4 DNA连接酶将BmALP连接到上述不同的载体上。将所得连接产物分别转化DH5α感受态细胞,随后分别通过菌落PCR、双酶切和基因测序验证获得构建正确的重组质粒。1.4 蛋白表达分析
蛋白表达纯化借鉴文献[42,44-45]。分别将3种正确构建的重组质粒转化Origami B (DE3)细胞,挑取单克隆在37℃培养过夜,然后在含有抗生素的LB培养基中扩大培养至OD600约0.6—1.0,加入0.1 mmol·L-1 IPTG分别在16℃和37℃下培养20 h和4 h以诱导重组蛋白表达。离心收集细胞,加入预冷的缓冲溶液A(20 mmol·L-1 Tris-HCl pH 8.0,500 mmol·L-1 NaCl,5% Glycerol)充分悬浮细胞,冰浴超声破碎细胞,然后于4℃下12 000 r/min离心20 min,分别收集细胞裂解后的上清和沉淀,最后通过12.5% SDS-PAGE电泳和考马斯亮蓝染色分析不同培养条件下3种重组蛋白的表达情况。1.5 重组蛋白纯化
发现重组的His-Trx-BmALP在16℃下在上清中表达量较高,故选择His-Trx-BmALP重组载体在16℃下进行大量表达纯化。在16℃、200 r/min转速下,加入0.1 mmol·L-1 IPTG继续培养20 h,收集细胞,破碎后于4℃以12 000 r/min离心20 min收集上清,经0.45 μm滤膜过滤后在4℃下与Ni-NTA填料结合,然后利用不同浓度的咪唑进行梯度洗脱,收集洗脱液进行SDS-PAGE电泳和考马斯亮蓝染色分析。收集较纯的蛋白组分,浓缩后利用HiPrep 26/10脱盐柱除去咪唑,同时置换为缓冲液B(50 mmol·L-1 Tris-HCl pH 8.0,150 mmol·L-1 NaCl,5%甘油),加入Prescission蛋白酶在4℃酶切12 h,将酶切产物再次流经Ni-NTA亲和层析柱,利用咪唑梯度洗脱,取少量洗脱液进行SDS-PAGE电泳检测,然后根据SDS-PAGE结果,收集较纯电泳条带相对应的洗脱下来的BmALP蛋白,脱盐后浓缩,于-80℃冻存。1.6 凝胶过滤分析
将BmALP蛋白解冻后于4℃、12 000 r/min离心20 min以去除不溶物,取0.5 mL上清载入Superdex 200 10/300 GL凝胶层析柱进行凝胶过滤分析,流速为0.5 mL·min-1,平衡缓冲液C为20 mmol·L-1 Tris-HCl pH 8.0,150 mmol·L-1 NaCl,5%甘油。收集蛋白组分,进行SDS-PAGE电泳分析。1.7 二级结构分析
借助超滤浓缩离心管将BmALP蛋白置换于磷酸缓冲液PBS中,然后在圆二色光谱仪MOS-500(法国)上对BmALP蛋白在溶液中的二级结构进行分析。试验在25℃下进行,波长范围为190—250 nm,比色皿光程1 cm,蛋白浓度为0.1 mg·mL-1,扫描速度为240 nm·min-1。在5—80℃范围内逐渐升高温度,记录BmALP蛋白的圆二色光谱。以222 nm处的椭圆度值θ222表征BmALP蛋白的α螺旋结构,然后对温度作图,分析温度对BmALP蛋白α螺旋结构的影响。1.8 酶活性分析
BmALP的酶活检测参考WANG等[46]。测活体系包括:10 mmol·L-1对硝基苯磷酸二钠 (p-nitrophenyl phosphate,pNPP),5 mmol·L-1 MgCl2,Na2CO3-NaHCO3缓冲溶液,pH 11.0,4 μL BmALP,反应总体积为200 μL。反应溶液现配现用,避光保存。将反应溶液在30℃孵育10 min后加入1 mL 1 mol·L-1 NaOH终止反应,在紫外分光光度计上记录生成的产物在405 nm处吸光值。以缓冲液为对照,所有试验重复3次,取平均值计算BmALP的活性。1.9 酶学性质分析
将BmALP的酶活反应体系分别设定为pH 3.0、4.0、5.0、6.2、7.2、8.2、9.2、10.0、10.2、10.4、10.6、11.0、12.0、13.0和13.7的缓冲溶液,其他保持不变,然后按照上述方法检测BmALP活性,从而确定BmALP酶活的最适反应pH。将BmALP的酶活反应体系分别在4、10、20、
25、30、35、40、45、50、55、60和65℃下孵育10 min,然后按照上述方法检测BmALP活性以确定其酶活最适反应温度。
以pNPP为底物,在最适反应pH和最适反应温度下测定BmALP催化的反应速度,利用双倒数作图法计算BmALP的米氏常数Km,pNPP的浓度范围为0.2—5.0 mmol·L-1。
将BmALP分别在4、10、20、25、30、35、40、45、50、55、60、65和70℃下孵育2 h,然后按照上述方法检测BmALP活性以分析其热稳定性。
向反应体系中分别加入不同终浓度的MgCl2、ZnCl2和CuCl2,然后按照上述方法检测BmALP 活性
以分析不同的金属离子对BmALP活性的影响。
2 结果
2.1 BmALP(s-ALP型)克隆与分析
根据SilkDB和PubMed数据库,以5龄3 d家蚕中肠组织cDNA为模板进行PCR扩增,获得长度约为1 536 bp的序列。将获得的片段分别与pSKB2、ppSUMO和pET32M.3C载体连接,转化DH5α,然后依次进行菌落PCR、双酶切和基因测序验证,最终成功构建了3个重组质粒载体。图1-A分别显示了BmALP克隆、pET32M.3C载体构建成功后的菌落PCR和双酶切验证过程的电泳检测图。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1BmALP克隆和分析
-->Fig.1Cloning and analysis of BmALP
-->
BmALP在PubMed中的登录号为692396,该基因定位于家蚕第3号染色体,为多外显子基因,基因全长7 652 bp,其中包括5个外显子和4个内含子(图1-B)。mRNA由1 587 bp组成,编码528个氨基酸残基,蛋白分子量为57.48 kD,等电点为5.55。
2.2 BmALP蛋白分析
信号肽预测发现BmALP蛋白N末端第1—17位氨基酸为信号肽,因此在引物设计时未予考虑。成熟的BmALP蛋白包含511个氨基酸残基,分子量为55.78 kD,等电点为5.51。BmALP蛋白由20种氨基酸组成,包含8个半胱氨酸和28个组氨酸残基,含量分别为1.5%和5.3%。N末端信号肽部分由带正电荷的氨基酸残基组成,N末端其余部分和C末端由带负电荷的氨基酸残基组成,中间部分由带正电荷和负电荷的残基交互组成(图2-A)。SMART分析发现BmALP蛋白主要由1个碱性磷酸酶结构域(75—514位氨基酸残基)组成,其中N末端1—17位氨基酸残基为信号肽,与预测一致(图2-B)。PubMed分析表明BmALP属于类碱性磷酸酶超家族一员,其中第83、132—133、196、198、209、355、360—361、364、401—402、477位氨基酸残基是决定酶活性的关键位点,第87—88、91、94—95、113、116、118—120、122、124、126、130、143—145、155、172、405、407—410、432—433、438—439、476、478—481、483、496—499、501—502、505位氨基酸残基作为同源二聚体的相互作用位点参与了BmALP同源二聚体的形成(图2-C)。二级结构和三级结构分析显示BmALP蛋白由2个显著部分组成,其中N末端由两段α螺旋结构和长长的柔性无规则结构组成,其余部分组成一个致密的完整结构域,主要由多段α螺旋包裹一些短的β片层结构组成(图2-D、2-E)。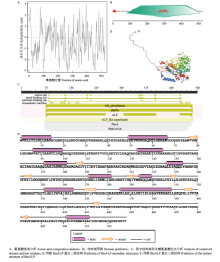 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2BmALP蛋白分析
-->Fig. 2Analysis of BmALP
-->
2.3 BmALP蛋白同源比对
以BmALP氨基酸序列为模板进行BLAST分析,然后构建蛋白同源比对分子进化树,结果如图3所示。氨基酸同源比对分析显示,家蚕BmALP与同为鳞翅目的柑橘凤蝶(Papilio xuthus)、草地夜蛾(Spodoptera frugiperda)的碱性磷酸酶序列相似度最高,暗示了这些物种的碱性磷酸酶可能具有共同的进化起源。序列相似性差异最大的是斑马鱼(Danio rerio)、小鼠(Mus musculus)和智人(Homo sapiens)的碱性磷酸酶,显示了碱性磷酸酶进化过程中在不同物种间的差异。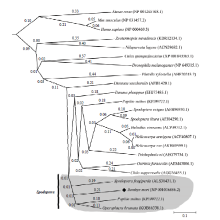 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3BmALP与其他物种同源蛋白的比对分析
-->Fig. 3Phylogenetic analysis of BmALP and ALPs from other species
-->
2.4 BmALP蛋白表达纯化
将BmALP分别与pSKB2、ppSUMO和pET32M.3C载体连接(图4-A),然后转化Origami B (DE3)细胞,在16℃和37℃下,加入0.1 mmol·L-1 IPTG分别诱导重组蛋白的表达。SDS-PAGE电泳分析显示,利用pSKB2-BmALP载体,在16℃下,无论是细胞裂解后的上清液还是沉淀中都没有观察到目的蛋白His-BmALP的条带(图4-B,泳道3和4);利用pET32M.3C-BmALP载体,在16℃的上清和沉淀中都观察到了目的蛋白His-Trx-BmALP条带的出现(图4-B,泳道5和6);ppSUMO载体同样可以促进BmALP的表达,在16℃和37℃诱导下,在细胞裂解后的上清液和包涵体中都能观察到目的蛋白His-SUMO-BmALP条带(图4-B,泳道7—10)。与37℃相比,在16℃下,可溶性的His-SUMO-BmALP表达量更高,包涵体表达量不如37℃明显,表明在37℃下,His-SUMO-BmALP更容易表达形成包涵体出现在沉淀中。比较发现pET32M.3C-BmALP载体更好地促进了His-Trx-BmALP以可溶性蛋白的形式出现在细胞裂解后的上清液中,因此选择在16℃下,利用pET32M.3C-BmALP重组载体来大规模表达纯化BmALP。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4BmALP蛋白表达分析
-->Fig. 4Analysis of the expression of BmALP
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5BmALP蛋白表达纯化
-->Fig. 5Expression and purification of BmALP
-->
在16℃下,加入0.1 mmol·L-1 IPTG大规模诱导重组His-Trx-BmALP蛋白的表达,然后在4℃利用Ni-NTA亲和层析柱纯化目的蛋白。SDS-PAGE电泳分析显示,250 mmol·L-1咪唑洗脱的目的蛋白纯度超过了90%(图5-A)。收集250 mmol·L-1咪唑缓冲液洗脱组分,脱盐除去咪唑后,加入Prescission蛋白酶在4℃酶切过夜,再次利用Ni-NTA亲和层析纯化去除标签后的BmALP蛋白。结果显示,大约90%的His-Trx-BmALP蛋白可以被Prescission蛋白酶切开(图5-B泳道2)。利用缓冲溶液、10和20 mmol·L-1咪唑洗脱可以获得纯度超过95%的BmALP蛋白(图5-B泳道4—6)。收集泳道4—6对应的蛋白组分,脱盐后浓缩,冻存于-80℃。
2.5 BmALP蛋白溶液构象分析
利用凝胶过滤层析法分析BmALP蛋白在溶液中的分子量,进而推测其相应的蛋白状态。结果显示,BmALP在Superdex 200 10/300 GL凝胶层析柱上显示为一个单一锐利的对称峰形(图6-A),表明BmALP折叠形成了良好的空间构象。SDS-PAGE分析显示,该峰代表的为BmALP蛋白(图6-B)。根据Superdex 200 10/300 GL凝胶层析柱手册和图6-A的出峰位置,可以初步推算出BmALP在溶液中的分子量约为110 kD,表明纯化获得的BmALP蛋白在溶液中以二聚体的形式存在。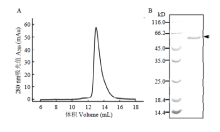 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6BmALP蛋白分子量和聚集态分析
-->Fig. 6Analysis of BmALP molecular weight and oligo state
-->
2.6 BmALP蛋白结构分析
利用圆二色光谱法分析BmALP蛋白在溶液中的二级结构及温度对其二级结构的影响。BmALP蛋白的圆二色光谱图显示,在约208和222 nm处具有两个明显的负峰(图7-A),这是α螺旋结构的特征峰形,表明纯化获得的BmALP蛋白含有一定的α螺旋结构,与之前预测的BmALP蛋白的结构基本一致。以222 nm处的椭圆度值θ222作为BmALP蛋白α螺旋结构的特征,对不同的温度作图从而反映温度对BmALP蛋白二级结构的影响,结果如图7-B所示。从图中可以看出,随着温度从5℃逐渐升高至80℃,θ222绝对值不断降低,表明在温度的影响下,BmALP蛋白的α螺旋结构逐渐减少。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7BmALP蛋白结构分析
-->Fig. 7Analysis of BmALP structure
-->
2.7 BmALP酶活性分析
在pH 3.0—6.0之间,BmALP几乎没有活性。随着pH从6.0升至11.0,BmALP的催化活性逐渐升高,在pH 11.0时达到最大;当进一步升高pH至12.0时,BmALP的催化活性降至最高时的约50%;当升高pH至14.0时,BmALP几乎完全丧失了催化活性。结果表明,BmALP酶学活性的最适pH为11.0(图8-A)。随着温度从4℃升至45℃,BmALP的催化活性逐渐升高,在45℃时达到最大;当温度高于45℃后,随着温度的升高,BmALP的催化活性逐渐下降,65℃时的活性降低至最高时活性的30%左右。因此,BmALP酶学活性的最适温度为45℃(图8-B)。
在最适pH和最适温度下,以pNPP为底物,测出BmALP的Km值为1.40 mmol·L-1。将BmALP在不同的温度下分别孵育2 h,然后检测其残余的催化活性。结果显示,10℃时BmALP的残余活性最高,其次是20℃和25℃。4℃时BmALP的活性约为10℃时活性的60%。30℃时BmALP的残余活性迅速降至约为10℃时活性的28%。在35℃及更高的温度下,BmALP完全丧失了其催化活性(图8-C)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8BmALP酶活分析
-->Fig. 8Analysis of BmALP activity
-->
2.8 金属离子对BmALP酶活的影响
向反应溶液中加入不同浓度的MgCl2、ZnCl2和CuCl2,检测BmALP的酶学活性,结果如图9所示。从图中可以看出,在同一种阴离子Cl-存在的情况下,Mg2+、Zn2+和Cu2+对BmALP的酶学活性表现出了截然不同的效应,Mg2+和Zn2+都促进了BmALP催化反应的进行,而Cu2+对BmALP的酶学活性则表现出了促进和抑制两种不同的效应。在0—40 mmol·L-1,随着Mg2+浓度的增加,BmALP的催化活性逐渐增加,40 mmol·L-1时达到最大,其激活效应最大可以达到最初活性的8倍;进一步增加Mg2+浓度,BmALP的催化活性相比最高时有所下降,在60 mmol·L-1时仍然约为最初活性的5.5倍(图9-A)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9金属离子对BmALP酶活的影响
-->Fig. 9Effects of metal ions on BmALP activity
-->
Zn2+对BmALP酶活的激活效应与Mg2+相似。在0—5 mmol·L-1,随着Zn2+浓度的增加,BmALP的催化活性逐渐增加,5 mmol·L-1时达到最大,其激活效应最大可以达到最初活性的9倍;进一步增加Zn2+浓度,BmALP的催化活性相比最高时逐渐下降,在40 mmol·L-1时仍然约为最初活性的2.5倍(图9-B)。Cu2+对BmALP的效应与Mg2+和Zn2+不同。在0—10 mmol·L-1以内,随着Cu2+浓度的增加,BmALP的催化活性逐渐增加,10 mmol·L-1时达到最大,其激活效应最大可以达到最初活性的1.7倍;进一步增加Cu2+浓度,BmALP的催化活性相比最高时逐渐下降,20 mmol·L-1时与最初的活性相当;当Cu2+浓度超过20 mmol·L-1后,BmALP的活性继续下降,Cu2+对BmALP的活性表现出抑制效应;当Cu2+浓度达到40 mmol·L-1时,BmALP的活性约为其最初活性的50%(图9-C)。
3 讨论
ALP是生物体内调控磷酸代谢的关键酶。不同物种ALP的性质因进化差异而有所不同,同一物种ALP的同工酶性质可能也不相同。本文从家蚕大造品种中肠克隆获得了一种BmALP,并将其构建到原核细胞表达载体,借助大肠杆菌表达系统,获得了在细胞裂解后的上清液中表达的可溶性BmALP蛋白,利用Ni-NTA亲和层析法纯化获得了BmALP,并通过凝胶过滤、圆二色光谱和酶学活性分析详细研究了其溶液构象、二级结构和酶学性质,为深入揭示其生理功能和分子调控机理打下了基础。分子进化分析表明碱性磷酸酶在低等和高等生物中氨基酸序列相当保守,暗示了碱性磷酸酶在大多数生物的生命活动过程中都具有极其重要的生理功能。OKADA等从其他品系家蚕的中肠纯化了ALP蛋白[13,41],本文从家蚕大造品种的中肠克隆获得了BmALP,暗示了ALP可能在不同品系的家蚕中肠中广泛存在。尽管所有的家蚕ALP同工酶都包含有保守的碱性磷酸酶结构域,不同ALP的氨基酸序列和性质还是存在一定的差异,反映了家蚕由于地域(日本品种和中国品种)和品系(大造和PMY000)分化在进化过程中所产生的差异。本文选择的大造与李长春等[41]选择的PMY000同为中国品种,二者的ALP同工酶大部分性质比较相似,比如分子量都约为55 kD,形成了同源二聚体,但也存在一些细小的不同,比如大造ALP最适pH为11.0,PMY000的ALP最适pH为10.5;大造ALP最适温度为45℃,PMY000的ALP最适温度为40℃。当然,这种最适pH和最适温度的差异可能是由于二者测活方法不同所导致,如大造ALP的酶活分析以pNPP为底物,而PMY000的ALP测活则以磷酸苯二钠为底物。PMY000的ALP在25℃下放置5 h不损失活性,50℃下放置5 h约损失了30%活性[41],而大造ALP在25℃下放置2 h已经损失了约30%活性,35℃下放置2 h则完全丧失了活性,表明大造ALP不如PMY000的ALP结构稳定。大造和PMY000 ALP的Km分别为1.40和1.25 mmol·L-1,表明PMY000 ALP对底物有更高的亲和力。PMY000是从家蚕基因资源库100多个品种中筛选出的ALP活性最高的品种,而大造是一般的试验品种,二者结构稳定性和Km值的差异反映了其ALP活性的不同,而ALP的活性一定程度上可以反映出家蚕的生理状况。与试验品种大造相比,实用品种PMY000容易饲养,生长速度快。
酶活分析表明,升高温度可以加速BmALP催化反应的进行,提高酶的催化活性,但也可能因温度升高引起BmALP构象变化而导致其活性下降。从4℃升至45℃的过程中,高温加速效应大于其失活效应,因此表现出酶活的升高;从45℃升至65℃的过程中,高温引起的失活效应大于其促进效应,从而导致了BmALP催化活性的下降。沙漠蝗、蚊类和烟粉虱ALP的最适温度分别为40、37和47℃[32-34],与家蚕ALP的最适温度差别不大,显示出不同物种昆虫ALP活性位点的关键氨基酸残基及其空间构象相对保守。有趣的是,家蚕的最适饲养温度为25—28℃,一般不会超过30℃。家蚕大造和PMY000的ALP最适温度分别为45和40℃,这种差异可能是因为体外酶活分析的试验条件与体内酶发挥催化功能的真实生理环境不一致所导致,如体外试验一般以小分子化合物如pNPP为底物,而体内ALP的底物则是磷酸化的蛋白质。家蚕ALP的最适pH在9.8—11.0,这与家蚕中肠的生理环境基本一致。烟粉虱和白粉虱ALP最适pH均为7.8[32],沙漠蝗中肠ALP最适pH为7.4[33],其附肢ALP最适pH为6.5[27],显示出不同昆虫ALP及其同工酶性质的差异,这可能与ALP在不同物种和组织中执行不同的生理功能有关。
BmALP蛋白包含8个半胱氨酸残基,在大肠杆菌中表达可能会影响其折叠形成正确的空间构象[47]。氨基酸疏水性分析显示,BmALP蛋白包含有相当高比例的疏水性氨基酸残基(图2-A),这些疏水性氨基酸同样可能会影响到BmALP在大肠杆菌中的表达、折叠和构象的稳定。之前尝试利用BL21 (DE3)和Rosetta (DE3)细胞表达BmALP,发现重组蛋白主要以包涵体的表达形式出现在沉淀中,后来将其与pET32M.3C载体相连,并利用Origami (DE3)细胞获得了可溶性表达的重组蛋白。凝胶过滤分析显示,BmALP在溶液中形成了二聚体。这个锐利、近乎对称的峰形反映出纯化的BmALP蛋白折叠形成了良好的空间构象,在溶液中仅存在一种构象状态。圆二色光谱结果表明BmALP在溶液中具有α螺旋结构,与之前生物信息学的分析一致。酶活分析显示纯化的BmALP具有良好的催化活性,表明Trx标签和Origami (DE3)细胞共同作用,促进了重组表达的BmALP折叠形成正确的空间构象。结构分析表明,BmALP主要由α螺旋结构包裹β片层的碱性磷酸酶结构域组成,随着温度逐渐升高,其α螺旋结构持续被诱导发生去折叠,没有明显的过渡态中间体形式存在,而酪氨酸磷酸酶在脲和盐酸胍诱导的去折叠过程中,则可以形成明显不同的中间体结构[46],显示了不同的磷酸酶在分子构象和蛋白质折叠途径中存在一定的差异。酶活分析显示,在4—10℃范围内,BmALP的构象比较稳定,高温有利于BmALP催化反应的进行,因此10℃时BmALP的残余活性最大;当温度超过10℃时,升温引起了BmALP活性位点的构象变化,从而导致其残余活性下降。35℃及以上,BmALP的活性位点构象几乎完全被破坏,因此导致其活性基本完全丧失。
ALP是一种金属酶。本研究中Mg2+和Zn2+对BmALP的酶活都表现出促进效应,其最适浓度分别为40和5 mmol·L-1,超过此浓度则其促进效应有所下降。Mg2+和Zn2+同样可以帮助被EDTA抑制的家蚕ALP同工酶部分恢复活性[29],表明Mg2+和Zn2+对家蚕ALP构象和酶学活性至关重要。低浓度的Cu2+对BmALP的酶活有一定的激活效应,但高浓度的Cu2+则显著地抑制了BmALP的活性。而Zn2+和Cu2+则对鲍鱼和白蜡虫ALP酶活都表现出抑制效应[30,48],显示出不同的金属离子在不同物种ALP维系其空间构象和催化反应过程中发挥着不同的作用。
4 结论
从家蚕中肠克隆了BmALP,构建了原核表达载体,表达纯化了可溶性家蚕BmALP蛋白,发现其包含有α-螺旋结构,在溶液中形成了稳定的二聚体结构。BmALP酶活最适pH为11.0,最适温度为45℃,Km为1.40 mmol·L-1,在低温下其构象稳定,温度高于35℃,BmALP的活性迅速丧失。Mg2+和Zn2+对BmALP的酶活具有促进作用,低浓度的Cu2+可以激活BmALP,高浓度的Cu2+则抑制其活性。The authors have declared that no competing interests exist.
