0 引言
【研究意义】牦牛(Bos Grunniens)分布在青藏高原及其周边高寒牧区,为牧民提供肉、乳和毛绒等畜产品,是当地重要的生产和生活资源。牦牛乳营养丰富,风味独特,其中乳脂率、乳蛋白率和总固体物质含量分别为5.45%—7.22%、4.86%—5.40%和16.91%—17.40%,均高于荷斯坦牛乳[1];牦牛乳是加工乳制品的重要原料,也是发展高原特色乳产业的主要来源。乳脂是乳的重要组成部分,高乳脂率是牦牛乳的主要特征,本研究检测牦牛乳脂性状候选基因,评估基因突变与乳品质性状间的关联程度,以期丰富牦牛乳品质性状分子遗传研究基础。【前人研究进展】乳脂肪中甘油三酯占95%以上,其合成受甘油-3-磷酸酰基转移酶(GPAT)、1-酰基甘油-3-磷酸酰基转移酶6(AGPAT6)、磷脂酸磷酸酯酶1(LPIN1)、二酰基甘油酰基转移酶(DGAT)等作用[2],其中DGAT是甘油三酯合成最后一步反应的关键酶[3]。DGAT基因包括DGAT1和DGAT2两种属于不同基因家族的基因类型。DGAT1基因属于酰基辅酶A胆固醇酰基转移酶(acylCoA: cholesterol acyltransferase, ACAT)基因家族,参与脂肪合成、储存及脂蛋白组装等过程,是影响产奶性状的重要功能候选基因[4] 。牛DGAT1基因位于14号染色体,由17个外显子和16个内含子组成,编码489个氨基酸[5]。牛DGAT1基因第8外显子AA→CG的双碱基突变导致其编码多肽链中232位的赖氨酸残基突变为中性疏水性丙氨酸残基[6-7],命名为K232A。研究表明,K基因能增加荷斯坦奶牛乳脂率、乳蛋白率及乳脂量,而A基因对提高产乳量和乳蛋白量有作用[8-9];DGAT1基因启动子区的可变数目串联重复序列(VNTR)多态性对产乳性状也有一定影响[10-11]。另外,DGAT1基因突变也影响肉牛肌内脂肪含量 [12-13],以及猪的脂肪沉积和背膘厚[14]。【本研究切入点】近年来,关于牦牛乳蛋白的遗传报道较多[15-16],但对其乳脂肪及其他乳品质性状的分子遗传机制研究较少。【拟解决的关键问题】本研究以DGAT1基因作为牦牛乳品质性状的候选基因,应用PCR-SSCP技术检测牦牛该基因相应区域的遗传突变,结合甘南牦牛乳品质性状测定数据,分析DGAT1基因突变与牦牛乳品质性状间的关联程度。1 材料与方法
1.1 试验材料
样品于2015年7月进行采集。血样分为甘南牦牛314头,天祝白牦牛、青海牦牛各95头,野血牦牛(野牦牛与家牦牛杂交后代)37头。颈静脉采血10 mL,ACD抗凝、-70℃冻存;部分血样滴于FTA卡(Whatman, Middlesex, UK)常温保存。对采集血样的甘南母牦牛,记录其年龄及产犊胎次,并早晚各采集乳样1次约25 mL、连续采集3 d,混合、冰袋冷却后放入冰盒,带回实验室测定乳品质性状。因甘南牦牛均在每年5—6月份产犊,因此,试验母牦牛泌乳月基本相同。
1.2 试验方法
1.2.1 乳品质性状测定 甘南牦牛乳品质性状测定包括乳蛋白率、乳脂率、乳糖率、总固体物质含量、无脂固体物质含量5项,送农业部动物毛皮及制品质量监督检验测试中心(兰州)采用福斯(FOSS)乳成分分析仪测定,其测定值见表1。Table 1
表1
表1甘南牦牛乳品质性状测定
Table 1Determination of milk quality traits of Gannan yak
| 测定数值 Determination data | 乳品质性状 Milk quality traits | ||||
|---|---|---|---|---|---|
| 乳蛋白率 Protein rate (%) | 乳脂率 Fat rate (%) | 乳糖率 Lactose rate (%) | 总固体物质含量 Total solids (%) | 无脂固体物质含量 Non-fat solids (%) | |
| 平均值 Average | 4.94±0.75 | 4.87±1.77 | 4.97±0.62 | 16.04±2.22 | 11.18±1.27 |
新窗口打开
1.2.2 基因组DNA提取 冻存血样采用“苯酚-氯仿法”和FTA卡“两步法”提取基因组DNA。
1.2.3 引物设计及PCR扩增 根据GenBank公布的普通牛DGAT1基因序列(GenBank no. AY065621.1),应用DNAMAN软件设计特异性引物P1和P2(表2),分别扩增牦牛DGAT1基因intron5-exon7和intron15-exon17区。引物由北京六合华大生物科技有限公司合成。
Table 2
表2
表2牦牛DGAT1基因的扩增引物信息
Table 2Primer information of yak DGAT1 gene
| 引物名称 Primers | 引物序列(5'-3') Sequences of primer | 扩增片段长度 Length of amplicons (bp) | 退火温度Tm (℃) |
|---|---|---|---|
| P1 | F:CTGCACCTCAGGCCTGGT | 446 | 63 |
| R:GAGGCAAGTGGCAGCCC | |||
| P2 | F:CTCCGCCTTCTTCCACGAG | 358 | 62 |
| R:CCGATGATGAGTGACAGC |
新窗口打开
PCR反应总体积20 μL,其中基因组DNA(100 ng·μL-1)1.0 µL(或FTA卡1.2 mm血样圆片1个),10 ×PCR Buffer 2.0 μL,上、下游引物各0.25 μmol·L-1,Taq DNA聚合酶(5U·μL-1)0.25 μL,Mg2+ 2.0 mmol·L-1,dNTP(10 mmol·L-1·M-1)0.4 μL,ddH2O加至20 μL。PCR扩增程序为94 ℃预变性 5 min,94 ℃变性30 s,63 ℃退火30 s(P1引物)或62 ℃退火30 s(P2引物),72 ℃延伸30 s,35个循环;72 ℃延伸10 min,4 ℃保存。PCR扩增产物用1%琼脂糖凝胶电泳检测。
1.2.4 SSCP分析 取PCR扩增产物 2 μL灭菌离心管中,加入8 μL变性上样缓冲液(98%去离子甲酰胺、0.025%二甲苯氰、0.025%溴酚蓝、10 mmol·L-1 EDTA),98 ℃变性10 min,冰水混合物中迅速冷却5 min,上样于非变性聚丙烯酰胺凝胶(Acr:Bis=37.5:1),0.5×TBE缓冲液电泳。电泳结束后银染显色并判定SSCP带型。P1和P2引物最佳SSCP电泳条件见表3。
Table 3
表3
表3SSCP电泳条件
Table 3SSCP electrophoresis conditions
| 扩增产物 Amplicons | 凝胶浓度 PAGE concentration (%) | 室温 Room temperature (℃) | 水循环温度 Circulating temperature of water (℃) | 电压 Voltage (V) | 电泳时间 Time (h) |
|---|---|---|---|---|---|
| P1 | 12 | 28 | 23 | 320 | 20 |
| P2 | 12 | 28 | 22 | 290 | 20 |
新窗口打开
1.2.5 等位基因序列测定 若等位基因存在纯合型个体,用PCR 扩增产物直接测序;若仅存在于杂合个体采用切胶测序。序列测定在上海生工生物工程有限公司完成。
1.2.6 数据统计分析 应用MEGA4软件比对等位基因序列;Popgen32.0软件计算等位基因频率、纯合度(Ho)、杂合度(He)、有效等位基因数(Ne)并进行χ2检验;PIC软件计算多态信息含量(PIC);SHEsis软件分析两位点SNPs连锁不平衡及单倍型频率[18];SPSS 19.0软件的一般线性模型分析基因型、等位基因及单倍型组合对甘南牦牛乳品质性状的影响。因母牦牛不同群体和胎次对乳品质性状有较大影响[19],因此统计模型考虑群体和胎次因素:
Yijk =μ+Genotypei +Parityj +Groupk+eijk
Yijk =μ+Allelei +Parityj +Groupk+eijk
Yijk =μ+Haplotypei +Parityj +Groupk+eijk
其中Yijk 为性状表型值,μ 为群体均值;Genotypei 为基因型效应;Allelei 为等位基因效应;Haplotypei 为单倍型效应;Parityj 为胎次效应;Groupk 为群体效应;eijk 为随机误差。
2 结果
2.1 PCR扩增及产物SSCP检测
P1和P2引物扩增牦牛DGAT1基因intron5—exon7和intron15—exon17区域,扩增产物经琼脂糖凝胶电泳检测,扩增产物长度与目的片段一致,且无非特异性条带。两对引物的PCR产物SSCP检测结果分别见图1和图2。intron5—exon7区在牦牛群体中检测到2种SSCP带型,对应M和N两种等位基因,形成MM和NN两种基因型。intron15—exon17区在牦牛群体中检测到3种SSCP带型,对应A、B、C等3种等位基因,形成AA、AB、BC、BB、AC和CC共6种基因型。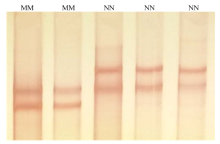 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1牦牛DGAT1基因intron5-exon7区SSCP检测
-->Fig. 1SSCP for intron5-exon7 of yak DGAT1 gene
-->
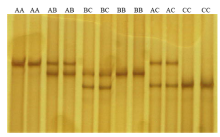 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2牦牛DGAT1基因intron15-exon17区SSCP检测
-->Fig. 2SSCP for intron15-exon17 of yak DGAT1 gene
-->
2.2 牦牛DGAT1基因等位基因序列比对
牦牛DGAT1基因intron5—exon7区等位基因序列测定及比对结果分别见图3和图4,其中等位基因N存在c.562+32_c.562+33insCCGCCC的插入/缺失突变。intron15—exon17区等位基因序列测定及比对结果分别见图5和图6,该区域共检测到c.1249-23C>T和c.1336C>T的突变。其中exon17的c.1336C>T为非同义突变,导致第447位氨基酸由碱性的精氨酸(Arg)变为中性的半胱氨酸(Cys)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3牦牛DGAT1基因intron5-exon7区序列测定
方框内为c.562+32_c.562+33insCCGCCC插入/缺失序列c.562+32_c.562+33insCCGCCC are represented with box
-->Fig.3Sequences of allele M and N in intron5-exon7 of yak DGAT1 gene
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4牦牛DGAT1基因intron5-exon7区等位基因序列对比
下划线部分为引物结合区,方框表示第6、7外显子区
-->Fig. 4Alignment for allelic sequences in intron5-exon7 of yak DGAT1 gene
Primer binding regions are represented with underline and the exon 6 and exon 7 of yak DGAT1 are shown in square frame
-->
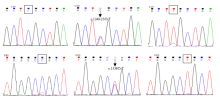 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5牦牛DGAT1基因intron15-exon17区等位基因序列测定
箭头表明c.1249-23C>T和c.1336C>T突变位点
-->Fig. 5Sequences of alleles in intron15-exon17 of yak DGAT1 gene
c.1249-23C>T and c.1336C>T are showed with arrows
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6牦牛DGAT1基因intron15-exon17区等位基因序列对比
下划线部分为引物结合区,方框表示第16、17外显子区
-->Fig. 6Alignment of allelic sequences in intron15-exon17 of yak DGAT1 gene
Primer binding regions are represented with underline and the exon 16 and exon 17 of yak DGAT1 are shown in square frame
-->
2.3 牦牛DGAT1基因遗传多态性及单倍型分析
2.3.1 牦牛DGAT1基因群体遗传学分析 牦牛DGAT1基因intron5—exon7区基因型频率、等位基因频率及群体遗传多态性见表4。四牦牛群体中,等位基因M、基因型MM频率67.37%—83.78%为优势等位基因和基因型;甘南牦牛和野血牦牛多态信息含量PIC<0.25属低度多态,天祝白牦牛和青海牦牛0.25<PIC<0.5属中度多态;各类群牦牛卡方检验均达到显著水平(P<0.05),即偏离Hardy-Weinberg平衡状态。Table 4
表4
表4牦牛DGAT1基因intron5-exon7区遗传多态性分析
Table 4Genetic diversity in intron5-exon7 of yak DGAT1 gene
| 群体 Populations | 个体数 No. (n) | 基因型频率(%) Genotypic frequency (%) | 基因频率(%) Allelic frequency (%) | 遗传多态性 Genetic polymorphism | χ2值 χ2 value | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| MM | NN | M | N | Ne | Ho | He | PIC | |||
| 甘南牦牛 Gannan yak | 314 | 83.44 | 16.56 | 83.44 | 16.56 | 1.3819 | 1.0000 | 0.0000 | 0.2382 | 0.00 |
| 天祝白牦牛 Tianzhu white yak | 95 | 82.11 | 17.89 | 82.11 | 17.89 | 1.4161 | 1.0000 | 0.0000 | 0.2506 | 0.00 |
| 青海牦牛 Qinghai yak | 95 | 67.37 | 32.63 | 67.37 | 32.63 | 17847 | 1.0000 | 0.0000 | 0.3430 | 0.00 |
| 野血牦牛 Wild-blood yak | 37 | 83.78 | 16.22 | 83.78 | 16.22 | 1.3731 | 1.0000 | 0.0000 | 0.2348 | 0.00 |
新窗口打开
牦牛DGAT1基因intron15-exon17区基因型频率、等位基因频率及群体遗传多态性见表5。四类群牦牛等位基因A频率56.76%—69.11%为优势等位基因;甘南牦牛、天祝白牦牛和青海牦牛基因型AA频率38.95%—47.13%为优势基因型,野血牦牛基因型AB频率59.46%为优势基因型。各类群牦牛PIC为0.3970—0.4988属中度多态。野血牦牛卡方检验达显著水平(P<0.05),偏离Hardy-Weinberg平衡状态。
Table 5
表5
表5牦牛DGAT1基因intron15-exon17区遗传多态性分析
Table 5Genetic diversity in intron15-exon17 of yak DGAT1 gene
| 群体 Populations | 个体数 No. (n) | 基因型频率(%) Genotypic frequency (%) | 等位基因频率(%) Allelic frequency (%) | 遗传多态性 Genetic polymorphism | χ2值 χ2 value | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AA | AB | BB | AC | BC | CC | A | B | C | Ne | Ho | He | PIC | |||
| 甘南牦牛 Gannan yak | 314 | 47.13 | 23.89 | 3.82 | 20.06 | 4.14 | 0.96 | 69.11 | 17.83 | 13.06 | 1.8995 | 0.5191 | 0.4809 | 0.4258 | 0.49 |
| 天祝白牦牛 Tianzhu white yak | 95 | 38.95 | 22.11 | 6.32 | 20.00 | 7.37 | 5.25 | 60.00 | 21.05 | 18.95 | 2.2716 | 0.5053 | 0.4947 | 0.4988 | 0.44 |
| 青海牦牛 Qinghai yak | 95 | 44.21 | 36.84 | 6.32 | 12.63 | / | / | 68.95 | 24.73 | 6.32 | 1.8500 | 0.5053 | 0.4947 | 0.3970 | 0.15 |
| 野血牦牛 Wild-blood yak | 37 | 18.92 | 59.46 | 5.41 | 16.21 | / | / | 56.76 | 35.13 | 8.11 | 2.2116 | 0.2432 | 0.7568 | 0.4625 | 0.01 |
新窗口打开
2.3.2 牦牛DGAT1基因单倍型分析 牦牛DGAT1基因intron5—exon7与intron15—exon17区突变位点间连锁不平衡分析及单倍型类型见表6和表7。D’值和r2值是衡量连锁不平衡的两个常用参数,其中连锁不平衡区域内重组事件的发生概率通过D’值反映,而连锁分析的效力与r2相关。SLATKIN等[20]认为D’>0.8表示两个位点处于强连锁不平衡状态,ARDLIE等[21]认为 r2>0.33则这两个SNPs是紧密连锁且作为一个整体遗传。4类群牦牛DGAT1基因3个突变位点间0<D’<0.8 且r2均接近0(r2≈0),存在连锁关系且接近于连锁平衡,表明他们趋向于相互独立遗传。两扩增区域构建6种潜在的单倍型分别为H1、H2、H3、H4、H5和H6,其中H1型频率最高为0.534为主要单倍型,H5型频率最低为0.020;6种单倍型形成11种单倍型组合(牦牛个体数)分别为H1H1(186)、H1H2(122)、H1H3(80)、H2H2(19)、H2H3(19)、H3H3(8)、H4H4(47)、H4H5(34)、H4H6(20)、H5H5(4)和H5H6(2)。
Table 6
表6
表6牦牛DGAT1基因突变位点间连锁不平衡系数D’及r2
Table 6The linkage disequilibrium coefficients D’ and r2 of yak DGAT1 gene
| 突变位点 Mutation site | c.1249-23C>T | c.1336C>T |
|---|---|---|
| c.562+32_c.562+33insCCGCCC | D’= 0.226 r2 = 0.002 | D’= 0.040 r2 = 0.000 |
新窗口打开
Table 7
表7
表7牦牛DGAT1基因intron5-exon7与intron15-exon17区单倍型及频率
Table 7Haplotypes and their frequencies between intron5- exon7 and intron15-exon17 of yak DGAT1 gene
| 单倍型名称 Haplotype name | 突变位点 Mutation site | 单倍型频率 Haplotype frequency | ||
|---|---|---|---|---|
| c.562+32_c.562+33insCCGCCC | c.1249- 23C>T | c.1336C>T | ||
| H1 | M | C | C | 0.534 |
| H2 | T | C | 0.106 | |
| H3 | C | T | 0.164 | |
| H4 | N | C | C | 0.136 |
| H5 | T | C | 0.020 | |
| H6 | C | T | 0.040 | |
新窗口打开
2.4 甘南牦牛DGAT1基因多态性与乳质性状相关性分析
2.4.1 甘南牦牛DGAT1基因intron5-exon7及intron15-exon17区突变与乳质性状相关性分析 DGAT1基因intron5—exon7区基因型与甘南牦牛乳质性状相关性分析见表8。该区域MM和NN基因型与乳质性状无显著相关性(P>0.05),即该区域突变对甘南牦牛乳质性状无显著影响。Table 8
表8
表8甘南牦牛DGAT1基因intron5-exon7区基因型与乳质性状关联性分析
Table 8Association of genotypes in intron5-exon7 of DGAT1 gene with milk quality traits in Gannan yak
| 基因型 Genotypes | 个体数 No.(n) | 性状 Traits | ||||
|---|---|---|---|---|---|---|
| 乳蛋白率 Protein rate (%) | 乳脂率 Fat rate (%) | 乳糖率 Lactose rate (%) | 总固体物质含量 Total solids (%) | 无脂固体物质含量 Non-fat solids (%) | ||
| MM | 210 | 4.96±0.77 | 4.85±1.76 | 4.97±0.65 | 16.04±2.26 | 11.21±1.33 |
| NN | 41 | 4.83±0.63 | 4.96±1.87 | 4.96±0.50 | 16.01±2.25 | 11.05±0.94 |
| P值 P-value | 0.222 | 0.841 | 0.822 | 0.781 | 0.373 | |
新窗口打开
DGAT1基因intron15—exon17区基因型及等位基因与甘南牦牛乳质性状相关分析见表9和表10。结果表明,该区域突变影响甘南牦牛乳蛋白率、乳脂率、总固体物质含量。甘南牦牛BB型个体乳蛋白率最低且显著低于AA、AB、AC型(P<0.05),携带等位基因A个体乳蛋白率显著高于未携带个体(P=0.004),即等位基因A有提高甘南牦牛乳蛋白率的趋势。甘南牦牛AC型个体乳脂率最高且显著高于其他个体(P<0.05);携带等位基因A及C的个体乳脂率显著高于未携带者(P=0.026),而携带等位基因B的个体乳脂率显著低于未携带者(P=0.022),即等位基因A和C有增加甘南牦牛乳脂率的趋势,而等位基因B对乳脂率有不利影响。甘南牦牛AC型个体总固体物质含量最高且显著高于AB、BC和BB型(P<0.05),携带等位基因A的个体总固体物质含量显著高于未携带者(P=0.001),而携带等位基因B的个体显著低于未携带者(P=0.013),即等位基因A有提高甘南牦牛总固体物质含量的趋势,而等位基因B对该性状有不利影响。该区域各基因型与甘南牦牛乳糖含量、无脂固体物质含量均无显著相关,而携带等位基因A的个体无脂固体物质含量显著高于未携带者(P=0.010)。综合上述分析结果,选择携带等位基因A的个体或淘汰携带等位基因B的个体,能够提高牦牛群体乳品质。
Table 9
表9
表9甘南牦牛DGAT1基因intron15-exon17区基因型与乳质性状关联性分析
Table 9Association of genotypes in intron15-exon17 of DGAT1 gene with milk quality traits in Gannan yak
| 基因型 Genotypes | 个体数 No. (n) | 性状 Traits | ||||
|---|---|---|---|---|---|---|
| 乳蛋白率 Protein rate (%) | 乳脂率 Fat rate (%) | 乳糖率 Lactose rate (%) | 总固体物质含量 Total solids (%) | 无脂固体物质含量 Non-fat solids (%) | ||
| AA | 122 | 4.99±0.68 a | 4.82±1.85 b | 5.00±0.49 | 16.06±2.20 ab | 11.28±1.03 |
| AB | 59 | 4.96±0.78 a | 4.71±1.60 b | 4.99±0.66 | 15.93±1.96 b | 11.22±1.35 |
| AC | 47 | 4.99±0.81 a | 5.57±1.88 a | 4.94±0.80 | 16.79±2.5 a | 11.21±1.55 |
| BB | 9 | 4.23±0.73 b | 3.48±0.71 b | 4.51±0.77 | 13.48±1.14 c | 9.95±1.49 |
| BC | 12 | 4.78±0.86 ab | 4.25±1.09 b | 4.95±0.72 | 15.24±1.54 bc | 10.99±1.53 |
| P值 P-value | 0.045 | 0.009 | 0.416 | 0.002 | 0.074 | |
新窗口打开
Table 10
表10
表10甘南牦牛DGAT1基因intron15-exon17区等位基因与乳质性状关联性分析
Table 10Association of alleles in intron5-exon7 of DGAT1 gene with milk quality traits in Gannan yak
| 等位基因 Alleles | 存在/缺失 Present/Absent | 个体数 No. (n) | 性状 Traits | ||||
|---|---|---|---|---|---|---|---|
| 乳蛋白率 Protein rate (%) | 乳脂率 Fat rate (%) | 乳糖率 Lactose rate (%) | 总固体物质含量 Total solids (%) | 无脂固体物质含量 Non-fat solids (%) | |||
| A | 存在 Present | 228 | 4.98±0.73 a | 4.95±1.81 a | 4.99±0.61 | 16.18±2.22 a | 11.25±1.23 a |
| 缺失 Absent | 23 | 4.52±0.80 b | 4.07±1.11 b | 4.77±0.73 | 14.63±1.65 b | 10.53±1.50 b | |
| P值 P-value | 0.004 | 0.026 | 0.135 | 0.001 | 0.010 | ||
| B | 存在 Present | 80 | 4.85±0.81 | 4.50±1.50 b | 4.93±0.69 | 15.55±1.97 b | 11.05±1.43 |
| 缺失 Absent | 171 | 4.98±0.72 | 5.04±1.87 a | 4.99±0.59 | 16.26±2.30 a | 11.25±1.19 | |
| P值 P-value | 0.137 | 0.022 | 0.537 | 0.013 | 0.203 | ||
| C | 存在 Present | 61 | 4.93±0.81 | 5.31±1.79 a | 4.94±0.77 | 16.46±2.38 | 11.14±1.52 |
| 缺失 Absent | 190 | 4.94±0.73 | 4.72±1.75 b | 4.97±0.57 | 15.90±2.15 | 11.19±1.18 | |
| P值 P-value | 0.877 | 0.026 | 0.640 | 0.092 | 0.755 | ||
新窗口打开
2.4.2 甘南牦牛DGAT1基因单倍型组合与乳质性状相关性分析 甘南牦牛DGAT1基因不同单倍型组合(个体数在7以上)与乳质性状相关性见表11。结果表明,不同单倍型组合与甘南牦牛乳蛋白率、乳脂率、总固体物质含量和无脂固体物质含量呈显著相关(P<0.05)。综合各单倍型组合乳品质性状,H2H2单倍型组合个体的乳蛋白率、乳脂率、乳糖率、总固体物质含量和无脂固体物质含量均最低,并在除乳糖率以外的其他乳质性状中均显著低于其他7种单倍型组合(P<0.05);H1H3单倍型组合乳脂率、总固体物质含量最高,也有较高的乳蛋白率及无脂固体物质含量,即选留H1H3单倍型组合及淘汰H2H2单倍型组合个体可显著改善后代群体的乳品质性状。
Table 11
表11
表11甘南牦牛DGAT1基因单倍型组合与乳质性状关联性分析
Table 11Association of haplotype combinations of DGAT1 gene with milk quality traits in Gannan yak
| 单倍型组合 Haplotype combinations | 个体数 No. (n) | 性状 Traits | ||||
|---|---|---|---|---|---|---|
| 乳蛋白率 Protein rate (%) | 乳脂率 Fat rate (%) | 乳糖率 Lactose rate (%) | 总固体物质含量 Total solids (%) | 无脂固体物质含量 Non-fat solids (%) | ||
| H1H1 | 107 | 5.03±0.68 a | 4.80±1.87 bc | 4.98±0.48 | 16.04±2.22 ab | 11.27±1.02 a |
| H1H2 | 45 | 5.00±0.80 a | 4.68±1.64 bc | 5.02±0.73 | 16.02±2.08 ab | 11.34±1.49 a |
| H1H3 | 37 | 5.00±0.84 a | 5.65±1.92 a | 4.97±0.88 | 17.01±2.59 a | 11.25±1.70 a |
| H2H2 | 7 | 4.01±0.70 b | 3.44±0.39 c | 4.26±0.72 | 13.00±1.11 c | 9.46±1.37 b |
| H2H3 | 12 | 4.79±0.85 a | 4.35±1.10 bc | 4.96±0.71 | 15.36±1.34 b | 11.01±1.50 a |
| H4H4 | 15 | 4.91±0.64 a | 4.95±1.69 ab | 5.14±0.60 | 16.26±2.16 a | 11.33±1.10 a |
| H4H5 | 14 | 4.72±0.53 ab | 4.78±1.51 bc | 4.87±0.38 | 15.64±1.53 ab | 10.84±0.56 a |
| H4H6 | 10 | 4.96±0.67 a | 4.90±1.58 ab | 4.81±0.37 | 15.97±2.10 ab | 11.05±0.85 a |
| P值 P-value | 0.046 | 0.036 | 0.148 | 0.003 | 0.035 | |
新窗口打开
3 讨论
3.1 牦牛DGAT1基因检测区域多态性较丰富
不同物种DGAT1基因intron5—exon7及intron15—exon17区域均报道存在多态性。刘源等[22]在莱芜猪DGAT1基因第6外显子、朱春梅等[23]在萨能奶山羊该基因第15内含子、杨具田等[24]在藏绵羊第16—17外显子、ANGIOLILLO等[25]在山羊第16内含子均发现单核苷酸突变,而周军[10]在广西水牛DGAT1基因第17外显子检测到C>T的碱基突变导致丙氨酸(Ala)转变为缬氨酸(Val)。本研究检测的牦牛DGAT1基因序列在intron5—exon7区域发现1处插入/缺失突变,intron15—exon17区域发现2处SNPs突变位点,与其他物种该基因相应区域的研究结果类似。本研究发现牦牛第17外显子c.1336C>T的突变导致编码蛋白的碱性精氨酸(Arg)变为中性半胱氨酸(Cys),刘洪瑜[26]在牛leptin 基因发现第2外显子C>T突变,其导致编码蛋白由精氨酸突变为半胱氨酸,并改变了蛋白的二级、三级结构及其疏水性。FUJII等[27]在猪RYRI基因编码区中检测到C>T错义突变,使精氨酸变为半胱氨酸,从而改变了RYRI基因的结构和功能。本研究发现牦牛DGAT1的精氨酸到半胱氨酸突变对其蛋白结构和功能的影响仍需进一步证实。
3.2 DGAT1基因intron15-exon17突变影响甘南牦牛乳质性状
DGAT1属于乙酰辅酶A胆固醇乙酰转移酶1(ACAT1)和乙酰辅酶A胆固醇乙酰转移酶2(ACAT2)家族成员,是甘油三酯(TAG)合成最后一步反应的限制酶,在高等真核生物TAG代谢途径(如肠脂肪吸收、脂蛋白集合、脂肪形成和泌乳等)中发挥着重要功能。SMITH等[28]报道敲除DGAT1基因的小鼠完全丧失泌乳能力,推测DGAT1基因是泌乳性状的功能候选基因。目前许多研究证实DGAT1基因第8外显子AA→CG的双碱基突变(命名为K232A)影响奶牛产奶量、乳脂及乳蛋白含量[29-30]。另外,在DGAT1基因5′调控区[23]及第8内含子区[31]均发现显著影响奶山羊及奶水牛乳品质性状的突变位点。DGAT1基因突变影响不同物种的乳品质性状。本研究发现甘南牦牛DGAT1基因intron15—exon17突变影响其乳品质性状,等位基因A有增加甘南牦牛乳脂率、乳蛋白率和总固体物质含量的趋势,等位基因C也可增加其乳脂率,而等位基因B对乳脂率、总固体物质含量有不利影响。朱春梅[23]报道西农萨能奶山羊DGAT1基因intron15的单核苷酸突变与乳脂率显著关性;DE FREITAS[32]研究发现水牛DGAT1基因第17外显子区两个SNPs位点与乳脂肪和蛋白质的比例显著相关,这与本研究结果类似。但孟莉[33]等在水牛DGAT1基因第17外显子区检测到1个SNP突变,且其对乳脂率及乳蛋白率无显著影响,与本研究结果不完全一致,这可能与不同物种、品种及突变位点有关。
3.3 DGAT1基因单倍型组合影响甘南牦牛乳品质性状
相对于单个SNP分析,单倍型分析在复杂性状的关联研究中具有更准确的统计效果,而且单倍型的传递比单个SNP传递更有效,所以单倍型分析已经成为研究复杂性状的优势选择和遗传关联分析的重要手段。本研究发现甘南牦牛H2H2单倍型组合个体的乳蛋白率、乳脂率、总固体物质含量和无脂固体物质含量均显著低于其他单倍型组合,H1H3单倍型组合乳脂率、总固体物质含量最高,也有较高的乳蛋白率及无脂固体物质含量。鲍斌等[34]在荷斯坦牛STAT5A基因研究中发现不同单倍型组合对产奶量和乳蛋白率有显著影响;鞠志花等[35]研究中国荷斯坦牛κ-酪蛋白基因多态性与泌乳性状的关联性中发现H1H4单倍型组合对乳蛋白率和乳脂率均有有利影响,可作为选择高乳蛋白率和高乳脂率牛群的分子标记。本研究中甘南牦牛DGAT1基因单倍型组合关联分析结果与基因型及等位基因关联分析结果基本一致,相应单倍型组合也可作为选育提高牦牛乳品质性状的分子标记。4 结论
本研究在4个牦牛群体DGAT1基因的intron5— exon7区发现c.562+32_c.562+33insCCCCGC的插入/缺失突变、intron15-exon17区检测到c.1336C>T、c.1249-23C>T 的SNPs,其中intron 17区域的c.1336C>T为非同义突变,两区域共发现6种潜在的单倍型。甘南牦牛intron15-exon17区突变及其与intron5-exon7区的单倍型组合均影响乳品质性状,选留携带等位基因A的个体和淘汰携带等位基因B的个体、或选留H1H3单倍型组合及淘汰H2H2单倍型组合个体,均可显著改善后代群体的乳品质。The authors have declared that no competing interests exist.
