0 引言
【研究意义】西瓜噬酸菌(Acidovorax citrulli)可以引起包括西瓜和甜瓜在内的葫芦科作物细菌性果斑病(bacterial fruit blotch,BFB),是一种严重的世界性病害[1]。该病一般由种子传播,在西瓜整个生长期均可侵染,致使果肉腐烂,失去食用价值。在适宜的环境条件下,果斑病一旦暴发,难以控制,常常给瓜农带来巨大的经济损失[2]。从1987年开始,该病在中国海南、甘肃、吉林、黑龙江等地陆续被报道[3-6]。细菌的鞭毛蛋白基因与病菌的致病性相关,但是有关果斑病菌鞭毛蛋白基因的研究较少,因而开展果斑病菌鞭毛蛋白基因研究,对进一步探明该基因在果斑病菌致病性等生物学功能中的作用具有重要意义。【前人研究进展】现已研究表明,鞭毛蛋白基因fliS与鞭毛的形成、菌株的游动性、毒性等有着密切的关系,如YOKOSEKI等对鼠伤寒沙门氏菌(Salmonella typhimurium)fliS突变体的研究表明,鞭毛蛋白基因fliS的缺失导致该菌的鞭毛变短且数量是野生菌的2倍左右[7-8];XU等[9]研究显示,在假结核耶尔森菌(Yersinia pseudotuberculosis)中,fliS缺失突变株鞭毛明显变短、游动性减弱,菌膜形成能力增强,互补后菌株鞭毛长度恢复野生状态;RADOMSKA等[10]对空肠弯曲杆菌(Campylobacter jejuni)的鞭毛蛋白基因fliS研究表明,该基因的缺失导致其丧失游动性,且鞭毛变短;刘丽云等[11]研究认为,在弗氏枸橼酸杆菌(Citrobacter freundii)中fliS缺失菌株游动性降低,可以导致巨噬细胞的黏附性减弱和细胞毒性下降。【本研究切入点】果斑病菌的鞭毛蛋白基因fliS是否具有相同或相似的生物学功能,目前尚未见报道。笔者课题组从构建的果斑病菌Tn5插入突变体库中筛选到一株鞭毛蛋白基因fliS(Aave_4398)被插入突变的突变株,该突变株的致病性显著降低,该基因在果斑病菌生物学特性中的作用需要进一步明确。【拟解决的关键问题】通过构建敲除载体和互补载体,获得鞭毛蛋白基因fliS突变株和互补菌株,分析该基因对果斑病菌生物学功能的影响,为解析果斑病菌鞭毛蛋白基因的功能,进一步明确果斑病菌的致病机理和鞭毛调控机制提供依据。1 材料与方法
试验于2015年10月至2017年1月在福建农林大学植物保护学院完成。1.1 菌株和质粒
西瓜果斑病菌野生菌株1号(RifR)、敲除菌株1-fliS(RifR、GmR)、互补菌株1-fliShb(RifR、GmR、KmR)。大肠杆菌DH5α、质粒PBBR1MCS-2(KmR)、质粒pMD19T-Gm由笔者实验室保存;助手菌DH5α(PRK 600)(CmR)、群体感应信号报告菌NTL4由中国农业大学张力群教授惠赠;群体感应阳性对照菌株Ecc-1、敲除载体PK18mobsacB(KmR)由中国农业科学院赵廷昌研究员惠赠。1.2 培养基
LB、NA、KB培养基配制参照方中达《植病研究方法》[12],ABM培养基配制参照刘鹏[13]的方法,半固体M9DCAA培养基参照TREMBLAY等[14]的方法。1.3 引物
本试验中所用的引物见表1。Table 1
表1
表1本试验所用的引物
Table 1Primes used in this study
| 引物 Prime | 序列 Sequence (5′-3′) | 退火温度 Annealing temperature (℃) | 长度 Length (bp) |
|---|---|---|---|
| fliSup F | CGGAATTCCATCCCGCAACCTCTACTGT | 57 | 820 |
| fliSup R | GCTCTAGACTACAAGGCCATCGAAGACA | ||
| fliSdown F | ACGCGTCGACTGCTGCTGGATGTAGCTGTT | 59 | 909 |
| fliSdown R | CCCAAGCTTAGCAAGATCAACGGCTCCA | ||
| Gm F | CGACGCACACCGTG GAAA | 55 | 855 |
| Gm R | GCGGCGTTGTGACAATTT | ||
| fliS up out | GACTGCGGACATGGTGCT | 56.6 | |
| fliSdown out | TTTCCGATTCGCTGACG | 55 | |
| GENT5OUT | GCGTTCGGTCAAGGTTCTG | 60 | |
| GENT3OUT | GTTGGGCATACGGGAAGAAG | 60 | |
| fliSin | CGCATTCTGGAGGAAGGGTT | 61.4 | |
| SEQID5[15] | CCTCCACCAACCAATACGCT | 53 | 246 |
| SEQID4m[15] | GTCATTACTGAATTTCAACA | ||
| fliS F | GGGGTACCTGTCTTCGATGGCCTTGTAGT | 59 | 605 |
| fliS R | GCTCTAGAAA CAGCTACATCCAGCAGCA | ||
| qglnA F | GCCACGAAGGACCTCTACCA | 59.8 | 144 |
| qglnA R | CAGCATGGAGTCCGAGAACA | 59.0 | |
| qflhD F | TTCGTTGCCGACCTTCTTG | 59.3 | 171 |
| qflhD R | TTCCGCCTGGGCATCAA | 61.0 | |
| qfliA F | ACACCGCCAAAGGACAGCT | 60.2 | 178 |
| qfliA R | CCCTGCGTCACCTCGTAGC | 61.2 | |
| qfliE F | CGCATCTCCAGCTCCACC | 59.1 | 186 |
| qfliE R | CGGGTTTTCCATCTGCACTTC | 61.9 | |
| qfliC F[16] | GACGTTGACGGTCTTGGTCT | 59.9 | 131 |
| qfliC R[16] | CCAACAATTATGGCGCCCAG | 59.9 | |
| qflgK F | ACGATGAGCGACGGCTATG | 59.3 | 107 |
| qflgK R | CGTTCGAGGTTGGTGGAGA | 59.6 | |
| qfliD F | GCGTCAGCGAATCGGAAAT | 60.9 | 117 |
| qfliD R | CGTCCAGCACCGATTTCGT | 61.5 | |
| qflgM F | CTTGACCTTGTTGGCATCGAAA | 59.7 | 176 |
| qflgM R | AGGCTGCCAAGCAACAGG | 60.6 |
新窗口打开
1.4 敲除载体的构建
参照《分子克隆实验指南》[17],分别使用引物fliSup F/R、fliSdown F/R扩增基因fliS的上游和下游片段,回收PCR液;用限制性内切酶EcoR I、Xba I分别酶切上游PCR扩增产物和pMD19T-Gm质粒DNA,通过T4 ligase连接,将上游片段连接到pMD19T-Gm质粒上,转化至感受态细胞DH5α,挑取阳性克隆子进行PCR和双酶切验证,并委托上海生工生物工程有限公司测序,得到质粒pMD19T-up-Gm;同样,将基因fliS的下游片段连接到pMD19T-up-Gm质粒上,得到质粒pMD19T-up- Gm-down;用限制性内切酶EcoR I和Hind III分别酶切质粒pMD19T-up-Gm-down和敲除载体PK18mobsacB的质粒DNA。将up-Gm-down基因片段连接到敲除载体PK18mobsacB上,转化,挑阳性克隆子进行PCR和酶切验证,得到的质粒命名为PK18-up-Gm-down,即敲除载体。1.5 基因敲除及验证
基因敲除采用三亲杂交的方法[18];使用引物Gm F/R、fliS F/R、fliS F/fliSin、fliSupout/GENT3OUT、fliSdown out/GENT5OUT进行PCR扩增,验证基因是否敲除。1.6 互补菌株的构建
利用引物fliS F/R进行PCR扩增,获得目的基因fliS片段,用限制性内切酶Kpn I和Xba I分别酶切目的基因片段和质粒PBBR1MCS-2,通过T4 ligase连接,转化,挑取单克隆子进行PCR验证,测序,NCBI比对,得到互补载体PBBR-fliS。采用三亲杂交的方法将互补载体PBBR-fliS转入敲除菌株1-fliS,挑选阳性克隆子进行PCR和酶切验证。1.7 生物学测定
1.7.1 烟草过敏性反应 参照汪新等[19]的方法,烟草叶片背面注射OD600=0.6的菌液,24 h内观察过敏性反应。1.7.2 游动性测定 参照TREMBLAY等[14]的方法,取1 μL OD600=1.0细胞悬浮液点接于半固体M9DCAA培养基,28℃正置培养2 d或以上,比较观察细菌的运动痕迹,测量游动半径,使用SPSS软件中LSD法进行单因素方差分析,比较野生菌株、敲除菌株和互补菌株之间的差异。
1.7.3 菌落形态 参照BAHAR等[20]的方法,稀释涂布NA平板,培养96 h后,于体式显微镜(Nikon SMZ800N)下观察并拍照。
1.7.4 菌膜测定 参照PETROCELLI等[21]的方法,略加改进。吸取OD600=1.5菌液150 μL,加至盛有15 mL新鲜KB液体的大试管中,并在试管中放置一个玻璃片,28℃静置培养。7 d后,向培养液中加入750 μL 1%的结晶紫染色40 min,吸出试管中液体,用蒸馏水冲洗3次,观察被结晶紫染色的菌膜,并拍照;另外,结晶紫染色后用1 mL的95%(v/v)乙醇脱色,在紫外分光光度计下测A570。
1.7.5 群体感应测定 参照刘鹏等[22]的方法,将待测菌液调至OD600=1.5,Ecc-1为阳性对照,每种菌液吸2 μL点接于ABM平板上,12 h后观察结果。
1.7.6 生长曲线的测定 参照陈娇梅[23]的方法,按1﹕1 000的比例取OD600 =1.5的菌液,加到50 mL新鲜的KB液体培养基中,180 r/min,28℃振荡培养,4 h后开始取样并测OD600,每2 h测一次,直到进入稳定期。
1.7.7 电镜观察 参照GAVIN等[24]的方法,将活化后的待测菌株在NA培养基上培养24 h后,加无菌水没过菌苔,静置10 min后,将铜网置于菌液中吸附1—2 min,用1%磷钨酸钾负染后,在透射电镜下(Hitachi,HT7700)观察鞭毛并拍照。
1.7.8 致病性测定 甜瓜菌液浸种:参照李俊阁[25]的方法,将甜瓜种子于OD600=0.8待测菌液中浸泡20 min,放置于1%的水琼脂上,28℃光照12 h,黑暗12 h交替培养,观察发病情况。
西瓜苗喷雾接种:参照李明明等[26]的方法,将待测菌株过夜摇培,调OD600=0.8,喷雾接种至2叶期西瓜苗,清水为对照,第3天开始观察发病情况。
西瓜果实接种:参照蔡学清等[27]的方法,略加改进,用灭过菌的小枪头针刺西瓜果皮造成伤口,将OD600=0.8的菌液用无菌棉涂抹在伤口上并将棉花敷于伤口上,清水对照。28℃培养,3 d后观察发病情况。
1.8 部分鞭毛相关基因表达量分析
在菌液OD600约为1.0时,使用TRNzol总RNA提取试剂(天根生化科技有限公司)提取RNA。使用Promega公司的GoScriptTM Reverse Transcription system和GoTaq® qPCR Mix分别进行反转录和荧光定量PCR。以谷氨酰胺合成酶基因glnA为内参,使用Eppendorf Realplex实时定量PCR仪进行试验。2 结果
2.1 敲除菌株的获得
通过PCR分别扩增基因fliS的上下游片段,并将扩增获得的片段分别连接到敲除载体PK18mobsacB,转化挑取阳性克隆子,利用引物fliSup F/fliSdown R进行PCR扩增,通过凝胶电泳获得一条大小约2 600 bp的片段,即up-Gm-down基因片段;另外,通过双酶切得到一条约5 600 bp(PK18mobsacB)的片段和一条约2 600 bp(up-Gm-down)的片段,这表明已将基因fliS的上下游片段连接到敲除载体PK18mobsacB上,将获得的敲除载体命名为PK18-up-Gm-down。通过三亲杂交的方法将敲除载体PK18-up-Gm- down导入西瓜果斑病菌1号菌株中,挑取阳性克隆子,用引物Gm F/R进行PCR扩增,可以扩增得到大小855 bp的单一条带,表明敲除载体成功导入果斑病菌中;由于引物fliS F/R位于上下游片段内部,使用其扩增也得到大小为855 bp的条带,为了明确fliS被Gm代替,在fliS基因内部设计fliSin引物,使用fliS F/fliSin扩增,野生菌株可以扩增得到约300 bp条带,克隆子扩增不到相应片段,表明基因fliS被抗性基因Gm代替;使用引物GENT3OUT和fliSup out引物以及GENT5OUT和fliSdown out进行PCR扩增,分别得到大小1 031、942 bp单一条带,说明fliS敲除过程中基因交换的位置和其在基因组中的位置一致;将敲除获得的菌株命名为1-fliS。
2.2 互补菌株的获得
通过PCR扩增基因fliS片段,并将扩增获得的片段连接到互补载体PBBR1MCS-2,转化挑取阳性克隆子,以fliS F/R为引物进行PCR扩增,得到大小605 bp单一片段。送生工测序,测序结果通过NCBI与西瓜噬酸菌基因组AAC00-1(GenBank登录号NC-008752)进行比对,比对结果一致性为100%,互补载体构建成功,命名为PBBR-fliS。通过三亲杂交的方法将互补载体PBBR-fliS导入敲除菌株1-fliS中,挑取阳性克隆子,使用引物fliS F/R进行PCR扩增,得到大小605 bp单一片段,敲除菌株1-fliS得到855 bp的单一片段,表明基因fliS转入敲除菌株中;用果斑病菌特异性引物SEQID5/4m扩增,可得到与野生菌一致的单一目标条带;将获得的菌株命名为1-fliShb。
2.3 生物学测定
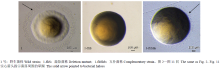
2.3.1 烟草过敏反应 烟草过敏反应测定结果表明,野生菌株、敲除菌株和互补菌株接种烟草叶片后24 h均可观察到坏死斑。2.3.2 菌落形态观察 NA平板上培养4 d后观察,野生菌1号菌株,中间凸起,菌落边缘具有一圈较透明的由细菌颤泳形成的特殊晕圈;敲除菌株1-fliS菌落边缘较光滑,没有晕圈形成;互补菌株1-fliShb菌落边缘也能形成较透明的晕圈,但晕圈直径较野生菌小(图1)。
2.3.3 菌膜测定 敲除菌株1-fliS形成菌膜的能力明显弱于野生菌1号菌株和互补菌株1-fliShb(图2);定量测定结果表明,野生菌株和互补菌株的菌膜之间没有显著差异(P>0.05),但与敲除菌株差异显著(P<0.05)(图3)。
2.3.4 游动性测定 在0.3%的半固体M9DCAA培养基上静置5 d后观察,敲除菌株1-fliS相对游动面积为0,互补菌株1-fliShb游动面积略小于野生菌株(图4),方差分析表明,野生菌株和敲除菌株以及互补菌株和敲除菌株游动半径之间均显著差异(P<0.05)(表2),由此说明基因fliS与细菌的运动性相关。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1NA平板上菌落形态
-->Fig. 1The colonial morphology under microscopy on NA medium
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同菌株产生的菌膜
-->Fig. 2The biofilm of different strains
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3菌膜定量测定
-->Fig. 3The quantitative test of biofilm
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同菌株的游动性测定
-->Fig. 4The motility test of different strains on semisolid plates
-->
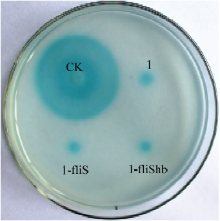
2.3.5 群体感应 阳性对照(CK)平均显色直径为3.83 cm,突变菌株1-fliS及其互补菌株1-fliShb和野生菌1号菌株没有明显差异,显色平均直径均为0.45 cm(图5)。说明基因fliS在西瓜果斑病菌1号菌株中,对病原菌的高丝氨酸内酯类群体感应信号分子的分泌没有影响。
Table 2
表2
表2不同菌株游动性
Table 2The motility analysis of different strains
| 菌株 Strain | 游动半径 Motility radius (cm) |
|---|---|
| 1 | 0.79±0.05a |
| 1-fliShb | 0.62±0.05b |
| 1-fliS | 0c |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5不同菌株的群体感应信号测定
-->Fig. 5Detection of Quorum sensing signal by different strains
-->
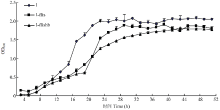
2.3.6 生长曲线 野生菌株、敲除菌株和互补菌株的生长趋势基本一致,但野生菌1号菌株的生长速度最快,敲除菌株和互补菌株的生长速度较野生菌株慢,特别是生长初期,这可能是由于插入外源基因,菌株在生长初期受到干扰所造成的(图6)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6西瓜果斑病菌的生长曲线
-->Fig. 6The growth curve of the tested strains
-->
2.3.7 电镜观测 透射电子显微镜(Hitachi HT7700)观测结果显示,敲除菌株1-fliS鞭毛长度明显比野生菌1号菌株的鞭毛短,约为其1/3—1/4;互补菌株1-fliShb的鞭毛长度约为野生菌株的4/5,说明互补后鞭毛合成能力基本恢复(图7)。
2.3.8 致病性测定 甜瓜菌液浸种:浸种接种后4 d,野生菌株、敲除菌株和互补菌株处理长出的幼苗子叶均出现水渍状病斑;接种后8 d,野生菌株和互补菌株处理长出的幼苗子叶全部褐变坏死,幼苗死亡,而敲除菌株1-fliS处理长出的幼苗子叶发病明显低于野生菌株和互补菌株,清水对照未发病(图8)。
西瓜苗喷雾接种:西瓜苗喷雾接种后3 d,野生菌和互补菌株处理的出现病斑,敲除菌株处理的未见发病,接种后5 d,野生菌株处理产生的病斑严重程度较互补菌株的高,但敲除菌株处理的仍未见病斑出现(图9)。
西瓜果实接种:接种后3 d,野生菌株和互补菌株处理的开始发病,敲除菌株处理和清水对照未见病斑,接种后5 d,敲除菌株1-fliS处理的发病程度明显低于野生菌株和互补菌株处理的(图10)。
2.4 部分鞭毛相关基因表达量分析
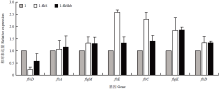
琼脂糖凝胶电泳和核酸浓度检测(BioDrop)结果显示提取细菌总RNA质量高,可用于后续试验。实时荧光定量PCR结果显示,fliS基因缺失突变后,flhD表达量明显降低,fliE、fliC和flgK表达量明显升高,flgM和fliD表达量略微上升,fliA表达量基本不变(图11)。其中,flhD、fliE和fliC表达量在fliS基因互补后均有所恢复,认为这3个基因表达量的变化可能与fliS的缺失有直接关系。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7电子显微镜下鞭毛形态图
-->Fig. 7Flagella form under the electronic microscope
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8甜瓜浸种致病性测定(接种后8 d)
-->Fig. 8The pathogenicity detection on melon seedling (8 days after inoculation)
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9西瓜苗致病性测定(接种后5 d)
-->Fig. 9The pathogenicity detection on watermelon leaves (5 days after inoculation)
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图10西瓜果实致病性测定(接种后5 d)
-->Fig. 10The pathogenicity detection on watermelon fruit (5 days after inoculation)
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图11部分鞭毛相关基因相对表达量检测
-->Fig. 11Relative expression of some genes related to flagellum
-->
3 讨论
研究表明,细菌的鞭毛蛋白基因fliS与鞭毛的形成、菌株的游动性、毒性等有着密切的关系,然而目前关于果斑病菌鞭毛蛋白基因fliS的生物学功能还不是十分清楚。笔者课题组曾通过构建Tn5突变体库筛选获得一株fliS被插入的突变株,在此基础上,本研究通过基因定点敲除的方法获得该基因的敲除突变株,结果表明该基因突变导致其对西瓜、甜瓜的致病性降低,游动性、菌膜形成能力减弱等。对假结核耶尔森菌、弗氏枸橼酸杆菌和空肠弯曲杆菌的研究结果均显示fliS突变菌株的游动性明显降低[9-11],本研究结果也显示突变菌株1-fliS的游动性明显弱于野生菌。CAPDEVILA等[28]研究表明,鞭毛蛋白特异的胞浆伴侣蛋白基因fliS的缺失可以引起多数FliC蛋白堆积在细胞质形成包涵体而不能分泌出去,或FliC错误聚合或不能形成稳定的聚合体,不能运输到细胞外从而影响正常的鞭毛丝的形成,电镜下表现为鞭毛的又短又细;FURUKAWA等[29]研究表明,fliS缺失突变体中形成非折叠的FliC,其输出被限制,表现为FliC的表达水平明显增加,影响正常的鞭毛丝的形成,电镜下也表现为鞭毛变短。本研究在对fliS突变菌株进行鞭毛观察时发现,敲除菌株1-fliS的鞭毛长度变短,约为野生菌株的1/3—1/4,与CAPDEVILA等的研究结果一致[28-29],但YOKOSEKI 等对鼠伤寒沙门氏菌fliS突变体的研究发现,插入突变基因fliS导致鞭毛变短且数量增多[7-8],这可能与细菌种类或鞭毛调控机制差异有关,具体原因还有待于进一步研究。另外,本试验对fliS缺失突变菌株和互补菌株实时定量PCR研究表明,fliS缺失突变菌株fliC表达量上升,flhD表达量降低,而fliS基因互补后,flhD和fliC的表达量没有完全恢复到野生菌株的水平,在电子显微镜下观察到的互补菌株的鞭毛长度也没能完全恢复到野生菌株状态,笔者推测鞭毛蛋白基因fliS通过调控flhD和fliC的表达从而调控果斑病菌鞭毛的形成,至于fliS对其他鞭毛基因的影响尚需进一步验证。大部分植物病原细菌的致病性与菌膜形成能力呈正相关,LUO等[30]通过Tn5插入突变研究表明,果斑病菌菌膜形成能力下降导致该病菌的致病性降低,本研究结果显示,fliS基因敲除后,导致果斑病菌的菌膜形成能力明显低于野生菌株,从而导致该病菌的致病性降低,因而,果斑病菌的鞭毛蛋白基因fliS与果斑病菌菌膜的形成有关,是该病菌致病的重要因子。
4 结论
获得了果斑病菌鞭毛蛋白基因fliS的敲除菌株和互补菌株,敲除菌株1-fliS鞭毛变短,游动性减弱,菌膜形成能力减弱,对西瓜、甜瓜致病力减弱。果斑病菌胞浆伴侣蛋白基因fliS对该病菌鞭毛的合成、菌膜形成能力及致病性等生物学特性起重要作用。The authors have declared that no competing interests exist.
