0 引言
【研究意义】单倍体育种是首先通过雄核发育(包括离体花药培养/小孢子培养)或孤雌生殖方法诱导形成单倍体植株,然后经染色体加倍形成纯合二倍体,其中具有优良性状的可育再生植株可作为新的育种材料。单倍体育种能加快获得某一性状纯系,更重要的是极大丰富了亲本种质资源,从而更好的实现倍性育种,加快育种进程[1-3]。花药培养是单倍体育种的主要途径之一,自然加倍形成的纯合二倍体植株则是挖掘特有性状基因、研究遗传基础及苹果分子标记辅助育种的理想材料[[4-8]。苹果(Malus dometic Brokh.)是世界上最重要的果树之一[9],中国苹果产量居世界首位[10]。苹果基因型高度杂合、异花授粉且自交不亲和[11],难以通过常规杂交育种获得纯合基因型植株,所以很大程度增加了苹果单倍体育种难度[12-13]。通过花药离体培养快速挖掘杂合体‘嘎啦’优良性状基因是苹果育种中种质创新的重要内容。【前人研究进展】自首次采用花药培养获得单倍体植株以来 [14],目前已有250多种植物利用单倍体育种方法获得再生植株[15]。20世纪70年代,NAKAYAMA等[16]率先开始苹果花药培养,之后多个苹果品种的花药经培养诱导获得了胚状体[17]以及纯合基因型植株[18]。依靠花药培养技术,杨振英等[19]育成苹果新品种‘华富’。OKADA等[20]则获得了‘千秋’纯合可育再生植株。这些苹果花药培养再生植株,很大程度丰富了单倍体育种种质资源[21],扩大了育种亲本范围。但是纯合再生植株育性和结实率很低,直接用于杂交育种还有一定的困难。任莹[22]通过苹果花药培养获得22个再生株系,同时证明γ射线辐射后会影响结果率、果实大小和种子育性。ZHANG等[23]选用SSR标记证实‘红星’和‘千秋’苹果花药培养再生植株来源于花粉。近期的苹果花药转录组测序研究证明多种植物激素信号转导相关基因是影响花药胚性潜能的关键因子[24]。在花药培养诱导形成胚状体的细胞学研究方面,冯丽云等[25]证明改良脱水流程能强化胚发育的细胞学观察。【本研究切入点】苹果‘嘎啦’(橘红×金冠)是当今全球最重要的苹果栽培主流品种之一。但‘嘎啦’苹果的花药离体培养未见报道。【拟解决的关键问题】当前限制苹果育种的关键因子之一就是缺乏优良性状基因,比如抗逆、抗病的纯合亲本材料。本研究旨在以优良杂合体‘嘎啦’为试验对象,采用花药单倍体培养获得一批再生株系纯合体,通过流式细胞仪分析染色体,继而应用苹果SSR标记鉴定基因型,建立SSR标记的再生植株基因型鉴定体系,从而创制新的苹果育种种质资源,为后期的苹果育种包括田间性状筛选、杂交提供丰富的育种材料。1 材料与方法
1.1 花药离体培养
2013—2015年每年4月初,采取山西省农业科学院果树研究所苹果圃的‘嘎啦’苹果未开放的花蕾(此时花药多处于单核晚期到双核早期[23])。花蕾经4℃低温预处理26—32 d,用75%酒精消毒(振荡漂洗)30 s,后用无菌水冲洗3—4次,再用0.5%的次氯酸溶液灭菌8 min,无菌水冲洗3—4次,放置于已灭菌的滤纸上待接种。剥取花药按50个/皿的密度接种于胚状体诱导培养基(N6培养基,附加2.0—3.0 mg·L-1 6-BA和0—0.15 mg·L-1 NAA),25℃恒温培养箱内进行暗培养,诱导胚状体形成,转移胚状体至分化培养基,后经继代培养、生根培养、驯化、室内移栽获得再生植株。1.2 染色体倍性分析
取再生植株叶片在500 μL裂解液中用刀片切碎,静置2 min后过滤于EP管中,PI染色后用BD Accuri C5 流式细胞仪分析叶片中的DNA含量。以茎尖培养获得的杂合二倍体‘嘎啦’试管苗叶片为倍性鉴定的参考标准。1.3 基因组DNA的提取
采用改良CTAB法提取叶片总DNA[26],经核酸蛋白仪(Bio-Rad)检测DNA浓度,再经1%琼脂糖凝胶电泳检测DNA浓度和质量。1.4 SSR标记筛选
从苹果HIDRAS数据库(http://www.hidras. unimi.it/)选定位于17个连锁群(Linkage Group,LG)的80个SSR标记,相应引物由华大基因合成。以杂合体‘嘎啦’叶片和再生株系叶片的DNA为扩增模板,使用80对SSR引物进行PCR扩增。PCR反应体系为15 μL,含dNTP mixture(2.5 mmol·L-1)1.2 μL、正向引物和反向引物(10 μmol·L-1)各1.5 μL、10×PCR Buffer(Mg2+)1.5 μL、rTaq酶(5 U·μL-1)0.15 μL、DNA 模板50 ng。PCR仪(Eppendorf AG 22331 Hamburg, Germany)反应程序为:94℃预变性150 s;94℃变性30 s,60℃退火30 s,72℃延伸4 s,35 个循环;72℃充分延伸10 min,4℃保存。PCR扩增产物加入7.5 μL(2﹕1)的上样缓冲液,在8%的非变性聚丙烯酰胺凝胶电泳上电泳100 min(150 A)左右,银染检测扩增产物,筛选扩增稳定、带型清晰、可区分杂合亲本与纯合再生株系的SSR标记。1.5 再生株系的基因型鉴定
对筛选得到引物的5′端TAM、FAM、HEX荧光标记,进行PCR扩增。PCR反应体系为25 μL,含dNTP mixture(10 mmol·L-1)0.5 μL、10×PCR Buffer 2.5 μL、25 mmol·L-1 MgCl2 2.0 μL、rTaq酶(5 U·μL-1)0.2 μL、DNA模板(100 ng·μL-1)1 μL、ddH2O 17.8 μL。PCR反应程序为:第一步95℃预变性3 min;第二步94℃变性30 s,60℃退火30 s,72℃延伸30 s,10个循环;第三步95℃变性30 s,55℃退火30 s,72℃延伸30 s,20个循环;第四步72℃充分延伸6 min,4℃保存。反应板每孔先加入9.9 μL去离子甲酰胺和0.1 μL ROX500或LIZ500分子量内标,再吸取50 pg扩增产物加入样品孔中。98℃变性5 min,急速冷却,放置于ABI 3730XL DNA分析仪上。使用Gene Mapper软件分析扩增片段峰型并读取相应数据。1.6 再生株系植物学观察
以‘嘎啦’供体(杂合二倍体)为对照,对胚状体分化出再生苗后继代培养60 d的再生株系进行形态学特征(包括株高、叶形、叶数、叶长宽比)观察和统计。2 结果
2.1 ‘嘎啦’花药培养再生植株获得
共接种74 200个‘嘎啦’花药。经统计,未被污染的花药数55 143个(未污染率74.3%),诱导形成386个胚状体(胚状体诱导率0.7%,图1-A),经过胚状体经分化培养后共获得64株再生苗(植株再生率16.6%,图1-B),之后经生根培养(图1-C)、室内移栽,最终获得30个花药培养再生株系(图1-D)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1‘嘎啦’花药培养再生株系
-->Fig. 1Regenerated plantlets derived from ‘Gala’anther culture
-->
2.2 再生株系倍性分析
采用流式细胞仪对成活再生株系进行染色体倍性鉴定。以杂合二倍体‘嘎啦’供体(图2-A)为对照,结果表明,再生株系呈现3种不同的倍性,其中株系Gala 17为单倍体(图2-B),Gala 22株系为四倍体(图2-C)外,其余28个再生株系包括Gala 5(图2-D)均为二倍体。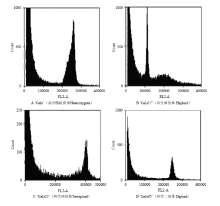 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2流式细胞仪对再生植株倍性分析
-->Fig. 2Flow cytometric (FCM) analysis of ploidy level of regenerated plantlets
-->
2.3 SSR标记分析
为了鉴别再生株系是纯合还是杂合体,首先对选自苹果SSR标记数据库(HIDRAS)的80个SSR标记进行筛选。用每一个SSR引物进行PCR扩增,然后根据扩增条带鉴别染色体来源。结果显示,80个SSR标记中有20个可区分纯合体/杂合体,扩增产物稳定,扩增片段长度在100—300 bp。如图3(Hi12c02(LG1)标记)聚丙烯酰胺凝胶电泳结果所示,‘嘎啦’杂合供体呈现2条PCR扩增带(170 bp和190 bp),而30个再生株系均只显示其中1条带,13个株系显示170 bp,其余17个株系为190 bp。20个标记如表1所示:LG4、LG9、LG14均筛得两个标记,其余连锁群各有一个标记。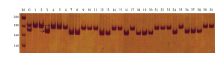 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3Hi12c02(LG1)PCR扩增产物在PAGE的电泳图结果
-->Fig. 3Hi12c02 (LG1) PCR-amplification analysis for identification of the homozygosity state
-->
2.4 再生植株基因型鉴定
进一步从LG4、LG9、LG14中各选择一个带型清晰的标记,与其余13个标记(另外13个连锁群)共17个SSR标记,利用荧光毛细管电泳技术鉴定PCR产物。图4(Hi12c02(LG1)标记)可见,‘嘎啦’杂合供体呈现176 bp和189 bp峰值,而纯合再生株系则只有其中一个峰值,其中13个再生株系呈现峰值176 bp,另外17个则呈现189 bp峰值,其他16个连锁群上的16个SSR标记也同样显示杂合体为两个峰,而再生株系只有其中的一个峰。此结果与上述聚丙烯酰胺凝胶电泳结果一致。证明,再生株系除单倍体Gala17外,所获其他29个再生株系均为纯合基因型植株。Table 1
表1
表1苹果HIDRAS数据库SSR 标记
Table 1Selected SSR markers from apple HIDRAS database
| 连锁群 LG | SSR标记 SSR markers | 上游引物 Forward primer | 下游引物 Reverse primer | 扩增范围 Primers range (bp) | 荧光标记 Labeling fluorescence dye |
|---|---|---|---|---|---|
| 1 | Hi12c02 | GCAATGGCGTTCTAGGATTC | GTTTCACCAACAGCTGGGACAAG | 170—190 | FAM |
| 2 | CH02c02a | CTTCAAGTTCAGCATCAAGACAA | TAGGGCACACTTGCTGGTC | 129—176 | FAM |
| 3 | CH03g07 | AATAAGCATTCAAAGCAATCCG | TTTTTCCAAATCGAGTTTCGTT | 119—171 | TAM |
| 4 | Hi08e04 | GCATGGTGGCCTTTCTAAG | GTTTACCCTCTGACTCAACCCAAC | 201—234 | - |
| CH04e02 | GGCGATGACTACCAGGAAAA | ATGTAGCCAAGCCAGCGTAT | 143—163 | TAM | |
| 5 | Hi04d02 | TTCGTGGCTGAGAAAGGAGT | GTTTGTACGGTGCATTGTGAAAG | 176—238 | HEX |
| 6 | C53 | GCCACTGTGGGTTGCTTTAT | AAAACATGCTGCTGTTGGAA | 170—220 | HEX |
| 7 | Hi03a10 | GGACCTGCTTCCCCTTATTC | CAGGGAACTTGTTTGATGG | 206—290 | HEX |
| 8 | CH02g09 | TCAGACAGAAGAGGAACTGTATTTG | CAAACAAACCAGTACCGCAA | 98—138 | TAM |
| 9 | Hi23d06 | TTGAAACCCGTACATTCAACTC | GTTTCAAGAACCGTGCGAAATG | 158—188 | - |
| Hi04a05 | GGCAGCAGGGATGTATTCTG | GTTTCATGTCAAATCCGATCATCAC | 194—222 | FAM | |
| 10 | Hi05b02 | GATGCGGTTTGACTTGCTTC | GTTTCTCCAGCTCCCATAGATTGC | 120—178 | FAM |
| 11 | Hi16d02 | AACCCAACTGCCTCCTTTTC | GTTTCGACATGATCTGCCTTG | 144—177 | FAM |
| 12 | CH01d09 | GCCATCTGAACAGAATGTGC | CCCTTCATTCACATTTCCAG | 134—172 | TAM |
| 13 | GD147 | TCCCGCCATTTCTCTGC | GTTTAAACCGCTGCTGCTGAAC | 135—155 | TAM |
| 14 | CH01g05 | CATCAGTCTCTTGCACTGGAAA | GACAGAGTAAGCTAGGGCTAGGG | 140—188 | TAM |
| CH04c07 | GGCCTTCCATGTCTCAGAAG | CCTCATGCCCTCCACTAACA | 98—135 | - | |
| 15 | C4299 | TGCCAATACTCCCTCATTTACC | GTTTAAACAGAACTGCACCACATCC | 182—204 | FAM |
| 16 | Hi22f06 | CAATGGCGTCTGTGTCACTC | GTTTACGACGGGTAAGGTGATGTC | 240—246 | HEX |
| 17 | Hi02f12 | ACATGGCCGAAGACAATGAC | GTTTCAACCTTTATCCCTCCATCTTTC | 130—150 | FAM |
新窗口打开
虽然一个SSR能鉴别杂合体或纯合体,但是不足以鉴定纯系间的基因型。因此采用一组SSR标记来鉴定基因型。从20个SSR选出的17个SSR(每个连锁群一个),利用荧光毛细管电泳技术用来鉴别植株的基因型。如表2所示,根据不同的产物大小组合,这17个SSR谱(组合)完全可以把所有30个植株鉴别。比如Gala03基因型可以用SSR扩增条带176 bp-176 bp-128 bp-153 bp-221 bp-193 bp-286 bp-112 bp-196 bp-124 bp-151 bp-134 bp-142 bp-158 bp-143 bp-149 bp-237 bp序列来表示,相当于植株的条形码。这种SSR 产物序列可以用于获得的‘嘎啦’花药植株纯合体种质资源鉴定,同时也是一种分子育种标记物。另外,发现部分株系在部分位点上存在变异:即未扩增出条带,或大小与亲本不一致。比如Gala01(189 bp-140 bp-119 bp-159 bp-175 bp-193 bp-286 bp-112 bp-196 bp-177 bp-0-149 bp-142 bp-141 bp-143 bp-130 bp-244 bp)在LG10未扩增出条带(用‘0’表示),Gala02、Gala14同在LG10未扩增条带;Gala07(176 bp-140 bp-119 bp-159 bp-221 bp-193 bp-238 bp-120 bp-196/229 bp-124 bp-141 bp-134 bp-142 bp-141 bp-143 bp-149 bp-244 bp)在LG9扩增异常。上述筛出的17个SSR标记谱(组合)能同时区分鉴定每个纯合植株的基因型,30个再生株系均为不同基因型的苹果新种质。这些SSR标记(每个连锁群一个SSR标记)为后期田间嫁接育种种质资源来源及新的‘嘎啦’苹果纯合基因型种质的鉴定提供了依据。
Table 2
表2
表2‘嘎啦’花药再生植株SSR标记鉴定
Table 2Molecular examination of regenarated ‘Gala’ plantlets
新窗口打开
图4Hi12c02(LG1)PCR扩增产物用毛细管电泳荧光检测法检测结果^横坐标:扩增片段大小;纵坐标:荧光信号强度。G:‘嘎啦’供体;1-30:‘嘎啦’花药再生株系
-->Fig. 4Hi12c02(LG1) PCR fragment detected by capillary electrophoresis with fluorescence detection^ The abscissa indicates the sizes of amplified fragment and the ordinate shows the intensity of fluorescence signal. G: ‘Gala’ Heterozygote; 1-30: Regenarated plantlets of ‘Gala’ by anther culture
-->
2.5 再生株系形态学观察
表3结果显示‘嘎啦’杂合供体株高为5.67 cm(n=1),纯合二倍体平均株高2.96 cm(n=28),比纯合四倍体为1.90 cm(n=1)和单倍体为2.53 cm(n=1)略高。同时也观察到纯合二倍体长势相对于嘎啦杂合供体较弱。不同二倍体纯合植株的植物学特征也存在差异,如图5所示,Gala05植株相对较高,叶基变宽,叶尖渐尖;Gala07叶片变小、变厚,叶柄变短且基部宽大,叶色深且有很强的光泽度;Gala18叶片较小,叶数较多。Table 3
表3
表3再生株系形态学观察
Table 3Morphological charicteristics of the regenarated plantlets
| 再生株系 Regenerated plantlets | 株高 Height (cm) | 叶数 Leaf number | 叶长宽比 Ratio of length/Breadth |
|---|---|---|---|
| 嘎啦杂合供体 Heterozygote | 5.67±0.25 | 18.67±5.69 | 1.79±0.22 |
| 再生单倍体 Haploid | 2.53±0.15 | 12.33±1.53 | 1.72±0.19 |
| 再生二倍体 Diploid | 2.96±0.44 | 15.33±0.78 | 1.78±0.52 |
| 再生四倍体 Tertaploid | 1.90±0.10 | 10.00±2.00 | 1.70±0.29 |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5嘎啦花药培养再生植株的形态学观察
-->Fig. 5Morphological characteristics of regenerated plantlets
-->
3 讨论
本研究的主要目的是通过花药培养获得纯合体再生植株丰富苹果育种亲本材料。苹果单倍体育种技术,尤其用花药离体培养诱导胚状体形成纯合基因型再生植株的研究仍存在较多问题。在技术上,采用了先前优化的花药培养种技术。试验结果表明,‘嘎啦’花药培养胚状体诱导率以及再生植株率都比较低。根据前人研究,花药培养研究低胚诱导率和植株再生率受到供体基因型、取样时间、培养基成分、培养条件(如光照、温度等)等多种因素影响[27-28]。其中供体基因型是最重要的影响因子[29]。就培养条件而言,HÖFER等[30]则证明花药先于27℃暗培养适当时间后转入23℃正常光下培养能提高苹果胚诱导率。此外,低温预处理可有效提高胚诱导率[31]。本研究采用的是前期优化后的培养条件,包括在胚诱导培养基N6附加L6-BA、NAA 和活性炭等成分[22]。一般来说在花药离体培养过程中,尤其是在愈伤组织诱导阶段,再生植株染色体倍数可能发生变化[32],导致花药培养诱导形成的再生植株呈现单倍体、二倍体、多倍体和混倍体[33]。本研究的倍性分析结果和前人的研告类似。在获得的 30个花药培养再生株系,结果显示有单倍体、二倍体、四倍体,其中28株为纯合二倍体株系(93.3%)。二倍体和四倍体再生株系经过SSR鉴定均是单倍体自然加倍得到的纯合株系,这些二倍体的纯合株系可能由于单倍体细胞发生了核融合或核内加倍[34]。这种倍性多样性与HÖFER 等[29]的研究相同。
单倍体育种是获得优势亲本供体材料的最有效方法之一。花药的花药壁是杂合体细胞,同时也可能诱导成杂合二倍体的再生植株,所以获得的二倍体植株并非一定为纯合体。通过鉴定再生植株的等位基因就可以把花药培养再生植株的杂合二倍体和纯合二倍体区分开。以前的技术包括同工酶标记[35]、S等位基因[36]及SSR分子标记[18,20,23,27]都曾被应用于花药再生植株的纯合性鉴定。本研究也采用了SSR鉴定方法。首先选用的80个SSR标记(来自HISDAS)对所有的再生植株进行PCR,筛出20个可区分再生植株为纯合的SSR标记。为了进一步区分再生植株的基因型,又筛选出分布于苹果17个连锁群的17个SSR标记。这17个SSR标记能明确标记‘嘎啦’苹果不同的植株,为今后进行‘嘎啦’苹果的基因型鉴定提供了技术指标。目前选出的SSR标记是低密度的SSR标记手段,这些低密度的SSR不能完全应用到所有‘嘎啦’苹果的后代植株,因此在鉴定30个‘嘎啦’苹果花药培养再生株系时出现了个别株系没有条带的现象,今后可能会获得一些新的植株,还需要增加新的不同SSR标记来鉴定这些株系的来源,这也是SSR标记的一个普遍技术局限性。随着高通量测序技术的普及,全基因组测序的成本降低,进行全基因组范围内的测序开发SNP标记是替代SSR标记的必然趋势,近年来,一种更加快速、简易和低成本的基因分型技术GBS(Genotyping-by- Sequencing)能有效的开发大规模的SNP标记[37],结合现有的SSR技术可以在全基因组范围内快速挖掘‘嘎啦’苹果的基因资源。
研究表明,花药再生植株的植物学特征呈现多样化。单倍体育种所获纯合植株虽然失去了杂种优势,出现不同程度返祖现象,其价值在于可作为遗传研究的基础材料,后代杂交种也许会表现出更强的杂种优势。而纯合二倍体之间的差异源于花粉母细胞减数分裂时(在不发生交换的情况下)非同源染色体(非等位基因)自由组合,应有217个基因重组类型,加之培养过程中可能诱导基因突变,使花药培养后代的表型差异显著,遗传变异类型较常规杂交后代更丰富[2]。再生植株的植物学特征也应证了这些发现。对花药培养试管苗的叶形、株高、叶长、叶宽等的评价结果显示,不同倍性的再生植株差异显著;即使同为纯合二倍体再生植株,其植物学性状也有差异。通常来看杂合供体的生长优于单倍体以及其他倍性植株[38]。从育种和生产实践而言,苹果以二倍体和三倍体的生长势最强。对再生植株组培苗的植物学观察同样发现,无论是纯合二倍体或者其他倍性植株长势均弱于杂合供体植株,这是因为丧失了杂种优势。当然,观察的是组培苗,植株育性有待于后期进一步观察。
4 结论
获得了30个‘嘎啦’花药再生株系并用SSR标记对每个植株进行了基因型鉴定,早期的植物学观察显示再生株系株高、叶长、叶宽等呈现多样性。鉴于苹果基因型高度杂合,生长周期长,苹果花药培养植株获得率极低,获得的再生株系以及SSR鉴定体系对分析鉴定‘嘎啦’优良性状基因研究,田间嫁接、杂交育种,以及表型-基因型关联分析具有重要意义。The authors have declared that no competing interests exist.
