0 引言
【研究意义】小麦禾谷孢囊线虫(Heterodera avenae)是一种严重危害小麦(Triticum aestivum)、大麦(Hordeum vulgare)和燕麦(Avena sativa)等禾谷类作物的重要病原线虫[1]。自1874年在德国首次发现后,现已在全球40多个国家和地区发生与危害[2]。中国1989年在湖北省天门县岳口镇首次发现该病原线虫[3],随着农业机械化和小麦跨区联合收割,小麦孢囊线虫病发生范围迅速扩大,危害程度日趋严重,目前已扩散至全国16个省(市、自治区)的小麦种植区[4],对小麦等麦类作物的生产造成了严重的经济损失[5]。研究表明,由植物线虫食道腺细胞产生、并通过口针穿刺分泌到寄主植物组织中的纤维素酶、果胶酸裂解酶等一系列细胞壁降解酶类,在线虫的侵染过程中,能够降解和软化细胞壁,从而有利于线虫的寄生和迁移[6]。对重要的细胞壁降解酶——果胶酸裂解酶(pectate lyase,PEL)基因进行克隆和表达特性分析,可为后续探究Ha-pel-1的基因功能及其与寄主的互作机制提供理论依据,为从基因和蛋白水平上对禾谷孢囊线虫进行防治打下基础。【前人研究进展】2000年,POPEIJUS等首次从马铃薯金线虫(Globodera rostochiensis)中发现果胶酸裂解酶基因[7],随后陆续从大豆孢囊线虫(Heterodera glycines)、甜菜孢囊线虫(H. schachtii)、马铃薯金线虫、根结线虫(Meloidogyne spp.)、松材线虫(Bursaphelenchus xylophilus)和燕麦真滑刃线虫(Aphelenchus avenae)等多种植物线虫中分离获得该基因[8-16]。基因组数据分析预测显示,松材线虫、北方根结线虫(M. hapla)、南方根结线虫(M. incognita)分别含有15、22和30个果胶酸裂解酶基因[17-19]。在大豆孢囊线虫研究中,先后发现了两类结构和功能具有显著差异的果胶酸裂解酶基因,BAKHETIA等[20]和PENG等[10]先后采用RNAi技术沉默了大豆孢囊线虫的两个果胶酸裂解酶基因(Hg-pel-1和Hg-pel-6),结果发现,当Hg-pel-1被沉默后,大豆孢囊线虫在寄主体内的雌雄比发生变化,但是对侵染寄主根系的线虫数量没有影响;而沉默Hg-pel-6后,寄主根系内的线虫数量和雌成虫数均明显下降,说明两类结构和功能不同的果胶酸裂解酶在线虫侵染过程发挥着不同的作用。【本研究切入点】在前期研究中,禾谷孢囊线虫中已分离克隆出多个与植物细胞壁降解相关的β-1,4-内切葡聚糖酶基因(β-1,4-endoglucanase gene)[21-22]、扩展蛋白基因(expansion gene)[23-24]和纤维素结合蛋白基因(CBP)[25],但关于果胶酸裂解酶的研究未见报道。【拟解决的关键问题】从禾谷孢囊线虫中克隆获得一个果胶酸裂解酶基因,对其序列特征、表达部位和发育动态进行系统研究,为进一步解析该类基因的功能打下基础。1 材料与方法
试验于2015年9月至2016年12月在中国农业科学院植物保护研究所完成。1.1 线虫材料
含有禾谷孢囊线虫成熟孢囊的土样采集于河南省濮阳市南乐县。采用蔗糖离心法分离获得孢嚢,并将挑取的孢囊在4℃条件下保存8周以上,然后放于16℃条件下中孵化2龄幼虫[26],参考亓晓莉等[27]方法,挑取单条线虫进行分子检测,确定为禾谷孢囊线虫后,将其他2龄幼虫接种到感病寄主小麦温麦19的根系中,进行扩大培养,从根系和土壤中再次分离出来的孢囊,在4℃低温刺激后,16℃孵化2龄幼虫用于下一步研究。1.2 试剂
Trizol Reagent、SuperScriptTM First-strand Synthesis System for RT-PCR反转录试剂盒、5′ RACE System for Rapid Amplification of cDNA Ends Version 2.0 Kit、Dynbeads® mRNA DIRECTTM Kit购自Invitrogen公司;3′-Full RACE Core Set Ver.2.0购自TaKaRa公司;DIG High Prime DNA Labeling and Detection Starter Kit I、PCR DIG Probe Synthesis Kit、蛋白酶K购自Roche公司;RQ1 RNase-Free DNase、pGEM-T easy vector购自Promega公司;DNeasy Blood & Tissue Kit购自QIAGEN公司;DNA Marker、DH5α感受态细胞、凝胶回收试剂盒购自北京天根生化有限责任公司;其他常规试剂购自Sigma等公司。1.3 方法
1.3.1 核酸提取 收集新鲜孵化的禾谷孢囊线虫2龄幼虫置于1 mL的Trizol溶液中,参考彭焕等[28]方法提取总RNA,总RNA用RQ1 RNase-Free DNase进行去DNA处理,纯化后产物置于-80℃保存。第一链cDNA的合成使用Invitrogen公司的SuperScriptTM First-Strand Synthesis System for RT-PCR试剂盒,反转录产物置于-20℃保存。参照DNeasy Blood & Tissue Kit试剂盒说明书提取禾谷孢囊线虫基因组DNA。1.3.2 RACE 扩增3′端和5′端序列 根据已报道的植物寄生线虫果胶酸裂解酶蛋白序列,参照TaKaRa公司3′-Full RACE Core Set Ver.2.0试剂盒引物设计说明,采用Primier 5.0软件,设计3′ RACE反应的简并引物(JPL-O和JPL-I,表1),以2龄幼虫总RNA为模板,进行3′末端扩增,具体步骤参照试剂盒说明书,然后对扩增片段进行回收、连接、转化、送生工生物工程(上海)股份有限公司进行测序。再根据已测序获得的基因3′末端片段序列,参考Invitrogen公司5′ RACE System for Rapid Amplification of cDNA Ends,Version 2.0 Kit试剂盒引物设计说明,设计Ha-pel-1的5′ RACE特异引物(GSP-PL1、GSP-PL2和GSP-nPL4,表1),以2龄幼虫总RNA为模板,进行5′末端扩增,具体步骤参照试剂盒说明书,对扩增片段进行回收、连接、转化、测序。
1.3.3 cDNA全长和基因组DNA克隆 根据已测序获得的基因cDNA拼接全长序列,设计全长引物(PEL-L1和PL-LA2,表1),以第一链cDNA和基因组DNA为模板,分别进行PCR扩增。反应参数:94℃预变性5 min;94℃变性30 s,50℃退火30 s,72℃延伸2 min;35个循环;72℃延伸10 min;对扩增片段进行回收、连接、转化、测序。
1.3.4 序列分析 分别使用DNAMAN和Clustal软件进行核苷酸序列的翻译和氨基酸序列的比对分析,使用在线工具(http://www.expasy.ch/tools/ pi_tool.html/)进行蛋白质等电点和分子量的预测,使用SignalP 4.0 Server(http://www.cbs.dtu.dk/services/ SignalP/)预测蛋白质前体信号肽[29],使用CBS Prediction Servers(http://www.cbs.dtu.dk/services/)对氨基酸序列中可能存在的糖基化位点和磷酸化位点进行预测,使用基因内含子分析工具(http://gsds.cbi.pku. edu.cn/)分析基因组结构[30],使用MEGA 5.0构建系统进化树[31]。
1.3.5 原位杂交 原位杂交方法参考DE BOER等[32]的方法进行,收集新孵化的禾谷孢囊线虫2龄幼虫用DEPC水清洗3次,4%多聚甲醛固定24 h,用手术刀将虫体切断后,采用甲醇和丙酮进行通透,蛋白酶K进行消化,再用1倍杂交液重悬并置于-20℃保存。根据Ha-pel-1全长序列设计特异性引物Yw-F和Yw-R(表1),以cDNA第一链为模板加入DIG标记的dNTP进行正、负链探针合成。将合成的DIG标记探针与预处理的禾谷孢囊线虫参考DIG High Prime DNA Labeling and Detection Starter Kit Ⅰ说明书进行杂交和洗脱,停止显色后,在Leica DM2500显微镜下进行观察拍照。
1.3.6 发育表达分析 参考LONG等[22]方法,通过控制接种时间结合酶裂解处理分离获得5种不同发育阶段的禾谷孢囊线虫(侵染前2龄幼虫、侵染后2龄幼虫、3龄幼虫、4龄幼虫和雌虫)。采用Dynbeads® mRNA DIRECTTM Kit提取不同龄期禾谷孢囊线虫mRNA,并取等量mRNA(200 ng)分别反转录合成第一链cDNA。分别以5个不同发育阶段线虫的第一链cDNA和小麦根系的第一链cDNA为模板,采用Ha-pel-1特异引物RT-F和RT-R(表1)进行PCR 扩增,30个循环,同时以引物ActinF和ActinR(表1)扩增禾谷孢囊线虫的actin作为阳性对照。扩增产物在1.5%琼脂糖凝胶中电泳分离检测。
Table 1
表1
表1本研究中的引物序列
Table 1Primer sequences used in this study
| 引物Primer | 序列 Sequences (5′-3′) |
|---|---|
| JPL-O | KSGYGYKCDTGYGGNAAYTGY |
| JPL-I | KSVSYBAAYKMVAAYTAYGGYGAY |
| GSP-PL1 | CAGATTCGGTTGGTTT |
| GSP-PL2 | TGTGGGCGTCAAAGAAGCGAAAGAAGTG |
| GSP-nPL4 | AGTCAGTCCCGAAATGTATGCTT |
| PEL-L1 | CCATTGATTTTGAAGTAAAAGAAAGGGC |
| PL-LA2 | GGCAATTTGAATTGACGAAGCACAGTAT |
| Yw-F | CCGGCAGACGAAAATTGCTT |
| Yw-R | AGCGCCACCCAGTATTTGAT |
| RT-F | GGCCAAGGCACACCAGATAA |
| RT-R | GGGCGTCAAAGAAGCGAAAG |
| ActinF | CCGTGACCTGACTGACTACCTG |
| ActinR | GTCGTTGGTCTTCTCCTCCTTT |
新窗口打开
2 结果
2.1 核酸提取及Ha-pel-1克隆
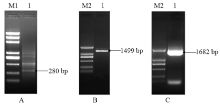
采用Trizol法提取的禾谷孢囊线虫2龄幼虫总RNA,电泳分离检测可见总RNA的28S、18S和5S 3条清晰的带,其OD260/280值为1.9—2.0,说明蛋白质和DNA去除较彻底,RNA纯度较高,可以用于后续试验。电泳检测提取的禾谷孢囊线虫基因组DNA,获得大小为23 kb左右的完整条带,无拖尾和降解,完整性较好,可用于下游试验。通过同源克隆策略,采用3′ RACE技术扩增获得长度为280 bp的禾谷孢囊线虫果胶酸裂解酶基因Ha-pel-1 cDNA 3′末端片段(图1-A),BLAST比对分析表明,该片段与已报道的线虫果胶酸裂解酶基因具有较高的同源性。在此基础上,采用5′ RACE技术获得长度为1 499 bp的Ha-pel-1 cDNA 5′末端片段(图1-B)。为验证拼接序列的准确性,采用全长引物从禾谷孢囊线虫cDNA模板中扩增获得到长度1 682 bp,包含完整ORF的cDNA全长序列(图1-C);采用分步克隆和序列拼接,从禾谷孢囊线虫基因组DNA中扩增获长度为7 199 bp的Ha-pel-1基因组全长。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1Ha-pel-1 3′端序列(A)、5′端序列(B)、cDNA全长(C)的PCR扩增产物电泳
1:PCR产物Product of PCR;M1:DL 2000 plus Marker;M2:DL 2000 Marker
-->Fig. 1Agarose gel electrophoresis of PCR product of cDNA 3′ terminal (A), 5′ terminal (B), cDNA (C) sequence of Ha-pel-1
-->
2.2 Ha-pel-1序列分析
序列分析结果表明,Ha-pel-1(GenBank登录号GQ998895)cDNA全长为1 717 bp(不包含多聚腺苷酸尾)(图2),其中5′端非编码区(UTR)为98 bp,3′端非编码区为56 bp,开放阅读框为1 563 bp,编码一个长度为521个氨基酸残基的蛋白,其理论分子量为57.5 kD,理论等电点为8.52。SignalP预测发现,Ha-PEL-1蛋白N端含有一个长度为20个氨基酸残基的信号肽,剪接位点在Gly20和Arg21之间。糖基化位点预测显示,该蛋白在Asn38存在一个N位糖基化位点。基因结构显示分析发现,Ha-pel-1基因组含有14个外显子和13个内含子,除第3个内含子的剪接位点为GC-AG外,其余12个内含子都符合真核生物基因剪接位点GT-AG规则,其中相位0的内含子有5个,相位1的内含子有6个,相位2的内含子有2个。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2Ha-pel-1基因组DNA结构分析
-->Fig. 2Structural analysis of Ha-pel-1 genome DNA
-->
2.3 Ha-PEL-1氨基酸序列分析及系统进化分析
NCBI中BLASTp比对分析发现,Ha-PEL-1预测蛋白C端的247个氨基酸残基与已报道的大豆孢囊线虫果胶酸裂解酶HG-PEL-1、甜菜孢囊线虫HS-PEL-1均有67%的一致性和83%的相似性,与大豆孢囊线虫HG-PEL-2和马铃薯孢囊线虫GR-PEL-1的相似性分别为82%和81%;其N端信号肽后的254个氨基酸残基与GenBank蛋白数据库中的蛋白无相似性,而与RCSB Protein Data Bank比对后发现,这段氨基酸序列后70个氨基酸残基(Lys205—Glu274)与RCSB蛋白质数据库中韦塞尔斯布朗病毒NS5蛋白(注册号3ELD)甲基转移酶区域的71个氨基酸残基具有32%的一致性和47%的相似性。多序列比对和保守结构域分析表明,预测蛋白Ha-PEL-1具有果胶酸裂解酶第3家族(PL3)的4个保守区域和多个保守的半胱氨酸残基,同时,在Ha-PEL-1上发现一个带负电荷的保守天冬氨酸和两个带正电荷的保守赖氨酸,可以确定Ha-PEL-1是果胶酸裂解酶第3家族的新成员。
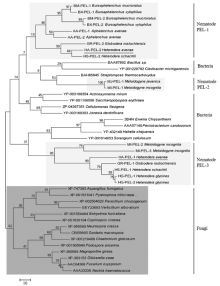
采用ME法构建了Ha-PEL-1及42个已报道的植物线虫、真菌和细菌来源的果胶酸裂解酶的系统发育树。结果显示,所有植物线虫来源的果胶酸裂解酶聚为3个独立的分支,其中燕麦滑刃线虫AA-PEL-1和AA-PEL-2、松材线虫BX-PEL-1和BX-PEL-2、拟松材线虫(B. mucronatus)BM-PEL-1和BM-PEL-2、马铃薯孢囊线虫HG-PEL-2、甜菜孢囊线虫HS-PEL-2和大豆孢囊线虫HG-PEL-5聚为一个分支,命名为Nematode PEL-1;南方根结线虫MI-PEL-1和爪哇根结线虫(M. javanica)MJ-PEL-1聚在另一个分支,命名为Nematode PEL-2;而禾谷孢囊线虫Ha-PEL-1与大豆孢囊线虫HG-PEL-1和HG-PEL-2、甜菜孢囊线虫HS-PEL-1、马铃薯孢囊线虫GR-PEL-1、南方根结线虫MI-PEL-2和MI-PEL-3聚为一个分支,命名为Nematode PEL-3。其中第1分支Nematode PEL-1和第2分支Nematode PEL-2又与芽孢杆菌(Bacillus sp.)、番茄细菌性溃疡病菌(Clavibacter michiganensis)等的果胶酸裂解酶聚在一个大分支上,第3分支Nematode PEL-3与菊欧式杆菌(Erwinia chrysanthemi)、纤维堆囊菌(Sorangium cellulosum)等细菌聚为一支(图3)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3线虫、真菌和细菌来源的果胶酸裂解酶系统进化分析
浅色部分:线虫PEL;深色部分:真菌PEL;无底色部分:细菌PEL;下划线:Ha-PEL-1
-->Fig. 3Phylogenetic analysis of pectate lyases from nematode, fungal or bacterial origin
The clusters of nematode proteins were marked in light grey, whereas fungi clusters were in dark grey. The remaining sequences were from bacterial. The protein Ha-PEL-1 was underlined
-->
2.4 Ha-pel-1组织定位
采用原位杂交方法明确了Ha-pel-1在禾谷孢囊线虫中的表达部位。地高辛标记的负链探针杂交结果表明,在禾谷孢囊线虫的两个亚腹食道腺细胞中有明显杂交信号(图4-A),而作为对照的正链探针无杂交信号(图4-B),由此确定Ha-pel-1在禾谷孢囊线虫的亚腹食道腺细胞中特异表达。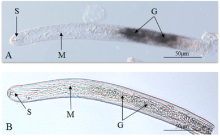 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4Ha-pel-1的组织定位
A:Ha-pel-1负链探针杂交 In situ hybridization of digoxigenin-labelled antisence probes of Ha-pel-1;B:Ha-pel-1正链探针杂交 In situ hybridization of digoxigenin-labelled sence probes of Ha-pel-1;S:口针 Stylet;M:中食道球 Metacorpus;G:亚腹食道腺 Subventral oesophageal gland region
-->Fig. 4Tissue localization of Ha-pel-1 mRNA
-->
2.5 Ha-pel-1发育表达分析
采用半定量RT-PCR方法对Ha-pel-1在禾谷孢囊线虫5个不同发育阶段中的表达差异进行了分析。结果表明,Ha-pel-1主要在禾谷孢囊线虫寄生前2龄幼虫和寄生后2龄幼虫中表达,而在寄生后期和雌成虫中表达量很低甚至检测不到,actin内标基因在各个龄期中均有表达,在小麦根系DNA的阴性对照中未检测到Ha-pel-1和Ha-actin的表达(图5)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5禾谷孢囊线虫Ha-pel-1在不同发育阶段的表达分析
1:侵染前2龄幼虫 Pre-parasitic 2nd stage juveniles;2:侵染后2龄幼虫 Parasitic 2nd stage juveniles;3:3龄幼虫 Parasitic 3rd stage juveniles;4:4龄幼虫 Parasitic 4th stage juveniles;5:雌虫 Adult females;6:阴性对照 Negative control
-->Fig. 5Expression of Ha-pel-1 at different life stages of H. avenae
-->
3 讨论
植物细胞壁是寄主植物抵御外界病原物侵染的物理屏障,其主要成分为纤维素、果胶质和半纤维素等,降解和软化植物细胞壁是植物线虫成功侵染和寄生的关键。目前的研究结果表明,植物线虫能从食道腺细胞中分泌一系列的细胞壁修饰酶类,共同作用于植物细胞壁,从而利于线虫侵染和寄生[6,33-34],其中果胶酸裂解酶在植物细胞壁降解过程中发挥着不可替代的作用。本研究从禾谷孢囊线虫中分离出一个果胶酸裂解酶基因Ha-pel-1,并对其序列结构、系统进化关系及表达特性进行了系统研究。结构域分析发现,Ha-PEL-1氨基酸序列C端有一个长度为247个氨基酸残基的果胶酸裂解酶区域,比报道的其他植物寄生线虫果胶酸裂解酶氨基酸序列多出一段长度为250个氨基酸左右的序列。这段序列中,靠近N端的184个氨基酸残基与数据库中的蛋白均无相似性,而靠近C端有70个氨基酸残基与韦塞尔斯布朗病毒NS5蛋白(注册号3ELD)的甲基转移酶区域有32%的一致性和47%的相似性。韦塞尔斯布朗病毒是一种危害人类的病毒,其NS5蛋白参与了病毒复制,该蛋白的甲基转移酶区域能够参与RNA的加帽反应,催化RNA的甲基化[35]。到目前为止,在其他病原线虫的果胶酸裂解酶中均未发现该结构域。在Ha-PEL-1中,果胶酸裂解酶结构域与类似甲基转移酶结构域结合在一起,该段与韦塞尔斯布朗病毒NS5蛋白具有相似性的氨基酸序列是否也具有甲基转移酶功能,有待于今后进一步研究。
序列同源比对结果显示,禾谷孢囊线虫Ha-PEL-1与大豆孢囊线虫HG-PEL-1、HG-PEL-2,甜菜孢囊线虫HS-PEL-1和马铃薯孢囊线虫GR-PEL-1的相似度高达81%—83%;进化分析也发现上述果胶酸裂解酶序列被聚类到同一个分支中,连同南方根结线虫MI-PEL-2和MI-PEL-3,聚为线虫果胶酸裂解酶的第3分支Nematode PEL-3;两个根结线虫果胶酸裂解酶聚在一起单独形成线虫果胶酸裂解酶的第2分支Nematode PEL-2;其他的线虫果胶酸裂解酶则聚为第1分支Nematode PEL-1,推测这些植物线虫PEL可能具有3个不同的进化起源。此外,这3个线虫果胶酸裂解酶进化分支均与细菌或真菌来源的果胶酸裂解酶聚在一起,在植物寄生线虫的其他细胞壁降解酶中也曾发现类似现象,如纤维素酶和扩展蛋白等[36],由上述结果推测植物线虫PEL的起源可能与其他微生物的基因水平转移有关,而植物寄生线虫分泌细胞壁降解酶也正是线虫与真菌和细菌之间存在基因水平转移的重要证明[36]。综上所述,本研究结果为植物寄生线虫果胶酸裂解酶的起源过程提供了新的依据。
原位杂交结果发现,Ha-pel-1在禾谷孢囊线虫的亚腹食道腺细胞中特异表达,这与其他的植物寄生线虫的PEL,如HG-PEL-1和HG-PEL-2、HS-PEL-1和HS-PEL-2、GR-PEL-1等的表达部位一致[7-16],此外,Ha-PEL-1蛋白N端具有信号肽,推测Ha-PEL-1是由禾谷孢囊线虫亚腹食道腺细胞合成,并通过口针分泌到寄主体内;同时,禾谷孢囊线虫亚腹食道腺细胞也是其他细胞壁降解酶类的合成场所[21-24]。
突破植物细胞壁的物理屏障是植物线虫成功寄生的关键,在禾谷孢囊线虫侵染过程中,食道腺细胞会分泌一系列细胞壁降解酶类如果胶酸裂解酶、β-1,4-内切葡聚糖酶[21-22]和扩展蛋白[23-24]等分泌物,协同口针穿刺的机械压力来完成对寄主的侵染和早期寄生。禾谷孢囊线虫Ha-pel-1在5个不同龄期的表达分析显示,该基因在寄生前2龄幼虫和寄生后2龄幼虫中大量表达,在寄生后期和雌成虫中表达量非常低或者不表达;LONG等研究发现禾谷孢囊线虫β-1,4-内切葡聚糖酶Ha-eng-1a、Ha-eng-2和Ha-eng-3及扩展蛋白Ha-EXPB1、HaEXPB2也均在侵染和寄生早期大量表达,由此推测Ha-pel-1可能在禾谷孢囊线虫侵染植物寄主的过程中与上述两类蛋白共同发挥作用[21-24]。
本研究从禾谷孢囊线虫中克隆获得一个果胶酸裂解酶基因Ha-pel-1,并对其序列特征、组织定位和发育表达进行了系统分析,结果可为明确Ha-pel-1在禾谷孢囊线虫与寄主互作过程中的功能研究打下基础,并为探究植物寄生线虫果胶酸裂解酶的起源提供了新的证据,后续将利用RNAi等技术,进一步对Ha-pel-1
进行功能验证;此外,Ha-PEL-1中与韦塞尔斯布朗病毒NS5蛋白甲基转移酶区域相似的氨基酸序列是否也具有甲基转移酶功能,仍有待进一步研究。
4 结论
从禾谷孢囊线虫中克隆获得一个新的果胶酸裂解酶基因Ha-pel-1,该基因cDNA全长1 717 bp,编码一个长度为521个氨基酸残基的蛋白Ha-PEL-1;Ha-pel-1基因组全长为7 199 bp,包含14个外显子和13个内含子。对其序列特征和表达特性进行系统研究表明,在Ha-PEL-1中,类似甲基转移酶结构域与果胶酸裂解酶结构域结合在一起;Ha-PEL-1属于果胶酸裂解酶第3家族,根据进化分析推测其起源可能与其他微生物的pel基因水平转移有关;Ha-pel-1主要在禾谷孢囊线虫寄生前和寄生后的2龄幼虫的亚腹食道腺中大量表达,揭示该基因与禾谷孢囊线虫的侵染和寄生过程密切相关。The authors have declared that no competing interests exist.
