0 引言
【研究意义】山西省地处华北西部的黄土高原东翼,海拔在1 000—2 000 m不等,全省年降水量在400—650 mm[1],降水少且在时空上分布不均,素有十年九旱之说[2],土壤贫瘠,农作物的长势不理想。藜麦(Chenopodium quinoa Willd)于2010年在山西静乐县引种成功,由于其耐寒、耐旱[3]、耐瘠薄、耐盐碱[4-5],具有良好的抗逆性,可以应对多变不良的环境[6],因而适合旱地生存。藜麦营养价值丰富[7],蛋白质含量高达16%—22%[8],且蛋白质富含氨基酸且种类丰富,含量配比均衡,适应人类营养需求[9-10],已经受到国内外营养学家和农学家的重视[11-12]。然而作为粮食作物,藜麦的“适种性”并不理想,适合它高产的环境极为有限。如何在山西推广藜麦大面积种植,获得高产高质藜麦,对藜麦种植的深层次研究意义深远。【前人研究进展】水资源短缺匮乏是旱地农业的主要限制因子[2],其次土壤肥力低同样是旱地农业的关键限制因素,贫瘠的土地限制了水分转化效率从而影响农业生产。研究表明,磷能促进作物根系发达,增强抗寒抗旱能力[13],还能促进作物增产[14]、作物成熟、穗粒增多及籽粒饱满[15],而水分是作物生长的必要条件,也是溶解肥料的良好溶剂,对养分的运输起到重要作用,水肥之间的合理互作直接关系到作物的正常生长。有关水磷耦合对小麦的研究表明,磷素的增加促进特殊根毛的生长、根系直径的加粗,且自然降水与高磷处理组合最优,根系生长最好[16]。对冬小麦的研究表明在相同水分条件下,施磷可以提高小麦抗旱性,在拔节期,高磷素水平与轻度水分胁迫组合能有效地从形态与生理代谢两方面表现响应策略,提高生长适合度,从而提高水分利用效率,增强抗旱能力[17]。水分与磷肥对玉米苗期根系的研究表明,水分亏缺与过量灌水均不利于磷素的吸收,反而轻度水分胁迫促进根系的生长,适量的灌水提高了磷肥的吸收利用率,适当的水磷耦合配比可以达到水磷协同效应[18]。藜麦灌水施肥的研究主要集中于藜麦的农艺性状,有研究表明,藜麦耐旱,苗期需预防过度积水,严格计算播种墒情,一般播种前需灌溉,生长中后期需排水。藜麦耐瘠薄,施肥量不宜太多,一般播种前底肥深施,中后期不宜追肥过多,避免后期植株倒伏[19]。前人对藜麦的水肥研究并没有将水肥进行耦合,且目前将水分与磷素耦合的研究不多见,而水磷耦合对其他作物的研究很多。如刘明[20]、于亚军[21]对春小麦的研究表明,适当的水磷配比可以促进春小麦的生长和产量的形成,达到“以水促磷”和“以磷促水”。【本研究切入点】结合藜麦的需水需肥规律,在适宜的水磷条件下进行耦合,发挥水磷协同效应,对藜麦在旱薄并存的黄土高原上种植具有一定的参考价值。【拟解决的关键问题】本研究以藜麦为研究对象,结合半干早地区土壤水分状况的实际特征,采用盆栽试验,对藜麦整个生长期进行水磷耦合处理,选取显序期(植株显穗到开花:此时植株营养器官基本建成)进行生物量分配、根系形态生理指标的测定;以及成熟期(80%以上的籽粒变硬:是植株生长期的最终阶段)产量的测定[19],研究藜麦在不同水磷耦合条件下的生理生态学适应特征,探明适合藜麦高产的水磷配比,从而为旱地农业藜麦高产提供理论依据。1 材料与方法
1.1 试验材料
采用上口径 27.5 cm、下口径 19.5 cm、高25.5 cm的塑料花盆进行盆栽试验,每盆装风干土10 kg。供试土壤采用距离地表3 m以下养分含量较低的生土,土壤理化性质为田间持水量22.3%,有机质2.32 g·kg-1,全氮0.07 g·kg-1,速效磷 2.1 mg·kg-1,速效钾91 mg·kg-1,pH 7.8。供试材料为藜麦品种亿隆2号,于2015年从山西忻州亿隆藜麦科技推广有限公司购得,贮存于纸袋中,室温(20—25℃)下通风保存。供试肥料为分析纯试剂硝酸铵(含N 35%)、过磷酸钙(含 P2O5 15%)和氯化钾(含 K2O 52%)。1.2 试验设计
试验于2015年5月至10月在山西师范大学试验遮雨棚内进行,采用完全随机设计,设置灌水量(W)和施磷量(P)两个因素,灌水量设3个水平,分别为重度干旱胁迫W1(土壤含水量为田间持水量的35%—45%),中度干旱胁迫W2(土壤含水量为田间持水量的55%—65%),正常水分供应W3(土壤含水量为田间持水量的75%—85%);施磷量设4个水平,按P2O5含量计算依次为P0:0、P1:0.1 g·kg-1、P2:0.2 g·kg-1、P3:0.4 g·kg-1,共12个处理,每个处理6次重复,共种72盆。另分别施硝酸铵(N:0.2 g·kg-1)和氯化钾(K2O:0.2 g·kg-1),所有肥料均作为基肥一次性施入。选取大小一致,籽粒饱满的种子,浸种12 h后,采用撒播方式播种(5月15日),每盆均匀播24粒种子,覆土3 cm,播种后等量浇水,待幼苗长到两叶一心(5月30日)时每盆定苗5株,定苗2 d后,采用称重补水法控制水分,于每天17:00用电子秤称重,使田间持水量处于设定水平。于显序期(7月17日)取3次重复收苗,收苗时用水将盆土浸满,然后连土带苗轻轻取出,用流水冲至土与苗分离,迅速带回实验室进行植株生物量、根系形态指标与根系抗逆生理指标的测定;于成熟期(9月17日)进行产量的测定。1.3 指标测定方法
根系最大根长用直尺测量,根系形态指标(根系表面积,根系总体积,总根长,根系直径)采用英国产Delta-T SCAN 根系分析系统测定。根系活力采用TTC法[22],根系POD活性采用愈创木酚比色法测定[22],根系SOD活性采用氮蓝四唑法测定[22],根系MDA含量采用硫代巴比妥酸法测定[22],根系可溶性糖含量采用蒽酮比色法测定,根系脯氨酸含量采用酸性茚三酮法测定[22]。植株生物量测定:分别将植株根、茎与叶装于纸袋中,于105℃杀青24 h,75℃烘干48 h至恒重,用直接法分别称量。
产量测定:每个处理选取植株顶穗,测量顶穗形态(穗长与穗宽),计算穗面积(穗长×穗宽),直接测量法测定顶穗小穗数与顶穗粒数;植株分枝数与穗数直接计数;千粒重测定方法为从不同水磷处理收获的种子中抽取1 000粒称重;单株粒重取单株藜麦所收获种子总数,用电子天平称重。各指标均设3次重复,取平均值。
1.4 数据分析
用SPSS 17.0统计分析软件进行数据分析,对不同水磷处理下的根系形态指标、根系抗逆生理指标、植株生物量和产量均采用单因素方差分析法(One-way ANOVA),多重比较采用最小差异显著法(LSD),Origin8.5作图。2 结果
2.1 水磷耦合对藜麦根系生长的影响
2.1.1 对藜麦根系形态指标的影响 不同水磷处理对藜麦根系形态指标影响不同。在同一水分条件下,根系表面积、根体积、根系总长度、最大根长和根系直径均随着施磷量的增加呈现先增大后减小的趋势,均在P2水平达到峰值,且均显著高于P0处理,表明适宜的磷素供给可以促进根系的生长(表1)。在相同施磷水平下,根系不同指标随水分的增多呈现不同的变化趋势。低磷(P0、P1)水平下,根系表面积随着水分的增加先增大后减小,均在中度干旱(W2)下表面积达到最大,表明低磷胁迫下,中度水分胁迫有利于根系表面积的增加;高磷(P2、P3)水平下,根系表面积随着水分的增加显著增大,在正常灌水(W3)达到最大,表明高磷条件下,水分的充足供给促进根系的生长,增加根系表面积。根系总长度和最大根长均随着水分的增加先增大后减小,均在中度干旱(W2)根长达到最长,且显著高于重度干旱(W1),表明适当的水分胁迫有利于根系的伸长生长。根系直径与根系体积均随着水分的增加逐渐增大,正常灌水(W3)达到最大,较W1显著增加,表明水分的充足供给促进根系的加粗生长,从而增大根系体积(表1)。
Table 1
表1
表1水磷耦合对藜麦根系生长的影响
Table 1Effect of water and phosphorus coupling on the development of root system of quinoa
| 处理 Treatment | 根表面积 Root area (cm2) | 根系体积 Root volume (mL) | 总根长 Total root length (cm) | 最大根长 Maximum length of root (cm) | 根系平均直径 Root average diameter (mm) |
|---|---|---|---|---|---|
| W1P0 | 23.71±2.50e | 3.5±0.26g | 2183.1±126.5g | 13.66±0.66f | 0.44±0.01e |
| W1P1 | 31.16±2.40de | 5.46±0.14f | 3282.4±219.9f | 18.45±0.87d | 0.49±0.01d |
| W1P2 | 50.13.±6.40c | 5.65±0.31ef | 5628.7±210.0d | 20.65±1.22cd | 0.50±0.02d |
| W1P3 | 25.30±2.85e | 3.90±0.12g | 5260.5±600.1d | 18.23±1.06e | 0.46±0.01e |
| W2P0 | 34.36±4.69d | 4.84±0.30fg | 4262.1±70.73e | 17.41±0.55de | 0.46±0.03e |
| W2P1 | 62.42±4.07b | 6.60±0.37e | 7067.4±45.45b | 21.37±1.03c | 0.52±0.02cd |
| W2P2 | 64.72±5.56b | 9.12±0.59c | 8001.5±211.2a | 27.46±0.96a | 0.59±0.01a |
| W2P3 | 37.61±1.86d | 8.96±0.81cd | 7150.2±306.6b | 23.63±1.04b | 0.52±0.02cd |
| W3P0 | 32.01±3.41e | 7.98±0.15d | 4240.8±133.8e | 16.48±1.12e | 0.51±0.01d |
| W3P1 | 55.21±8.35c | 14.12±0.47a | 6476.8±373.0c | 18.24±0.95de | 0.54±0.01bc |
| W3P2 | 80.47±5.55a | 14.24±0.82a | 7452.2±382.3b | 19.12±1.57d | 0.56±0.01b |
| W3P3 | 63.37±5.72b | 11.42±1.35b | 6433.6±294.0c | 11.42±1.35g | 0.53±0.01d |
新窗口打开
2.1.2 对藜麦根系活力的影响 不同水磷处理均对藜麦根系活力影响显著(P<0.05)。在相同水分条件下,根系活力随着施磷量的增加先增高后降低。在重度干旱(W1)下,根系活力在P1磷素水平下达到最大,且显著高于其他磷处理;在中度干旱(W2)和正常灌水(W3)下,根系活力均在P2水平下达到最大。在相同施磷水平下,随着水分的增加,根系活力显著增大,表明水分的增加可以提高藜麦植株的根系活力(图1)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1水磷耦合对藜麦根系活力的影响
-->Fig. 1Effect of water and phosphorus coupling on root activity of quinoa
-->
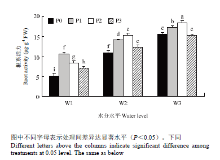
2.1.3 对藜麦根系SOD、POD活性和MDA含量的影响 在相同水分条件下,随着施磷量的增加,根系POD、SOD活性总体呈先增高后降低的趋势(图2),且均在磷素达到P2水平时,活性达到最大,表明适当的磷素供给可以提高植物抗氧化酶活性,增强抗氧化力。在相同施磷水平下,随着水分的增多,植物干旱得到缓解,POD、SOD活性均显著降低,在正常灌水(W3)下最低。
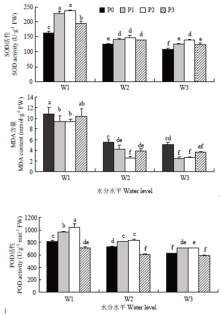 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2水磷耦合对藜麦根系 SOD、POD 活性和 MDA含量的影响
-->Fig. 2Effects of water and phosphorus coupling on SOD activity, POD activity, MDA content of quinoa root
-->
在重度干旱(W1)下,随着施磷量的增加,藜麦根系MDA含量在P1、P2水平较P0水平显著降低13.76%、13.96%,P3水平较P0水平降低4.14%,差异不显著;在中度干旱(W2)下,随着施磷量的增加,根系MDA含量在P1、P2、P3水平分别较P0水平显著降低24.28%、53.46%、29.73%;在正常灌水(W3)下,随着施磷量的增加,P1、P2、P3水平根系MDA含量均较P0水平显著降低52.46%、47.97%、29.67%。在相同施磷水平下,随着水分的增加,MDA含量逐渐降低。P0水平下,W2、W3灌水均较W1灌水显著降低48.27%、52.47%;P1水平下,W2、W3灌水均较W1灌水显著降低54.58%、73.80%;P2水平下,W2、W3灌水均较W1灌水显著降低72.02%、71.26%;P3水平下,W2、W3灌水均较W1灌水显著降低62.08%、65.13%。
2.1.4 对藜麦根系可溶性糖、脯氨酸含量的影响 在相同水分条件下,随着施磷量的增加,可溶性糖含量呈现先降低后升高的趋势,且在P1、P2水平下显著低于P0水平,而在P3水平下可溶性糖含量又逐渐升高,但较P0水平差异不显著。在相同施磷水平下,W2、W3灌水下的可溶性糖含量均较重度干旱
(W1)显著降低(图3)。
在不同水磷处理下,脯氨酸含量与可溶性糖含量规律相似。相同水分条件下,施磷(P1、P2、P3)均较不施磷(P0)显著降低,但P2、P3水平间差异不显著。同一施磷水平下,W2、W3灌水下的脯氨酸含量均较重度干旱(W1)显著降低(图3)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3水磷耦合对藜麦根系可溶性糖、脯氨酸含量的影响
-->Fig. 3Effects of water and phosphorus coupling on soluble sugar content and proline content of quinoa root
-->
2.2 水磷耦合对藜麦显序期生物量的影响
2.2.1 对藜麦根、茎、叶和序重的影响 P0水平下,根重随着水分的增加逐渐增加,但W2、W3灌水均较重度干旱(W1)不显著;P1与P2水平下,根重随着水分的增加逐渐增大,且均在正常灌水(W3)达到最大,分别较重度干旱(W1)增加71.58%、26.03%;P3水平下,根重在中度干旱(W2)下达到最大,较重度干旱(W1)增加89.82%。根重在同一灌水处理不同施磷水平下表现不同,重度干旱(W1)下,根重于P2水平达到最大;中度干旱(W2)下,根重于P3水平达到最大;正常灌水(W3)下,根重于P2水平达到最大。在同一施磷水平下,茎重与叶重随着水分的增加均显著增大,表明水分的增加可以促进茎与叶的生长。在同一水分条件下,茎重与叶重表现不同。W1、W3灌水下,茎重均随着施磷量的增加呈先增后降的趋势,分别在P2、P1水平下达到最大;在W2灌水下,随着施磷量增加茎重逐渐增大,在P3水平达到最大,且显著高于其他施磷水平。3种灌水处理下,叶重均随着施磷量的增加先增加后减少,且均在P2水平达到峰值。
在干旱胁迫(W1、W2)下,序重均随着施磷量的增加显著增大,在P3水平达到最大;在正常灌水(W3)下,序重随着施磷量的增加先增加后减少,在P2水平达到最大。在同一施磷水平下序重表现为P3水平序重于中度干旱(W2)达到最大,P0、P1、P2水平,序重于正常灌水(W3)达到最大。比较各处理得出,W2P3与W3P2组合最有利于花序的生长(图4)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4水磷耦合对显序期藜麦植株生物量的影响
-->Fig. 4Effect of water and phosphorus coupling on biomass per plant of quinoa at inflorescence-show phase
-->
2.2.2 对藜麦根、茎、叶和序重分配的影响 在同一施磷水平下,根重/苗重随着灌水的增加显著降低,而茎重/苗重、叶重/苗重均随灌水的增加逐渐升高。序重/苗重在不同施磷水平表现不同,P0水平下,序重/苗重随着灌水的增加变化不显著;P1水平下,序重/苗重随着灌水的增加逐渐降低,在正常灌水(W3)降到最低,显著低于干旱处理(W1、W2);P2水平下,序重/苗重随着灌水的增加呈现先增后降的趋势,在中度干旱(W2)达到最大,显著高于W1、W3灌水处理;在P3水平下,序重/苗重随着灌水的增加显著降低。
同一水分条件下,生物量分配在不同施磷水平表现不同。根重/苗重在干旱胁迫下(W1、W2),施磷水平(P1、P2、P3)均较不施磷水平(P0)显著增大,在正常灌水(W3)下,不同施磷水平差异不显著;茎重/苗重在3种灌水处理下,施磷(P1、P2、P3)均较不施磷(P0)显著降低;叶重/苗重在中度干旱(W2)下,不同磷水平差异显著,且在P1水平达到最大,P3水平降到最低,其他灌水处理下不同施磷水平差异不显著;序重/苗重在干旱胁迫(W1、W2)下,均随着磷素的施加逐渐增大,在P3水平达到最大,显著高于其他磷水平,在正常灌水(W3)下,施磷(P1、P2、P3)较不施磷处理(P0)显著增大,但不同施磷水平差异不显著(图5)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5水磷耦合对显序期藜麦植株生物量分配的影响
-->Fig. 5Effect of water and phosphorus coupling on biomass distribution of quinoa at inflorescence-show phase
-->
2.3 水磷耦合对藜麦产量及其构成因素的影响
2.3.1 对藜麦顶穗的影响 在相同灌水条件下,顶穗粒数、顶穗小穗数、顶穗面积均随着施磷量的增大先增大后减小,且均在P2水平达到最大;在相同施磷水平下,顶穗粒数、顶穗小穗数、顶穗面积均随着灌水的增加逐渐增加,在正常灌水(W3)下达到最大(图6)。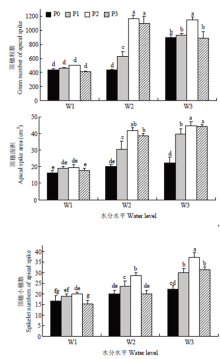 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6水磷耦合对藜麦顶穗构成因素的影响
-->Fig. 6Effects of water and phosphorus coupling on apical spike components of quinoa
-->
2.3.2 对藜麦产量及其构成的影响 在相同灌水条件下,分枝数、穗数、单株粒重、千粒重均随着磷素的施加有先升后降的趋势,且均在P2水平达到最大(图7)。在相同施磷水平下,分枝数与穗数均随着水分的增加先增多后减少,在中度干旱(W2)达到最大;单株粒重随着灌水的增大逐渐增大,正常灌水(W3)下达到最大,且较其他水分处理差异显著;千粒重与单株粒重变化规律相同,均随着灌水的增大逐渐增大。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7水磷耦合对藜麦产量及其构成因素的影响
-->Fig. 7Effects of water and phosphorus coupling on yield and its components of quinoa
-->
3 讨论
3.1 不同水磷耦合条件下藜麦的根系生长
植物的根系生长发育不仅与植物自身遗传有关,还与植物所处的生长环境有关[23]。根系是植物直接与外界土壤环境接触的营养器官,根系的强弱可通过根系的数量、形态以及生理指标进行体现。对根系的研究表明,作物根系的大小、生长构型与作物对水分和养分的吸收密切相关,根系越大,获取的水分和养分越多,植物抗旱性越强,作物产量越大[24]。因而根系可以作为植物抗旱性强弱的评价标准。本研究表明,不同水磷处理对藜麦根系形态指标有不同的影响,从而影响根系构型。在相同水分条件下,不同根系参数(根系表面积、根系总长度、最大根长、根系直径、根体积)均在P2水平达到最大,表明适宜的磷素供给可以促进根系的生长,增加根系与土壤的接触面积,提高根系吸水能力,从而提高幼苗抗旱能力,增强植株抗旱性。在相同施磷水平下,根系最大根长与根系总长均在中度干旱(W2)达到最大,表明适当的水分胁迫可以刺激根系的伸长生长,使植株吸收更多的水分与养分,提高植物抗旱力。在低磷水平(P0、P1)下,根系表面积在中度干旱(W2)大于正常灌水(W3),即W2P0>W3P0,W2P1>W3P1,表明低磷条件下,中度干旱有利于根系表面积的增大;高磷水平(P2、P3)下,根系表面积在中度干旱(W2)小于正常灌水(W3),即W2P2<W3P2,W2P3<W3P3,表明高磷条件下,正常灌水有利于根系表面积的增大,说明不同的磷素生长环境,所需水磷耦合配比不同,这可能是由于中度干旱胁迫下水势较低,过量的磷肥无法溶解完全,同时增加了土壤溶液的渗透势[25],不利于根系吸水。根系直径与根系体积均随着水分的增加逐渐增加。
POD、SOD是植物保护酶系统中重要的抗氧化酶,是植物体内清除自由基的关键酶;MDA是膜脂过氧化产物,其含量可以衡量膜脂过氧化程度,评价细胞膜受伤害程度[26]。本研究表明,在重度干旱(W1)下,根系活力在P1(0.1 g P2O5·kg-1)达到最大,其他灌水条件下,根系活力均在P2达到最大。在3种水分条件下,POD、SOD活性均在P2(0.2 g P2O5·kg-1)达到最高,MDA含量降到最低,表明施磷量在P2(0.2 g P2O5·kg-1)水平下可以提高根系活力,提高POD与SOD活性,降低膜脂过氧化程度,提高植物抗旱性,这与钟鹏等[27]对大豆在低磷与干旱胁迫下的研究结果一致。脯氨酸与可溶性糖作为渗透调节物质,其含量的多少同样可以衡量植株的抗旱能力与受伤害程度[28]。试验结果表明,可溶性糖含量与脯氨酸含量在重度干旱(W1)下最高,随着水分的增加,受胁迫程度降低,其含量降低。同时施磷量P2(0.2 g P2O5·kg-1)显著降低了可溶性糖含量与脯氨酸含量,缓解干旱胁迫对植株的伤害,维持正常渗透压,水磷均衡的配比对植株胁迫的缓解更有利。
3.2 不同水磷耦合条件下藜麦的生物量分配
植物生物量分配是指植物对不同营养器官及结构的分配,从而实现对外界环境的更好适应[29-31],而生物量的积累与分配是由遗传因素与生活环境共同决定的[32-33]。本研究探讨了水磷耦合对藜麦显序期生物量的积累与分配,表明在相同施磷水平下,茎、叶生物量均在正常灌水(W3)达到最大,且均显著高于其他处理,说明水分的充足供应促进营养器官茎叶的生长。根重与序重在P0、P1、P2磷水平下与茎、叶生物量规律相同,这是由于水分的增多使得光合作用增强,促进有机物的积累,使生物量增加;施磷量(P3)水平下,根、序重在中度干旱(W2)达到最大,即W2P3>W3P3,可能是由于W3P3处理下,充分的水分与磷素营养供应使得植株倾向于茎叶的生长,而W2P3处理的低水势土壤环境刺激植株根的生长,促进根重的增加,体现出藜麦旱生植物的特性,表明藜麦具有较强的耐旱力。研究表明高水处理更有利于植株对茎、叶生物量的分配,低水处理有利于植株对根、序生物量的分配,这样使得植株在干旱环境下合理地分配更多资源给根系与序。根系的生长可以提高植株吸水能力,序重的增加提高了植株繁殖力,从而提高植株存活力,达到更好的生长适合度,一方面体现了植株旱生植物的特性[34],另一方面体现了植株的可塑性分配[35]。不同水磷处理,植株生物量分配表现不同,根重/苗重在W1P2处理下达到最大,表明在干旱胁迫下,施磷量在P2水平下提高了植株对根重的分配;叶重/苗重在W3P3处理达到最大,显著高于其他处理,表明在水分跟磷素营养充足条件下,植株更倾向于叶器官的建成;3种水分条件下,序重/苗重均表现为P3>P2>P1>P0,表明高磷有利于植株对序重的分配,从而促进作物增产[14]。
3.3 不同水磷耦合条件下藜麦的产量构成
顶穗的生长良好是藜麦高产的评价指标,施磷量在P2(0.2 g P2O5·kg-1)水平下,有利于植株顶穗的形成。在相同施磷水平下,顶穗粒数、顶穗小穗数、顶穗面积均随着水分的增加逐渐增加,表明正常灌水(土壤含水量为田间持水量的65%—75%),有利于藜麦顶穗穗数增多,粒数增大。在相同水分条件下,分枝数、穗数、单株粒重、
千粒重均表现出低磷促进,高磷抑制的单峰曲线变化,均在P2水平达到峰值。千粒重、单株粒重均在W3P2处理达到最大,说明适宜的水磷耦合配比,提高植物抗旱性同时,促进了作物增产[18]。
4 结论
适宜的施磷量P2(0.2 g P2O5·kg-1)能够提高藜麦根系活力,促进根系生长,提高根系与土壤的接触面积,增强根系抗氧化能力,从而提高藜麦抗旱能力,这对藜麦在山西黄土高原旱薄并存的土壤条件下的种植具有一定的参考价值。藜麦在干旱胁迫下表现出一定的生物量可塑性分配,从而提高植株在逆境胁迫下的生存能力和生长适合度。适宜的水磷耦合配比W3P2(W3:土壤含水量为田间持水量的75%—85%;P2:施磷量0.2 g P2O5·kg-1)有利于藜麦各营养器官生物量的积累以及成熟期产量的形成,此水磷配比是藜麦高产的合理选择,但对于大田藜麦栽培是否适用,仍需进一步研究。The authors have declared that no competing interests exist.
