0 引言
【研究意义】养猪业带来的氮污染对环境、人畜健康及生产的危害逐渐受到广泛重视[1-2]。因尿氮比粪氮易分解释放氨气,所以研究氮减排的重心便集中在减少尿氮排放或者将尿氮转至粪便中[3]。大量体内研究已证实[4-6],猪日粮中添加日粮纤维(dietary fiber, DF)可以促进尿氮向粪氮的转移,DF在后肠内经微生物发酵产生短链脂肪酸(short-chain fatty acid, SCFA)为微生物供能,促进其生长,导致微生物对氨的需要量增多,尿素合成减少,而微生物蛋白(microbial protein, MCP)合成增加,并随粪便排出。但不同来源的纤维因自身理化性质的迥异,对宿主肠道微生物的刺激具有选择性,在微生物的作用下有不同的发酵模式,对氮排放的影响也必然存在差异[7]。随着纤维型饲料原料越来越被重视,在养猪业生产实际中,如何选择DF来源、充分利用其发酵性能成为一个关键问题,既在缓解饲料资源短缺、降低生产成本的同时还能有效实现氮减排。【前人研究进展】在猪营养相关研究中,体外法(in vitro)因其快速、省力、易于标准化等特点受到关注。目前普遍使用的体外胃-小肠-大肠三步法因在大肠阶段未引入微生物发酵、不能发挥DF的发酵性能,而具有一定的局限性[8-10]。近几年国外****将猪的新鲜粪便作为微生物来源,引入纤维日粮体外发酵研究中,实现对大肠微生物环境较大程度的模拟[11-12],但当前在国内研究中的应用仍然较少。纤维型饲料原料的化学组成复杂,DF在宿主肠道内的发酵情况受其他组分的综合影响[13]。【本研究切入点】为了去除其他组分的干扰,客观地反应DF组分的发酵特性,本研究选择小麦、麦麸与燕麦麸3种生产中常用的饲料原料,提取原料的总日粮纤维(total dietary fiber,TDF),分别配制成生长猪日粮,并利用单胃动物仿生消化系统(SDS-Ⅱ)对日粮进行猪胃-小肠模拟消化,之后对消化产物进行体外微生物发酵。【拟解决的关键问题】以探讨并比较不同纤维日粮的发酵特性及对氮排放相关指标的影响,为生猪生产中合理应用DF及减少氮排放的日粮配制提供试验依据。1 材料与方法
1.1 试验时间、地点
试验于2016年1—6月在中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室进行。1.2 试验日粮
选择小麦、麦麸与燕麦麸3种饲料原料,参照Prosky(AOAC Method 985.29)[14]酶-重量法去除蛋白与淀粉,提取原料的TDF,并对提取纤维的纤维含量进行测定,见表1。Table 1
表1
表13种原料提取纤维的纤维含量
Table 1The fiber content of the extracted fiber (%)
| 项目 Items | 可溶性日粮纤维 Soluble dietary fiber | 不溶性日粮纤维 Insoluble dietary fiber | 总日粮纤维 Total dietary fiber | 可溶性日粮纤维/总日粮纤维 Soluble dietary fiber/Total dietary fiber |
|---|---|---|---|---|
| 小麦纤维 Wheat fiber (WF) | 6.91 | 72.48 | 79.39 | 8.70 |
| 麦麸纤维 Wheat bran fiber (WBF) | 4.87 | 77.19 | 82.06 | 5.93 |
| 燕麦麸纤维 Oat bran fiber (OBF) | 27.50 | 55.36 | 82.86 | 33.19 |
新窗口打开
以玉米和豆粕为基础,分别添加5%的提取纤维(小麦纤维、麦麸纤维与燕麦麸纤维),形成3种日粮:小麦纤维日粮、麦麸纤维日粮与燕麦麸纤维日粮。日粮满足NRC(2012)20—50 kg生长猪营养需要量,其组成及营养水平如表2所示。
Table 2
表2
表2试验日粮组成及营养水平(风干基础,%)
Table 2Composition and nutrient levels of the experimental diets (air-dry basis, %)
| 项目 Items | 小麦纤维日粮 WF diet | 麦麸纤维日粮 WBF diet | 燕麦麸纤维日粮 OBF diet |
|---|---|---|---|
| 玉米 Corn | 57.52 | 57.52 | 57.52 |
| 豆粕 Soybean meal | 28.47 | 28.47 | 28.47 |
| 大豆油 Soybean oil | 4.81 | 4.81 | 4.81 |
| 小麦纤维 Wheat fiber | 5 | 0 | 0 |
| 麦麸纤维 Wheat bran fiber | 0 | 5 | 0 |
| 燕麦麸纤维 Oat bran fiber | 0 | 0 | 5 |
| 石粉 Limestone | 0.68 | 0.68 | 0.68 |
| 磷酸氢钙 CaHPO4 | 1.37 | 1.37 | 1.37 |
| 食盐 NaCl | 0.30 | 0.30 | 0.30 |
| L-赖氨酸 L-Lys | 0.05 | 0.05 | 0.05 |
| 硅藻土 Celite | 0.80 | 0.80 | 0.80 |
| 预混料 Premix1) | 1.00 | 1.00 | 1.00 |
| 合计 Total | 100.00 | 100.00 | 100.00 |
| 营养水平 Nutrient levels2) | |||
| 干物质 Dry matter | 89.96 | 90.28 | 90.04 |
| 粗蛋白质 Crude protein | 19.21 | 18.90 | 19.06 |
| 消化能 Digestible energy (MJ·kg-1) | 14.71 | 14.71 | 14.71 |
| 粗灰分 Crude ash | 5.39 | 5.30 | 5.37 |
| 粗脂肪 Ether extract | 6.80 | 6.72 | 6.79 |
| 中性洗涤纤维 Neutral detergent fiber | 11.62 | 11.94 | 11.15 |
| 可溶性日粮纤维 Soluble dietary fiber | 1.69 | 1.58 | 2.70 |
| 不溶性日粮纤维 Insoluble dietary fiber | 13.03 | 13.30 | 12.14 |
| 总日粮纤维 Total dietary fiber | 14.72 | 14.88 | 14.84 |
| 可溶性日粮纤维/总日粮纤维 Soluble dietary fiber/Total dietary fiber | 11.48 | 10.61 | 18.19 |
新窗口打开
1.3 体外胃-小肠消化
体外条件下对各日粮进行猪的胃-小肠模拟消化。利用动物营养学国家重点实验室研发的单胃动物仿生消化系统(SDS-Ⅱ)完成,具体操作规程参见《单胃动物仿生消化系统操作手册(第二版)》[15],收集消化产物(即为发酵底物)备用。1.4 体外发酵
1.4.1 发酵培养液 参照MENKE等方法配制[16],现用现配。培养液由蒸馏水、溶液A、溶液B、溶液C、刃天青溶液和还原剂溶液组成,具体组成见表3。在400 mL蒸馏水中加入0.1 mL溶液A、200 mL溶液B、200 mL溶液C和1 mL刃天青溶液(指示培养液厌氧状况,有氧时呈红色,厌氧时呈无色),通无氧CO2饱和后置于(39±0.25)℃恒温水浴锅中,在与粪便混合前1 h加入40 mL还原剂溶液,混匀并持续通入CO2。1.4.2 发酵菌源 选择6头健康、体重接近(BW,(37.2±4.6)kg)杜×长×大三元杂交阉公猪(动物营养学国家重点实验室昌平试验基地)作为粪便供体动物。收集每头猪的新鲜粪便,直接保存于100 mL的塑料注射器中,推动活塞驱赶空气,放置于水浴(39±0.25)℃的保温瓶中,立即带回实验室。
1.4.3 接种液 将收集的粪便混匀,取28.5 g与预热至(39±0.25)℃的培养液210 mL充分混合(机械搅拌60 s)后,经4层纱布过滤,取滤液密封于适宜体积的玻璃瓶中,持续搅拌,并通入CO2使其保持在厌氧环境中。所有操作均于(39±0.25)℃恒温水浴锅中进行,尽量在最短时间内完成。
1.4.4 体外发酵设计 称取经胃和小肠消化后的残渣200 mg,分装于100 mL的玻璃发酵瓶中,加入30 mL接种液,持续冲入CO2 5 s后,立即盖上瓶塞,转入已预热至(39±0.25)℃的恒温培养箱中(SPX-250 B-2,上海福玛实验设备有限公司)培养,在发酵4、12、24、36、48和72 h后(各时间点设6个重复,另设3个空白用于校正数据),取出对应发酵瓶,收集发酵残渣和发酵液,进行相关指标的检测。
Table 3
表3
表3培养液组成
Table 3Composition of culture solution
| 成分 Component | 组成 Composition | 添加量 Volume of addition (mL) |
|---|---|---|
| 蒸馏水 Distilled H2O | 蒸馏水 Distilled H2O | 400 |
| 溶液A Solution A | 每100 mL溶液A含CaCl2·2H2O 13.2 g、MnCl2·4H2O 10 g、CoCl2·6H2O 1 g和FeCl3·6H2O 8 g 100 mL solution A contained 13.2 g CaCl2·2H2O, 10 g MnCl2·4H2O, 1 g CoCl2·6H2O and 8 g FeCl3·6H2O | 0.1 |
| 溶液B Solution B | 每1 L溶液B含NH4HCO3 4 g和NaHCO3 35 g 1 L solution B contained 4 g NH4HCO3 and 35 g NaHCO3 | 200 |
| 溶液C Solution C | 每1 L溶液C含Na2HPO4 5.7 g、KH2PO4 6.2 g 和MgSO4·7H2O 0.6 g 1 L solution C contained 5.7 g Na2HPO4, 6.2 g KH2PO4 and 0.6 g MgSO4·7H2O | 200 |
| 刃天青溶液 Resazurin solution | 每100 mL刃天青溶液中含刃天青100 mg 100 mL resazurin solution contained 100 g resazurin | 1 |
| 还原剂溶液 Reducer solution | 每100 mL还原剂溶液含NaOH 160 mg和Na2S·9H2O 625 mg 100 mL reducer solution contained 160 mg NaOH and 625 mg Na2S·9H2O | 40 |
新窗口打开
1.5 测定指标与方法
1.5.1 常规成分 日粮的干物质、能量、粗蛋白质、粗脂肪、中性洗涤纤维及粗灰分含量按照《常规饲料分析与检测技术》[17]方法测定。1.5.2 纤维含量 采用PROSKY(AOAC Method 985.29)[14]酶-重量法测定日粮及提取纤维的可溶性日粮纤维(soluble dietary fiber,SDF)、不溶性日粮纤维(insoluble dietary fiber,IDF)及总日粮纤维(total dietary fiber,TDF)含量。
1.5.3 体外发酵阶段干物质降解率 (dry matter degradability during the in vitro fermentation,IVDMD)
IVDMD(%)=(日粮干物质重-发酵后残渣干物质重)/日粮干物质重×100。
1.5.4 发酵液短链脂肪酸含量、pH及氨氮浓度 发酵液短链脂肪酸含量采用气相色谱法[18](Agilent 7890B气相色谱仪,安捷伦科技有限公司)测定。
发酵结束后,立即使用pH酸度计(Sartorius PB-10)测定发酵液pH。
使用纳氏比色法(CM-02N台式氨氮水质测定仪,北京双晖京承电子产品有限公司)测定发酵液氨氮(NH3-N)浓度。
1.5.5 发酵液微生物蛋白浓度及产量 采用嘌呤法[19]测定发酵液微生物蛋白浓度。
微生物蛋白产量(mg)=微生物蛋白浓度(mg·mL-1)×发酵液体积(mL)
1.6 数据处理
根据单因子完全随机设计,以SAS 9.2 MEANS模块对基本统计量进行分析,GLM模块对数据进行方差分析,均值通过Tukey法进行多重比较,P<0.05为差异显著。2 结果
2.1 日粮纤维对体外发酵阶段干物质降解率的影响
不同底物在体外发酵阶段的干物质降解率如表4所示。在发酵4与12 h,OBF组的IVDMD极显著高于其他两组(P<0.01),其他时间点3组差异不显著。在4 h,OBF组的IVDMD比WF组与WBF组分别高18.32%、15.21%(P<0.01);在12 h,比WF组与WBF组分别高14.87%、10.06%(P<0.01)。不同底物的IVDMD随发酵时间的变化情况如图1所示。各组底物的IVDMD在发酵4—24 h随发酵时间增加而极显著增加(P<0.01),之后便缓慢增加,但差异不显著(P>0.05)。
Table 4
表4
表4日粮纤维对体外发酵阶段干物质降解率的影响
Table 4Effects of dietary fiber on dry matter degradability during the in vitro fermentation (IVDMD)
| 发酵时间 Fermentation time (h) | 体外发酵阶段干物质降解率 Dry matter degradability during the in vitro fermentation (%) | 平均标准误 SEM | P值 P-value | ||
|---|---|---|---|---|---|
| 小麦纤维日粮 WF diet | 麦麸纤维日粮 WBF diet | 燕麦麸纤维日粮 OBF diet | |||
| 4 | 44.43b | 45.63b | 52.57a | 1.08 | <0.01 |
| 12 | 51.91b | 54.18b | 59.63a | 1.16 | <0.01 |
| 24 | 73.45 | 74.87 | 75.04 | 0.71 | 0.25 |
| 36 | 74.93 | 76.06 | 76.82 | 0.91 | 0.36 |
| 48 | 75.66 | 78.30 | 77.55 | 0.73 | 0.06 |
| 72 | 77.86 | 79.04 | 79.06 | 0.69 | 0.17 |
新窗口打开
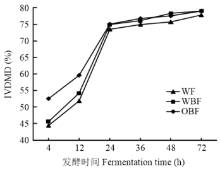 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1体外发酵阶段干物质降解率随发酵时间的变化情况
-->Fig. 1The change of IVDMD with the increase of fermentation time
-->
2.2 日粮纤维对体外发酵总短链脂肪酸含量的影响
不同纤维日粮体外发酵总短链脂肪酸含量有显著差异(P<0.05,表5)。在发酵24 h与36 h,OBF组发酵液总SCFA含量显著高于其他两组(P<0.05),在72 h,OBF组与WBF组极显著高于WF组(P<0.01),在4与12 h,OBF组有高于其他两组的趋势(P=0.0599;P=0.0504)。在24 h,OBF组发酵液总SCFA含量比WF组与WBF组分别高27.32%、17.11%(P<0.05);在36 h,比WF组与WBF组分别高16.65%、25.96%(P<0.05)。不同纤维日粮体外发酵总SCFA含量随发酵时间的变化情况如图2所示。随着发酵时间的延长,各组发酵液总SCFA含量表现为先升高后降低(P<0.01),并在发酵48 h达到最大。
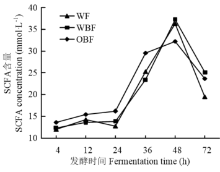 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2发酵液总短链脂肪酸含量随发酵时间的变化情况
-->Fig. 2The change of total SCFA concentration in fermentation broth with the increase of fermentation time
-->
Table 5
表5
表5日粮纤维对发酵液总短链脂肪酸含量的影响
Table 5Effects of dietary fiber on total SCFA concentration in fermentation broth
| 发酵时间 Fermentation time (h) | 发酵液总短链脂肪酸含量 Total short-chain fatty acid concentration in fermentation broth (mmol·L-1) | 平均标准误 SEM | P值 P-value | ||
|---|---|---|---|---|---|
| 小麦纤维日粮 WF diet | 麦麸纤维日粮 WBF diet | 燕麦麸纤维日粮 OBF diet | |||
| 4 | 12.03 | 12.35 | 13.55 | 0.45 | 0.06 |
| 12 | 14.21 | 13.57 | 15.44 | 0.90 | 0.05 |
| 24 | 12.74b | 13.85b | 16.22a | 0.80 | 0.02 |
| 36 | 25.29b | 23.42b | 29.50a | 1.26 | 0.01 |
| 48 | 36.32 | 37.26 | 32.21 | 2.69 | 0.39 |
| 72 | 19.50b | 25.13a | 23.67a | 1.00 | <0.01 |
新窗口打开
2.3 日粮纤维对体外发酵pH的影响
不同纤维日粮体外发酵pH有显著差异(P<0.05,表6)。在发酵4 h与12 h,OBF组发酵液pH极显著低于其他两组(P<0.01);在24、36与72 h,OBF组与WBF组显著低于WF组(P<0.05)。不同纤维日粮体外发酵pH随发酵时间的变化情况如图3所示。在发酵4—36 h,随发酵时间的增加各组发酵液pH极显著降低(P<0.01),之后便维持平稳(P>0.05)。不同时间点各组发酵液pH介于6.79—6.96之间。
Table 6
表6
表6日粮纤维对发酵液pH的影响
Table 6Effects of dietary fiber on pH in fermentation broth
| 发酵时间 Fermentation time (h) | 发酵液pH pH in fermentation broth | 平均标准误 SEM | P值 P-value | ||
|---|---|---|---|---|---|
| 小麦纤维日粮 WF diet | 麦麸纤维日粮 WBF diet | 燕麦麸纤维日粮 OBF diet | |||
| 4 | 6.94a | 6.96a | 6.88b | 0.02 | <0.01 |
| 12 | 6.89a | 6.89a | 6.84b | 0.01 | <0.01 |
| 24 | 6.86a | 6.82b | 6.84b | 0.01 | 0.02 |
| 36 | 6.83a | 6.81b | 6.82b | 0.01 | 0.02 |
| 48 | 6.82 | 6.79 | 6.80 | 0.01 | 0.07 |
| 72 | 6.83a | 6.79b | 6.81b | 0.01 | <0.01 |
新窗口打开
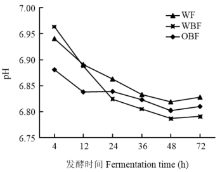 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3发酵液pH随发酵时间的变化情况
-->Fig. 3The change of pH in fermentation broth with the increase of fermentation time
-->
2.4 日粮纤维对体外发酵氨氮浓度的影响
不同纤维日粮体外发酵氨氮浓度有极显著差异(P<0.01表7)。在发酵24与48 h,OBF组发酵液NH3-N浓度显著低于其他两组(P<0.05),并在12 h,有低于其他两组的趋势(P=0.0559)。在24 h,OBF组发酵液NH3-N浓度比WF组与WBF组分别低6.86%、4.59%(P<0.05);在48 h,比WF组与WBF组分别低8.44%、7.09%(P<0.05)。不同纤维日粮体外发酵NH3-N浓度随时间的变化情况如图4所示。随着发酵时间的增加,各组发酵液NH3-N浓度基本呈现出相同的变化,即先上升后降低再升高(P<0.01),并在发酵72 h达到最高。
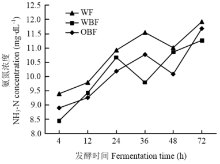 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4发酵液氨氮浓度随发酵时间的变化情况
-->Fig. 4The change of NH3-N concentration in fermentation broth with the increase of fermentation time
-->
Table 7
表7
表7日粮纤维对发酵液氨氮浓度的影响
Table 7Effects of dietary fiber on NH3-N concentration in fermentation broth
| 发酵时间 Fermentation time (h) | 发酵液氨氮浓度 NH3-N concentration in fermentation broth (mg·dL-1) | 平均标准误 SEM | P值 P-value | ||
|---|---|---|---|---|---|
| 小麦纤维日粮 WF diet | 麦麸纤维日粮 WBF diet | 燕麦麸纤维日粮 OBF diet | |||
| 4 | 9.40 | 8.45 | 8.89 | 0.18 | 0.12 |
| 12 | 9.80 | 9.43 | 9.26 | 0.28 | 0.06 |
| 24 | 10.93a | 10.67a | 10.18b | 0.18 | 0.01 |
| 36 | 11.54 | 9.79 | 10.77 | 0.17 | 0.07 |
| 48 | 11.02a | 10.86a | 10.09b | 0.23 | 0.03 |
| 72 | 11.92 | 11.27 | 11.68 | 0.16 | 0.09 |
新窗口打开
2.5 日粮纤维对体外发酵微生物蛋白产量的影响
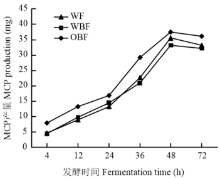
不同纤维日粮体外发酵微生物蛋白产量有显著差异(P<0.05,表8)。在发酵4 h,OBF组发酵液MCP产量显著高于其他两组(P<0.05),在12与24 h,OBF显著高于WF组(P<0.05),在36与48 h,OBF组显著高于WBF组(P<0.05)。在4 h,OBF组发酵液MCP产量比WF组与WBF组分别高69.85%、82.25%(P<0.05)。不同纤维日粮体外发酵MCP产量随发酵时间的变化情况如图5所示。在发酵4—48 h,各组发酵液MCP产量随发酵时间的增加而极显著增加(P<0.01),之后基本不变(P>0.05)。
Table 8
表8
表8日粮纤维对发酵液微生物蛋白产量的影响
Table 8Effects of dietary fiber on MCP production in fermentation broth
| 发酵时间 Fermentation time (h) | 发酵液微生物蛋白产量 Microbial protein production in fermentation broth (mg) | 平均标准误 SEM | P值 P-value | ||
|---|---|---|---|---|---|
| 小麦纤维日粮 WF diet | 麦麸纤维日粮 WBF diet | 燕麦麸纤维日粮 OBF diet | |||
| 4 | 4.71b | 4.45b | 8.00a | 0.70 | 0.01 |
| 12 | 8.97b | 9.82ab | 13.20a | 0.25 | 0.03 |
| 24 | 13.36b | 14.52ab | 16.89a | 0.35 | 0.03 |
| 36 | 22.74ab | 20.95b | 29.27a | 0.17 | 0.02 |
| 48 | 35.53ab | 33.19b | 37.57a | 0.29 | 0.02 |
| 72 | 33.23 | 32.18 | 36.13 | 0.91 | 0.36 |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5发酵液微生物蛋白产量随发酵时间的变化情况
-->Fig. 5The change of MCP production in fermentation broth with the increase of fermentation time
-->
3 讨论
日粮纤维在促进猪尿氮向粪氮转移上的效果越来越受到重视。笔者前期也做过研究,发现日粮中添加20%麦麸或燕麦麸后,生长猪尿液总氮与氨氮含量显著降低[20-21]。在此基础上,本试验采用体外研究手段,选择麦麸、燕麦麸及生产中常用的原料小麦,提取原料中的总日粮纤维,配制3种纤维日粮,体外条件下模拟其在猪消化道内的消化与发酵,以研究并比较纤维日粮的发酵特性及发酵过程中氮排放相关指标的变化情况。但目前相关体外研究中,评价纤维的发酵特性多集中为纤维原料,鲜少涉及以上3种纤维日粮,且结合研究氮排放相关指标的报道比较少[4,12,22-23]。因此,本研究对体外法、纤维日粮的发酵特性及氮排放相关指标的有机结合,为深入了解DF、DF在猪日粮中的合理应用及减少氮排放的日粮配制提供了新的思路。3.1 对发酵起始阶段干物质降解有显著影响
DF是不能被胃与小肠内源消化酶分解,只能部分或全部由微生物发酵利用的碳水化合物的总称[24]。不同来源DF的可发酵性各异[11],对其他养分被微生物利用程度的影响也不尽相同。前人研究表明[20,25-26],SDF型纤维比IDF型纤维的可发酵性高,更易降解,并通过发酵供能及促进微生物生长等,进一步促进其他养分的酵解利用。IVDMD是反应底物DM在体外发酵阶段的降解率及被微生物利用的程度的直观指标,本试验中,在发酵起始阶段,DF对IVDMD有显著影响,且燕麦麸纤维组的IVDMD最高,这符合笔者的认识,燕麦麸纤维属SDF型纤维(SDF/ TDF=33.19%),而其他两种纤维为IDF型纤维,也与孟丽辉[20]的体内试验结果一致,即SDF含量最高日粮的后肠发酵率显著高于其他日粮。此外,3种底物的IVDMD均随发酵时间的增加而增加,但从24 h开始增加缓慢,这可能是随着发酵进行,底物被大量消耗,发酵速率有所下降的缘故[27]。目前相关研究也以发酵期间产气量的多少来反映底物被微生物利用的程度[22-23],产气量随时间的变化趋势与本试验中IVDMD变化趋势基本一致,且AWATI指出[28]在发酵一定时间后产气量增加缓慢的原因:在发酵一定时间后,接种液中微生物区系已适应发酵底物,作为产气来源的物质已被大量消耗,产气量基本达到最大。
3.2 体外发酵总短链脂肪酸含量与pH的影响
SCFA是猪后肠微生物发酵DF的主要终产物,是估测后肠发酵的一个重要指标。在体内,后肠发酵产生的SCFA迅速被肠上皮细胞吸收,而体外发酵过程中不存在吸收过程,因此提供了一种值得信赖的测定SCFA含量的方法[29]。有研究证实,SCFA含量受DF来源及发酵率的影响,即当底物中可发酵DF含量越高,被微生物利用程度越高,SCFA含量也相继提高[30-31]。本研究中,在发酵前4个时间点,燕麦麸纤维组的总SCFA含量均高于其他两组,这与燕麦麸纤维组可发酵DF含量(SDF/TDF=18.19%)及IVDMD最高的试验结果切合。随着发酵时间的延长,3组总SCFA含量在4—48 h不断增加,这是微生物不断发酵产酸而SCFA无法外流、吸收的结果,在48—72 h又降低,可能是由代谢产物积累使微生物增长变缓以及可发酵碳水化合物大量消耗引起。动物后肠内pH主要受SCFA含量、肠上皮对SCFA的吸收及食糜外流等的共同影响[27],显然,在体外发酵过程中,动物体内生理代谢过程并不存在,发酵液pH则主要被SCFA含量影响。本试验中,随着发酵时间的延长,发酵液pH变化与SCFA变化基本相对应,在发酵4—48 h,SCFA的大量积累导致pH不断下降,且在48—72 h,从数值上看,发酵液pH呈增加趋势,与前文所述SCFA含量下降吻合。
3.3 对体外发酵氨氮浓度与微生物蛋白产量的影响
NH3-N是底物中蛋白质发酵的产物,同时也是微生物维持生长及合成自身MCP的主要氮源,其浓度反映了蛋白质降解与合成间的平衡状况,可作为体外条件下预示氮排放潜力的重要指标[32]。同样地,BINDELLE等研究发现,体外发酵产生的MCP可被用来预测猪尿氮与粪氮的排放比例[11],之后JHA等[12]也在其研究中进行应用。当底物的可发酵碳水化合物利用率低,微生物即开始利用蛋白质,发酵产NH3[33]。而许多体内试验显示,日粮中添加DF后,纤维发酵增加,蛋白质发酵减少,NH3产生减少[12,34]。NH3产生后,微生物利用其合成MCP,在氮源充足的情况下,MCP的合成效率又反过来由可发酵碳水化合物的发酵率及提供的可利用能量决定[19]。本研究中,在发酵多个时间点,燕麦麸纤维组发酵液NH3-N浓度均低于其他两组,对应地,MCP产量最高。综合前面分析,相比其他两组,燕麦麸纤维组无论是在SDF(SDF/TDF=18.19%)含量上,还是底物DM发酵率、SCFA(提供能量)产量上均显示出其突出的优势,进一步验证了前述观点。本试验同时发现,随着发酵进行,蛋白质发酵逐渐开始,不断产NH3,发酵液NH3-N浓度持续上升,之后微生物利用NH3合成MCP,导致NH3-N浓度在36 h或48 h下降,因体外发酵消除了肠壁对NH3-N的吸收及参与尿素循环的影响,且发酵液无法外流,因此,在发酵末NH3-N浓度又出现回升。相应地,随着发酵时间的增加,发酵液MCP产量显著增加,而72 h的MCP产量与48 h基本持平,这可能暗示着在48 h该体外发酵系统中微生物区系达到动态平衡[28]。
值得注意的是,本研究中,小麦纤维组与麦麸纤维组的部分指标(SCFA及pH)在发酵某时间点出现显著差异。麦麸是小麦籽实加工面粉后的副产品,也即麦麸纤维与小麦纤维在某种程度上具有一定的同源性。然而,二者的DF组成、各组分结构不同,由此对肠道菌群等的影响也不尽相同[35],因此,二者产生的差异可能与此有关,尚需进一步研究。
此外,在进行纤维日粮的体外消化时,研究者们越来越意识到,需在大肠阶段引入微生物发酵,只有这样才能对纤维日粮进行更理性客观的评价[20,31]。因受实际条件所限,相关研究通常使用新鲜粪便作为微生物来源。而具有不确定性的一点是,以粪便为微生物来源得出的结果,是否能够代表后肠微生物利用底物的能力[36]。同时,引入微生物后,如何使体外大肠环境与猪实际生理环境更加类似,仍是相关研究的重点。因此,使用体外法来模拟猪纤维日粮的后肠发酵,还需在选择微生物来源、更加贴近动物生理条件等方面做出改进,有待深入探究。
4 结论
体外条件下,燕麦麸纤维显著提高了日粮在发酵阶段的干物质降解率、发酵液总短链脂肪酸含量与微生物蛋白产量,并显著降低了发酵液pH与氨氮浓度。因此,相比小麦纤维与麦麸纤维,燕麦麸纤维在促进微生物发酵及氮减排方面具有更高的潜力。The authors have declared that no competing interests exist.
