0 引言
【研究意义】桃树根癌病是由根癌土壤杆菌(Agrobacterium tumefaciens)引起的、严重危害桃生产的一种细菌性病害[1]。生物防治是目前防控根癌病最有效的方法,但以K84及其遗传改造菌株K1026[2-5]为代表的根癌病生防制剂有一定的局限性,只能通过抢先占领果树伤口位点、产土壤杆菌素Agrocin 84保护植物伤口来阻止根癌土壤杆菌的入侵。植物体内存在大量的内生细菌,它们是植物微生态系统的重要组成部分,对寄主植物具有防病、促生、固氮和生物修复等作用[6-8]。在占据有利生态位、经受植物防卫反应、与病原菌直接相互作用等方面具有优势[9]。从内生细菌中筛选出对根癌土壤杆菌有抑制作用的拮抗菌,不仅能为生物防治根癌病提供新思路,而且可为有效防控根癌病提供新的菌种资源。【前人研究进展】寄主植物对生物胁迫的耐受性与其内生细菌有关。如病原菌的侵入会引发寄主植物内生菌群的变化,而这又反过来会增强寄主植物对病原菌的抵抗能力[10]。近年来,具有生防作用的内生细菌资源不断被发现[11-13]。从水稻、棉花、马铃薯、橡树等植物中都分离筛选到了可用于生物防治相关病害的内生细菌[14]。而且研究表明内生细菌在防治植物病害方面具有广阔的应用前景。如陈延熙等[15]利用植物内生芽孢杆菌研制的生物制剂已广泛应用于多种作物的病害防治;PLEBAN等[16]通过接种内生细菌实现了对向日葵和花椰菜病虫害的防控。然而,到目前为止,国内外尚未有分离鉴定防控桃相关病害的桃内生菌的研究报道。【本研究切入点】HAO等[17]在筛选抗根癌病的桃种质资源时发现,桃单株“西北13-1”重复接种根癌土壤杆菌后,其发病情况均轻于第一次接种,这表明根癌土壤杆菌的侵染使该品种获得了对桃根癌病的抗性,由此推测桃单株“西北13-1”对根癌病的获得抗性可能与其内生细菌有关。因此,本研究将分析根癌土壤杆菌侵染对桃内生细菌菌群的影响,并从中筛选出对根癌土壤杆菌有拮抗作用的菌株,从而探索利用内生细菌防治桃根癌病的可能性。【拟解决的关键问题】揭示桃内生菌与桃“西北13-1”具有根癌病获得抗性的关系,开发对根癌土壤杆菌具有拮抗活性的生防菌,从而为桃根癌病的生物防治提供新的思路和菌种资源。1 材料与方法
试验于2015年在中国农业科学院植物保护研究和中国农业科学院郑州果树研究所基地完成。1.1 试验材料
供试植物材料:“西北13-1”实生桃苗,对根癌病具有获得抗性。桃苗于2011年实生种植于中国农业科学院郑州果树研究所基地。向日葵作为指示植物测定拮抗菌的防治效果。番茄用于检测拮抗菌在植株根部的定殖情况。供试病原菌:根癌土壤杆菌ATCC 23308T(生物Ⅰ型)和TA-AT-2(生物Ⅱ型)均由中国农业微生物菌种保藏管理中心(ACCC)提供。
质粒:带有绿色荧光标记的表达载体pBBR1MCS-2,具有卡那霉素(Kana,终浓度为50 µg·mL-1)抗性。由中国农业科学院植物保护研究所赵廷昌研究员惠赠。
1.2 内生细菌的分离统计
1.2.1 根癌土壤杆菌的接种 将根癌土壤杆菌TA-AT-2接种于YEB培养基中,28℃、200 r/min培养16 h,调整菌液浓度至109 CFU/mL。选5棵长势一致的桃苗,每棵树选6个不同方向的枝条,将根癌土壤杆菌菌液接种到新发嫩枝上[18],用无菌水接种作为对照。1.2.2 样品采集及处理 分别于接种前(0 D)、接种后10 d (接种处理10 DI,对照处理10 DM)和接种后60 d(接种处理60 DI,对照处理60 DM)收集枝条。每棵树每个时期选3个方向不同的枝条用无菌修枝剪剪下,分别用70%酒精浸泡30 s、1% NaClO浸泡3 min后用无菌水清洗5次[19]进行表面消毒。将表面消毒后的材料在NA培养基上做印记,28℃培养5—10 d,观察平板,验证表面消毒效果。用无菌剪刀将表面消毒的枝条各接种点之间的部分剪切成0.5 cm长的小段,将同一棵树同一处理的不同枝条的片段混和为一个样品,用于内生细菌的分离培养和种属鉴定。
1.2.3 内生细菌的分离培养与纯化 每个样品取1 g于无菌研钵中,加入9 mL PBS溶液,研磨后静置得到茎组织悬浮液。采用TSA培养基进行细菌的分离培养,24 h后根据菌落形态特征进行分类、编号,分别记录各类细菌的形态及菌落数。挑取单菌落在NA平板上划线纯化3次后,将其接种到相应培养基斜面上,4℃冰箱保存,同时采用-80℃甘油管冻存。
1.2.4 内生细菌种属鉴定及分类统计 将内生细菌培养至指数期,利用通用引物27f:5′-AGAGTTTG ATCCTGGTCAG-3′,1492r:5′-TACGGCTACCTTGT TACGACTT-3′[20],扩增细菌16S rDNA序列。50 μL反应体系:2×pfu Mix 25 μL;上下游引物各2 μL(10 pmol),ddH2O 17 μL;菌液4 μL。反应程序:95℃预变性5 min;94℃变性1 min;55℃退火1 min;72℃延伸2 min;35个循环;72℃延伸10 min。PCR产物由生工生物工程(上海)有限公司测序并拼接后,在GenBank数据库中进行BLAST检索,寻找具有较高相似性(≥97%)的16S rDNA序列,并确定该序列所属的门和属,参照《伯杰氏细菌系统分类学手册》[21]对内生细菌进行分类。
1.3 拮抗菌的筛选及鉴定
1.3.1 内生细菌的平板拮抗测定 方法参考文献[22]。根癌土壤杆菌菌悬液由ATCC 23308T和TA-AT-2按1﹕1体积混和而成。1.3.2 温室防病效果测定 分别挑取产生抑菌圈的菌株、ATCC 23308T和TA-AT-2于NB中28℃、200 r/min培养18—24 h,调整发酵液浓度至108 CFU/mL。将ATCC 23308T和TA-AT-2发酵液按1﹕1体积混和而成(以下简称病原菌发酵液)。将拮抗菌发酵液和病原菌发酵液以5﹕1体积比混和,接种出苗7 d左右的向日葵子叶下方[23]。以体积比5﹕1的无菌水与病原菌发酵液的混和液作为对照。每个处理包括10株向日葵苗,3个重复。放置于28℃培养室内,7 d后观察根瘤产生情况,20 d后用游标卡尺测量根瘤的直径和向日葵茎粗。统计发病率和病情指数[24],计算拮抗菌的防病效果。采用SAS软件对数据进行差异显著性分析(P≤0.05)。
1.3.3 菌株16S rDNA序列测定与初步鉴定 16S rDNA序列扩增同1.2.4。PCR产物经1.2%的琼脂糖凝胶电泳后,紫外灯下快速切胶、回收。回收步骤参照AxyPrep DNA凝胶回收试剂盒(康宁生命科学有限公司)说明书进行。参照零背景pTOPO-Blunt平末端克隆试剂盒(北京艾德莱生物科技有限公司)说明进行克隆。选取阳性克隆送至生工生物工程(上海)股份有限公司测序。使用MEGA 6进行系统发育分析。
1.3.4 菌株形态和生理生化特性 按照《常见细菌系统鉴定手册》[25]对拮抗菌株的菌落和菌体形态、氧化酶、接触酶等生理生化特性进行测定;采用Biolog全自动微生物鉴定系统的Biolog GEN II微孔板测定菌株对碳源的发酵利用。
1.4 绿色荧光蛋白(GFP)标记菌株的构建及其生物学特性测定
1.4.1 制备感受态细胞 以2%的比例将过夜培养的拮抗菌菌液接种于NB培养基中,28℃,200 r/min振荡培养至OD600=0.4左右,冰上预冷15 min。4℃,5 000 r/min离心20 min收集菌体,用预冷的无菌水重悬菌体,重复2次。离心后用无菌冷藏的10%甘油悬浮菌体,重复3次。最后再重悬于10%甘油中,100 μL/管分装于1.5 mL离心管中,液氮速冻后于-80℃冰箱中保存。1.4.2 电击转化 将1.4.1中感受态细胞分别与pBBR1MCS-2质粒混合后进行电击转化[26]。电击后加入1 mL不含Kana的LB液体培养基,28℃、200 r/min培养4 h复苏菌体。取菌液100 μL涂布于含Kana的LB固体培养基平板上,28℃培养24 h。
1.4.3 转化子的验证 将1.4.2中培养的平板直接在OLYMPUS SZX16荧光体式显微镜下观察,对照原始菌株,通过观察菌落发出的绿色荧光直接筛选阳性转化子,挑取阳性转化子转接于Kana抗性平板上,同时采用-80℃甘油管冻存。
1.4.4 标记菌株与原始菌株的生物学特性比较 生长曲线、稳定性测定均参考文献[27]。培养条件为28℃、200 r/min,每隔2 h测定菌液的OD600。抑菌活性比较参照1.3.1。温室防病效果比较参照1.3.2。
1.5 标记菌株在番茄根际的定殖
接种方法参考文献[22]。拮抗菌菌悬液浓度为108 CFU/mL,病原菌菌悬液浓度为107 CFU/mL。共3个处理,分别对应2个标记菌株的接种处理和无菌水接种的对照处理,每处理10株番茄苗,2个重复。分别于第0、3、10、30天取样,激光扫描共聚焦显微镜观察定殖情况并采用平板稀释法测定菌株定殖量[27]。2 结果
2.1 桃“西北13-1”不同处理枝条内生菌群的差异分析
2.1.1 桃树枝条内生细菌分离 对不同处理的桃枝条进行内生细菌的分离培养,结果在TSA平板上均可长出大量菌落,且菌落形态存在明显差异,说明桃树枝条中存在大量种类不同的内生细菌。对从不同处理的枝条内所分离的内生细菌进行计数(CFU/g鲜重),分别为0 D/9.9、10 DI/3.9×104、10 DM/4.5×102、60 DI/5.6 ×104、60 DM/2.2×104。随着枝条成长,内生细菌的数量逐渐增加。接种10 d时,接种枝条内的细菌数量是对照处理的近100倍,表明病原菌的侵入引起了枝条内生菌群数量的急剧增加。而接种60 d时接种处理仅为对照的2.5倍,表明枝条内生菌群变化趋于平稳。选择形态差异明显的菌落进行平板划线纯化,共得到108株内生细菌。其中0 D 3株,10 DI 27株,10 DM 25株,60 DI 26株,60 DM 27株。2.1.2 内生细菌的鉴定 对纯化的108株内生细菌的16S rDNA进行PCR扩增,均能够得到大小1.5 kb的目的片段。测序比对,这108株细菌分别属于5个细菌类群中的17个属。其中伽马变形菌类(Gammaproteobacteria)和阿尔法变形菌类(Alphaproteobacteria)为优势菌群,分别占43.5%和32.7%;其次为放线菌类(Actinobacteria),占15.0%;剩余两类分别为厚壁菌类(Firmicutes)和拟杆菌(Bacteroidetes),各占8.0%和0.8%(图1-A)。其中,伽马变形菌类的泛菌属(Pantoea,37.03%)、根瘤菌属(Rhizobium,12.23%)和肠杆菌属(Enterobacter,7.59%),阿尔法变形菌类的土壤杆菌属(Agrobacterium,23.15%),放线菌类的短杆菌属(Brevibacterium,14.64%)组成了总分离菌的94.62%(图1-B)。
2.1.3 内生细菌不同种群在不同处理枝条中的分布情况 除0 d及10 d的对照枝条外,革兰氏阴性细菌的数量(CFU)均达到了105;而革兰氏阳性细菌只有在60 d的接种枝条中其数量才上升至105。在0 d时,革兰氏阴性细菌与革兰氏阳性细菌的数量没有明显差异。接种病原菌后显著刺激了革兰氏阴性细菌的上升,尤其接种10 d时,枝条内革兰氏阴性细菌的数量为革兰氏阳性细菌的7 800倍,但这种差异在60 d时不再明显,仅为2倍。对照枝条中,革兰氏阴性细菌的数量也大于革兰氏阳性细菌,10 d时为革兰氏阳性细菌数量的6倍,60 d时则为10倍。
在门水平上看(图2-A),随着枝条由嫩变老,内生细菌的数量也逐渐增加;同时,根癌土壤杆菌的接种也刺激了菌群的增长,接种处理的菌群数量显著高于清水对照。其中伽马变形菌类存在于接种前后的各个时期,是数量最多,分布最广泛的一个类群。其数量在0 d时为33,10 d时数量上升至104,60 d时则达105,即随枝条变老而上升。其次是阿尔法变形菌类,除了新生嫩枝没有分离到以外,其他接种枝条和对照都有阿尔法变形菌分布。病原菌的接种显著刺激了阿尔法变形菌的上升,尤其接种10 d后,枝条内的阿尔法变形菌数量为对照的300倍。放线菌类则主要存在于60 d的枝条中,接种枝条中的数量是对照的近10倍。而厚壁菌类却主要集中于对照枝条中,在接种枝条中几乎分离不到厚壁菌。拟杆菌仅存在于接种60 d的枝条中。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1桃树枝条各类内生细菌的分离频率
A:桃树枝条内生细菌在门水平的分布情况; B:桃树枝条内生细菌在属水平的分布情况
-->Fig. 1Isolation frequency of various endophytic bacteria from ‘Xibei 13-1’ twigs
A:Distribution of endophytic bacteria on phylum in ‘Xibei 13-1’ twigs; B:Distribution of endophytic bacteria on genus in ‘Xibei 13-1’ twigs
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同处理枝条中内生细菌菌群组成的差异
A:不同处理枝条中内生细菌菌群在门水平的分布情况; B:不同处理枝条中内生细菌菌群在属水平的分布情况
-->Fig. 2Differences in the composition of endophytic bacteria in ‘Xibei 13-1’ twigs in different treatments
A:Distribution of endophytic bacteria composition on phylum in ‘Xibei 13-1’ twigs in different treatments; B:Distribution of endophytic bacteria composition on genus in ‘Xibei 13-1’ twigs in different treatments
-->
在属水平上看(图2-B),只有肠杆菌属分布于各处理中,其数量由于接种刺激而显著上升,具体为10 d时为对照处理数量的34倍,60 d时为对照的210倍。数量最多的泛菌属存在接种刺激效应,尤其接种10 d时接种枝条是对照枝条中泛菌的655倍,但这种差异在60 d时不再明显,仅为2倍;根瘤菌属与泛菌属趋势类似,10 d时接种处理为对照处理数量的151倍,而60 d时仅为1.05倍。土壤杆菌属几乎只存在于接种枝条中且数量很多,但土壤杆菌与根瘤菌数量都随时间推移而下降。其他属细菌都只存在于某个时间点或某个处理中。
2.2 拮抗细菌的筛选及鉴定
2.2.1 拮抗细菌的筛选 通过平板拮抗测定,从108株桃树枝条内生细菌中筛选获得14株拮抗菌,它们都能形成抑菌圈且长势良好。这14株拮抗菌分别属于6个属,其中根瘤菌属4株;泛菌属4株;肠杆菌属2株;假单胞菌属(Pseudomonas)2株; 短小杆菌属(Curtobacterium)1株;葡萄球菌属(Staphylococcus)1株。以向日葵为感病植物,测定这14株待选拮抗菌的防病效果。接种7 d后,对照组发病严重,病情指数为65.83。菌株10DM4-1和10DI2-2与病原菌混和接种向日葵后形成的根癌瘤大小明显小于对照组(图3),发病率分别降低了60.0%和63.3%;所形成的根癌瘤直径大约为0.3 cm×0.5 cm,明显小于对照组的根癌瘤直径(0.6 cm×1.0 cm);病情指数明显降低,防治效果分别为86.08%和89.87%(表1)。其余12株待选拮抗菌对根癌土壤杆菌侵染向日葵形成根癌瘤有一定的抑制作用,但防治效果不及10DM4-1和10DI2-2。
Table 1
表1
表1拮抗菌对根癌土壤杆菌侵染向日葵形成根癌瘤的抑制作用
Table 1Suppression effect of antagonistic bacteria on gall formation caused by A. tumefaciens in sunflowers
| 菌株 Strain | 病情指数 Disease index | 防治效果 Control efficacy (%) |
|---|---|---|
| 10DM4-1 | 9.17±1.44b | 86.08±2.19a |
| 10DI2-2 | 6.67±5.77b | 89.87±8.77a |
| 10DM4-1-gfp | 13.33±2.89b | 79.74±4.39a |
| 10DI2-2-gfp | 5.83±5.20b | 91.14±7.90a |
| CK | 65.83±3.82a | — |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3拮抗菌对根癌土壤杆菌侵染向日葵形成根癌瘤的抑制作用
-->Fig. 3Suppression effect of antagonists on crown gall formation caused by A. tumefaciens in sunflower seedlings
A: CK; B: 10DM4-1; C: 10DI2-2; D: 10DM4-1-gfp; E: 10DI2-2-gfp
-->
2.2.2 拮抗菌的菌落形态和生理生化特性 菌株10DM4-1在NA培养基上的单菌落圆形扁平,呈黄色,表面光滑,边缘整齐。革兰氏染色阴性,接触酶反应阳性,不水解明胶等。根据菌体形态特征、生化特性及Biolog测定结果(表2),初步判定10DM4-1为Pantoea deleyi[28-30]。菌株10DI2-2在NA培养基上的单菌落圆形中凸,呈淡黄色,表面光滑黏稠。革兰氏染色阴性,能水解七叶灵等。根据菌体形态特征、生化特性及Biolog测定结果(表3),初步判定10DI2-2为Enterobacter cowanii[31-32]。
2.2.3 16S rDNA序列测定及其系统发育分析 菌株10DM4-1和10DI2-2的16S rDNA序列已提交至GenBank,登录号分别为KY451836和KY451837。16S rDNA序列比对结果显示,10DM4-1与P. deleyi(EF688011)相似性达98.94%,且与其在系统发育树同一分支(图4-A),结合形态学特征和生理生化特性,将10DM4-1鉴定为P. deleyi。10DI2-2的16S rDNA序列与E. cowanii(AJ508303)序列相似性达99.56%,且与其在系统发育树同一分支(图4-B),结合形态学特征和生理生化特性,将10DI2-2鉴定为E. cowanii。
2.3 GFP标记菌株的检测及其生物学测定
2.3.1 转化子的荧光检测 将电转复苏后的菌液涂布于Kana抗性平板上,培养1 d后长出许多小菌落,在荧光体式显微镜下观察这些菌落,均发出强烈的绿色荧光。挑取单克隆转接后,菌落同样发出强烈的绿色荧光(图5-A、5-B),证明含有绿色荧光蛋白的质粒在目标菌株中成功表达。10DM4-1和10DI2-2的绿色荧光蛋白标记菌株分别命名为10DM4-1-gfp和10DI2-2-gfp。Table 2
表2
表2菌株10DM4-1的形态和生理生化特征鉴定结果
Table 2Morphology and physiological, biochemical characteristics identity of strain 10DM4-1
| 特征 Characteristics | 10DM4-1 | Pantoea deleyi |
|---|---|---|
| 形态 Morphology | 短杆状 Short rods | 短杆状 Short rods |
| 革兰氏染色 Gram stain | - | - |
| 接触酶 Catalase reaction | + | + |
| 氧化酶 Oxidase reaction | - | - |
| 明胶水解 Degradation of gelatin | - | - |
| 碳源利用Carbon source utilization | ||
| 糖原Glycogen | - | - |
| 吐温40 Tween40 | + | + |
| 吐温80 Tween80 | + | + |
| 核糖醇Adonitol | - | - |
| L-阿拉伯糖L-Arabinose | + | + |
| D-阿拉伯醇D-Arabitol | + | + |
| i-赤藓糖醇i-erythritol | - | - |
| D-果糖D-Fructose | + | + |
| L-岩藻糖L-Fucose | - | - |
| D-半乳糖D-Galactose | + | + |
| 龙胆二糖Gentiobiose | + | + |
| α-D-葡萄糖α-D-Glucose | + | + |
| m-肌醇m-inositol | + | + |
| 乳果糖Lactulose | - | - |
| 麦芽糖Maltose | + | + |
| D-甘露糖D-Mannose | + | + |
| D-阿洛酮糖D-Psicose | + | + |
| D-棉籽糖D-Raffinose | - | - |
| L-鼠李糖L-Rhamnose | + | + |
| D-山梨醇D-Sorbitol | w | - |
| 蔗糖Sucrose | + | + |
| D-海藻糖D-trehalose | + | + |
| 木糖醇Xylitol | - | - |
| 顺乌头酸Cis-aconitic acid | + | + |
| 丙二酸Malonic acid | + | + |
| L-丙氨酸L-Alanine | + | + |
| L-脯氨酸L-Proline | + | + |
| D-丝氨酸D-Serine | - | - |
| 甘油Glycerol | + | + |
新窗口打开
Table 3
表3
表3菌株10DI2-2的形态和生理生化特征鉴定结果
Table 3Morphology and physiological, biochemical characteristics identity of strain 10DI2-2
| 特征 Characteristics | 10DI2-2 | Enterobacter cowanii |
|---|---|---|
| 形态 Morphology | 杆状 Rods | 杆状 Rods |
| 革兰氏染色 Gram stain | - | - |
| 接触酶 Catalase reaction | + | + |
| 氧化酶 Oxidase reaction | - | - |
| 明胶水解 Degradation of gelatin | - | - |
| 七叶灵水解 Aesculin hydrolysis | + | + |
| 甲基红试验 Methyl red test | - | - |
| 碳源利用Carbon source utilization | ||
| 核糖醇Adonitol | - | - |
| L-阿拉伯糖L-Arabinose | + | + |
| 纤维二糖Cellobiose | + | + |
| D-果糖D-Fructose | + | + |
| L-岩藻糖L-Fucose | - | - |
| D-半乳糖D-Galactose | + | + |
| 龙胆二糖Gentiobiose | + | + |
| 麦芽糖Maltose | + | + |
| D-甘露醇D-Mannitol | + | + |
| D-甘露糖D-Mannose | + | + |
| D-蜜二糖D-Melibiose | + | + |
| D-棉籽糖D-Raffinose | + | + |
| L-鼠李糖L-Rhamnose | + | + |
| D-山梨醇D-Sorbitol | + | + |
| 蔗糖Sucrose | + | + |
| 松二糖Turanose | - | - |
| 木糖醇Xylitol | - | - |
| 柠檬酸Citric acid | + | + |
| 腐胺Putrescine | - | - |
| 甘油Glycerol | + | + |
新窗口打开
2.3.2 标记菌株的生物学特性 在相同培养条件下,标记前后菌株的生长曲线变化趋势基本相同,在培养6 h后进入对数生长期,12 h后进入稳定生长期,20 h后开始衰亡。荧光镜检结果表明连续转接10次后,菌落仍然保持均匀而且强烈的绿色荧光,标记菌株质粒的稳定性接近100%。10DM4-1、10DM4-1-gfp、10DI2-2和10DI2-2-gfp对根癌土壤杆菌形成的抑菌圈直径(mm)分别为12.29±1.02a、13.41±0.52a、12.47±0.78a和13.44±0.94a,平板抑菌活性检测及温室防病效果测定(表1)的结果表明标记菌株10DM4-1-gfp、10DI2-2-gfp分别与原始菌株10DM4-1、10DI2-2对根癌土壤杆菌的抑菌活性无明显差异。结果证明外源质粒的存在及GFP的表达未对菌株10DM4-1和10DI2-2的生理代谢、生防功能产生明显的不利影响。
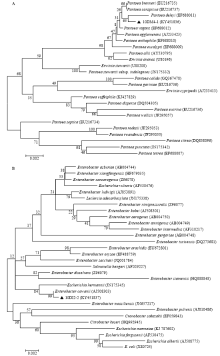 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4基于16S rDNA序列构建的系统发育树
-->Fig. 416S rDNA phylogenetic tree of strain 10DM4-1 and 10DI2-2
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5转化子的荧光检测
A:10DM4-1-gfp的荧光显微镜观察; B:10DI2-2-gfp的荧光显微镜观察
-->Fig. 5Identification of transformants by fluorescence under fluorescence microscope
A:Fluorescence detection of strain 10DM4-1-gfp under fluorescence microscope;B: Fluorescence detection of strain 10DI2-2-gfp under fluorescence microscope
-->
2.4 标记菌株在番茄根际的定殖
定殖试验结果表明,10DM4-1-gfp和10DI2-2-gfp灌根当天的初始菌量接近108 CFU/g,3 d后种群数量迅速下降至106 CFU/g,随后下降速度稍缓,10 d后种群数量约为104 CFU/g,30 d后标记菌株仍然能被检测到且数量级趋于稳定,同样约为104 CFU/g。用蔡司激光共聚焦显微镜观察到,灌根当天10DM4-1-gfp和10DI2-2-gfp的绿色菌体大量定殖在番茄根围,形成一层绿色的保护膜,处理3 d后绿色菌体的数量迅速下降,标记菌株大量进入细胞间隙,10 d及30 d之后标记菌株在番茄根部的定殖动态变化不大,在30 d后根部细胞间隙能明显观测到绿色菌群(图6)。对照组在接种3 d后没有发现任何荧光,表明该番茄根组织没有背景荧光。3 讨论
植物内生细菌指能定殖在健康植物组织内,并与植物建立了和谐联合关系的一类微生物[33]。植物内生细菌的菌群会随环境的改变而发生变化,以此增加寄主植物对环境的适应性[10]。为验证桃的内生细菌是否也会增加桃对病害的抗性,本研究选取了对根癌病具有获得抗性的桃单株“西北13-1”进行分析。从“西北13-1”的枝条中分离出了多种内生细菌,绝大多数为泛菌属、肠杆菌属和根瘤菌属,并且其菌群数量在接种根癌土壤杆菌后急剧增加,这说明在桃的内生细菌中,泛菌属、肠杆菌属和根瘤菌属的菌群数量变化与接种根癌土壤杆菌相关。值得指出的是,筛选到的产抑菌圈的菌株大部分都属于这3类细菌。以上结果暗示了桃“西北13-1”对桃根癌病的获得抗性或许与其内生细菌的菌群有关。使用生防菌是防控根癌病的有效方法。通过平板拮抗测定获得了14株拮抗根癌土壤杆菌的细菌,进一步从中筛选出两个有明显防治效果的菌株10DM4-1和10DI2-2,经鉴定分别为泛菌属P. deleyi和肠杆菌属E. cowanii。虽然泛菌可防治青霉病、火疫病等[34-35];肠杆菌对干腐病、青枯病等具有良好的防治效果[36-37],但目前未见泛菌属和肠杆菌属防控根癌病的报道。本研究结果表明泛菌属和肠杆菌属中存在可用于防控根癌病的生防菌资源,这为生物防治桃根癌病提供了新的思路。
生防菌的防治效果受多种因素影响,其中菌株的定殖能力是重要因素。目前常用的生防菌大多来自植物根际土壤,其生长易受外界环境影响,难于长期稳定定殖,这极大的影响了实际防病效果[8]。分离于植物组织内的内生菌,因受到植物组织的保护,可稳定定殖。因此,来自植物组织内的内生生防菌相对于根际生防菌,可能具有更稳定的防治效果。根内定殖试验表明,本研究获得的两株拮抗菌在接种番茄30 d后仍可在根细胞间隙观察到,并且其数量保持稳定,说明两株拮抗菌均可稳定定殖于寄主植物,具有良好的应用前景。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6激光扫描共聚焦显微镜观察灌根30天后标记菌株在番茄根际的定殖情况
A—C:10DM4-1-gfp的暗场、明场及叠加;D—F:10DI2-2-gfp的暗场、明场及叠加
-->Fig. 6Colonization images of 10DM4-1-gfp and 10DI2-2-gfp on tomato roots after 30 days of root irrigation by laser scanning confocal microscope
Fluorescence (GFP) micrographs of tomato roots are taken under dark fields (A, D), bright fields (B, E) and merge fields (C, F) using a Zeiss LSM880 fluorescent microscopy, respectively. A-C: Strain 10DM4-1-gfp; D-F: Strain 10DI2-2-gfp
-->
内生菌的生防机制主要是通过产生拮抗物质和酶类、与病原菌竞争营养物质和生态位、诱导寄主植物产生系统抗性及防卫信号等方式,持续抑制病原菌的生长和入侵[6]。本研究获得的两株生防菌可以产生明显的抑菌圈,这说明它们均产生抗菌物质,但具体成分仍需进一步测定。番茄根部定殖试验发现初期生防菌10DM4-1和10DI2-2可大量定殖在番茄根围;随后进入根部细胞间隙,将细胞包裹起来,形成绿色的保护膜;最后稳定存在于细胞间隙。这说明它们在番茄根组织内具有良好的生存和定殖能力,可能通过与病原菌竞争营养物质和生态位来抑制根癌土壤杆菌的入侵。
4 结论
“西北13-1”内生的肠杆菌、泛菌和根瘤菌可能与其对根癌病的抗性有关。获得两株对根癌病的防治具有良好应用前景的生防菌株,占据有利的生态位和产生抗菌物质是其发挥生防作用的重要机制。研究结果为进一步利用内生生防菌资源和根癌病的生物防治提供了材料及依据。The authors have declared that no competing interests exist.
