0 引言
【研究意义】捕食性天敌-猎物关系是生态系统中最普遍的基本关系,对生态群落的发展具有重要意义[1-2]。自然界中捕食性天敌与猎物的作用关系除了直接的取食消耗(consumptive effect),还存在间接的胁迫效应(non-consumptive effect)[3-4]。这种胁迫压力带来的影响在生物界中十分广泛,对猎物具有深远的意义[5-8]。了解天敌与猎物之间的直接与间接关系,是利用天敌防治害虫,优化生态系统结构的必要基础。【前人研究进展】目前,关于捕食胁迫风险对猎物的影响已涉及多种昆虫,包括蜻蜓目[9-10]、蜉蝣目[11-12]、双翅目[13-15]、直翅目[2,16]、同翅目[17]、鳞翅目[18-19]等昆虫。现有的研究表明,捕食胁迫会造成猎物的发育加快或者减缓[11,15,20]、致死率升高[10]、变态成功率下降[21-22],而猎物的应激反应往往在捕食者取食近源物种下最强烈[23-24]。捕食性天敌胁迫压力能够引起猎物分子水平上的生理反应,如压力蛋白(即热激蛋白,一般在热激反应方面研究较多)表达量的上调[9,25-26],糖皮质激素水平升高[27-28]。棉铃虫(Helicoverpa armigera)食性杂,其寄主植物多达200多种,曾给中国棉花生产造成过巨大的经济损失[29]。Bt棉的种植虽然有效地控制了棉铃虫的暴发,但其抗药性问题不容忽视[30-32]。生物防治作为一种有效的替代手段,符合绿色植保的发展理念,也是实现到2020年农药使用量零增长行动目标的有力落脚点。目前,异色瓢虫(Harmonia axyridis)在生物防治领域应用广泛,其适生性强,成虫和高龄幼虫均可大量捕食各类蚜虫、多种介壳虫、木虱、螨类、鳞翅目与鞘翅目昆虫的卵、低龄幼虫和蛹等[33-37]。【本研究切入点】以异色瓢虫和棉铃虫建立的胁迫体系研究却寥寥无几,棉铃虫受异色瓢虫胁迫的影响有待阐明。【拟解决的关键问题】通过设置不同食源的捕食性瓢虫胁迫处理,探讨:(1)棉铃虫是否能感知外界胁迫的存在,并对异色瓢虫食源表现出敏感性;(2)胁迫下的棉铃虫是否会缩短发育历期,以躲避被捕食风险;(3)胁迫下的棉铃虫是否会表现出一定的权衡效应,即发育历期的缩短或延长是否会对变态发育造成一定的负面影响;(4)胁迫压力能否引起棉铃虫分子层面的生理反应。1 材料与方法
试验于2012年9月至2015年9月在中国农业大学完成。1.1 供试昆虫
供试棉铃虫幼虫采自河北邯郸棉田,在无天敌环境下,饲养于中国农业大学有害生物综合治理实验室。幼虫用人工饲料单管饲养[38],成虫羽化后饲喂10%蜂蜜水。选取发育、繁殖情况稳定良好的棉铃虫幼虫进行胁迫试验。捕食性天敌异色瓢虫采自北京市农林科学院植物保护环境保护研究所试验田,室内以豆蚜(Aphis craccivora)饲喂扩繁,仅取异色瓢虫成虫用于胁迫试验。所有试虫均在人工气候箱中饲养,饲养温度(25±2)℃,相对湿度(75±5)%,光周期14L﹕10D。瓢虫胁迫处理在全程安静的环境中进行,尽量避免人为干扰。1.2 试剂
RNAiso Plus(Trizol)、反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser、荧光定量染料SYBR Premix Ex TaqTM购自TaKaRa公司;PCR MasterMix购自宝如亿(北京)生物技术有限公司;IPTG、Amp购自TaKaRa公司;X-gal购自北京拜尔迪生物有限公司;DNA胶回收试剂盒Gel Extraction Kit购自Omega公司;克隆载体pEASY-T1 Cloning Vector、感受态细胞购自北京全式金生物技术有限公司;PCR引物由上海生工生物工程公司合成;其他试剂均为国产AR级或进口分装AR级产品。1.3 异色瓢虫胁迫对棉铃虫生长发育的影响
取同日孵化、活性良好一致的棉铃虫初孵幼虫为试验材料,棉铃虫以人工饲料为食物源。试验共设置以下7组处理用以分析异色瓢虫取食不同食物对棉铃虫的胁迫效果,胁迫设置直至棉铃虫成虫羽化。(1)饥饿处理:将棉铃虫和人工饲料放入经灭菌的透明试管(直径1.8 cm×长9.6 cm)中,以灭菌纱布封口,保持良好透气性。将试管平铺在灭菌的塑料养虫盒(22 cm×15 cm× 8 cm)底部,每盒投放30头不供给食物的饥饿瓢虫,每日添加瓢虫以维持瓢虫数量;(2)虾卵处理:同批次虾卵购买于北京市官园花鸟虫鱼市场。将装有棉铃虫的试管平铺在塑料养虫盒内,每盒投放30头异色瓢虫,并投放充足的虾卵,瓢虫以虾卵为食物来源;(3)棉铃虫幼虫处理:将装有棉铃虫的试管平铺在塑料养虫盒内,每盒投放30头异色瓢虫,并投放充足的棉铃虫1龄幼虫,瓢虫以棉铃虫1龄幼虫为食物来源;(4)棉铃虫卵处理:将装有棉铃虫的试管平铺在塑料养虫盒内,每盒投放30头异色瓢虫,并投放充足的棉铃虫卵,瓢虫以棉铃虫卵为食物来源;(5)蚜虫处理:将装有棉铃虫的试管平铺在塑料养虫盒内,每盒投放30头异色瓢虫,并投放充足的蚜虫,瓢虫以蚜虫为食物来源;(6)蚜虫对照处理:将装有棉铃虫的试管平铺在塑料养虫盒内,不投放瓢虫,只投放蚜虫作对照,排除蚜虫释放信号的干扰;(7)对照处理:将装有棉铃虫的试管平铺在塑料养虫盒内,不投放瓢虫。羽化成虫单独饲养,继续观察寿命直至成虫死亡。7个处理彼此隔离,设置3次重复,每个重复包含50头棉铃虫,观察统计棉铃虫各虫态的发育历期(刨除不能正常化蛹、羽化的个体),统计3日龄蛹重、化蛹率、羽化失败率和成虫卷翅率。1.4 异色瓢虫长时和短时胁迫对棉铃虫压力蛋白基因表达的影响
长时胁迫取样:取发育进度一致、活性良好的初孵棉铃虫幼虫600头单头饲养,棉铃虫以人工饲料为食物源。将试虫分为2个处理:(1)长时胁迫处理:置于有30头异色瓢虫存在的养虫盒内饲养,瓢虫以蚜虫为食物来源;(2)对照处理:置于无瓢虫存在的养虫盒内饲养。分别在棉铃虫幼虫5个龄期、预蛹期、第3日龄蛹期和第3日龄成虫期取样,对蛹和成虫分雌、雄取样。于棉铃虫发育过程中的每个取样点取3个生物学重复。
短时胁迫取样:取发育进度一致、活性良好的棉铃虫3龄幼虫300头单头饲养,棉铃虫以人工饲料为食物源。将试虫分为2个处理:(1)短时胁迫处理:置于有30头异色瓢虫存在的养虫盒内,瓢虫以蚜虫为食物来源;(2)对照处理:置于无瓢虫存在的养虫盒内饲养。分别在胁迫进行15 min、30 min、1 h、1.5 h、2 h、3 h、6 h时间点取样。每个取样点取3个生物学重复。
借助Trizol法对棉铃虫样本进行RNA提取,反转录生成cDNA。借助实时荧光定量PCR(qRT-PCR)检测压力蛋白基因(热激蛋白基因)Hsp70和Hsp90、热激同源蛋白基因Hsc70的表达量。根据GenBank已公布的基因序列和发表的文章[39],设计qRT-PCR引物(表1)。在qRT-PCR之前,通过测序保证PCR产物是目的基因片段,PCR扩增程序:94℃预变性5 min;94℃ 30 s,60℃ 30 s,72℃ 60 s,35个循环;72℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测后,将回收的目的条带与克隆载体连接,转化到大肠杆菌内,37℃培养过夜。菌落进行蓝白斑筛选,随机选取阳性克隆送至北京擎科生物技术有限公司测序。基因的相对表达量检测在Bio-RAD CFX Connect Real-Time System仪器上进行。选取棉铃虫EF-1α为内参基因[40-44]。qRT-PCR反应程序:95℃预变性10 min;95℃,15 s,60℃,30 s,72℃,35 s,40个循环,此外再加上qRT-PCR仪器自带的熔解步骤。检测所取样本中目的基因和内参基因的Ct值,每个样本设置3次点样重复,基因相对表达量的计算采用2-ΔΔCt方法[45]进行。
Table 1
表1
表1实时荧光定量PCR所用引物
Table 1Primers used for qRT-PCR
| 引物名称Primer name | 序列Sequence (5′ to 3′) | 登录号GenBank accession number | 片段大小Size (bp) |
|---|---|---|---|
| HSP70F | CCGTAGCTTATGGTGCCG | FJ432703 | 176 |
| HSP70R | CTGAGTCTGCTTGGTGGG | ||
| HSP90F | GAAGCGTGAGGAAGACAAGG | GU230740 | 166 |
| HSP90R | CATGATACGCTCCATGTTGG | ||
| HSC70F | CGACTGCTGCTGCGATTGC | XM_021342205 | 174 |
| HSC70R | CGAAGTCCTCTCCTCCCAAGTG | ||
| EFF | AGGAGTTGCGTCGTGGTTA | U20129 | 236 |
| EFR | GACTTGATGGACTTAGGGTTGT |
新窗口打开
1.5 数据分析
数据分析采用Tukey比较和独立样本t检验方法进行,P<0.05视为差异显著。所有统计分析借助SPASS 16.0软件包完成。2 结果
2.1 不同食源异色瓢虫胁迫对棉铃虫发育历期的影响
不同食源的瓢虫胁迫显著缩短了棉铃虫幼虫历期、蛹历期和棉铃虫的总寿命,瓢虫以蚜虫为食源时,棉铃虫幼虫历期缩短最显著;以棉铃虫卵为食源时,棉铃虫蛹历期缩短最显著;以虾卵为食源时,棉铃虫总寿命缩短最显著。在7个处理之间,瓢虫胁迫后棉铃虫雌雄蛾寿命虽然有缩短的趋势,但7个处理间无显著性差异。在比较的5个指标中,蚜虫对照处理与对照处理均不存在显著性差异,排除了瓢虫取食蚜虫胁迫处理中可能因蚜虫存在而引起的干扰因素。将总胁迫处理与总对照处理进行比较,棉铃虫幼虫历期、蛹历期、雌雄蛾寿命以及总寿命在胁迫因子存在下均显著性缩短(表2)。Table 2
表2
表2不同食源异色瓢虫胁迫对棉铃虫发育历期的影响
Table 2Effects of Ha. axyridis stress with various feeding resources on the developmental duration of He. armigera (d)
| 处理 Treatment | 幼虫历期 Larval duration | 蛹历期 Pupal duration | 雌蛾寿命 Female longevity | 雄蛾寿命 Male longevity | 总寿命 Total longevity |
|---|---|---|---|---|---|
| 饥饿处理Hungry treatment | 14.60±0.20c | 11.63±0.24bc | 6.31±0.23 | 7.98±0.63 | 33.38±0.23b |
| 虾卵处理Shrimp egg treatment | 14.46±0.14c | 11.99±0.14b | 5.59±0.15 | 7.09±0.09 | 32.79±0.19b |
| 棉铃虫幼虫处理 Cotton bollworm larva treatment | 14.68±0.18c | 12.06±0.11b | 6.55±0.15 | 7.66±0.26 | 33.85±0.35b |
| 棉铃虫卵处理 Cotton bollworm egg treatment | 15.43±0.32b | 11.33±0.12c | 6.52±0.75 | 7.85±0.51 | 33.95±0.37b |
| 蚜虫处理Aphid treatment | 14.30±0.33c | 12.14±0.05b | 6.49±0.18 | 7.06±0.04 | 33.21±0.37b |
| 蚜虫对照处理CK treatment with aphid | 16.32±0.08ab | 12.97±0.12a | 7.79±0.73 | 8.35±0.81 | 37.37±0.66a |
| 对照处理CK treatment | 16.63±0.11a | 13.20±0.05a | 7.47±0.40 | 8.90±0.61 | 38.02±0.12a |
| F6,14 | 19.375 | 25.815 | 2.753 | 1.718 | 33.547 |
| P | <0.001 | <0.001 | 0.056 | 0.189 | <0.001 |
| 总胁迫处理Total stress treatment | 14.69±0.14 | 11.83±0.10 | 6.29±0.17 | 7.53±0.18 | 33.44±0.16 |
| 总对照处理Total CK treatment | 16.48±0.09 | 13.09±0.08 | 7.63±0.38 | 8.63±0.47 | 37.69±0.33 |
| t | 7.681 | 10.114 | 3.741 | 2.712 | 12.801 |
| df | 19 | 17.886 | 19 | 19 | 19 |
| P | <0.001 | <0.001 | 0.001 | 0.014 | <0.001 |
新窗口打开
2.2 不同食源异色瓢虫胁迫对棉铃虫变态发育的影响
不同食源的瓢虫胁迫处理显著提高了棉铃虫成虫卷翅率,瓢虫以棉铃虫卵为食源时,棉铃虫成虫卷翅率提高最显著;以棉铃虫幼虫为食源时,成虫卷翅率提高程度最小。在7个处理之间,瓢虫胁迫后棉铃虫蛹重和化蛹率有下降趋势、羽化失败率有提高趋势,但7个处理间无显著性差异。在比较的5个指标中,蚜虫对照处理与对照处理均不存在显著性差异,排除了瓢虫取食蚜虫胁迫处理中可能因蚜虫存在而引起的干扰因素。将总胁迫处理与总对照处理进行比较,在胁迫因子存在下,棉铃虫蛹重和化蛹率均显著下降,成虫卷翅率显著性上升(表3)。Table 3
表3
表3不同食源异色瓢虫胁迫对棉铃虫变态发育的影响
Table 3Effects of Ha. axyridis stress with various feeding resources on the metamorphosis of He. armigera
| 处理 Treatment | 蛹重 Pupae weight (mg) | 化蛹率 Pupation rate (%) | 羽化失败率 Fail eclosion rate (%) | 卷翅率 Wrinkled-wing rate (%) |
|---|---|---|---|---|
| 饥饿处理Hungry treatment | 243.1±5.1 | 62.67±1.76 | 34.15±1.95 | 31.67±1.67a |
| 虾卵处理Shrimp egg treatment | 243.4±3.8 | 62.00±3.06 | 29.92±11.18 | 30.00±1.53ab |
| 棉铃虫幼虫处理Cotton bollworm larva treatment | 238.8±4.7 | 62.00±6.43 | 38.56±3.88 | 28.33±2.03ab |
| 棉铃虫卵处理Cotton bollworm egg treatment | 239.6±1.4 | 64.00±3.06 | 27.33±8.53 | 31.89±0.11a |
| 蚜虫处理Aphid treatment | 244.1±2.4 | 64.00±4.16 | 26.37±5.77 | 31.00±1.15a |
| 蚜虫对照处理CK treatment with aphid | 253.0±4.1 | 68.33±2.20 | 25.30±1.22 | 20.67±2.73bc |
| 对照处理CK treatment | 254.4±6.5 | 71.00±5.51 | 23.29±5.05 | 18.00±2.93c |
| F6,14 | 2.055 | 0.731 | 0.734 | 8.450 |
| P | 0.125 | 0.633 | 0.630 | 0.001 |
| 总胁迫处理Total stress treatment | 241.8±1.53 | 62.93±1.54 | 31.27±2.93 | 30.58±0.65 |
| 总对照处理Total CK treatment | 253.7±3.5 | 69.67±2.72 | 24.30±2.36 | 19.33±1.89 |
| t | 3.698 | 2.269 | 1.415 | 7.255 |
| df | 19 | 19 | 19 | 19 |
| P | 0.002 | 0.035 | 0.173 | <0.001 |
新窗口打开
2.3 异色瓢虫长时胁迫对压力蛋白基因表达的影响
对比胁迫与对照处理的棉铃虫各个虫态压力蛋白基因Hsp70的表达量(图1),结果表明胁迫与对照处理Hsp70的相对表达量随虫龄变化趋势较为一致,在1—2龄阶段低水平表达,3—4龄阶段出现表达峰值(胁迫处理:F9,20=17.277,P<0.001;对照处理:F9,20=15.212,P<0.001)。胁迫处理中3龄幼虫Hsp70的表达量显著升高(t=7.980,df=4,P=0.001),而其他发育阶段,胁迫与对照处理间不存在显著性差异(1龄:t=0.406,df=4,P=0.705;2龄:t=0.251,df=4,P=0.814;4龄:t=2.136,df=4,P=0.100;5龄:t=1.893, df=4,P=0.131;预蛹:t=0.008,df=4,P=0.994;雌蛹:t=1.951,df=4,P=0.123;雄蛹:t=1.393,df=4,P=0.236;雌蛾:t=1.258,df=4,P=0.277;雄蛾:t=2.356,df=4,P=0.078)。对Hsp90表达量检测结果表明(图1),在对照处理中,Hsp90在蛹期和成虫期表达水平较高(F9,20=81.327,P<0.001),在棉铃虫各个生长发育阶段,胁迫与对照处理之间均无显著性差异(1龄:t=1.782,df=4,P=0.149;2龄:t=4.098,df=2.014,P=0.054;3龄:t=2.737,df=4,P=0.052;4龄:t=1.185,df=4,P=0.302;5龄:t=0.650,df=2.182,P=0.577;预蛹:t=0.374,df=4,P=0.728;雌蛹:t=1.017,df=4,P=0.367;雄蛹:t=0.657,df=4,P=0.547; 雌蛾:t=0.741,df=2.022,P=0.535;雄蛾:t=2.348,df=2.044,P=0.141)。在对照处理中,热激同源蛋白基因Hsc70在蛹期和成虫期表达水平高(F9,20=299.092,P<0.001)。棉铃虫在进入5龄后,胁迫处理中Hsc70表达有上调趋势,其中在棉铃虫5龄幼虫期、预蛹期、雄蛹期、雌蛾期,胁迫处理中Hsc70表达水平显著高于对照处理(5龄:t=11.48,df=4,P<0.001;预蛹期:t=39.998,df=4,P<0.001;雄蛹期:t=3.046,df=4,P=0.038;雌蛾期:t=3.976,df=4,P=0.016)。而在棉铃虫其他发育阶段,胁迫与对照处理间无显著性差异(1龄:t=0.538,df=4,P=0.619;2龄:t=2.392,df=4,P=0.075;
3龄:t=1.583,df=2.261,P=0.240;4龄:t=0.048,df=4,P=0.964;雌蛹:t=2.638,df=2.239,P=0.106;雄蛾:t=3.184,df=2.013,P=0.085)(图1)。
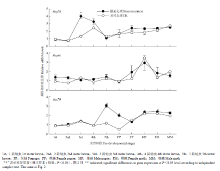 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1异色瓢虫长时胁迫对棉铃虫各发育阶段Hsp70、Hsp90、Hsc70表达的影响
-->Fig. 1Effects of Ha. axyridis long-term stress on Hsp70, Hsp90 and Hsc70 expression during the various developmental stages of He. armigera
-->
2.4 异色瓢虫短时胁迫对压力蛋白基因表达的影响
无胁迫因子存在下,棉铃虫3龄幼虫3个压力蛋白基因的表达水平比较稳定(Hsp70:F6,14=1.650,P=0.206;Hsp90:F6,14=5.590,P=0.004;Hsc70:F6,14=2.412,P=0.082)。短时胁迫后,棉铃虫3龄幼虫Hsp70和Hsp90的表达有上调趋势,Hsp70在胁迫开始30 min至3 h内表达量显著提升(30 min:t=5.269,df=4,P=0.006;1 h:t=3.538,df=4,P=0.024;1.5 h:t=4.559,df=2.02,P=0.044;2 h:t=4.478,df=4,P=0.011;3 h:t=3.183,df=4,P=0.033);Hsp90在胁迫开始15 min、1.5 h、2 h和6 h时间点表达量显著提升(15 min:t=3.057,df=4,P=0.038;1.5 h:t=4.391,df=4,P=0.012;2 h:t=13.06,df=4,P<0.001;6 h:t=10.895,df=4,P<0.001)。而短时胁迫处理后,棉铃虫Hsc70的表达水平没有出现显著性变化(15 min:t=0.777,df=2.008,P=0.518;30 min:t=0.660,df=2.180,P=0.572;1 h:t=1.462,df=4,P=0.217;1.5 h:t=0.310,df=4,P=0.772;2 h:t=1.042,df=2.029,P=0.406;3 h:t=2.094,df=4,P=0.104;6 h:t=3.035,df=2.132,P=0.086)。综合短时胁迫各时间点数据,结果表明棉铃虫3龄幼虫受到短时胁迫后,Hsp70和Hsp90表达增强,Hsc70表达无显著性变化(Hsp70:t=6.520,df=40,P<0.001;Hsp90:t=3.884,df=40,P<0.001;Hsc70:t=0.383,df=32.867,P=0.704)(图2)。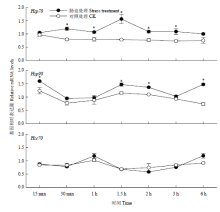 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2异色瓢虫短时胁迫对棉铃虫Hsp70、Hsp90、Hsc70基因表达的影响
-->Fig. 2Effects of Ha. axyridis short-term stress on Hsp70, Hsp90 and Hsc70 expression of He. armigera
-->
3 讨论
捕食胁迫作用可能引起猎物发育加快或者减慢,猎物选择哪种策略与其生态特点相关,同时取决于哪种策略有利于其增加存活率[14-15,20]。本试验表明捕食性天敌异色瓢虫的胁迫导致棉铃虫各虫态发育历期及成虫寿命的缩短,此现象在笔者实验室之前的研究中也有类似发现[19]。异色瓢虫倾向于取食棉铃虫低龄幼虫,对高龄幼虫的捕食现象偶然才会发生,棉铃虫蛹多位于土中被隔离,且蛹壳质地硬,不利于瓢虫捕食,成虫由于生活栖境的改变而免于被瓢虫捕食的风险[35-36]。因此,加快幼虫期的生长发育对于棉铃虫来说,有助于快速脱离被捕食的高风险虫态,逃避捕食风险,增加存活率,这一变化对种群发展具有积极意义。而棉铃虫蛹和成虫发育历期缩短的现象,有可能与加快发育进度的策略有关,也有可能是其他表型变化的副产物。猎物在胁迫下发育变缓或加快,红眼树蛙(Agalychnis callidryas)幼虫阶段受到捕食性蝽(Belostoma spp.)胁迫时会加快发育,而受到觅食水生蜘蛛(Thaumasia spp.)胁迫时,则会减缓发育[20];黑腹果蝇(Drosophila melanogaster)在面对龟纹瓢虫(Propylea japonica)捕食性胁迫的体系中,也表现了不同程度的发育加快现象[15]。猎物对捕食胁迫的适应性反应建立在猎物对胁迫风险的感知和识别的基础之上,猎物是否能够识别环境中的捕食风险,是否有对风险进行分级的能力,将决定猎物采取何种策略[46-49]。天敌取食食源的不同往往为天敌贴上了某种化学信号标签,不同食源的天敌对某一种特定猎物来说所暗示的捕食风险不同。本试验设置7种食源的捕食性瓢虫,棉铃虫幼虫历期、蛹历期和寿命在不同食源的捕食性瓢虫胁迫下具有显著性差异,暗示棉铃虫对不同食源的瓢虫胁迫具有一定的敏感性,但在发育历期的指标上,这种敏感性没有得到规律性体现,这可能与棉铃虫对风险评估的敏感性、选取指标的灵敏性等因素有关。BRODIN等[24]设置不同食源的捕食者泉蜓(Aeshna juncea)胁迫一种豆娘(Coenagrion hastulatum)幼虫,食物充足条件下,C. hastulatum的行为防御反应在捕食者取食同源物种的处理下最强烈,这种影响在蜻蜓幼虫发育早期显著,而后期不显著;CHIVERS等[23]通过对豆娘混合种群(Enallagma spp.)幼虫设置不同食源捕食者梭子鱼(Esox lucius)证实,豆娘对豆娘食源环境刺激反应显著比对照强烈,而对黄粉虫(Tenebrio molitor)食源环境反应不明显。这反应了蜻蜓和豆娘幼虫对胁迫程度具有一定的识别能力,将天敌取食食源的不同定为不同的风险等级,进而采取不同强烈程度的适应性反应。因为猎物与其近源猎物拥有共同天敌的概率较大,当近源猎物遭遇捕食时,释放出的危险信号对猎物的警示作用更强,进而更容易采取防御措施抵御或逃避被捕食的风险。
天敌胁迫作用引入的表型变化,有可能在防御反应与发育表现上反应出权衡效应。本试验结果表明加快的发育进度引起了变态成功率不同程度的降低,蛹重和羽化率显著下降,卷翅率显著上升,表明了过快的生长发育对变态过程产生了负面的影响,与权衡理论相符。但5种食源的捕食性瓢虫处理之间,只有卷翅率存在显著性差异,而其他变态指标没有显著性变化,没有体现出不同食源天敌捕食胁迫的敏感性。权衡效应也在其他昆虫中被证实,一种蜉蝣(Baetis bicaudatus)在有捕食性鱼类存在的溪流中表现出变态后个体变小,繁殖力下降的现象[11];一种蚊子(Aedes notoscriptus)暴露于捕食性鱼信号的环境下,存活率提高但发育减缓,变态时体型变小,并且成虫对饥饿的耐受力减弱[50]。翅的对称性是压力反应的可靠指示指标,在捕食性天敌胁迫下,艳丽丝蟌(Lestes sponsa)会降低发育的稳定性,提高后翅的不对称性[22]。MANGEL等[51]认为生物体最大化的生长率能够在之后的生活史中表现出一定代价,因为过快的生长速率降低了细胞与免疫功能的功效,使其对生理压力的抵抗力降低。综上所述,在面对捕食性瓢虫长时胁迫作用下,棉铃虫为了躲避捕食风险和适应环境,表现出了发育加速的现象,而快速的生长发育在一定程度上干扰了变态发育。
自然界中多变的胁迫因子能给生物的生长发育、种群发展与进化造成重要影响,天敌胁迫作用对猎物生理生化方面的影响涉及诸多方面[52-56]。本试验设计长时胁迫和短时胁迫两种水平的胁迫处理,检测2种重要的压力蛋白基因Hsp70和Hsp90,以及热激同源蛋白基因Hsc70的表达量水平,以探讨天敌胁迫是否能够诱导棉铃虫体内压力蛋白基因的表达变化。在长时胁迫下,棉铃虫自5龄幼虫起,Hsc70的表达有上调趋势;在短时胁迫下,Hsp70和Hsp90的表达有上调趋势。可见捕食胁迫,无论是慢性作用还是急性作用,都不同程度地影响了棉铃虫体内压力蛋白基因的表达水平,使其产生了一定的应激反应。棉铃虫压力蛋白基因Hsp70与Hsp90受到短时胁迫的反应较为明显,而热激同源蛋白基因Hsc70受到慢性胁迫刺激的反应更为显著,这可能与三者执行的功能不同有关。尽管捕食压力对生物来说是非常普遍的选择压力,但是目前有关胁迫压力响应的分子机制尚不清楚。在蛋白水平上,心斑绿蟌(Enallagma cyathigerum)在捕食性鱼5 d的胁迫处理下,HSP60表达水平未受影响,而HSP70表达水平显著上调[9];以鱼激素作为捕食者存在的化学信号,大型水蚤(Daphnia magna)在捕食性天敌的胁迫处理下,HSP60在胁迫6 h表达显著上调,24 h后回落[26];鲫鱼(Carassius auratus)在蓝鳃太阳鱼(Lepomis macrochirus)胁迫下,视叶中HSP70在胁迫6 h高水平表达,在12 h表达水平回落,暗示视觉在胁迫中起到重要的作用[25]。综上所述,面对捕食性天敌胁迫,不同种类压力蛋白的表达水平与胁迫处理时间、猎物物种有关,但总体来说,胁迫下的压力蛋白含量呈现出上调或不变的趋势。本试验结果与这一趋势相符,进一步证明捕食性瓢虫胁迫压力能够引起棉铃虫分子层面的生理反应,这种生理反应与应对胁迫压力可能有着密切关系。而且,棉铃虫在胁迫压力作用下的分子生理反应机制,很可能与其在胁迫压力下的生长发育、变态发育等表型变化相关。
4 结论
在面对捕食性瓢虫长时胁迫作用下,棉铃虫为了躲避被捕食风险表现出了发育加速的现象,而快速的生长发育在一定程度上干扰了变态发育,导致蛹重和羽化率显著下降,卷翅率显著上升。棉铃虫对不同食源的天敌捕食胁迫具有不同程度的敏感性,即棉铃虫对潜在的捕食风险可能存在一定的分级能力,但这种分级能力没有得到规律性体现。捕食性瓢虫胁迫压力能够引起棉铃虫分子层面的生理反应,其压力蛋白基因Hsp70与Hsp90受到短时胁迫的反应较为明显,表现为基因表达的上调,而热激同源蛋白基因Hsc70受到慢性胁迫刺激的反应更为显著,同样表现出表达上调的现象,暗示三者在棉铃虫体内执行的功能存在差异,这种生理反应(基因表达水平的变化)可能与应对胁迫压力有着密切的关系。The authors have declared that no competing interests exist.
