0 引言
【研究意义】水稻是典型的单子叶植物,也是重要的粮食作物之一,其花器官的发育直接影响稻米的品质和产量,但水稻花发育的分子机制有待于进一步深入研究。利用一些新发现的水稻花器官异常突变体,克隆更多花发育基因不仅有助于进一步阐明水稻花器官发育的分子机制,同时也可为分子育种提供重要的理论依据。【前人研究进展】水稻小穗具有确定性,即含有2个护颖和一朵可育的小花,1个外稃1个内稃、2个浆片、6个雄蕊和1个雌蕊构成水稻小花的四轮花器官[1]。双子叶植物的花器官由外至内包括花萼、花瓣、雄蕊和雌蕊。通过对双子叶模式植物金鱼草和拟南芥的研究,前人提出了花发育的“ABCDE”模型[2-6],该模型认为A、B、C、D和E这5类基因协同调控双子叶植物花器官的形成和发育,其中任何一类基因发生突变都将引起对应轮次花器官的同源异型转化[7],进而导致花器官的形态和数目发生变化,该模型的部分内容也适用于单子叶植物花器官的发育。除了典型的5大类功能基因外,还有一些基因也参与了水稻颖花发育的过程,如FZP、DL、EG1、MFS1、FON1、FON2/FON4、FON3、fon5、fon6、fon(t)、OsIG1和JMJ706等[8-20]。EG1可以通过高温介导线粒体脂肪酶的通路保护下游花器官特性基因OsMADS1、OsMADS6和OsG1的表达,抵御环境温度波动而促进花器官稳态[21]。SUN等[20]对突变体jmj706的研究表明,JMJ706蛋白通过组蛋白赖氨酸甲基化的途径进行表观遗传修饰,其功能缺失将影响水稻花器官的形态和数目;CLARK等[22]和BLECKRNANN等[23]通过拟南芥clv1、clv2和clv3突变体研究明确了WUS(WUSCHEL)/CLV(CLAVATA)反馈调节环途 径,认为WUS在顶端分生组织中表达后可以诱导分生组织细胞增殖、产生反馈信号CLV3,通过LV1/CLV2/CRN受体复合体激活信号途径在转录水平上降低WUS的表达,而WUS的表达又可反馈调节CLV3的表达,从而形成一个调控花分生组织大小的反馈调节环以维持拟南芥整个花发育过程中分生组织的大小。任何一个CLV发生突变,顶端分生组织以及花序和花分生组织都将变大,而小花和花器官数目增加正是由于花分生组织增大所致[22,24];该反馈调节环也同样适用于水稻花器官数目的调控,关键基因WUS、CLV1和CLV3对应于水稻的OsWUS、FON1和FON4[25]。现已明确FON1是编码一个富含亮氨酸重复序列的受体激酶[12],而FON4则编码一个含有CLE功能域的小分子分泌蛋白[15]。水稻内轮花器官数目增加往往会导致内外稃不能正常闭合,进而严重影响花粉的育性和种子发芽。【本研究切入点】尽管目前与水稻花器官数目相关的基因研究较多,但导致水稻花器官数目异常的分子机制与调控途径尚不清楚。利用甲基磺酸乙酯(EMS)诱变籼稻品种浙农34,获得一个花器官数目异常突变体afon1(abnormal floral organ number1),该突变体中59.64%小穗的花器官数目表现出不同程度的增加,其中大部分小穗仅在内稃一侧产生一个颖壳状器官,且具有外稃的维管束特征;极少数小穗表现2—4轮花器官数目同时增加。【拟解决的关键问题】以花器官数目异常突变体afon1为材料进行详细的形态观察和组织学分析,以明确afon1的表型特征;利用SSR等分子标记对afon1进行精细定位、克隆和序列分析,采用实时荧光定量PCR分析afon1在根、茎、叶和穗各组织中的表达特性以及不同时期花器官数目相关基因在突变体afon1花器官中的表达差异,以进一步明确花器官数目异常突变体的特征和控制花器官数目异常表现的分子机理。1 材料与方法
1.1 供试材料
用EMS诱变籼稻品种浙农34,获得一个能稳定遗传的花器官数目异常突变体afon1。2014年夏在浙江大学紫金港校区试验田用突变体afon1分别与粳稻品种浙农大104和野生型籼稻品种浙农34杂交获得F1,自交后获得F2种子;2015年夏在相同的环境条件下种植亲本、F2定位群体和遗传分析群体。在鉴定温度影响花器官数目变异的试验中,取籼稻品种浙农34和突变体afon1各20粒种植于实验室组培室内进行温度处理,2个处理条件为35℃光照12 h/20℃暗处理12 h、25℃光照12 h/20℃暗处理12 h,3次重复。
1.2 表型分析与花粉育性鉴定
开花期随机取大田和组培室内突变体afon1和野生型的稻穗各5个,在体式显微镜下解剖观察突变体和野生型的花器官形态和数目并统计数目。参照ZENG等[26]的方法在显微镜下观察花粉育性。成熟期随机取突变体afon1和野生型植株各10株,测定其株高(plant height,cm)、分蘖数(number of tillering,个)、穗长(panicle length,cm)、每穗颖花数(number of floret per panicle,粒)、每穗实粒数(number of filled grain per panicle,粒)、千粒重(1 000-grain weight,g)。1.3 发芽势、发芽率测定与石蜡切片观察
随机取突变体afon1和野生型饱满种子各100粒,参照钱春荣等[27]方法测定发芽势和发芽率,3次重复。孕穗期分别取突变体afon1和野生型幼穗,于4℃ FAA固定液中固定24 h,经脱水(乙醇梯度)、透明(二甲苯)、包埋(石蜡)、脱蜡、切片(厚度为10 μm)、染色(1%番红和1%固绿)后,在Nikon ECLIPSETI-SR荧光显微镜下观察。
1.4 扫描电镜观察
取孕穗期花序在4℃ 2.5%戊二醛溶液中固定24 h;0.1 mol·L-1磷酸缓冲液(pH 7.0)漂洗3次,每次15 min;1%锇酸溶液固定1—2 h后取出,用0.1 mol·L-1磷酸缓冲液(pH 7.0)漂洗3次,每次15 min。经乙醇浓度梯度脱水、醋酸异戊酯处理30 min后干燥、镀膜。处理后的样品在Hitachi TM-1000型扫描电镜下观察。1.5 基因定位与测序比对
应用分离群体分组分析法(bulked segregation analysis,BSA)寻找与目的基因连锁的分子标记。分别选取F2定位群体中突变体afon1和野生型植株各10株,剪取等量叶片混合构成突变池和野生型池,参照简易CTAB法[28]提取亲本、基因池和F2定位群体DNA,利用位于水稻12条染色体上并在粳稻浙农大104和籼稻浙农34间具有多态性的280对SSR和InDel分子标记,筛选连锁标记,初步确定目的基因的位置。SSR引物序列参照(http://www.gramene.org/ microsat/),由上海生工生物技术公司合成;InDel分子标记由杭州擎科梓熙生物技术公司合成。PCR反应体系为20 μL,包括10×PCR buffer 2.0 μL、50 ng·μL-1 DNA模板1 μL、2.5 mmol·L-1 dNTPs 0.3 μL、ddH2O 15.7 μL、10 μmol·L-1正反向引物各0.3 μL和5 U·μL-1Taq DNA聚合酶0.4 μL。PCR程序为94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,35个循环;72℃ 10 min,4℃保存。PCR产物经8%非变性聚丙烯酰胺凝胶电泳、快速银染后于观灯片上观察并统计结果[29]。
利用Gramene网站(http://www.gramene.org/)获取粳稻品种日本晴和籼稻品种9311的目的区间基因组序列,于NCBI网站(https://blast.ncbi.nlm.nih. gov/Blast.cgi)进行序列比对,结合使用DNASTAR和Primer 5.0设计开发新的分子标记进行精细定位。根据水稻基因组注释数据库(http://rice.plantbiology. msu.edu/index.shtml)注释候选基因的功能,并对其测序以获得突变基因、突变位点和突变方式。利用生物信息学分析网站(http://smart.embl-heidelberg.de/)和(https://swissmodel.expasy.org/)分析蛋白质序列和结构。
1.6 基因的表达分析
采用Trizol法分别提取突变体afon1和野生型孕穗期时根、茎、叶和穗的总RNA,参照逆转录试剂盒DRR047A(TaKaRa)的操作说明经逆转录合成第一条cDNA链。随后以逆转录合成的第一条cDNA链为模板,参照SYBR Premix Ex TaqⅡ(Tli RNaseH Plus)(RR820A,TaKaRa)的操作方法用荧光定量引物进行实时荧光定量PCR,3次重复。分析不同时期突变体afon1在不同组织中的表达情况,以及参与调控水稻花器官数目的FON1和FON2/4在穗中的表达量,用Actin(上游:5′-GTGGTCGCCCCTCCTGAAAG-3′,下游:5′-GGCTTAGCATTCTTGGGTCCG-3′)作为内参基因进行归一化处理。荧光定量PCR反应在Roche LightCycler96实时荧光定量PCR仪上进行,用2-△△Ct计算方法分析结果。2 结果
2.1 突变体afon1表型分析与农艺性状测定
突变体afon1部分主要农艺性状发生了显著的变化,如株高和千粒重分别比野生型植株增加6.70%和7.27%,每穗实粒数和结实率则分别降低了19.01%和18.84%,其差异均达到显著或极显著水平(图1-A,表1)。内外稃开裂会严重影响花粉的育性。本研究发现,突变体afon1中内外稃开裂小花的花粉育性显著低于野生型植株,仅有18.75%的花粉表现为可育,内外稃闭合状的小花花粉育性则与野生型无显著差异(图1-B—图1-D)。推测内外稃开裂小花的花粉育性显著降低是导致突变体结实率降低的主要原因。发芽试验结果表明,突变体种子的发芽势与发芽率均显著降低,分别比野生型下降25.87%和13.43%(图1-E)。
Table 1
表1
表1突变体afon1和野生型主要农艺性状
Table 1The main agronomic traits of wild type and mutant afon1
| 农艺性状 Agronomic trait | 野生型 Wild type | 突变体 Mutant |
|---|---|---|
| 株高 Plant height (cm) | 89.50±2.30 | 95.49±2.49** |
| 分蘖数 Number of tillering | 6.67±1.32 | 6.55±1.51 |
| 穗长 Panicle length (cm) | 20.90±1.74 | 21.91±1.87 |
| 每穗颖花数 Number of floret in per panicle | 169.14±27.44 | 169.25±25.79 |
| 每穗实粒数 Number of filled grains per panicle | 151.57±27.99 | 122.75±20.70* |
| 结实率 Seed setting rate (%) | 89.48±5.92 | 72.62±5.39** |
| 千粒重 1000-grain weight (g) | 25.45±0.05 | 27.30±0.05** |
新窗口打开
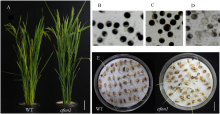 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1突变体afon1和野生型的表型
A:抽穗期野生型与突变体afon1植株形态,Bar=10 cm;B:野生型花粉育性;C:突变体afon1内外稃闭合状花粉育性;D:突变体afon1内外稃开裂状花粉育性;E:野生型与突变体afon1发芽试验,Bar=2 cm
-->Fig. 1Phenotype of wild type and mutant afon1
A: The plant morphology of wild type and mutant afon1 at the heading stage, Bar=10 cm; B: Pollen fertility of wild type; C: Pollen fertility of mutant afon1 with closing hull; D: Pollen fertility of mutant afon1 with opening hull; E: The germination test of wild type and mutant afon1, Bar=2 cm
-->
2.2 突变体afon1形态与组织学观察
营养生长阶段的突变体afon1与野生型植株无明显差异。抽穗后与野生型(图2-A)相比,突变体afon1中59.64%小穗的花器官数目表现不同程度的增加,其中多数小穗仅在内稃一侧产生一个颖壳状的器官,其他轮次花器官数目表现正常(图2-H和图2-K—图2-L)。观察野生型小穗横切面发现,小穗的外稃具有5个维管束(图2-K),而在突变体afon1小穗的横切面中,内稃一侧产生的颖壳状器官也有5个维管束,表明新增的颖壳状器官与外稃具有较高的相似性(图2-L)。小部分小穗表现2—4轮花器官数目同时增加,主要表现为2个外稃、2个退化的片状内稃、3个浆片、7—11个雄蕊、2—3个子房、3个柱头(图2-B—图2-G、图2-I和图2-M—图2-P)。退化的片状内稃出现在两外稃嵌合的位置导致稃片不能正常闭合,四轮花器官同时增加的小穗其花器官数目并非成倍增加(图2-I、图2-M—图2-P),而子房数目增加的小花往往与成熟时形成双米粒有关(图2-J)。突变体在35℃和25℃不同温度培养条件下,分别有61.23%和60.89%的小穗花器官数目出现异常,两者差异不显著,说明温度的变化对突变体afon1花器官数目异常的表型影响不大。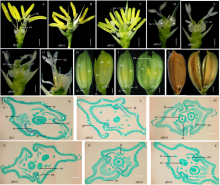 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2突变体afon1与野生型的小花
A:野生型的小花;B、C:突变体afon1雄蕊数目异常;D:突变体afon1的浆片数目异常;E、F:突变体afon1的子房数目异常;G:突变体afon1的柱头数目异常;H、I:野生型和突变体afon1小穗;J:野生型和突变体afon1成熟小穗;K:野生型小穗横切面;L、M、N、O和P:突变体afon1小穗横切面。白色五角星代表雄蕊;黑色五角星代表子房;白色三角形代表浆片;黑色三角形代表柱头;白色四角星代表外稃维管束。A、B、C、K、L、M、N、O和P中,Bar=200 μm;D、E和F中,Bar=100 μm;G中,Bar=50 μm;H、I和J中,Bar=1 mm;sl:不育外稃;gl:颖壳状器官;le:外稃;pa:内稃;st:雄蕊;lo:浆片;ov:子房;sti:柱头
-->Fig. 2The flowers of wild type and afon1
A: Wild type flower; B, C: The stamens of afon1 with abnormal number; D: The lodicules of afon1 with abnormal number; E, F: The ovaries of afon1 with abnormal number; G: The stigmas of afon1 with abnormal number; H, I: The panicles of WT and afon1; J: The mature panicles of WT and afon1; K: The cross-section of wild type panicles; L, M, N, O, P: The cross-section of mutant afon1 panicles. White five-pointed star indicates stamen; black five-pointed star indicates ovary; white triangle indicates lodicule; black triangle indicates stigma; white four-pointed star indicates vascular bundle of lemma. A-C, K-P, Bar=200 μm; D-F, Bar=100 μm; G, Bar=50 μm; H-J, Bar=1 mm; sl: Sterile leman; gl: Glume-like; le: Leman; pa: Palea; st: Stamen; lo: Lodicule; ov: Ovary; sti: Stigma
-->
扫描电镜观察发现花器官在花原基发育的早期就发生了变化,形成内外稃原基时在内稃一侧能观察到颖壳状原基(图3-A),内轮花器官原基分化完全后,可清晰观察到内稃一侧有一个颖壳状器官原基(图3-B)、退化成片状的内稃原基出现在两个外稃嵌合的位置(图3-C)。说明从突变体afon1的花分生组织形成稃片原基开始,各轮花器官原基的数目依次开始发生变化。
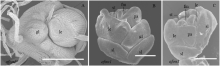 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3小花扫描电镜图
A、B和C:突变体afon1小花扫描电镜图。A中,Bar=200 μm;B和C中,Bar=100 μm;gl:颖壳状器官;sl:退化颖壳;le:外稃;pa:内稃;st:雄蕊;fm:花分生组织
-->Fig. 3Scanning electron micrographs of flower
A, B, C: Scanning electron micrographs of mutant afon1 flowers. A, Bar=200 μm; B and C, Bar=100 μm. gl: Glume-like; sl: Sterile lemma; le: Lemma; pa: Palea; st: Stamen; fm: Floral meristerm
-->
2.3 突变体afon1遗传分析、afon1定位与蛋白质结构分析
突变体afon1与籼稻品种浙农34杂交获得的F1植株表型和花器官数目均与野生型相同。在F2群体中,花器官数目正常的植株有466株,花器官数目异常的植株有156株,分离比符合3:1(χ2=1.03<χ20.05=3.84),说明该突变体afon1性状受一对隐性核基因控制。选用280对分布于水稻12条染色体上、在籼稻浙农34与粳稻浙农大104之间具有多态性的SSR和InDel分子标记,用BSA分池法筛选多态性分子标记。从突变体afon1和浙农大104杂交构建的F2定位群体中随机取46株进行单株验证,将目的基因初步锁定在第1染色体长臂端InDel分子标记1M2(1/46)和1M11(1/46)之间(图4-A)。随后用DNASTAR和Primer 5.0软件在该区间内开发更多具有多态性的分子标记(表2),用上述F2定位群体中的763个植株将基因定位在InDel分子标记1M5(2/763)和1M18(1/763)之间73 kb的范围内(图4-B),该区间内共有6个注释基因(图4-C)。对6个基因进行测序比对后发现,与野生型相比在突变体afon1中仅LOC_Os01g67430发生了单碱基替换。进一步对该基因的cDNA编码框进行扩增和测序比对,发现突变体afon1中LOC_Os01g67430的外显子第565个碱基T突变成A,导致第189个氨基酸由色氨酸突变为精氨酸(图4-D)。对这6个注释基因的功能进行预测分析,发现LOC_Os01g67430是一个脂肪酶基因,总长1 308 bp,仅含一个外显子;其编码产物脂肪酶主要存在于线粒体上,该脂肪酶在茉莉酸合成的初始过程中发挥其催化作用,而植物激素茉莉酸信号途径在小穗分化、花器官形态和数目的确定性过程中扮演着重要的角色[30],说明该基因是突变体afon1的候选基因。因此,推测LOC_Os01g67430的突变导致了突变表型的出现。Table 2
表2
表2部分基因定位多态性引物
Table 2Part of polymorphic markers used for gene mapping
| 标记 Marker | 正向引物 Forward sequence (5′-3′) | 反向引物 Reverse sequence (5′-3′) |
|---|---|---|
| RM315 1M2 1M4 1M5 1M18 1M15 1M11 | GAGGTACTTCCTCCGTTTCAC GCAAGGAGAGAGTACAGAGC CGCGGTGATTATCCCACCAC AGCTAACCGCCGAAAGGGA CGGGTTAGTGTAAGTGTCA AAAGCGGCGAGGTTAC ATAATTCCACAAGGTATGCTGC | AGTCAGCTCACTGTGCAGTG AGTTATCTACTTGCACACCAAA ATCGCTCAGGTAGCTAGGCTT CGGGCTCCAAGGACATACC GCGGGTGAGGATTTG TTTGTTTCGGGGTTCTT GGTCCAACATCTCCTCCTCC |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4afon1在水稻第1染色体上的具体位置和测序结果
A、B:afon1在水稻第1染色体上的连锁图谱;C:该区间内的候选基因;D:突变体afon1和野生型的cDNA测序比对结果
-->Fig. 4The detail location of afon1 on the chromosome 1 and the result of sequencing in rice
A, B: Linkage map of afon1 on chromosome 1 in rice; C: The candidate genes on the region; D: The cDNA sequencing result of mutant afon1 and WT
-->
蛋白质序列比对和结构分析还发现,蛋白质序列中含有一个Lipase_3结构域(图5-A),由于结构域内的突变以致蛋白质的空间结构发生了明显变化(图5-B和图5-C)。
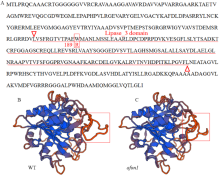 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5AFON1蛋白序列和结构
A:AFON1蛋白序列;B、C:AFON1蛋白结构
-->Fig. 5The sequence and structure of AFON1
A: Sequence of AFON1; B, C: Structure of AFON1
-->
2.4 水稻花器官发育相关基因的表达分析
为明确afon1在水稻花器官发育过程中的时空表达模式,利用实时荧光定量PCR检测afon1在根、茎、叶及不同穗发育时期的表达量。结果发现,afon1在根、茎、叶和穗中都有表达。其中,afon1在穗长度<4.0 cm(早中期)时的表达量显著高于其他组织(图6-A和图6-B),当穗长>4.1 cm(后期)后在各组织中的表达量则无显著差异(图6-C),说明afon1主要在花器官发育早期发挥调控作用。由于SUZAKI等[12]在研究突变体fon1时发现FON1在水稻整个花分生组织中表达,而FON2/4仅在花分生组织顶端的几层细胞中表达[13,15],2个基因均是作为顶端分生组织反馈调节环途径中的主要基因共同参与调控花器官的数目。猜测在穗发育早期,LOC_Os01g67430发生单碱基突变后使FON1和FON2/4在花分生组织中的表达量增加,引起花分生组织变大,从而导致突变体afon1的花器官数目增加。因此,利用实时荧光定量PCR分析了不同时期FON1、FON2/4和afon1的表达差异(表3)。与野生型植株相比,FON1、FON2/4和afon1在穗长度<1.0 cm(早期)时的表达量均显著增加,分别提高了2.6、1.7和3.9倍(图6-D);当穗长为1.1—4.0 cm(中期)时,FON1和afon1在花器官中的表达量仍显著增加,而FON2/4无显著变化(图6-E);当穗长>4.1 cm(后期)时,FON1、FON2/4和afon1表达量均无显著变化(图6-F)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6afon1和花器官数目相关基因的相对表达量分析
A、B和C:afon1在不同时期不同组织中的相对表达量;D、E和F:不同时期花器官数目相关基因在穗中的相对表达量
-->Fig. 6Relative expression analysis of afon1 and associated genes of floral organ number
A, B, C: Relative expression of afon1 in different tissues at different stages; D, E, F: Relative expression of flower organ number development-associated genes in floral organ at different stages
-->
Table 3
表3
表3qRT-PCR引物
Table 3Primers for qRT-PCR
| 基因 Gene | 正向引物 Forward sequence (5′-3′) | 反向引物 Reverse sequence (5′-3′) |
|---|---|---|
| FON1 FON2/4 afon1 Actin | GCTGGCTCCTACGGCTACA GTTGCTCTGCTGCTTGTTG GTGCTACAAGGCGTTCGACCTGGAC GTGGTCGCCCCTCCTGAAAG | GCCGTAGGAGCCAGCAAT TCTCATCCGATTCCTACGT TACGTCGCGGTGTCCACCGACG GGCTTAGCATTCTTGGGTCCG |
新窗口打开
3 讨论
水稻花器官的发育是一个复杂的生物学过程,参与该过程的基因很多,其中任何一个基因发生功能性突变都有可能导致花器官表现异常[30]。水稻正常小穗的小花数目、各轮花器官数目具有恒定性[11,30],但本研究报道的突变体afon1有59.64%小花花器官数目失去恒定性而表现不同程度的增加,以内稃一侧多一个颖壳状器官为主,极少数小穗因多子房多小花而出现双米粒表型进而导致该粒粒重显著增加。通过基因定位将afon1定位在水稻第1染色体长臂端InDel标记1M5和1M18之间,物理距离为73 kb。目前,国内外已报道了很多水稻花器官数目异常突变体,如fon(1-6)[12-17]、fon(t)[18]、mfs1[11]、eg1[10]和snb[31]。分别位于水稻第6、11、11、11、6、未知、6、5、1和7染色体上。未被定位的fon6其突变体表型以双子房为主,雄蕊数目变化较大,最少仅有1个而最多可达14个[17]。fon1-1和fon1-2属于等位突变体,其中突变体fon1-1仅雌蕊数目发生变化,而突变体fon1-2的70%小花有雌蕊4—5个、雄蕊7—12个,其余小花均有额外的浆片和稃片状的器官[12]。FON2和FON4也是一对等位基因,其中,FON2的3个等位突变体fon2-1、fon2-2和fon2-3的雄蕊数目分别增加2.9、2.2和2.0倍[13];而fon4表现为一次枝梗数目和花器官数目均增加,具有2—10个心皮、6—10个雄蕊,部分小穗的浆片转化成内外稃状器官[15]。fon3以心皮数目增多为主[14]。fon5内外稃正常,仅雄蕊和雌蕊数目发生变化[16]。fon(t)以浆片同源转化成内外稃、雄蕊和柱头外露为主[18]。mfs1主要表现出在同一个小穗轴上出现多个小花[11]。snb以多个苞片为主[31]。EG1的2个突变体小穗所有轮次花器官的形态和数目均发生异常变化,主要缺陷为增加一个额外的颖壳,较为严重的突变体会失去小花的确定性;其中突变体eg1-2的护颖、浆片和雄蕊表现异常,部分小花护颖数目增加了3—4个而其他花器官数目均表现正常。eg1-1表型缺陷更为严重,在护颖与外稃之间或内外稃之间异位形成多个颖壳状器官,有浆片0—4个(部分增加的浆片出现在稃片外侧、部分浆片还会同源异型转化为稃片状器官),雄蕊数目有1—12个;心皮数目增减不定,其中部分小穗的心皮可以全部转化成颖壳状器官、极少数小穗的几个心皮甚至会融合而生并伴有11个柱头,个别小穗内部出现两朵小花且各小花第3和4轮花器官数目均表现正常[10]。与上述突变体相比,afon1表型与eg1具有较高的相似性且定位区间相同,与其他突变体不仅定位区间不同,而且表型也具有较大差异,因此笔者猜测afon1可能是eg1的等位突变体。虽然EG1也来源于LOC_Os01g67430,但由于测序比对的结果证实afon1的候选基因LOC_Os01g67430的外显子第565个碱基T突变成A,导致第189个氨基酸由色氨酸突变为精氨酸,因此这两个等位突变体基因的突变位置和植株表型有着明显差异。EG1的eg1-1和eg1-2 2个等位突变体,一个(eg1-1)发生单碱基突变,由C突变为A导致第309位半胱氨酸变成终止密码子;另一个(eg1-2)则是由T突变为A而导致第178位缬氨酸变成天冬氨酸[10]。在植株性状的表型上,突变体afon1各轮花器官数目仅表现增加,并未出现花器官缺失或数目减少的表型,部分小穗出现四轮花器官同时增加;成熟期部分突变体afon1出现双米粒的特性,而这些表型在突变体eg1-1和eg1-2中并未见报道。EG1是现今发现的第一个调节水稻花器官稳定性的可塑基因[21],由于EG1与环境之间的互作,突变体eg1花器官形态和数目表现较高的可塑性,EG1的活性随环境温度的升高而增强,极高温条件下花器官缺陷更为明显,而低温环境下花器官无任何异常;该基因通过高温介导线粒体脂肪酶通路保护下游的花器官特性基因OsMADS1、OsMADS6和OsG1的表达,抵御环境温度波动进而促进花器官稳态。而本试验的突变体afon1表型几乎不受环境温度的影响。
本研究通过实时荧光定量PCR分析发现,afon1仅在花器官发育早中期参与水稻花器官发育的调控过程,且通过增加花器官数目相关基因的表达而发挥其调控作用。穗发育早期2个基因的表达量显著增加而后期无显著变化,扫描电镜试验表明花器官原基形成早期就能清晰地观察到数目异常的花器官。由此推测基因afon1可能主要在花器官原基形成早期,通过正调控的形式增加水稻花器官数目相关基因在花分生组织中的表达,以改变花分生组织大小,从而影响花器官的数目;但可能由于afon1在各小穗之间的表达有差异,使花器官呈现不同的表型,甚至部分小穗花器官未出现异常。
蛋白质序列比对和结构分析表明,AFON1蛋白序列中含有一个Lipase_3结构域,结构域内单个氨基酸突变导致AFON1蛋白的空间结构发生了明显的变化。因此推测发生在Lipase_3结构域内的突变使AFON1的空间结构发生改变而引起功能变化,进而导致花器官数目增加。由于蛋白空间结构仅发生了局部变化,推测由此引起的蛋白质功能的微弱改变,仅能使59.64%的小穗花器官数目发生变化,以致部分小穗的花器官数目仍能表现正常。此外笔者猜测还可能是因为afon1具有较弱的可塑性且与环境的互作效应较小,部分小穗能维持花器官数目的恒定性。但具体的分子机理与调控途径还需更深入的研究才能加以证实。
4 结论
通过甲基磺酸乙酯诱变获得一个花器官数目异常突变体afon1,其59.64%小穗的花器官数目表现不同程度的增加,株高和千粒重显著增加,而结实率则显著降低。该突变体性状受一对隐性核基因控制,afon1位于水稻第1染色体长臂端InDel标记1M5和1M18之间,物理距离为73 kb;该区间内的LOC_Os01g67430为突变基因afon1,是EG1的等位基因。LOC_Os01g67430外显子中第565个碱基发生替换使对应氨基酸发生变化,进而导致AFON1蛋白空间结构发生变化而引起功能变异。基因afon1主要在花器官原基发育过程中通过正调控的形式增加花器官数目相关基因的表达,从而影响花器官的数目。The authors have declared that no competing interests exist.
