0 引言
【研究意义】大豆花叶病毒(Soybean mosaic virus,SMV)病是中国大豆产区最主要的病害之一,严重影响大豆产量和籽粒品质,一般年份可造成大豆产量损失10%—30%,严重年份或地区甚至造成大面积绝产[1,2]。SMV主要通过受侵染的种子或由蚜虫以非持久性的方式传播,在生产上易造成流行性危害。抗病品种的选育是控制SMV最为经济、有效的措施。转基因技术为广谱、抗性持久的大豆新品种培育提供了强有力的手段。【前人研究进展】目前,在大豆资源中已鉴定出3个控制SMV抗性的显性位点(independent single-dominant SMV resistance loci,R gene),包括Rsv1、Rsv3和Rsv4,分别位于大豆F、B2和D1b连锁群[3,4,5]。尽管R基因可以有效控制SMV的发生,但由于R基因的广泛应用造成的正向选择压力,易导致新型SMV株系的出现和原有品种抗性的逐渐丧失。目前已发现多个SMV株系对Rsv1、Rsv3和Rsv4产生抗性[6,7,8,9]。CHOI等[6]研究表明,部分SMV变异株系甚至可抵制目前已知所有Rsv1等位基因和Rsv3和Rsv4产生抗性。SMV基因组的广泛变异以及与其他病毒基因组之间的重组,导致新型强致病力SMV株系的不断出现[10,11,12,13,14,15]。YANG等[16]对中国境内采集的206个病毒株和589个SMV样本分析表明,新型重组花叶病毒(recombinant Soybean mosaic virus,SMV-R)出现频率达到16.7%—60.0%。因此,培育广谱、抗性持久的大豆新品种对于有效控制SMV危害,保障中国大豆持续稳产具有重要意义。来源于粟酒裂殖酵母(Schizosaccharmyces pombe)的PAC1基因编码由364个氨基酸组成的双链RNA(double- stranded RNA,dsRNA)降解酶。研究表明,PAC1含有dsRNA结合域和核糖核酸酶Ⅲ(RNaseⅢ)结构域,是一类依赖于dsRNA的核糖核酸酶[17]。原核表达研究表明,PAC1可以有效识别和降解dsRNAs,且对dsRNAs序列无特殊要求,对单链RNA(single-stranded RNA,ssRNA)则无降解活性[18]。植物RNA病毒(正链或负链RNA病毒)在复制过程中均产生dsRNA复制中间体。而对于环状单链RNA类病毒来说,由于其主要以滚环模式进行复制,在复制过程中也会产生类似dsRNA的棒状结构[19]。研究表明,PAC1能够以非特异性的方式识别和降解上述两类病毒复制过程中产生的dsRNAs,从而有效抑制植物RNA病毒或类病毒在寄主中的复制和积累[18]。PAC1的这一特点为广谱抗RNA病毒及类病毒转基因作物的创制和培育提供了有效的靶标基因。WATANABE等[20]将PAC1导入烟草,获得的转基因烟草不仅有效抑制烟草花叶病毒(Tobacco mosaic virus,TMV)的侵染,同时对黄瓜花叶病毒(Cucumber mosaic virus,CMV)及马铃薯Y病毒(Potato virus Y,PVY)也具有较好的抑制效果;SANO等[21]将PAC1导入马铃薯中,转基因株系对马铃薯纺锤块状类病毒(Potato spindle tube viroid,PSTVd)的抑制效果达到33%—90%;YAN等[22]利用农杆菌介导法将PAC1成功转入小麦,研究表明,PAC1介导对大麦黄矮病毒(Barley yellow dwarf virus,BYDV)的抗性表现出剂量效应。【本研究切入点】利用PAC1有效识别和降解植物病毒或类病毒dsRNA的特性,将来源于粟酒裂殖酵母的PAC1导入栽培大豆品种,获得对SMV抗性显著提高的转基因大豆。【拟解决的关键问题】利用Southern blot、qRT-PCR等分子检测技术,明确PAC1在转基因大豆中的拷贝数及表达水平。结合田间表型调查及SMV抗性鉴定结果,为广谱抗病毒转基因大豆种质资源创新及新品种培育提供参考依据。1 材料与方法
试验于2013—2016年在吉林省农业科学院转基因植物实验基地(吉林省公主岭市)完成。1.1 材料
栽培大豆品种Williams82由笔者实验室保存,SMV SC-3株系由吉林省农业科学院植物保护研究所提供;重组质粒pBI121-PAC1由中国农业科学院植物保护研究所李世访研究员惠赠。双元表达载体pCAMBIA3300-35S和根癌农杆菌(Agrobacterium tumefaciens)菌株EHA105由笔者实验室保存;大肠杆菌DH5α购自北京TIANGEN公司;KOD FX高保真酶和ExTaq MasterMix聚合酶分别购自日本TOYOBO和北京康为试剂公司;限制性内切酶Sac I和Xba I购自美国Thermo Fisher Scientific公司;Hybood TM-N+尼龙膜和Southern杂交检测试剂盒(DIG High Prime DNA Labeling and Detection Starter KitⅡ)分别购自美国Amersham和德国Roche公司;RNA提取试剂盒EasyPure PlantRNA Kit,反转录试剂盒TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix,qRT-PCR检测试剂盒TransStart Top Green qPCR SuperMix均购自北京全式金公司;草铵膦和除草剂Basta(活性成分为草铵膦)分别购自美国Sigma公司和北京鼎国生物公司;QuickStix PAT/BAR检测试纸购自美国EnviroLogix公司。遗传转化试验中所用的培养基基础成分、植物激素、抗生素等均购自美国Phyto Tech和Sigma公司;基因及引物合成委托南京金斯瑞生物有限公司完成。1.2 方法
1.2.1 植物表达载体构建 根据粟酒裂殖酵母来源的PAC1序列(GenBank登录号:AAU05314.1)设计引物PAC-F1/PAC1-R1(5′-GCTCTAGAATGGGAAG ATTCAAGAGGCATC-3′,5′-GCGAGCTCTCATCTA GCG AATTTTGAATAATCC-3′,下划线分别为Xba I和Sac I酶切位点)。以重组质粒pBI121-PAC1为模板,利用KOD FX高保真酶扩增目的片段PAC1,扩增片段大小为1.1 kb。采用Xba I/Sac I双酶切,将PAC1连接到双元表达载体pCAMBIA3300-35S中,构建植物表达载体pCAMBIA3300-PAC1(图1-A)。在构建的表达载体中,PAC1上游启动子为组成型强启动子CaMV 35S,终止子为NOS,植物筛选标记为草铵膦抗性基因BAR。采用冻融法,将载体质粒导入农杆菌菌株EHA105以备转化。1.2.2 农杆菌介导大豆遗传转化 以大豆栽培品种Williams82为受体品种,采用农杆菌介导法进行大豆遗传转化[23]。用氯气灭菌的大豆成熟种子置于萌发培养基中培养24 h。利用接种刀将萌动大豆种子沿种脐部位剖开,并在子叶节位置轻微划伤。将外植体置于农杆菌菌液中侵染30 min后,转至共培养基中暗培养3—4 d。然后将外植体近轴面朝上转至诱导培养基中,于25℃,16 h光照/8 h黑暗条件下培养2周左右,此时外植体上产生绿色的丛生芽。将丛生芽转至伸长培养基中继续培养,培养条件同上。待抗性芽长至3—5 cm时将其切下,并用1 mg·L-1 IBA浸泡30 s,然后转至生根培养基中生根。待抗性芽长出健壮的根时,将其移栽至温室中生长结实。
1.2.3 转基因植株分子检测及除草剂筛选鉴定 利用PAT/BAR试纸对移栽至温室中的T0代转化再生植株进行检测,具体检测方法参照产品说明书。采用DNA快速提取法提取植株叶片总DNA[24],对PAT/BAR试纸阳性植株进行PCR检测。PAC1检测引物为PAC1-F2/PAC1-R2(5′-GTGGATTGATGTGAT ATCTCCACTG-3′, 5′-GAAGATGGCTCCTCAATCA CAGG-3′),预期扩增片段大小为448 bp。BAR检测引物为BAR-F1/BAR-R1(5′-GCACCATCGTCAACC ACTACATCGAG-3′,5′-TGAAGTCCAGCTGCCAGA AACCCAC-3′),预期扩增片段大小为441 bp。PCR扩增条件为95℃ 5 min;94℃ 30 s,58℃ 45 s,72℃ 1 min,共35个循环;72℃延伸10 min。对T1—T3代转基因株系采用除草剂喷施和PCR进行鉴定筛选。待大豆幼苗长出第一组三出复叶时,喷施500 mg·L-1 Basta,7—14 d后拔除对除草剂Basta敏感的植株。对耐除草剂大豆植株进行PCR检测,检测引物及扩增条件同上。获得的抗Basta且PCR阳性株系用于后续试验。
1.2.4 转基因植株Southern杂交检测 选取T2代PCR阳性植株进行Southern杂交检测。采用高盐CTAB法提取转基因大豆和对照品种叶片总DNA[25]。利用XbaⅠ酶切基因组总DNA(~50 μg),并转移至Hybood TM-N+尼龙膜上。根据载体pCAMBIA3300- pac1中BAR基因序列设计引物(引物序列同上),扩增探针模板。利用DIG随机引物标记试剂盒标记探针,探针制备及杂交程序根据试剂盒说明书进行。
1.2.5 SMV田间抗性鉴定及表型调查 采用人工摩擦接种法,对T2和T3代转基因大豆株系进行抗SMV鉴定。鉴定株系为黄淮和长江流域流行SMV株系SC-3[10]。每个株系种植3垄,每垄30株,随机区组设计,重复3次。待大豆第一对真叶完全展开时,进行人工摩擦接种,期间进行灭蚜处理1—2次。接种35 d后进行SMV抗性调查。参照智海剑等[26]提出的SMV病情分级标准,计算病情指数(disease index,DI)。SMV抗性分级标准为高抗(HR):无可见发病症状,病情指数为DI=0;抗病(R):病情指数为0<DI≤20;中抗(MR):病情指数为20<DI≤35;中感(MS):病情指数为35<DI≤50;感病(S):病情指数为50<DI≤70;高感(HS):DI>70。
在未接种SMV条件下,对T3代转基因大豆株系进行农艺性状调查,调查内容包括生育期(MP)、株高(PH)、分枝数(BN)、节数(NN)、叶形(LS)、花色(FC)、结荚高度(PoH)、种皮颜色(SCC)、种脐色(HC)和百粒重(100SW)。
1.2.6 SMV CP表达分析 选取接种SMV 28 d 后大豆叶片,利用EasyPure Plant RNA Kit提取总RNA。采用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒合成cDNA第一链。SMV CP检测引物为CP-F1/CP-R1(5′-GCCTTTCAGT ATTTTCGGCG-3′,5′-TACTGAGGAATTTGAGAGAT AGAGAGC-3′)。内标基因GmACT11(GenBank登录号:BW652479)检测引物为GmACT-F1/GmACT- R1(5′-ATCTTGACTGAGCGTGGTTATTCC-3′,5′-GC TGGTCCTGGCTGTCTCC-3′)。采用TransStart Top Green qPCR SuperMix试剂盒进行qRT-PCR检测,反应程序为94℃ 30 s;94℃ 5 s,60℃ 30 s,72℃ 10 s,共40个循环。根据内参基因表达量,计算目标基因相对表达量(2-ΔΔCt),每个样品重复3次。
1.2.7 数据分析 采用SPSS(v.17.0)软件对转基因株系与对照在抗性水平及表型性状的差异显著性进行t-检验(P=0.05或0.01)。
2 结果
2.1 转PAC1大豆的获得及分子检测
采用农杆菌介导法,将粟酒裂殖酵母来源的dsRNA降解酶基因PAC1导入大豆栽培品种Williams82。共转化2 600多个外植体,经分化、筛选和再生,获得耐草铵膦(5 mg·L-1)大豆再生植株76株。PAT/BAR试纸和PCR检测结果表明(图1-B、1-C),其中65株能够扩增出目的条带,PAC1扩增条带大小为448 bp,BAR扩增条带大小为441 bp,与预期大小一致,而对照则没有相应的扩增条带,表明外源基因已导入受体大豆品种。本试验条件下,大豆遗传转化效率为2.48%。获得的转基因植株移栽至温室中后均能够正常开花结实,且在表型上与对照无明显差异。对T1—T3代转基因大豆株系喷施除草剂表明,在500 mg·L-1 Basta处理7 d后,对照非转基因大豆植株叶片出现明显的叶片黄化或枯死现象,而转基因植株则表现正常(图1-D)。对耐除草剂转基因大豆进行PCR跟踪检测表明,外源基因在转基因大豆不同代际间能够稳定遗传。
2.2 外源基因整合及拷贝数分析
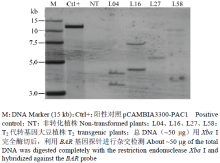
对T2代转基因大豆植株进行Southern杂交检测表明,转基因大豆植株均可以检测到杂交信号,且杂交片段均大于3.24 kb(表达载体中Xba I位点至左边界序列),而对照非转基因大豆则没有杂交条带出现,表明外源基因片段已整合到大豆基因组中(图2)。在检测的4个转基因大豆植株中,外源T-DNA插入拷贝数为1—2个,其中L04和L16为2个拷贝,L27和L58为1个拷贝。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1植物表达载体示意图及转基因大豆植株检测
-->Fig. 1Schematic representation of the vector construct and detection of the transgenic plants
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2转基因大豆外源T-DNA整合及插入拷贝数分析
-->Fig. 2Integration and copy number analysis of T-DNAs in the transgenic plants
-->
2.3 PAC1过表达增强转基因大豆SMV抗性
采用人工摩擦接种法对T2—T3代转基因大豆株系进行田间抗SMV鉴定。结果表明,接种SMV SC-3株系35 d后,对照非转基因植株叶片出现严重花叶、皱缩等典型SMV发病症状,而转基因大豆植株仅部分叶片出现轻微花叶症状,且大部分叶片均无明显的SMV症状(图3),表明PAC1过表达显著抑制了SMV的症状发展。连续2代抗性鉴定结果表明,鉴定的4个转基因大豆株系L04、L16、L27、L57病情指数在11.11—22.22,显著低于对照品种Williams82(病情指数为36.81—46.24),表明转基因大豆SMV抗性水平较对照受体品种显著提高。在鉴定的4个转基因大豆株系中,其中L27病情指数最低,且连续2代抗性鉴定病情指数均为11.11,对SMV表现出稳定的抗性水平。在人工接种条件下,T3代转基因大豆L04和L16及对照品种Williams病情指数较T2代有所提高(表1),其原因可能是由于SMV通过种子在不同世代中积累的缘故。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3接种SMV大豆叶片症状表现
-->Fig. 3Leaf symptoms of soybean inoculated with SMV
-->
Table 1
表1
表1T2和T3代接种SMV抗性鉴定结果
Table 1The resistance identification results of T2 and T3 inoculated with SMV
| 材料 Material | 鉴定株数 Identification number | 病情指数 Disease index | |
|---|---|---|---|
| T2 | T3 | ||
| NT | 90 | 36.81±2.07 | 46.24±0.06 |
| L04 | 90 | 15.42±0.85* | 17.37±2.28* |
| L16 | 90 | 18.51±1.06* | 22.22±0.33* |
| L27 | 90 | 11.11±0.97* | 11.11±0.00* |
| L58 | 90 | 17.64±0.00* | 18.20±2.66* |
新窗口打开
主要农艺性状调查结果表明,在未接种SMV条件下,4个转基因大豆株系与对照受体品种在叶形、花色、种皮色、种脐色、株高、节数、结荚高度、生育期、百粒重等方面没有显著差异(表2),表明外源PAC1整合及表达对转基因大豆没有造成非特异性影响。
2.4 PAC1过表达抑制SMV基因表达及积累
为进一步分析SMV在转基因大豆中的表达和积累,采用qRT-PCR技术对T2代转基因大豆中SMV CP的表达进行了分析。结果表明,在接种SMV 28 d后,转基因大豆CP表达较对照品种极显著下降,表明PAC1过表达显著抑制SMV基因在大豆中的表达及积累,这与田间抗性鉴定结果相一致(图4)。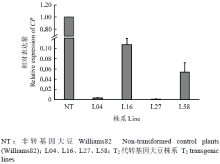 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4T2代转基因大豆中CP表达水平
-->Fig. 4The level of CP expression in the T2 transgenic soybean
-->
Table 2
表2
表2转基因大豆主要农艺性状表现
Table 2Main agronomic traits of the transgenic lines
| 农艺性状 Agronomic trait | 株系Line | ||||
|---|---|---|---|---|---|
| NT | L04 | L16 | L27 | L58 | |
| 叶形Leaf shape | 圆形Circular | 圆形Circular | 圆形Circular | 圆形Circular | 圆形Circular |
| 花色Flower color | 白色White | 白色White | 白色White | 白色White | 白色White |
| 种皮色Seed coat color | 黄色Yellow | 黄色Yellow | 黄色Yellow | 黄色Yellow | 黄色Yellow |
| 种脐色Hilum color | 黑色Black | 黑色Black | 黑色Black | 黑色Black | 黑色Black |
| 生育期Maturity period (d) | 131 | 131 | 131 | 131 | 131 |
| 株高Plant height (cm) | 99.31±5.28 | 100.57±5.17 | 101.86±4.82 | 101.86±4.82 | 99.16±5.81 |
| 分枝数Branching number (/plant) | 4.15±0.52 | 4.26±1.33 | 4.35±1.58 | 4.35±1.58 | 4.52±1.22 |
| 节数Node number (/plant) | 20.98±0.99 | 21.02±1.52 | 20.24±2.06 | 21.79±1.23 | 21.00±1.51 |
| 结荚高度Podding height (cm) | 5.95±1.37 | 6.63±1.44 | 6.21±1.37 | 6.44±1.29 | 6.77±2.07 |
| 百粒重100 seed weight (g) | 17.19±1.21 | 18.06±1.23 | 17.69±1.54 | 17.71±1.81 | 16.87±1.62 |
新窗口打开
3 讨论
由于SMV与寄主、环境之间的互作,病毒基因组之间的重组和变异以及大豆R基因的广泛应用造成的强烈选择压力,造成新型SMV株系不断出现[1,2]。特别是随着国内外大豆种质资源交流的日益频繁,这一趋势将日益明显。转基因技术为广谱、抗性持久的大豆新品种培育提供了强有力的手段。已有的研究表明,利用宿主介导RNAi技术,沉默单个或多个病毒基因,可以显著提高植物抗多种病毒水平,部分转基因株系可以达到高抗或接近免疫水平[27,28]。PAC1作为一类依赖于dsRNA的核糖核酸酶,可以以非特异性的方式,有效降解植物RNA病毒或类病毒在复制过程中产生的dsRNAs,从而有效抑制病毒在寄主中的复制和积累[11],为广谱抗RNA病毒研究提供了有效的靶标基因[29,30,31]。本研究将来源于粟酒裂殖酵母的PAC1导入栽培大豆品种,获得了对中国黄淮和长江流域SMV主要流行株系SC-3抗性显著提高的转基因大豆。接种鉴定表明,转基因大豆叶片仅表现出轻微的花叶症状或无明显SMV症状,且病情指数较对照品种极显著下降。qRT-PCR检测结果也显示,转基因大豆中SMV CP表达水平极显著下降,表明PAC1过表达显著抑制了SMV积累以及SMV症状的发展,从而提高了大豆SMV抗性水平。但本研究仅分析了转PAC1大豆对SMV SC-3株系的抗性,在后续研究中,将进一步分析转PAC1大豆对其他SMV株系或病毒类型如菜豆荚斑驳病毒(Bean pod mottle virus,BPMV)的抗病谱。
另一方面,尽管过表达PAC1限制了SMV症状的发展,但其抗性效果并没有达到高抗或免疫水平,其原因可能与转基因大豆中PAC1表达水平有关。YAN等[22]研究表明,PAC1对病毒抗性存在剂量效应。由于PAC1对SMV复制过程中产生dsRNAs降解低于病毒本身复制速度,或是由于SMV在宿主中以单链正义RNA形式存在,因此,病毒在转基因大豆中仍有一定程度的积累,并在部分叶片上产生轻微的花叶症状。
已有的研究表明,PAC1可以有效识别和降解长链dSRNAs或小发夹RNA分子[21]。在植物细胞中,由于RNA分子间或分子内的序列互补性,会形成类似dsRNA或小发夹RNA的结构[32],因此,PAC1是否会降解植物内源dsRNA或小发夹RNA分子,从而对植物体内正常代谢过程产生非特异性的影响,目前国内外尚没有这方面的报道。不过在本试验条件下,PAC1过表达并没有对转基因大豆农艺性状产生明显影响。关于PAC1对植物内源基因表达及代谢过程的影响还需进一步深入研究。
4 结论
PAC1过表达显著抑制了大豆花叶病毒(SMV)的积累及症状发展,增强了转基因大豆对SMV的抗性水平。在未接种SMV条件下,PAC1表达对转基因大豆没有非特异性影响。The authors have declared that no competing interests exist.
