0 引言
【研究意义】 Glial cell missing(Gcm)与神经发育密切相关,调控果蝇胶质细胞的生成[1,2],同时Gcm通过与多种因子,如GATA和lozenge的相互作用,调控浆细胞的生成、复制和成熟等过程[3]。研究家蚕(Bombyx mori)Gcm有助于解析该基因在家蚕神经发育和造血调控中的功能,为推动家蚕模式化作出贡献。【前人研究进展】Gcm是一小类调控转录因子,其N端含有一个长度约为150个氨基酸残基的保守GCM结构域基序[4]。Gcm首先在果蝇中被鉴定出来,可以直接调控神经元前体细胞分化为胶质细胞,是胶质细胞生成主要调控因子[1-2,5-6]。其功能缺失会导致神经胶质细胞的完全缺失,而过表达则可以激活repo和pnt等相关转录因子[7,8],进而诱导与胶质细胞发育相关基因的表达[9,10,11],促进胶质细胞生成,此外Gcm通过激活ttk抑制神经元的形成[12,13]。而在哺乳动物中,GCMa是胎盘发育所必需的,参与调控滋养层细胞的分化[14,15]。而另一个基因GCMb与甲状旁腺发育相关[16],发生突变会引发甲状旁腺功能减退症[17]。Gcm在果蝇造血中也发挥着重要的调控作用[3],能够促进浆细胞的发生,而抑制结晶细胞生成。Gcm/Gcm2的缺失会导致浆细胞数量明显减少,结晶细胞的数量增多,异位表达Gcm能够诱导浆细胞特异性分子标记基因的表达[18]。除调控血细胞与神经胶质细胞外,果蝇Gcm同时也参与调控腱细胞的分化[15]。Gcm的结构及其调控作用具有高度的保守性,果蝇Gcm1和Gcm2的缺失会致死,而在人中,Gcm主要参与调控胎盘和甲状旁腺,而这两个组织在果蝇中是不存在的[19,20],说明Gcm的功能在不同物种间存在一定的差异[21]。【本研究切入点】家蚕作为一种经典的鳞翅目昆虫代表,其在生物反应器、蚕丝纤维材料和模式生物等方面显示出广阔的前景[22]。目前已经在果蝇中鉴定出两个Gcm同源基因,对其功能进行了详细的解析[3,23]。而在家蚕中,还未见关于Gcm的相关报道。【拟解决的关键问题】通过生物信息学分析和RACE技术鉴定克隆BmGcm,分析其序列和表达特征。利用原核表达、蛋白纯化和免疫小鼠制备多克隆抗体,在细胞水平研究BmGcm蛋白的亚细胞定位,对其功能进行探索。1 材料与方法
试验于2015年9月至2017年3月在家蚕基因组生物学国家重点实验室(西南大学)完成。1.1 材料与试剂
供试家蚕品系为大造,取自西南大学家蚕基因资源库,在正常条件下进行催青和饲养。细胞系BmE-SWU3由笔者实验室建立并保存[24]。RNAiso、PMD19-T simple、限制性内切酶和T4连接酶购自TaKaRa公司,HiFi酶和DNA Marker购自Transgen公司,反转录试剂盒购自Promega公司,Click-iT® EdU Imaging Kits购自Invitrogen公司,胶回收试剂盒购自Axygen公司,RACE试剂盒、BrdU、荧光二抗和细胞爬片购自Invitrogen公司,转染试剂NDE3000由重庆高圣医药提供。质粒DNA试剂盒购自Qiagen公司,Tubulin抗体、DAPI和抗荧光淬灭剂购自碧云天,ECL显色试剂盒购自Thermo scientific公司,测序和所有引物的合成均在华大基因完成。1.2 方法
1.2.1 RNA提取及cDNA的合成 胚胎1—9 d和5龄3 d各组织,包括表皮、头部、中肠、丝腺、精巢、卵巢、脂肪体、血细胞和整蚕等材料,除血细胞直接加入RNAiso外,其他材料在液氮中研磨为粉末后加入RNAiso,提取总RNA。利用1%的琼脂糖凝胶电泳和紫外分光光度计分别对RNA的完整性纯度和浓度进行检测。参照反转录试剂盒说明书反转录得到cDNA模板。1.2.2 全长克隆 以黑腹果蝇(Drosophila melanogaster)的Gcm蛋白作为质询序列,通过检索比对家蚕数据库SilkDB(http://silkworm.genomics.org.cn/)和KAIKObase(http://sgp.dna.affrc.go.-jp/KAIKObase/)获得家蚕gcm同源基因,设计特异性引物并进行PCR扩增,获得部分中间序列。然后设计RACE扩增特异引物GSP1、NGSP1、GSP2和NGSP2(表1),参照RACE试剂盒提供的方法步骤进行5′和3′ RACE扩增。所有PCR产物经切胶回收并连接至pMD19-T-simple载体后进行测序。利用BioEdit软件对测序结果进行拼接,最终获得全长cDNA序列。为了验证RACE结果的准确性,设计了全长cDNA引物并进行PCR扩增。
Table 1
表1
表1引物序列
Table 1Primer sequences
| 引物名称 Primer name | 引物序列 Primer sequence (5′→3′) | 用途 Usage |
|---|---|---|
| F1 | AGGAACACGAACAATCACAATG | 基因克隆 Gene clone |
| R1 | CCGTTGAAAGCGTTCATG | |
| A3-F | AACACCCCGTCCTGCTCACTG | 内参基因扩增Reference gene amplification |
| A3-R | 5GGGCGAGACGTGTGATTTCCT | |
| GSP1 | TGGCGGCACGGGAGGGACATAGGT | 5′ RACE |
| NGSP1 | GGCGGTGGCTGGGAATGAGGATTA | |
| GSP2 | GCGGACCCTTCGTCAGAGCCTTG | 3′ RACE |
| NGSP2 | CGGGCAGGATTGTGTTCAGACTTTGG | |
| F2 | GTTAACATCGTAGGCGG | 全长克隆验证 Full length cloning verification |
| R2 Gcm-qRT-F Gcm-qRT-R GAPDH-qRT-F GAPDH-qRT-R CCNA-qRT-F CCNA-qRT-R CCNB-qRT-F CCNB-qRT-R CCND-qRT-F CCND-qRT-R CCNE-qRT-F CCNE-qRT-R CDK2-qRT-F CDK2-qRT-R | CCAAACCAATGATCACTTGA GACCCTTCGTCAGAGCCTTG GGTGGAAGATGTCGTCAGCC CATTCCGCGTCCCTGTTGCTAAT GCTGCCTCCTTGACCTTTTGC CTCTCAACACCCACCTCAC CGCTGCTATTACTGAGGGT TTGCGAGACCGATACCTTTG AGATTGCTGCCGCTGCTA CCTCAAAGTTTCGTCAGTGTCATC GCATAATCTCCCATTGCCTCA CCCAAGACAATCCAGGCAA AGAGGCGAGTCCACCCCA GGTACACCAGGCGAGGCACTATG CACCAGAGTCGCATCAGCCAAG | 定量PCR Quantitative PCR 定量PCR Quantitative PCR 定量PCR Quantitative PCR 定量PCR Quantitative PCR 定量PCR Quantitative PCR 定量PCR Quantitative PCR 定量PCR Quantitative PCR |
| PE-F (Eco RI) | GgaattcATGTCCGAGGGTGCAGC | 原核表达 Prokaryotic expression |
| PE-R (Xho I) | CCGctcgagTTAAAAGACCGTTGAAAGCGTT | |
| OE-F (Eco RI) | GgaattcATGTCCGAGGGTGCAGC | 亚细胞定位和过表达 Subcellular localization and overexpression |
| OE-R (Xho I) | CCGctcgagTAAAAGACCGTTGAAAGCGTT |
新窗口打开
1.2.3 蛋白序列分析 利用在线工具ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)对BmGcm的表达框ORF进行预测,获得推导的氨基酸序列。利用在线软件SignalP 4.1 Server(http://www.cbs.dtu.dk/ services/SignalP/)对信号肽基序进行预测,利用SMART(http://smart.embl-heidelberg.de/)对蛋白结构特征进行研究,蛋白质分子量和等电点运用Isoelectric point calculator(http://isoelectric.ovh.org/)进行预测。将gcm全长cDNA序列作为质询序列,比对家蚕基因组数据库,获得基因组DNA信息,利用在线工具Splign(https://www.ncbi.nlm.nih.gov/sutils/splign/splign. cgi?textpage=online&level=form)对基因外显子和内含子分布进行分析。
1.2.4 进化分析 从NCBI下载包括智人(Homo sapiens)、小鼠(Mus musculus)和黑腹果蝇等多种物种在内的Gcm蛋白序列,通过Clustalx软件对这些蛋白序列进行比对,将比对结果导入MEGA 6.0软件,以NJ (neighbor-joining)法构建进化树,重复次数为1 000次。
1.2.5 PCR扩增 以胚胎1—9 d和5龄3 d各组织cDNA为模板,对BmGcm进行PCR扩增检测,以肌动蛋白3(Actin3)为内参(引物序列见表1)。PCR扩增反应体系:模板100 ng,10×PCR buffer 2.5 μL,2 mmol·L-1 dNTPs 2 μL,20 μmol·L-1上下游引物各0.5 μL,HiFi-Taq酶0.2 μL,最终加ddH2O至总体积为25 μL。反应体系配制完成并瞬时离心后置入PCR仪进行扩增,扩增条件:94℃预变性2 min;94℃变性30 s、55℃退火30 s、72℃延伸90 s,共30个循环;72℃延伸10 min。取5 μL PCR产物经琼脂糖电泳、EB染色和成像后对BmGcm表达情况进行分析。
1.2.6 实时荧光定量PCR 实时荧光定量PCR所用试剂为TaKaRa公司的SYBR®Premix Ex TaqTM II(Tli RNaseH Plus),所用仪器为Applied Biosystems公司的StepOne PlusTM Real-Time PCR system。定量所用引物见表1,其中以家蚕GAPDH为内参。定量PCR的反应条件:95℃预变性30 s,95℃变性5 s,60℃结合与延伸30 s,循环数为40次。
1.2.7 原核表达、蛋白纯化与抗体制备 利用表达框ORF全长引物扩增得到BmGcm的片段,经EcoR I和Xho I酶切后连接至经同样限制性内切酶处理的pET32a载体中,命名为pET32a-Gcm。测序验证后转化至大肠杆菌Rosseta(DE3)感受态,挑取单菌落,利用PCR技术检测目的质粒是否导入菌体。将阳性克隆接种至LB 培养基,于37℃,220 r/min振荡培养。至OD值达到0.6—1.0时,加入IPTG至终浓度为0.6 mmol·L-1,然后分别置于16、25和37℃进行诱导,诱导时间分别为20、12和4 h,其中以不加IPTG为对照。诱导完成后,低温离心弃上清,收集菌体,用PBS清洗菌体数次重悬于PBS,利用高压破碎仪进行破碎至菌液透亮。高速冷冻离心后分别收集上清蛋白和包涵体蛋白,取8 μL蛋白样品加入2 μL 5×SDS PAGE上样缓冲液,混合均匀后100℃水浴变性30 min。随后将样品注入SDS-PAGE胶进行电泳,经考马斯亮蓝染色后对蛋白的表达情况进行观察。经过比较,最终选择IPTG终浓度为0.6 mmol·L-1,诱导温度为16℃,诱导时间为20 h进行大规模诱导表达Gcm重组蛋白,经Ni+亲和层析法纯化后获得纯度较高的重组蛋白。用纯化的重组蛋白免疫昆明鼠,第1次取50 μg蛋白和等体积的弗氏完全佐剂混合,完全乳化后腹腔注射;第2、3、4次分别取75、100和125 μg蛋白和等体积的弗氏不完全佐剂混合,完全乳化后腹腔注射,每次间隔为10 d。最后一次直接注射150 μg蛋白,3 d后摘取小鼠眼球取血,经梯度离心获得抗血清,加入25%灭菌甘油后分装保存于-80℃。
1.2.8 过表达载体的构建及细胞转染 通过Gcm-CDS引物扩增得到BmGcm全长ORF序列片段,根据BmGcm完整的阅读框序列设计特异性过表达引物,将片段利用EcoR I和Xho I酶切后连接至PIZ-OpIE2-GST-DsRed-SV40载体[25],转化后挑取阳性克隆,测序验证后用于下一步试验,命名为PIZ-OpIE2- BmGcm-GST-DsRed-SV40和PIZ-OpIE2-GST-DsRed- BmGcm-SV40,其中Gcm与GST-DsRed在同一读码框下,共同形成融合蛋白。将无菌玻片铺于24孔细胞培养板,细胞铺板1 d后用无抗Grace培养基培养。转染方法参照谈娟等[26]的报道,即在超净工作台中将0.5 μg PIZ-OpIE2-BmGcm-GST-DsRed-SV40或PIZ- OpIE2-GST-DsRed-BmGcm-SV40质粒添加至100 μL Grace培养基(不抗生素和血清)并轻柔混合均匀,然后加入1.5 μL脂质体并混匀,室温静置30 min后将混合液加入24孔板,6 h 后换液。转染3 d后,一部分孔直接收集细胞进行Western blot检测,另外一部分经多聚甲醛固定和DAPI染色后进行荧光观察。
为了提高转染效率,利用限制性内切酶XhoⅠ和XbaⅠ将PIZ-OpIE2-BmGcm-GST-DsRed-SV40载体中的GST-DsRed元件切除,通过载体自连获得表达BmGcm蛋白的载体,命名为PIZ-OpIE2-BmGcm- SV40。利用同样的方法转染细胞,于转染3 d后进行EDU标记检测、Western blot和流式分析,同时收集RNA材料,用于定量检测。
2 结果
2.1 BmGcm克隆
以智人、小鼠和黑腹果蝇等物种的Gcm同源蛋白序列在家蚕数据库中比对到一个高度相似的同源基因,编号为BGIBMGA006182。该基因定位于4号染色体的nscaf2847上,NCBI登录号为XP_004929375.2。根据预测序列设计引物进行PCR扩增,得到了长度约为1 200 bp的序列。利用RACE技术,扩增得到长度约为500 bp的5′ RACE产物和长度约为450 bp的3′ RACE产物。根据软件拼接得到的全长序列,设计全长引物,成功扩增得到BmGcm,证实RACE结果的准确性。BmGcm基因组DNA全长4 046 bp,由4个外显子和3个内含子构成(图1)。该基因cDNA全长序列为1 734 bp,其中包含一个166 bp的5′ UTR、227 bp的3′ UTR和1 341 bp的完整开放阅读框(ORF),在3′ UTR末端有一个polyA尾(图1)。其cDNA全长编码446个氨基酸残基,其预测蛋白分子量为50.61 kD,等电点为5.557。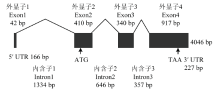 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1BmGcm结构分析
黑色框表示外显子,黑线表示内含子
-->Fig. 1Genomic sequences analysis of BmGcm
Exons and introns are represented by black frames and black lines, respectively
-->
2.2 BmGcm蛋白结构域分析
利用在线工具SMART(http://smart.embl- heidelberg.de/)对BmGcm推导的氨基酸序列进行分析,结果显示在23—163氨基酸之间存在一个典型的GCM结构域。2.3 序列比对分析
下载帝王蝶(Danaus plexippus,DpGcm,EHJ73156.1)、黑腹果蝇(DmGcm,BAA10905.1和DmGcm2,BAB83120.1)以及智人(HsGCMa,NP_003634.2和HsGCMb,NP_004743.1)相应的Gcm蛋白序列,与BmGcm蛋白进行序列比对分析,结果显示这些蛋白在GCM结构域部分具有高度的保守性,而在其他部分差异较大(图2-A)。单独分析GCM结构域的相似性,结果表明BmGcm蛋白的GCM结构域与帝王蝶DpGcm、黑腹果蝇DmGcm、DmGcm2、智人HsGCMa、HsGCMb的序列相似度分别为95%、72%、69%、57%和68%(图2-B)。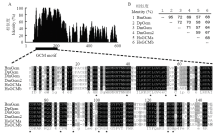 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2家蚕与其他物种Gcm蛋白序列多重比对
-->Fig. 2Multiple alignment of Gcm protein sequence from B. mori and other species
A:BmGcm蛋白与其他物种同源蛋白比对分析 Alignment analysis of BmGcm protein with its homologous protein from other species;B:不同物种Gcm蛋白GCM结构域相似性分析Similarity analysis of the GCM domain from various species。保守的半胱氨酸和组氨酸残基用星号标记 Conserved cysteine and histidine residues are marked with asterisks
-->
2.4 BmGcm进化分析
使用MEGA 6.0软件,利用NJ法构建包括家蚕在内的多物种Gcm蛋白序列进化树,结果显示脊椎动物和无脊椎动物Gcm蛋白分别位于不同的分支上,高等生物如智人和小鼠中均存在两种Gcm蛋白,即GCMa和GCMb,分别构成脊椎动物中的两个分支(图3)。选取了包括棘皮动物、软体动物和节肢动物等多种低等生物进行聚类分析,发现具有很强的规律性,其中家蚕Gcm蛋白与其他昆虫的同源蛋白聚为一类。在大部分昆虫中,双翅目(如冈比亚按蚊Anopheles gambiae、埃及伊蚊Aedes aegypti、黑腹果蝇和家蝇Musca domestica等)中存在两个Gcm同源基因,而在鞘翅目(如赤拟谷盗Tribolium castaneum)、膜翅目(如木蚁Camponotus floridanus、印度跳蚁Harpegnathos saltator和丽蝇蛹集金小蜂Nasonia vitripennis等)和鳞翅目(如帝王蝶和家蚕)等昆虫中只发现一个Gcm。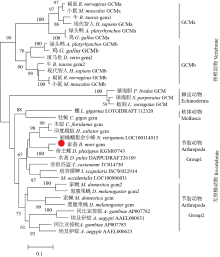 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3家蚕与其他物种Gcm的系统进化分析
-->Fig. 3Evolutionary analysis of Gcm from B. mori and other species
-->
2.5 BmGcm表达分析
利用RT-PCR和荧光定量PCR技术检测了BmGcm在胚胎各时期的表达情况,结果显示其在胚胎第1、2天有表达,第3天时高表达,第4天达到峰值,随后表达水平逐渐降低(图4-A、4-C)。同时,检测了5龄3 d幼虫各组织中的表达情况,结果显示BmGcm在中肠、精巢和卵巢中有表达,而在脂肪体有微弱的表达(图4-B、4-D)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4BmGcm在家蚕胚胎发育时期和幼虫各组织的时空表达分析
-->Fig. 4The temporal and spatial expression of BmGcm at embryonic stage and different tissues of larval stage
A、C:BmGcm在胚胎时期的表达 The expression profile of BmGcm at embryonic development stage;B、D:BmGcm在幼虫各组织中的表达 The expression profile of BmGcm in different tissues at larval stage。Ep:表皮 Epidermis;He:头部Head;Mi:中肠Midgut;Ma:马氏管 Malpighian tubules;Si:丝腺Silk gland;Te:精巢Testis;Ov:卵巢Ovary;Fa:脂肪体Fat body;Ha:血细胞Haemocyte;Wh:整蚕Whole body
-->
2.6 BmGcm原核诱导、蛋白纯化及抗体制备
选择BmGcm全长序列,经PCR扩增后连接至pET32a质粒,重组质粒可以被EcoR I和Xho I酶切开,测序发现无突变,证明构建的pET32a-Gcm质粒是成功的(图5-A)。将pET32a-Gcm转化至大肠杆菌Rosseta (DE3)感受态细胞中,获得重组蛋白表达菌株。在0.6 mmol·L-1 IPTG的诱导下,检测温度对蛋白表达的影响,发现25℃诱导蛋白表达的产量最高(图5-B),所以在后续试验中选择此条件进行大规模的诱导表达。经过镍离子亲和层析纯化,获得了纯度较高的重组蛋白(图5-C)。通过免疫小鼠,最终获得了抗Gcm血清,Western blot检测结果表明该抗体可以特异性识别外源重组BmGcm蛋白(图5-D)。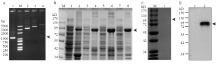 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5BmGcm原核诱导、蛋白纯化及抗体制备
-->Fig. 5The prokaryotic expression and protein purification of BmGcm and antibody preparation
A:pET32a-Gcm原核表达载体的鉴定 The construction of the PET32a-Gcm plasmid。M:DNA分子标准 DNA Marker;1:Gcm扩增产物 PCR product of Gcm;2:PET32a质粒 pET32a vector;3:pET32a-Gcm重组质粒 pET32a-Gcm recombinant plasmid;4:pET32a-Gcm质粒酶切验证 Restriction enzyme digestion analysis of PET32a-Gcm plasmid。B:BmGcm在大肠杆菌中的表达 Induction of BmGcm protein in E. coli。M:蛋白分子标准 Protein Marker;1:未诱导重组菌的上清蛋白 The soluble fraction of recombinant E. coli without induced by IPTG;2:未诱导重组菌包涵体蛋白 The inclusion body of recombinant E. coli without induced by IPTG;3:16℃,0.6 mmol·L-1 IPTG诱导重组菌的上清蛋白 The soluble fraction of recombinant E. coli by 0.6 mmol·L-1 IPTG at 16℃;4:16℃,0.6 mmol·L-1 IPTG诱导重组菌的包涵体蛋白 The inclusion body of recombinant E. coli by 0.6 mmol·L-1 IPTG at 16℃;5:25℃,0.6 mmol·L-1 IPTG诱导重组菌的上清蛋白 The soluble fraction of recombinant E. coli by 0.6 mmol·L-1 IPTG at 25℃;6:25℃,0.6 mmol·L-1 IPTG诱导重组菌的包涵体蛋白 The inclusion body of recombinant E. coli by 0.6 mmol·L-1 IPTG at 25℃;7:37℃,0.6 mmol·L-1 IPTG诱导重组菌的上清蛋白 The soluble fraction of recombinant E. coli by 0.6 mmol·L-1 IPTG at 37℃;8:37℃,0.6 mmol·L-1 IPTG诱导重组菌的包涵体蛋白 The inclusion body of recombinant E. coli by 0.6 mmol·L-1 IPTG at 37℃。C:BmGcm重组蛋白纯化 Purification of BmGcm recombinant protein。M:蛋白分子标准 Protein Marker;1:纯化得到的包涵体蛋白Purified BmGcm protein。D:BmGcm抗体Western blot检测 BmGcm antibody detection with Western blot。1:菌体蛋白 Bacterial protein;2:纯化得到的包涵体蛋白 Purified BmGcm protein
-->
2.7 BmGcm蛋白亚细胞定位
将BmGcm完整的表达框构建至PIZ-OpIE2-GST- DsRed-SV40载体上,获得PIZ-OpIE2-BmGcm-GST- DsRed和 PIZ-OpIE2-GST-DsRed-BmGcm质粒,分别表达BmGcm-GST-DsRed和GST-DsRed-BmGcm两种融合蛋白(图6-A)。转染家蚕BmE-SWU3细胞系3 d后,进行固定和DAPI染色。荧光显微观测结果显示对照质粒EGFP 阳性信号均匀分布于细胞质中,而重组质粒EGFP 信号则只存在于细胞核中(图6-B),说明BmGcm蛋白与其他物种同源蛋白一样,定位于细胞核,是一类核蛋白。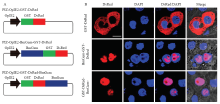 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6BmGcm蛋白在BmE-SWU3细胞系中的亚细胞表达定位
-->Fig. 6The subcellular localization of BmGcm in embryonic cell line BmE-SWU3
A:载体构建策略 The strategy for constructing vector。B:细胞转染PIZ-OpIE2-GST-EGFP、PIZ-OpIE2-BmGcm-GST-DsRed和PIZ-OpIE2-GST- DsRed-BmGcm质粒后观察 The cells transfected with PIZ-OpIE2-GST-EGFP, PIZ-OpIE2-BmGcm-GST-DsRed and PIZ-OpIE2-GST-DsRed-BmGcm plasmids。标尺Scale bar=5 μm
-->
2.8 BmGcm过表达及对周期的影响
对PIZ-OpIE2-GST-DsRed和PIZ-OpIE2-BmGcm- GST-DsRed质粒进行改装,去除了GST-DsRed表达元件(图7-A)。Western blot结果表明PIZ-Gcm质粒能够在家蚕BmE-SWU3细胞中显著上调BmGcm蛋白的表达水平(图7-B)。随后,利用EDU细胞增殖标记对细胞的增殖情况进行研究,结果显示BmGcm过表达组的细胞增殖要低于空载组(图7-C),且差异显著(P<0.05)(图7-D)。同时利用流式细胞仪对细胞周期进行分析,结果显示BmGcm过表达组细胞G1期细胞比例增高,且差异显著(P<0.05),而S期细胞比例显著降低(图7-E、7-F)。同时,利用实时荧光定量PCR技术,对过表达BmGcm前后周期相关调控因子进行检测。如图7-G所示,与对照组相比,过表达BmGcm组除CCNA外,CCNB、CCND、CCNE和CDK2均广泛下调。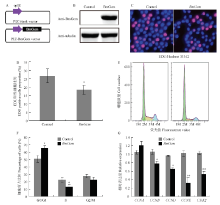 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7过表达BmGcm对家蚕BmE-SWU3细胞的影响
-->Fig. 7The effect of BmGcm overexpressed in B. mori BmE-SWU3 by transient transfection
A:载体构建策略 The strategy for constructing vector;B:Western blot检测过表达细胞中BmGcm蛋白的表达 Expression of BmGcm protein in the transfected cells detected by Western blot;C:EDU检测细胞增殖情况 The proliferate rates of transfected cells detected by EDU staining assay;D:转染细胞增殖率统计 Quantification of transfected cells positive for EDU staining;E:流式分析转染细胞周期(碘化丙啶染色) The cell cycle of transfected cells analyzed by flow cytometry (staining with pyridine iodide);F:流式分析转染细胞周期结果统计分析 Statistical analysis of the results from flow cytometry assay;G:周期相关基因定量检测 Quantitative detection of the genes related to cell cycle。*:P<0.05;**:P<0.01
-->
3 讨论
Gcm作为一类重要的转录因子,在果蝇神经[23,27-28]和血细胞[3,29]发育中发挥着重要的调控功能。在哺乳动物(人和小鼠)以及果蝇等多种物种中均鉴定得到Gcm的同源蛋白,这类蛋白在N端均有一段非常保守的GCM motif基序,能够特异性识别DNA上的(A/G)CCCGCAT序列[30],进而调控基因的表达。为了揭示Gcm在家蚕中的功能,通过检索家蚕基因组数据库,对BmGcm进行鉴定和全长克隆。与其他物种Gcm 蛋白结构相似,BmGcm蛋白在N端也有一个保守的GCM motif,表明BmGcm与已报道的同源蛋白具有相似或相同的DNA结合模式,比对结果表明BmGcm蛋白与其他同源蛋白在GCM motif区域具有较高的保守性。BmGcm在胚胎第4天表达达到峰值,随后表达水平逐渐降低,暗示BmGcm在家蚕胚胎发育中发挥着重要的功能。检测BmGcm在幼虫各组织的表达情况,发现该基因主要表达于中肠、精巢和卵巢,而在脂肪体有微弱的表达,暗示BmGcm在这些组织中可能也发挥一定的功能。
核蛋白的结构与功能研究中,核定位机制的确定是一项重要的研究内容。在真核细胞内,蛋白质入核必须通过核孔复合体才能进入细胞核。分子量较小的蛋白可以自由穿过或通过被动扩散进入细胞核,而分子量较大的蛋白则需要与核输入蛋白互作才能入核[25]。为了排除被动运输的干扰,在载体中添加了GST表达元件,这样表达的GST-DsRed融合蛋白就只能定位于胞质中,这也是许多****在进行亚细胞定位分析,特别是转录因子核定位信号分析时的一种常用策略[31,32]。图6显示GST-DsRed融合蛋白只分布于细胞质中,在细胞核没有信号,说明该策略是有效的。此外,为了增加结果的可靠性,BmGcm蛋白与GST-DsRed融合标签采取了两种不同的融合方式,即BmGcm-GST-DsRed和GST-DsRed-BmGcm。BmGcm荧光信号聚集于细胞核,这进一步证实BmGcm也具有转录因子的功能。
为了进一步探索BmGcm的功能,在家蚕BmE- SWU3细胞系上过表达BmGcm。Western blot结果显示与对照组相比,BmGcm过表达组靶标蛋白的表达水平明显增高,意味着在细胞系水平成功过表达BmGcm。本研究中,过表达BmGcm会明显抑制细胞的增殖,进一步分析发现试验组的细胞周期进程明显受到影响,G1期细胞比例增高,而S期细胞比例降低。定量结果显示G1/S期细胞周期监检测点关键调控蛋白大部分出现了显著的下调。推测BmGcm可能通过调控这些周期相关蛋白,将细胞周期阻滞于G1期,从而抑制细胞的增殖。
4 结论
从家蚕基因组中克隆得到BmGcm,该基因定位于4号染色体。BmGcm在胚胎发育第4天表达达到峰值,而在幼虫阶段,BmGcm主要表达于中肠、精巢和卵巢。构建原核表达载体,在大肠杆菌中成功诱导表达,经纯化获得重组蛋白后免疫小鼠,成功制备了可特异识别重组蛋白的抗体。BmGcm蛋白定位于细胞核,细胞实验发现BmGcm可以显著抑制增殖和影响正常的细胞周期进程。The authors have declared that no competing interests exist.
