0 引言
【研究意义】桑树是最早的栽培林木之一,从海南岛到黑龙江,桑树有广泛的分布和利用。长期以来,桑树都是以养蚕为目的而栽培,其根、皮、枝、叶和富含次生代谢产物的桑果也已被用于保护肝脏,提高视力,促进排尿,改善便秘,降低血压等[1,2,3]。此外,桑树根系发达、耐贫瘠,抗旱、耐盐碱等抗逆性强[4]。氮代谢在桑树生长发育、化合物的合成和抗逆过程中起着重要作用,谷氨酸脱氢酶(GDH)普遍存在于植物中,在碳、氮代谢中既能催化铵与α-酮戊二酸合成谷氨酸,又能催化谷氨酸的氧化同时释放铵。目前对其生理作用的认识还不清楚,因此研究桑树GDH的特点对阐述其生理作用具有重要意义。【前人研究进展】谷氨酸脱氢酶(GDH)曾被认为是在高等植物中铵同化的关键酶[5],自1974年谷氨酰胺合成酶(glutamine synthetase,GS)和谷氨酸合酶(glutamate synthase,GOGAT)被发现以后,GS/GOGAT循环被公认为高等植物铵同化的关键酶[6],GDH催化α-酮戊二酸与NH4+合成谷氨酸被认为是除GS/GOGAT途径外的另外一种NH4+同化途径。此外,GDH存在于线粒体中,GS存在胞质中,因此谷氨酸脱氢酶被认为对光呼吸过程产生的NH3再同化起着关键作用,但是用GS抑制剂磷丝菌素预处理或者缺乏GS2或Fd-GOGAT的突变体进行试验表明,在光呼吸释放铵的再同化过程中,GS2的作用是主要的[7,8]。MASCLAUX- DAUBRESSE等[9]通过15N的铵盐和谷氨酸示踪研究证实,无论任何叶龄,铵盐的同化在黑暗和光照的条件下都是经过GS/GOGAT途径,不依靠GDH途径,而谷氨酸分解为α-酮戊二酸和铵盐的过程中,GDH在起着重要作用。WANG等[10]研究表明,小麦在低浓度的盐胁迫下,GS的活性增加,在高浓度的盐胁迫下,GDH的酶活性增加,GS的酶活性降低。MIYASHITA等报道[11]拟南芥的两个GDH表达具有组织特异性,受到细胞内碳源调控,并且认为GDH在C缺乏条件下在氨基酸酸降解中起着重要作用。水稻OsGDHs基因家族成员在氮和磷胁迫下表达量不同[12]。蔗糖饥饿处理会诱导羽扇豆的GDH酶活性增加,Cd2+和Pb2+导致铵盐积累,同时伴随着GDH酶活性增加,这些结果表明GDH主要在逆境条件下在C、N代谢中具有重要功能[13]。近几年来,国内外涉及到的研究GDH的物种越来越多,也越来越深入,主要集中在模式植物[14,15,16]和农作物[17,18,19]中进行GDH克隆、生物信息学及表达分析,中国科学院微生物研究所发现将真菌的GDH转入到棉花中,可提高氮素利用率30%以上,转GDH植物是属于抗营养贫瘠类的新一代转基因植物,它不仅可以节约氮肥30%—40%,降低生产成本,还有利于环境保护[20]。【本研究切入点】桑树为多年生木本植物,生物产量高,耐肥性强,而GDH在桑树中的特点及生物学功能未见报道。【拟解决的关键问题】本研究拟应用RT-PCR技术克隆MaGDHs,分析其结构和表达特点,构建原核重组表达载体在大肠杆菌BL21(DE3)中高效表达,并对诱导时间和IPTG浓度等参数进行研究和优化,建立高效原核表达体系,为下一步桑树的GDH功能研究及其酶促动力学研究奠定基础。1 材料与方法
试验于2016年3月至2017年5月在西南大学生物技术学院桑树遗传育种研究室及家蚕基因组生物学国家重点实验室进行。1.1 试验材料
取桂桑优62号桑树(广西区审定的桑树杂优组合,购于广西蚕业技术推广总站),属于广东桑,将种子消毒后播种于1/2MS培养基上,待其生长至四叶一心时,在对照培养基(MS +琼脂7 g∙L-1+蔗糖30 g∙L-1,CK)培养10 d后转移到不同的培养基中(表1),每个浓度处理4瓶,每瓶3—4株。在不含NH4+的培养基中,硝酸铵用硝酸钾代替,增加的铵盐以(NH4)2SO4提供。处理后0、12、24和48 h分别取材。取材时,每一组试验随机采取多株试管苗混合取材,重复3次。另外,从成熟桑树(同一株,雌雄同株不同花穗)中收集根、茎、老叶、嫩叶、幼叶、雌花、雄花、果实、叶柄、表皮,以检测不同组织的转录水平。收集的所有材料立即在液氮中冷冻带回实验室并储存在-80℃冷冻箱中。Table 1
表1
表1培养基的成分
Table 1Medium ingredients
| 组 Group | 培养基元素配料 Medium ingredients | ||
|---|---|---|---|
| NH4+ (mmol∙L-1) | 蔗糖 Sucrose (g∙L-1) | 6-BA (mg∙L-1) | |
| 1 | 20 | 10 | 0 |
| 20 | 20 | 0 | |
| 20 | 30 | 0 | |
| 2 | 0 | 30 | 0 |
| 20 | 30 | 0 | |
| 30 | 30 | 0 | |
| 3 | 20 | 30 | 1.0 |
| 20 | 30 | 2.0 | |
| 20 | 30 | 3.0 | |
新窗口打开
1.2 数据搜索和分析
为鉴定桑树中GDH基因家族的成员,以“Glutamatedehydrogenase”为关键词在川桑(Morus notabilis)数据库(http://morus.swu.edu.cn/morusdb/)中检索,并使用BLASTN(www.ncbi.nlm.nih.gov)和SMART(http://smart.embl-heidelberg.de/)鉴定候选基因,利用GeneScript公司在线工具(http://www. genscript. com.cn/index.html)设计用于克隆和qRT-PCR的引物(表2),通过在线软件(http://web.expasy.org/ compute_pi/)预测MaGDHs分子量和等电点。下载可可(Theobroma cacao)、猕猴桃(Actinidia chinensis)、拟南芥(Arabidopsis thaliana)、大豆(Glycine max)、花生(Arachis hypogaea)、水稻(Oryza sativa)、玉米(Zea mays)、小麦(Triticum aestivum)8个物种的GDH氨基酸序列,使用Genetyx-v7、Bioxm 26,Sequencher 4.2、BioEdit、GeneDoc等软件对GDH基因序列和氨基酸序列进行分析和比对,系统发育树由MEGA 5.0软件构建。Table 2
表2
表2MaGDH1和MaGDH2的克隆及荧光定量引物序列
Table 2Primers of MaGDH1and MaGDH2 for cloning and qRT-PCR
| 引物名称 Primer name | 上游引物(5'→3')Forward primer (5'→3') | 下游引物(5'→3')Reverse primer (5'→3') |
|---|---|---|
| pMaGDH1 | ATGAATGCTTTAGTGGCAAC | TCAGGCTCCCCAACCCCTGA |
| pMaGDH2 | ATGAACGCCCTCGCCGCAAC | TCACGCTTCCCATCCCCTTA |
| qMaGDH1 | AGCATCGCTGGGCAACGGTT | CTTTGCTGTTCTTTACAGCC |
| qMaGDH2 | TTCATGAGAGAGGTGGCAAG | GCTTTGTGCTTCAGCAACTC |
| qMaACTIN3 | GCATGAAGATCAAGGTGGTG | CATCTGCTGGAAGGTGCTAA |
新窗口打开
1.3 RT-PCR克隆MaGDHs
按照TaKaRa公司RNA抽提试剂盒说明书提取桂桑优62号桑叶总RNA。分别取适量体积RNA用1%的琼脂糖凝胶电泳检测,并用紫外分光光度计检测总RNA的浓度。以总RNA为模板,参照反转录酶M-MLV(Promega)说明书,并以Oligo(dT)18作为引物,合成cDNA第1链,存于-20℃备用。以cDNA为PCR模板,进行PCR扩增,扩增条件为94℃ 4 min;94℃ 40 s,51℃ 1 min,72℃ 2 min,循环32次;72℃ 10 min。DNA凝胶回收试剂盒回收PCR产物,目的片段与TaKaRa公司的PMD19-T载体16℃过夜连接,转化大肠杆菌DH5α,挑选阳性克隆,送至生工生物工程(上海)股份有限公司测序。1.4 MaGDHs的原核表达及酶活性测定
本研究使用pET-28a(+)、pET-32a(+)、pcold-TF载体。设计每个载体含有限制酶位点的引物用于PCR(表3)。将PCR产物克隆到载体中并转化到大肠杆菌BL21细胞中以在大肠杆菌细胞中产生组氨酸标记的重组蛋白。分别用0.1、0.5和1.0 mmol∙L-1 IPTG(异丙基-bD-硫代吡喃半乳糖苷)在大肠杆菌中诱导重组蛋白,pET-28a(+)和pET-32a(+)载体28℃培养6 h,pcold-TF载体在16℃培养24 h。培养物4℃下5 000 r/min离心15 min,收集菌体并进行超声破碎,使用不同浓度的咪唑,利用Ni-NTA亲和层析(Genscript,NJ,USA)纯化在大肠杆菌中表达的重组蛋白质,用12%(w/v)SDS-PAGE进行电泳检测。将纯化的蛋白质用尿素梯度透析液进行梯度透析,收集复性蛋白,用Bradford法测定蛋白浓度,用索莱宝公司的谷氨酸脱氢酶试剂盒测定酶活性,具体方法如下:酶标仪预热30 min以上,调节波长至340 nm,蒸馏水调零。在试剂二中加入19 ml试剂一充分溶解混匀,25℃水浴5 min,在96孔板中加入10 μL样本和190 μL试剂二,混匀,立即记录340 nm处20 s的吸光值A1和5 min后的吸光值A2,计算△A=A1-A2。定义每毫升复性的蛋白溶液每分钟消耗1 nmol NADH定义为一个酶活力单位。计算公式如下:
GDH(nmol∙min-1∙mL-1)=[△A×V反应总体积/(ε×d)×109] /V样品体积/T=643×△A
Table 3
表3
表3MaGDH1和MaGDH2原核表达载体构建引物序列
Table 3The primer sequences of prokaryotic expression vectors for MaGDH1 and MaGDH2
| 引物名 Primer name | 引物序列(5' - 3') Primers sequence (5' - 3') | 酶切位点 Restriction sites |
|---|---|---|
| MaGDH1-F | CGGATCCATGGATGAATGCTTTAGTGGCAACCA | BamH I |
| MaGDH1-R | GGAATTCTCAGGCTCCCCAACCCCTGAGG | EcoR I |
| MaGDH2-28aF | GCTCTAGAATGAACGCCCTCGCCGCAACAA | Xba I |
| MaGDH2-28aR | CGGAATTCTCACGCTTCCCATCCCCTTAGA | EcoR I |
| MaGDH2-32aF | GGGGTACCATGAACGCCCTCGCCGCAACAA | Kpn I |
| MaGDH2-32aR | GCGTCGACCGCTTCCCATCCCCTTAGAACA | SaI I |
| MaGDH2-pcoF | CGGAATTCATGAACGCCCTCGCCGCAACAA | EcoR I |
| MaGDH2-pcoR | GCTCTAGATCACGCTTCCCATCCCCTTAGA | Xba I |
新窗口打开
1.5 定量PCR分析
分别从收集到的植物材料中提取总RNA。DNase I(TaKaRa,Japan)消化RNA样品以去除DNA。参照反转录酶M-MLV(TaKaRa)说明书,以Oligo(dT)18为引物,合成cDNA第1链。将cDNA稀释3倍,使用实时荧光定量PCR试剂SYBR® Premix Ex TaqTM (Tli RNaseH Plus)扩增,扩增体系为SYBR®Premix Ex TaqTM(Tli RNaseH Plus)(2×) 10 μL,ROX Reference Dye(50×) 0.4 μL,cDNA 2 μL,depc H2O 6 μL,上、下游引物各0.8 μL。程序为95℃预变性30 s;94℃ 5 s, 60℃ 30 s, 72℃ 10 min,循环40次,并以MaACTIN3 (HQ163775.1)为内参。用StepOne Software V2.1和GraphPad Prism 5软件分析试验数据,采用2-△△Ct法进行基因相对表达量分析。所有试验均重复3次,采用SPSS16进行统计学分析。2 结果
2.1 桑树谷氨酸脱氢酶基因家族的鉴定和克隆
在川桑数据库中搜索到川桑谷氨酸脱氢酶基因GDH(登录号为Morus014749和Morus017087),以该序列设计引物,以栽培桑品种桂桑优62号的叶片cDNA为模板,通过RT-PCR,琼脂糖电泳鉴定出两条750—1 500 bp的目的条带(图1-A)。经回收,测序后发现两条序列全长均为1 236 bp,编码411个氨基酸,含一个开放阅读框(ORF),命名为MaGDH1和MaGDH2。同源比较分析得知,川桑和桂桑优62号的GDH相似性为99%,MaGDH1和MaGDH2氨基酸水平相似度为81%,均含有9个外显子,8个内含子(图1-B)。在线软件(http://web.expasy.org/ compute_pi/)预测MaGDH1蛋白质的分子量为44.1 kD,理论等电点为5.84;MaGDH2蛋白质的分子量为44.2 kD,理论等电点为6.68。NCBI上分析氨基酸序列的保守结构域,发现MaGDH1和MaGDH2蛋白属于ELFV-dehydrog superfamily超家族。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1MaGDHs琼脂糖电泳图(A)及其外显子内含子结构模式图(B)
M: Marker; 1: MaGDH1; 2: MaGDH2
-->Fig. 1Agarose gel electrophoresis of MaGDHs and their scaled diagram of exon-intron structure
-->
2.2 MaGDHs氨基酸序列比较及进化树分析
在NCBI数据库中下载拟南芥、水稻、大豆、可可、猕猴桃等8个物种的GDH氨基酸序列进行同源性分析结果显示,MaGDH编码的氨基酸序列与双子叶植物中GDH编码的氨基酸序列同源性为86%—93%,与单子叶植物GDH编码的氨基酸序列同源性为84%—87%。多重序列比对结果表明这些GDH所编码的氨基酸序列含有在N末端的线粒体转移肽序列,包含Glu/a-KG结合域的PF02812结构和包含NAD(P)结合域的PF00208结构。PF02812结构比PF00208结构的序列更保守,PF00208结构的N-和C-端比中间区域序列更保守(图2)。同时利用它们的氨基酸序列构建进化树如图3所示,桑树的两个MaGDHs聚为两支,验证了克隆的MaGDHs分别为GDH1和GDH2。MaGDH1与可可先聚为一支,然后与猕猴桃再聚为一支,再与其他双子叶、单子叶植物聚类;MaGDH2并没有与可可聚为一类,而是可可与猕猴桃先聚为一支,然后与桑树再聚为一支,表明MaGDH1和MaGDH2在进化顺序上并不是一致的。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2桑树谷氨酸脱氢酶GDH的氨基酸与其他物种氨基酸序列同源性序列比对
MaGDH1、MaGDH1:桑树Morus atropurpurea;GmGDH1:大豆Glycine max,NP_001236404.1;AtGDH1、AtGDH2:拟南芥Arabidopsis thaliana,NP_197318.1,NP_196361.1;AcGDH1:猕猴桃Actinidia chinensis,ABR45723.1;TcGDH1:可可Theobroma cacao,XP_007030721.1;OsGDH1:水稻Oryza sativa,XP_015631051.1;TrGDH1:小麦Triticum aestivum,ADW95819.1
-->Fig. 2Amino acid sequence alignment of glutamate dehydrogenase (GDH) mulberry and other species
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3GDH家族的系统树
Theobroma cacao:可可;Actinidia chinensis:猕猴桃;Arabidopsis thaliana:拟南芥;Glycine max:大豆;Arachis hypogaea:花生;Oryza sativa:水稻;Zea mays:玉米;Triticum aestivum:小麦
-->Fig. 3Phylogenetic tree of the glutamate dehydrogenase family
-->
2.3 MaGDHs在大肠杆菌BL21(DE3)中原核表达
以pET-28a(+)、pET-32a(+)、pCold-TF为载体构建融合蛋白重组质粒pET-28a(+)-MaGDH1、pET- 32a(+)-MaGDH1、pcold-TF-MaGDH1,pET-28a(+)- MaGDH2、pET-32a(+)-MaGDH2、pcold TF-MaGDH2,酶切电泳如图4所示,除含有3种质粒大小的目的条带,也含有MaGDH1和MaGDH2片段。以IPTG诱导后,pET-28a(+)-MaGDH1、pET-32a(+)-MaGDH1、pcold-TF-MaGDH1在大肠杆菌BL21(DE3)中均能表达,且使用pET-28a(+)载体时以IPTG浓度为0.1 mmol∙L-1表达效果最佳,pET-32a(+)载体时IPTG浓度为1.0 mmol∙L-1效果最佳,pCold-TF载体时 IPTG浓度对蛋白表达量影响不大(图5-A、B、C)。MaGDH2只能以重组质粒pET-32a(+)-MaGDH2才能在大肠杆菌BL21(DE3)中成功表达,IPTG浓度为1.0 mmol∙L-1时效果最佳(图5-D、E、F)。融合蛋白pET-28a(+)- MaGDH1,pCold-TF-MaGDH1大小接近44.3 kD,与预测结果基本一致,pET-32a(+)自带标签大于pET-28a(+)和pCold-TF,因而融合蛋白pET-32a(+)- MaGDH1、pET-32a(+)-MaGDH2大小接近66.4 kD。将菌液进行超声破碎,将上清和沉淀分别进行SDS- PAGE电泳检测,结果表明pET-28a(+)-MaGDH1、pET-32a(+)-MaGDH1、pCold-TF-MaGDH1和pET-32a (+)-MaGDH2均以包涵体的形式存在(图5-G、H)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4重组质粒的酶切电泳
A: pET-28a(+)-MaGDH; B: pET-32a(+)- MaGDH; C: pcold-TF- MaGDH; M: DL2000 Marker; 1: MaGDH1; 2: MaGDH2
-->Fig. 4Electrophoresis of recombinant plasmid after restriction digestion
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5原核表达MaGDHs蛋白表达产物SDS-PAGE电泳(箭头所指为目的蛋白)
A:pET-28a(+)-MaGDH1;B:pET-32a(+)-MaGDH1;C:pcold-TF-MaGDH1;D:pET-28a(+)-MaGDH2;E:pET-32a(+)-MaGDH2;F:pcold-TF-MaGDH2,M:Marker;1:CK;2:0.1 mmol∙L-1 IPTG;3:0.5 mmol∙L-1 IPTG;4:1.0 mmol∙L-1 IPTG;G—H为重组蛋白表达形式的鉴定 The identification of recombinant protein expression form(1、4、7、10:空载体 Empty vector;2、5、8、11:细胞破碎后的上清Supernatant after cell disruption,3、6、9、12:细胞破碎后的沉淀Precipitation after cell disruption)
-->Fig. 5SDS-PAGE electrophoresis of MaGDHs fusion protein product by prokaryotic expression (The arrow refers to the target protein strip)
-->
2.4 MaGDHs蛋白的纯化及酶活性测定
用Ni-NTA树脂层析柱,利用不同浓度的咪唑洗涤蛋白沉淀,对目的蛋白进行纯化SDS-PAGE电泳表明,pET-28a(+)-MaGDH1、pET-32a(+)-MaGDH1和pCold-TF-MaGDH1均在咪唑浓度为100 mmol∙L-1时目的蛋白被大量洗脱下来(图6-A、B、C),而pET-32a(+)-MaGDH2目的蛋白则在咪唑浓度为250 mmol∙L-1时被大量洗脱下来(图6-D),获得纯化的MaGDH1蛋白和MaGDH2蛋白。经过测定,不同载体重组质粒在最适IPTG浓度条件下,表达的蛋白质含量不同(表4),活性也有差异,其中pCold-TF- MaGDH1表达的蛋白最高,为633.6 μg∙mL-1,但表达的蛋白没有酶活性,而pET-28a(+)-MaGDH1表达的蛋白活性最高,为10.07 nmol-1∙min-1∙mL-1。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6重组MaGDHs蛋白的纯化
A:pET-28a(+)-MaGDH1;B:pET-32a(+)-MaGDH1;C:pCold-TF-MaGDH1;D:pET-32a(+)-MaGDH2;1—4:咪唑浓度分别为10、40、100、250 mmol∙L-1 1-4 : imidazole concentration were 10, 40, 100, 250 mmol∙L-1, respectively
-->Fig. 6Purification of recombinant MaGDHs fusion protein
-->
Table 4
表4
表4MaGDHs重组蛋白含量及酶活性
Table 4The content and activity of MaGDHs protein
| 重组蛋白 Recombinant protein | 蛋白含量 Protein content (μg∙mL-1) | 酶活力 Enzyme activity (nmol-1∙min-1∙ mL-1) |
|---|---|---|
| pET-28a(+)-MaGDH1 | 245.6 | 10.07 |
| pET-32a(+)-MaGDH1 | 445.6 | 3.64 |
| pCold-TF-MaGDH1 | 633.6 | 0 |
| pET-32a(+)-MaGDH2 | 117.6 | 6.64 |
新窗口打开
2.5 MaGDH1和MaGDH2的组织表达
MaGDH1和MaGDH2在桑树各个组织中都有表达(图7),总体上MaGDH1在各个组织上表达量高于MaGDH2。MaGDH1在雄花中的表达量最高,其次为嫩叶、茎、叶柄、雌花,在果实中表达量低。MaGDH2也是在雄花中的表达量最高,其次为雌花、幼叶、嫩叶、茎、叶柄,在果实中几乎不表达。桑树的开花期在花和幼叶代谢生长发育旺盛,茎和叶柄起运输作用,由此推测,MaGDH1和MaGDH2在各个组织中的表达量与桑树的生长发育密切相关。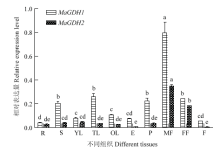 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7MaGDHs在各个组织中定量表达分析
横坐标字母分别代表为根(R)、茎(S)、幼叶(YL)、嫩叶(TL)、老叶(OL)、表皮(E)、叶柄(P)、雄花(MF)、雌花(FF)和果实(F) Letters of abscissa represent root (R), stem (S), young leaf (YL), Tender leaf (TL), Old leaf (OL), Epidermis (E), Petiole (P), Male flower (MF), Female flower (FF) and Fruit (F)
小写字母表示差异显著(P<0.05)
-->Fig. 7Quantitative real-time PCR (qPCR) results for MaGDHs genes
The lowercase indicates significant difference (P<0.05)
-->
2.6 MaGDH1和MaGDH2的表达的调控
在培养基中添加10、20和30 g∙L-1的蔗糖,MaGDH1和MaGDH2的表达量如图8所示。随着蔗糖浓度的增加,MaGDH1和MaGDH2表达量增加,MaGDH1在蔗糖浓度为30 g∙L-1处理12 h时表达量最高,MaGDH2则在蔗糖浓度为30 g∙L-1处理24 h时表达量最高,MaGDH2的相对表达量比MaGDH1表达量高。MaGDHs受NH4+调控表达如图9所示,培养基中即使没有外源NH4+,MaGDHs也有表达,添加20 mmol∙L-1(常规量)NH4+时,MaGDHs表达量立即增加;当NH4+增加到30 mmol∙L-1(过量)时,MaGDHs并没有立即增加反而受到抑制,MaGDH1在24 h表达量超过常规NH4+浓度的表达量,MaGDH2在48 h表达量超过常规NH4+浓度的表达量。在培养基中添加细胞分裂素6-BA,MaGDH1和MaGDH2的表达量如图10所示,添加6-BA 12 h后,MaGDH1和MaGDH2的表达量都受到抑制,浓度越高,抑制更加明显;24 h后,MaGDH1的表达量受到浓度为1.0 mg∙L-1和2 mg∙L-1的6-BA促进,当浓度为3 mg∙L-1时抑制其表达;48 h时,3个浓度的6-BA都促进MaGDH2的表达。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8MaGDHs在不同浓度蔗糖条件下定量表达
*表示差异显著(P<0.05)。下同
-->Fig. 8Quantitative real-time PCR (qPCR) results for MaGDHs genes under different concentration of sucrose
* indicates significant difference (P<0.05). The same as below
-->
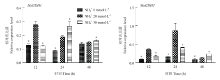 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9MaGDHs在不同浓度NH4+条件下定量表达
-->Fig. 9Quantitative real-time PCR (qPCR) results for MaGDHs genes under different concentration of NH4+
-->
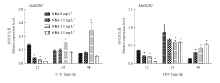 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图10MaGDHs在不同浓度6-BA条件下定量表达
-->Fig. 10Quantitative real-time PCR (qPCR) results for MaGDHs genes under different concentration of 6-BA
-->
3 讨论
一般认为,高等植物GDH中的α和β亚基分别由不同的两个基因编码,GDH1(或GDHB)基因编码β亚基,GDH2(或GDHA)编码α亚基[21],在拟南芥中发现了GDH3编码γ亚基[22]。在有些植物中如黑小麦、黄羽扇豆、烟草、番茄等已克隆出了至少2个GDH,分别编码α和β亚基[23,24,25,26],而一些植物中目前却只克隆获得了其中一个基因[27,28,29]。本研究结果表明,桑树中有两个GDH,进化树分析表明MaGDHs蛋白属于两种类型,分别为MaGDH1和MaGDH2,分别编码β亚基和α亚基。LEHMANN等[24]报道黄羽扇豆GDH1和GDH2的表达具有组织特异性,虽然两个基因在黄羽扇豆的所有组织中都有表达,但GDH1的转录明显高于GDH2,本研究的结果与其结果基本一致。此外,在检测的桑树组织中,MaGDH1和MaGDH2均在花中表达量最高,与前人对水稻[12]和拟南芥[30]GDH的研究结果相似,他们认为花器官是能量需求较多的器官,因此AtGDH2和OsGDH2在花中表达量最高。谷氨酸脱氢酶的生理功能有较多的争论,由于植物体内的GDH对于铵具有很高的Km值(5.2—70 mmol∙L-1),使人们对于GDH在植物体内的铵同化功能提出质疑。也有人认为GDH的底物是NH3而不是NH4+,本研究在未加外源NH4+的情况下,检测到GDH的表达,因此推测,GDH底物至少不会完全来源于外源NH4+也可能由植物自身代谢产生。本研究表明添加过量的NH4+能促进MaGDHs表达,且MaGDH1与响应比MaGDH2早,结果暗示MaGDHs可能对过量的NH4+有一定的解毒作用。FOX等[31]以胡萝卜悬浮细胞为材料发现培养基中碳源缺乏时GDH活性最大,当给培养基添加蔗糖时,GDH活性急剧降低;MELO-OLIVEIRA[32]以拟南芥为材料,发现在黑暗或碳源有限供给条件下,GDH1的mRNA大量积累,而光照条件或蔗糖供给都会抑制GDH1 mRNA积累,本研究发现随着蔗糖浓度增加,MaGDH1和MaGDH2的表达量增加,因此,碳源对MaGDHs的调控还有待进一步研究。同时,MaGDHs还受到外源激素的调控,培养基中添加细胞分裂素6-BA 12 h后,抑制了MaGDH1和MaGDH2的表达,并且浓度越高,抑制作用越强。随着时间延长,这种抑制作用减弱,推测6-BA对MaGDHs的正调控可能是间接调控。
4 结论
获得两个MaGDHs,全长均为1 236 bp,编码411个氨基酸,分别编码β和α亚基,基因序列高度保守。MaGDHs表达具有组织特异性,在旺盛生长的组织中表达量较高,受到过量NH4+、细胞分裂素的调控。IPTG浓度和载体都会影响重组蛋白的高效表达,大肠杆菌表达的重组MaGDH蛋白以包涵体形式存在,不同载体的重组蛋白酶活性存在差异。The authors have declared that no competing interests exist.
