0 引言
【研究意义】猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus , PRRSV)引起的以妊娠母猪早产、晚期流产、死胎、弱胎和木乃伊胎等繁殖障碍及仔猪和生长猪的呼吸系统疾病为主要特征的一种高致死性的传染病[1,2]。因该病在临床上表现为耳部皮肤紫绀,所以又被称为“蓝耳病”。根据抗原性,基因组及致病性的差异,PRRSV可分为2个型,即欧洲型和美洲型,又被称为1型和2型[3,4,5]。PRRS于1987年首次在美国被发现,紧接着于1989 年在欧洲爆发,并逐渐向世界其他地区扩散,其在世界范围内的频繁爆发对养猪业造成了极大的经济损失[6,7]。自20世纪90年代初期,科学家们通过表型选择、免疫遗传标记辅助选择等途径开展了很多PRRSV的抗病育种工作,也取得了很大的进展,但并未从根本上杜绝疾病的发生。PRRSV在与机体互作时,能够抑制天然免疫、延迟中和抗体的产生,再加上抗病性状属于多基因性状,PRRSV基因组易发生变异,导致国内外市面上的疫苗效果并不理想。随着分子育种手段的不断发展和PRRSV致病机理的逐渐清楚,利用遗传操作手段制备对PRRSV引起的传染性疾病具有抗性的动物育种新材料对畜牧业的发展具有重要意义。【前人研究进展】PRRSV在体内主要通过侵染猪肺泡巨噬细胞(porcine alveolar macrophages,PAM)表面的受体而发挥作用[8]。研究发现,硫酸乙酰肝素(heparin sulphate, HS)、唾液酸粘附素(sialoadhesin, Sn)和CD163(cluster of differentiation 163)分子是PAM上存在的能与PRRSV结合的3个重要受体分子[9]。其中,CD163是一种富含半胱氨酸的清道夫受体,属于典型的Ⅰ型糖基化蛋白,也是一种巨噬细胞分化的抗原,因其分子大小为130kDa,故又被称为M130蛋白[10]。有研究表明,在PRRSV非易感细胞系(BHK-21和PK-15)中转染表达CD163分子可以使这些细胞系感染PRRSV并在细胞内产生子代病毒粒子,而抗人CD163的抗体可以阻断PRRSV 的感染,表明CD163 是该病毒的必需受体[11]。VAN GORP等研究发现CD163蛋白结构域scavenger receptor cysteine-rich domain 5(SRCR5)由第7外显子所编码,是病毒感染细胞所必需的,而氨基端的4个scavenger receptor cysteine-rich(SRCR)区域和胞质尾部是非必需的[12]。近几年,科学家们成功通过敲除或者替换宿主内源的受体基因来达到抗PRRSV的目的。WHITWORTH等利用CRISPR/Cas9技术敲除猪内源CD163基因,活体攻毒试验证明敲除猪具有抵抗1型和2型PRRSV的能力[5, 13-14]。随后,WELLS等获得用人的同源基因CD163-like的SRCR8区域替换猪CD163的SRCR5区域的基因修饰猪,攻毒试验发现该基因替换猪具有抵抗1型PRRSV和降低感染2型PRRSV的能力[5]。最近,BURKARD等获得了删除猪CD163的SRCR5结构域的基因编辑猪,细胞水平试验证明,其巨噬细胞具有抵抗1型和2型PRRSV的表型,同时该编辑猪在标准饲养条件下生长发育正常[15]。另外,LI等发现siRNA能够引起特异性的抗病毒反应后,其通过攻毒实验证明重组腺病毒介导的RNAi可以使猪抵抗PRRSV 的感染[16]。LU等制备的过表达histone deacetylase6(HDAC6)转基因猪能够阻碍病毒复制,延缓发病时间,减弱发病症状,并表现出对PRRSV的抗性[17]。【本研究切入点】目前,尽管关于CD163基因编辑猪已有研究报道,然而利用体细胞核移植技术获得无筛选标记的CD163双等位基因编辑纯合猪的研究国内未见报道。【拟解决的关键问题】利用CRISPR/Cas9基因编辑技术结合体细胞核移植制备CD163双等位基因编辑猪,既无外源筛选标记引入同时又可以快速扩繁后代,可获得具有抵抗PRRSV能力的育种新材料。1 材料与方法
本研究于2015年9月到2017年12月在中国农业科学院北京畜牧兽医研究所猪基因工程与种质创新团队实验室和天津市宁河原种猪场完成。1.1 材料
试验用到的细胞为中国农业科学院北京畜牧兽医研究所猪基因工程与种质创新团队2013年分离的纯种大白猪胎儿成纤维细胞,CRISPR/Cas9载体为pX330-U6-hSpCas9载体。1.2 方法
1.2.1 猪CD163基因gRNA设计和载体构建 首先锁定编码猪CD163基因SRCR5结构域的第7外显子的打靶区域,利用麻省理工学院张峰实验室开发的网站(http://crispr.mit.edu)对其打靶区域进行评分,从候选的打靶位点中选择一个合适的gRNA,其序列为GGAAACCCAGGCTGGTTGGA。根据gRNA序列合成互补配对的寡聚核苷酸,合成的寡聚核苷酸序列如下:CD163-gRNA-F:caccGGAAACCCAGGCTGGTT GGA,CD163-gRNA-R:aaacTCCAACCAGCCTGGGT TTCC。载体构建步骤为:(1)将两条寡聚核苷酸稀释至10μmol∙L-1后各取10μL, 98℃反应10min,在自然冷却至室温的条件下对其进行退火。(2)37℃条件下,用限制性内切酶Bbs I 对含有Cas9序列的pX330骨架载体酶切2h,切胶回收线性化片段。(3)回收的线性化载体骨架与退火的寡聚核苷酸16℃连接1h,随后转化Top10或DH5α感受态细胞,涂布于含氨苄的LB平板进行生长,挑取单菌落扩大培养并测序,测序引物为U6-FWD。序列正确后进行扩大培养,用去内毒素大提质粒试剂盒提取pX330-CD163-gRNA质粒,所提的质粒纯化后用于细胞的转染。1.2.2 转染效率检测和gRNA活性检测 转染前一天将原代大白猪胎儿成纤维细胞复苏至6cm平皿中,当细胞达到70%—80%汇合度时即可进行细胞转染。细胞分两组进行转染,一组转染表达EGFP的质粒,另一组转染pX330-CD163-gRNA质粒,转染步骤严格按照Basic Primary Fibroblasts Nucleofector Kit(Lonza)试剂盒说明书进行操作。转染后48h,荧光显微镜下观察转EGFP组的细胞发光情况用以检测细胞的转染效率。转pX330-CD163-gRNA质粒48h后的细胞部分用于铺板,另一部分用以提取基因组检测gRNA活性。以提取的细胞基因组为模板,用Pre mixTaq DNA聚合酶进行PCR,扩增出300bp片段,引物为CD163-F:5′- AAGCCCACTGTAGGCAGAA-3′和CD163-R:5′- GTGGTTTCCCTCCTGGGG-3′。扩增条件为95℃,5min;95℃,30s;61℃,30s,36个循环;72℃,30s;72℃,10min;PCR产物送北京天一辉远公司测序,根据靶位点附近序列的套峰情况即可对gRNA的活性进行检测。
1.2.3 单克隆细胞培养 将电转48h后细胞铺板于10cm培养皿中,每3d更换一次培养液。铺板后10d左右可以观察到合适大小的克隆点,将单克隆细胞进行扩大培养,同时取部分细胞提取基因组用以基因型鉴定。
1.2.4 单克隆细胞基因型鉴定 以提取的细胞基因组为模板进行PCR扩增,PCR按照1.2.2的条件进行操作。PCR产物送北京天一辉远公司测序,根据测序结果,筛选具有移码突变的纯合编辑细胞用作核移植的供体细胞。
1.2.5 体细胞核移植及克隆猪基因型鉴定 以体外成熟40h的青年猪卵母细胞为核移植受体细胞,将核移植供体细胞移入去核的卵母细胞,经电融合与激活,构建成重组克隆胚胎,挑选发育状态良好的克隆重组胚胎用手术法移入自然发情的经产大白母猪子宫内进行妊娠。胚胎移植后,技术人员注意观察其返情情况,定期用B型超声波检查受体母猪妊娠情况。小猪出生后剪取部分耳样,提取基因组后进行PCR和测序鉴定。
1.2.6 克隆猪的扩繁及F1代仔猪基因型鉴定 CD163双等位基因编辑公猪与野生型大白母猪交配,扩繁后代并定期检查交配母猪的妊娠情况。F1代仔猪出生后剪取部分耳样,提取基因组后进行PCR和T-A克隆测序,鉴定其基因型。
2 结果
2.1 猪CD163基因gRNA设计及活性检测
针对大白猪的第7外显子序列设计了一条gRNA(图1-A),构建好的载体转染胎儿成纤维细胞,靶位点PCR测序检测gRNA活性。与未转染质粒组对比,转染pX330-CD163-gRNA质粒组靶位点下游出现套峰(图1-B),可说明部分细胞靶位点附近序列处造成了碱基的随机插入或缺失,说明pX330-CD163- gRNA能够对靶位点进行切割。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1gRNA靶位点设计和打靶效率检测
A:gRNA打靶位点示意图;B:细胞混池测序峰图
-->Fig. 1Design of gRNA and detection of the target efficiency
A: A schematic model of the gRNA targeting site; B: Sequencing chromatograms of the cell pools
-->
2.2 细胞转染效率检测
将表达EGFP的质粒转染猪胎儿成纤维细胞,48h后荧光显微镜下观察细胞发光情况,结果显示大部分细胞能够表达EGFP蛋白(图2),表明转染效率较高。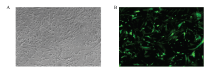 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2转染效率检测
A:明场下的细胞;B:细胞EGFP表达情况
-->Fig. 2Detection of cell transfection efficiency
A: The phase contrast image; B:Expression of EGFP
-->
2.3 单克隆细胞培养及基因型鉴定
通过PCR和测序鉴定获得的127个单克隆细胞基因型,统计结果显示共有21个细胞克隆的CD163基因发生移码突变,突变效率为16.5%,其中有14个克隆(11.0%)出现单等位基因突变或双等位基因杂合突变,7个克隆(5.5%)为双等位基因纯合突变(图3-A)。7个双等位基因纯合突变克隆的基因型如图3-B所示。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3克隆基因型鉴定
A:不同基因型百分比。1:野生;2:杂合;3:纯合。B:7个纯合双等位基因突变克隆基因型
-->Fig. 3Detection ofclone genotyping
A: The percentage of different genotypes. 1: Wild-type; 2: Heterozygous; 3: Homozygous. B: The genotypes of seven biallelic homozygous colonies
-->
2.4 克隆猪的基因型检测及蛋白序列预测
选择CD163-34号细胞克隆(-50bp/-50bp)作为核供体进行体细胞核移植,移植受体母猪3头,成功获得CD163双等位基因纯合编辑的大白猪。采取猪耳组织进行基因型鉴定,PCR和测序结果显示该猪CD163基因型与供体细胞克隆基因型一致,均为双链缺失50bp(图4-A、B)。CD163基因编辑猪缺失50bp 后,第7外显子缺失16个氨基酸,同时发生移码突变并提前终止(图4-C)。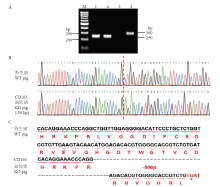 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4克隆猪基因型鉴定及蛋白序列预测
A:CD163基因编辑猪PCR检测结果,1:基因编辑猪1;2:基因编辑猪2;3:阴性对照;4:野生型猪。B:PCR产物测序。C:CD163基因编辑猪蛋白序列预测。WT:野生型;KO:敲除型
-->Fig. 4Detection of cloned pigs genotyping and prediction of protein sequence
A.PCR test results of CD163 gene edited pigs. B: The sequencing of PCR products. C: The protein sequence prediction of CD163 gene edited pig. 1: gene edited pig 1; 2: gene edited pig 2; 3: negative control; 4: WT pig. B: The sequencing of PCR products. C: The protein sequence prediction of CD163 gene edited pig. WT: Wild-type; KO: Knock-out
-->
2.5 基因编辑猪的种系传代
CD163双等位基因编辑公猪与野生型大白母猪繁殖获得15头F1代仔猪,其中5头公猪,10头母猪,仔猪平均出生重为1.21kg(图5-A)。提取F1代仔猪耳缘组织DNA,进行PCR扩增,对PCR产物进行T-A克隆并测序鉴定其基因型,结果表明为CD163基因杂合(WT/-50bp)型(图5-B、C)。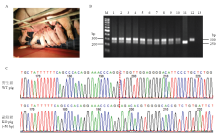 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5F1代仔猪基因型鉴定
A:F1代仔猪。B:部分F1代仔猪PCR检测结果,泳道1-10为F1代仔猪,泳道11为F0代克隆猪,泳道12为野生型猪,泳道13为阴性对照,M为100bp DNA marker。C:T-A克隆测序。WT:野生型;KO:敲除型
-->Fig. 5Detection of F1 piglets genotyping
A: F1 piglets. B: PCR test results of partial F1 piglets, lane 1-10: F1 piglets, lane 11: F0 cloned pig, lane 12: wild-type pig, lane 13: negative control, M: 100bp DNA marker. C: T-A cloning and sequencing. WT: Wild-type; KO: Knock-out
-->
3 讨论
CRISPR/Cas9 技术介导的基因突变是指Cas9蛋白通过sgRNA靶向识别并定点切割基因组DNA,导致DNA双链断裂(double strand break, DSB),细胞通过非同源末端连接修复机制修复DSB时所引发的切割位点处DNA碱基的插入或缺失[18]。II型CRISPR/Cas系统已经在各物种中得到了较为广泛的应用,如:小鼠[19,20,21]、大鼠[22]、猪[23,24,25]、牛[26,27]、羊[28]、猴子[29]、斑马鱼[30]、果蝇[31]、线虫[32]等。与基因打靶、ZFN、TALEN等基因修饰技术相比,CRISPR/Cas9具有操作简单、效率高等诸多优势,利用CRISPR/Cas9对重要经济性状基因进行修饰已经成为家畜新品种培育的重要手段[33]。最近几年,科学家们通过CRISPR/Cas9技术已成功获得抗PRRSV的基因编辑猪[5, 13-15]。密苏里大学Prather团队通过细胞水平和个体水平攻毒试验发现制备的CD163基因敲除猪具有同时抵抗1型和2型PRRSV的能力,而用人的同源基因CD163-like的SRCR8区域替换猪CD163的SRCR5区域制备的基因替换猪具有抵抗1型PRRSV的能力,其对2型PRRSV易感性降低,但与对照相比差异不明显[5, 13]。爱丁堡大学ARCHIBALD团队通过删除CD163基因SRCR5区域获得的基因敲除猪,细胞水平攻毒试验发现其PAM细胞不受1型和2型PRRSV的感染,这一研究成果同PRATHER团队的结论一致[15]。本研究利用CRISPR/Cas9技术对PRRSV受体基因CD163进行修饰,用构建好的pX330-CD163-gRNA载体转染猪胎儿成纤维细胞并检测gRNA活性,结果表明在无任何筛选标记富集的情况下,pX330-CD163-gRNA能够有效的对靶位点进行识别和切割。考虑到CRISPR/Cas9的高效编辑特性和筛选标记残留引起的安全问题,本研究中细胞单克隆的筛选没有使用药物、流式等细胞富集方法,但是仍然得到了21个移码突变的细胞单克隆,整体突变效率达16.5%(21/127),其中7个细胞克隆为双等位基因纯合突变,效率达到5.5%。本研究利用CRISPR/Cas9基因编辑技术结合体细胞核移植技术成功制备了CD163双等位基因编辑的纯合大白猪,并通过扩繁获得了后代。综合分析首批F1代基因编辑仔猪的出生数据,未发现CD163基因编辑对猪繁殖性能有不利的影响。该研究获得的基因编辑猪不携带筛选标记,能够安全地为培育抗PRRSV的新品种猪提供育种材料,同时可为进一步阐明蓝耳病发病机制的研究奠定坚实的基础。
4 结论
本研究利用CRISPR/Cas9基因编辑技术结合体细胞核移植技术,成功制备出CD163双等位基因纯合编辑大白猪,并已获得CD163F1代基因编辑猪,安全并快速地为培育抗PRRSV新品种猪提供了育种新材料。The authors have declared that no competing interests exist.
