0 引言
【研究意义】磷是植物生长发育过程中必需的营养元素,其不仅参与植物体内重要化合物(磷脂、ATP和核酸等)的形成[1],而且在植物生命活动过程(光合作用、呼吸作用和信号转导等)中发挥着重要作用[2]。然而,多数土壤中磷元素分布不均,并且多以植物难以利用的有机磷形式存在,植物因此常常受低磷胁迫影响[3]。在生产中,人们通过施用磷肥来改善土壤有效磷含量不足的状况提高作物产量,但却导致了一系列环境污染问题[4]。因此,通过分子生物学手段发掘优质基因,通过转基因手段提高作物磷吸收能力对减少化肥使用具有重要意义。【前人研究进展】紫色酸性磷酸酶(purple acid phosphatases,PAP)主要由植物在低磷条件下分泌产生,能够在有机磷底物上水解磷酸基团,产生有效磷供植物吸收利用[5,6]。目前,许多植物的PAP已被鉴定出来,如拟南芥[7]、烟草[8]、番茄[9]、玉米[10]、水稻[11]、和大豆[12]等,并且许多PAP的转录与翻译明显受低磷条件的诱导。在拟南芥中,一共发现29个AtPAP,在多个方面影响拟南芥的生长发育,其中AtPAP10是根表面最主要的酸性磷酸酶,并且atpap10突变体对磷的吸收明显受到抑制,长势弱于野生型[13];AtPAP15在种子和花粉萌发时期磷酸盐的利用过程发挥重要作用[14];AtPAP23在花器官中明显积累,可能参与了花器官的发育[15];atpap26突变体叶片衰老延迟,可能参与植物体内磷元素的回收利用过程[16]。在水稻中,存在26个OsPAP,可分为3个家族和7个亚家族,其中有4个基因(OsPAP10a、OsPAP10b、OsPAP10c和OsPAP10d)与AtPAP10同源性最高。OsPAP10a和OsPAP10c明显受低磷诱导,并且在转录水平上均受OsPHR2、OsPHO2和OsSPXI的调控。进一步研究表明,过表达OsPAP10a和OsPAP10c增加水稻的分蘖数,并且提高水稻在低磷条件下的磷含量[17]。而OsPAP26在蛋白水平受缺磷诱导和衰老调控,但在转录水平对缺磷没有响应[18]。【本研究切入点】苹果作为多年生木本果树,磷元素的丰缺对果树生长和产量具有重要影响。虽然目前关于紫色酸性磷酸酶(PAP)已有大量研究,但主要集中在拟南芥和水稻等草本植物,而PAP在苹果中的研究尚未见报道。【拟解决的关键问题】本研究以‘嘎啦’苹果(Malus×domestica‘Royal Gala’)为材料,通过基因克隆获得苹果紫色酸性磷酸酶基因MdPAP10,并对其表达模式及基因功能进行研究,运用分子生物学手段验证MdPAP10在苹果响应低磷过程中所起到的重要作用。1 材料与方法
1.1 材料收集与处理
本试验所用到的植物材料有‘嘎啦’(Malus× domestica‘Royal Gala’),苹果‘王林’(‘Orin’)愈伤组织。11年生自根‘嘎啦’苹果种植在山东果树科学研究所的果树试验田(山东泰安)。于2016年5月开始,分别对‘嘎啦’苹果当年新生根、幼茎、新生叶、初花时的花和花后30 d的幼果取样,取样后迅速放入液氮中,于-80℃保存。‘王林’苹果叶片诱导的愈伤组织用来进行遗传转化。愈伤组织放置在继代培养基(MS 培养基+1.0 mg∙L-1 2,4-D+1.0 mg∙L-1 6-BA)室温(24℃)暗培养。并且每隔15 d继代一次。
‘嘎啦’组培苗生长于继代培养基(MS 培养基+0.2 mg∙L-1 IAA+0.8 mg∙L-1 6-BA),其生长条件为14 h光照/10 h黑暗,温度24℃。选择继代20 d长势一致的‘嘎啦’苹果组培苗,转移到生根培养基(1/2MS培养基+1 mg∙L-1 IAA)进行生根处理。30 d后选择生根一致的10棵苹果苗进行低磷胁迫处理。将5棵苹果苗置于低磷营养液(50 μmol∙L-1 Pi)中,分别于0、3、6、12和48 h取样;另外5棵苹果苗作为对照置于正常磷含量(1.25 mmol∙L-1 Pi)营养液中,分别于0、3、6、12和48 h取样。
正常磷含量营养液(+Pi):MS营养液[19];
低磷营养液(-Pi):KH2PO4含量为正常MS营养液的1/25,另加入0.6 mmol∙L-1 K2SO4,其他成分含量不变[20]。
1.2 MdPAP10的克隆、蛋白质结构域分析和同源性分析
以拟南芥AtPAP10氨基酸序列在苹果基因组数据库中进行序列比对,获得同源性最高的基因(MDP0000272096)。根据检索到的基因序列设计引物,以‘嘎拉’组培苗的cDNA[21]为模板进行PCR扩增。PCR扩增反应条件:95℃预变性10 min;95℃变性30 s,58℃退火30 s,72℃延伸2 min,35次循环;72℃延伸10 min。PCR产物采用1.5%的琼脂糖凝胶进行电泳,回收目的条带后连接到pMD18-T克隆载体上进行测序。以MDP0000272096的氨基酸序列在NCBI数据库(http://www.ncbi. nlm. nih. gov/)中进行检索和蛋白质结构预测,下载对应的其他物种的氨基酸序列。通过MEGA5.0软件构建Neighbor-Joining系统进化树。Table 1
表1
表1本研究中所用的引物
Table 1Primers used in this study
| 基因Gene | 引物名称Prime name | 引物序列Prime sequence |
|---|---|---|
| MdPAP10 | MdPAP10-F | GTCGACATGGAGAAATTATATCTTC |
| MdPAP10-R | GAATTC TAATTCATCGTTAACAGA | |
| MdPAP10 (RT) | MdPAP10(qRT)-F | AAAATCCGGCTTCCCCTCTG |
| MdPAP10(qRT)-F | TGATGAACCCACCTTCTGGC | |
| MdPHT1.1 (RT) | MdPHT1.1 (qRT)-F | CCAAGGCTCCAAGCCATATC |
| MdPHT1.1 (qRT)-R | GGCCTTGTGATCAAGCAACA | |
| MdPT2 (RT) | MdPT2 (qRT)-F | AGCTGCCCGGAGTCGGATTCAAGAA |
| MdPT2 (qRT)-R | GGAAGCCAGATGGAGTTCAAGCAAT | |
| MdPS2 (RT) | MdPS2 (qRT)-F | GGGCCAAGTGCATTACCCGACAAGC |
| MdPS2 (qRT)-R | CTAGCCGACGAGCACACAGCTCCCT | |
| MdPS3 (RT) | MdPS3 (qRT)-F | CAGCAATCCCCCGGGAATTCGGTT |
| MdPS3 (qRT)-R | AACTCATCCTCCATGGCCAAGA | |
| MdRNS1 (RT) | MdRNS1 (qRT)-F | CTCAGGACTTCGATTTCTTCTAC |
| MdRNS1 (qRT)-R | GTCATCAGCTCTGAGATCTGAGATT | |
| MdPHO1 (RT) | MdPHO1 (qRT)-F | CCTTCATGACAGCAGTGGTTG |
| MdPHO1 (qRT)-R | GCACACTAGCAGTGCAATGGA | |
| MdActin | MdActin-F | AGGCGCGAAATTACCAATCC |
| MdActin-R | GCCCTCCAATTGTTCCTCGTTAAG |
新窗口打开
1.3 总RNA的提取及实时荧光定量PCR分析
试验材料的RNA提取采用康为世纪科技有限公司的全能型植物RNA提取试剂盒(DNase I)。反转录采用连宝生物公司PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒。选取MdActin(GenBank accession number CN938024)为内参基因。使用Ultra SYBR Mixture(with ROX)试剂盒(康为世纪)进行实时荧光定量PCR分析。荧光定量PCR仪器型号为BIO-RAD IQ5,所有PCR反应都设3次生物学重复。PCR反应体系为:2×UltraSYBR Mixture 10.0 μL,上游引物(10 μmol·L-1)1.0 μL,下游引物(10 μmol·L-1)1.0 μL,cDNA 1.0 μL,ddH2O 7.0 μL。PCR反应程序为:94℃预变性10 min,94℃变性15 s,56℃退火15 s,65℃延伸10 s,40个循环;每次循环第2步进行荧光采集。试验结果采用2-∆∆CT法对数据进行分析。1.4 载体构建及苹果愈伤转化和鉴定
通过限制性内切酶分别对pBI121表达载体和pMD18-T中间载体进行酶切反应,将酶切产物回收后在16℃进行连接反应。连接产物转化大肠杆菌感受态细胞。成功筛选到阳性克隆,获得MdPAP10-pBI121植物过表达载体。将构建的MdPAP10过表达载体转化农杆菌LBA4404,然后用筛选到的阳性农杆菌侵染继代10 d左右处于指数生长期的苹果‘王林’愈伤组织。浸泡15 min后过滤掉菌液,并用无菌水清洗2—3次。将愈伤组织转移至固体继代培养基上暗培养2 d,再转移至含300 mg∙L-1头孢霉素和30 mg∙L-1卡那霉素的继代培养基筛选一个月以上,获得具有抗性的愈伤组织,并在抗性培养基上继代多次获得稳定的抗性愈伤组织,提取DNA,用于PCR鉴定。
1.5 BCIP染色及愈伤表面酸性磷酸酶活性检测
低磷条件会诱导植物分泌酸性磷酸酶。附着在植物材料表面的酸性磷酸酶可以与BCIP反应,并生成蓝色产物。可以依据产物颜色的深浅判断酸性磷酸酶活性的高低[22]。选取生长状态一致的野生型和过表达MdPAP10的转基因愈伤,分别平铺在正常磷含量培养基和低磷培养基上,培养7 d。将BCIP溶液(含有0.01% BCIP(w/v)和0.5%琼脂(w/v))放入微波炉中加热,沸腾数次后冷却至45—50℃[23]。将冷却的BCIP溶液均匀覆盖正常和低磷培养的愈伤组织,1 h后观察拍照。将染色后的愈伤组织取出,放入1.5 mL离心管中,加入1 mL DMSO,震荡混匀,12 000 r/min离心2 min取上清,测定A635[24]。
正常磷含量培养基(+Pi):MS培养基+1.0 mg∙L-1 6-BA+1.0 mg∙L-1 2,4-D;低磷培养基(-Pi):KH2PO4含量为正常MS培养基的1/25,其他成分含量不变,添加0.6 mmol∙L-1 K2SO4、1.0 mg∙L-1 6-BA、1.0 mg∙L-1 2,4-D。
1.6 愈伤组织磷含量测定
称取1 g左右愈伤组织,在液氮中充分研磨,加入100 μL磷提取液混匀,转入1.5 mL离心管中。再加入900 μL 1%冰乙酸,上下颠倒混匀,于42℃反应30 min。12 000 r/min离心5 min,吸取300 μL上清提取液到700 μL显色液中,上下颠倒混匀,于42℃反应30 min后测定A820。依据标准曲线计算磷含量[25]。磷提取液(1 L):1 mol∙L-1 Tris-HCl(pH 8.0)10 mL,0.5 mol∙L-1 EDTA(pH 8.0)2 mL,NaCl 5.844 g,P-巯基乙醇700 μL,100 mmol∙L-1 PMSF(现用现加)10 mL。
显色液(100 mL):(NH4)6Mo7O2∙4H2O 0.35 g,98%硫酸2.339 mL,抗坏血酸1.4 g,滴定水定容到100 mL。
1.7 数据分析
使用DPS 7.05数据分析软件,进行显著性分析。不同小写字母表示不同处理间差异显著(P<0.05)。所有试验均重复3次。2 结果
2.1 MdPAP10的克隆、蛋白质结构域分析、基因结构分析和同源性分析
以‘嘎拉’组培苗的cDNA为模板,克隆得到一条约1 300 bp的条带,与预期结果一致。对克隆到的片段进行回收测序分析。结果表明,目的基因片段含有完整的开放阅读框,长度为1 332 bp,编码443个氨基酸和一个终止子,命名为MdPAP10。结构域分析表明,MdPAP10包含有一个信号肽和一个磷酸酶结构域,与拟南芥中的AtPAP10结构相似(图1-A),证明MdPAP10属于磷酸酶基因家族。基因结构分析显示,MdPAP10包含5个外显子和4个内含子(图1-B)。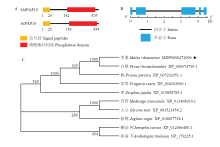 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1MdPAP10蛋白质结构域分析(A)、基因结构分析(B)及进化树分析(C)
-->Fig. 1MdPAP10 functional domain analysis (A) , gene structure analysis (B) and phylogenetic tree analysis (C)
-->
将苹果MdPAP10的氨基酸序列与白梨、桃、草莓和拟南芥等10种不同植物的MdPAP10氨基酸序列进行比对,构建Neighbor-Joining系统进化树。进化树分析结果表明,苹果MdPAP10与白梨PbPAP10的同源性最高,亲缘关系最近(图1-C)。
2.2 苹果MdPAP10基因的分析
采用qRT-PCR分析MdPAP10在11年生自根‘嘎啦’苹果不同器官中的表达情况。结果表明,MdPAP10在苹果根中的表达量最高,在叶中的表达量次之,在果实中的表达量最低(图2-A)。分别在正常和低磷条件下,处理长势一致的‘嘎啦’苹果苗,检测MdPAP10在苹果根和叶中的表达情况。结果表明,MdPAP10在根中随低磷处理时间的延长表达量逐渐升高,在6 h的时候达到最高值,而后逐渐下降(图2-B)。在低磷条件下,MdPAP10在叶中表达量明显低于正常条件,但表达量比较稳定,没有明显波动(图2-C)。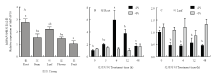 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2MdPAP10在苹果不同器官(A)、不同磷条件下根(B)和叶(C)中的相对表达量
不同小写字母表示不同处理间差异显著(P<0.05)。下同
-->Fig. 2Relative expression of MdPAP10 in different organs, root (B) and leaf (C) under different phosphorus condition of apple
Different lowercase letters indicate significant differences (P<0.05). The same as below
-->
2.3 载体构建与转基因苹果愈伤鉴定
通过限制性内切酶分别对pBI121表达载体和pMD18-T中间载体进行酶切反应,将酶切产物回收后进行连接,随后将连接产物转化大肠杆菌感受态细胞,筛选阳性克隆,获得MdPAP10-pBI121植物过表达载体(图3-A)。将构建的MdPAP10-pBI121过表达载体转化农杆菌LBA4404后,侵染苹果愈伤组织。通过35S启动子和MdPAP10的筛选引物PCR鉴定得到MdPAP10转基因苹果愈伤(L1和L2)(图3-B),进而通过qRT-PCR检测MdPAP10在转基因苹果愈伤中的表达水平(图3-C),结果表明转基因愈伤MdPAP10表达量高于野生型。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3MdPAP10-pBI121结构示意图(A)、转基因苹果愈伤鉴定(B)和MdPAP10表达水平检测(C)
WT:野生型 Wide type;L1、L2:转基因愈伤 Transgenic calli。下同 The same as below
-->Fig. 3Schematic diagram of the MdPAP10-pBI121 structure (A), identification of transgenic apple calli (B) and detection of MdPAP10 expression in transgenic apple calli (C)
-->
2.4 过量表达MdPAP10促进了苹果愈伤酸性磷酸酶在低磷条件下的分泌
将生长状态一致的野生型苹果愈伤与MdPAP10转基因愈伤同时放于正常磷含量(+Pi)和低磷含量(-Pi)的培养基中培养7 d,之后用BCIP溶液进行染色。结果表明,在正常磷含量条件下MdPAP10转基因愈伤有少量染色痕迹(图4-A),存在少量酸性磷酸酶的分泌;而在低磷条件下,MdPAP10转基因愈伤相比于野生型着色更深(图4-A),酸性磷酸酶活性更高(图4-B)。说明在低磷条件下,过表达MdPAP10能够促进酸性磷酸酶的分泌。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4野生型和转基因苹果愈伤BCIP染色(A)和酸性磷酸酶活性测定(B)
-->Fig. 4BCIP staining (A) and the measurement on acid phosphatase activity of wild type and transgenic apple calli
-->
2.5 过量表达MdPAP10促进苹果愈伤对低磷胁迫的耐受性
既然MdPAP10能够促进苹果在低磷条件下酸性磷酸酶的分泌,为验证MdPAP10是否能够提高苹果对低磷胁迫的耐受性,将MdPAP10过表达愈伤与野生型愈伤放置于正常磷含量(+Pi)和低磷含量(-Pi)的培养基中长时间培养20 d,观察愈伤组织的生长状况。结果表明,在正常条件下,转基因愈伤与野生型相比并无明显差异;而在低磷条件下,转基因愈伤的生长量明显大于野生型(图5-A、B)。进一步检测愈伤组织中的磷含量,发现MdPAP10转基因愈伤能够在低磷条件下明显促进磷吸收(图5-C)。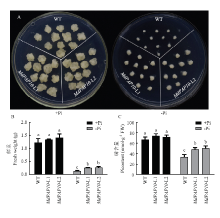 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5野生型和转基因苹果愈伤生长状况(A)、鲜重(B)和磷含量测定(C)
-->Fig. 5Growth status (A) and the measurement on fresh weight (B) and Pi content (C) of wild type and transgenic apple calli
-->
2.6 过量表达MdPAP10促进苹果愈伤中磷相关基因的表达
为进一步深入研究MdPAP10促进磷吸收的分子机理,通过qRT-PCR检测低磷条件下MdPAP10转基因苹果愈伤中磷相关基因(MdPHT1.1、MdPT2、MdPS2、MdPS3、MdRNS1和MdPHO1)的表达情况。结果表明,这些磷相关基因的表达量均明显上调(图6)。说明低磷条件下MdPAP10可能通过影响磷相关基因的表达,促进苹果对磷的吸收。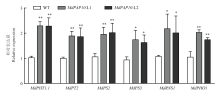 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6磷相关基因表达水平检测
*差异显著(P<0.05); **差异极显著(P<0.01)
-->Fig. 6Detection of phosphorus related gene expression
*Significant difference (P<0.05); **Highly significant difference (P<0.01)
-->
3 讨论
磷是植物生长发育所必须的大量元素,而土壤中有效磷的缺乏常常成为影响植物生长的限制因素[3,26]。而紫色酸性磷酸酶作为一类植物吸收磷所依赖的关键酶,在植物响应低磷和信号转导过程中发挥了重要调控作用[27,28,29]。随着分子生物学的进步和基因组数据库的不断丰富,越来越多的PAP,被不断的发现和鉴定,但各PAP的功能并不完全相同。在拟南芥的29个AtPAP中,明显受低磷诱导的只有AtPAP10、AtPAP11、AtPAP12、AtPAP17、AtPAP25和AtPAP26[21]。研究显示,将AtPAP12和AtPAP26突变后,拟南芥酸性磷酸酶活性明显下调,说明AtPAP12和AtPAP26对植物吸收利用外界有机磷至关重要[30]。而AtPAP17不仅受低磷诱导,而且还受盐胁迫和ABA的诱导;推测AtPAP17可能在磷胁迫与逆境胁迫的信号转导过程中起着重要作用[31]。目前,许多PAP具体功能仍不清晰,是否通过其他途径影响磷的代谢与吸收仍需要进一步研究。对于已鉴定的PAP研究多集中在功能鉴定方面,只有AtPAP10研究相对深入一些。目前研究表明,局部信号调控低磷诱导AtPAP10蛋白的积累和分泌,并且乙烯信号和糖信号可能通过不同途径影响AtPAP10的活性。进一步研究显示,AtMYB2、miR399过表达植株和AtPHO2突变体均能正调控根表面酸性磷酸酶的积累,并且能够调控AtPAP10的转录;说明AtPAP10可能参与到经典的AtMYB2-miR399-AtPHO2信号通路过程,并且位于AtPHO2下游[13]。但是,AtPHO2影响AtPAP10的分子机制仍不清楚。SUN等[32]研究表明,AtPAP10启动子中包含有多个P1BS元件,植物低磷响应的关键转录因子PHR1及其同源基因AtPHLs能够结合到AtPAP10启动子上调控AtPAP10的转录。本研究结果表明,MdPAP10在根部明显受低磷条件的诱导,而低磷条件下MdPAP10在叶中表达量较低,说明MdPAP10对低磷胁迫有明显响应。MdPAP10转基因愈伤组织在正常条件下能够分泌少量酸性磷酸酶,而在低磷条件下,能够显著促进酸性磷酸酶的分泌,并且促进磷吸收,进而提高了苹果‘王林’愈伤组织对低磷胁迫的耐受性。说明MdPAP10很可能存在翻译后水平的调控。在低磷条件下,可能存在其他酸性磷酸酶相关基因与MdPAP10共同调控植物对低磷的响应过程。本研究证明在木本植物中PAP与草本植物的PAP具有相似的功能,都能够促进低磷条件下酸性磷酸酶的分泌;但本文只研究了MdPAP10对低磷的响应,MdPAP10是否参与了其他逆境响应,是否影响到其他营养元素的吸收与利用仍需要进一步研究。另一方面,MdPAP10促进磷吸收的分子机制仍然不清楚;MdPHR1在苹果中尚未被鉴定,MdPHR1是否能够结合MdPAP10的启动子直接调控MdPAP10的转录;是否影响到其他MdPAPs的表达仍需要细致而深入的研究。
4 结论
克隆获得MdPAP10,该基因编码443个氨基酸。MdPAP10包含有一个信号肽和一个磷酸酶结构域;基因结构分析表明,MdPAP10包含5个外显子和4个内含子。进化树分析显示MdPAP10与白梨PbPAP10亲缘关系最近。MdPAP10在根中表达量最高,并且对低磷条件有明显响应。MdPAP10转基因愈伤在低磷条件下能够分泌更多酸性磷酸酶,促进磷吸收和磷相关基因的表达,提高对低磷的耐受性。说明MdPAP10在响应低磷胁迫过程中发挥着重要的正调控作用。The authors have declared that no competing interests exist.
