0 引言
【研究意义】美洲斑潜蝇(Liriomyza sativae)是一种多食性昆虫,能够危害多种蔬菜、花卉,其主要通过成虫在叶片上取食、产卵形成刻点和幼虫取食叶肉组织进行危害,影响蔬菜、花卉的产量和品质,严重时可以导致寄主植物生长缓慢甚至死亡[1]。目前,美洲斑潜蝇的防治主要以化学药剂防治为主,但是很多研究发现杀虫剂的使用及其导致的抗药性的形成,可能导致美洲斑潜蝇大规模暴发并产生更严重的危害[2],因此需要探寻安全、无毒的绿色防控手段,而基于嗅觉靶标的害虫控制策略为防治美洲斑潜蝇提供了新的方法和途径。对美洲斑潜蝇气味结合蛋白进行研究,对于揭示嗅觉反应机制及基于嗅觉靶标的防治策略制定具有重要意义。【前人研究进展】有关美洲斑潜蝇气味结合蛋白的研究目前尚无报道,仅有文献报道研究了其成虫对各种气味物质的行为学反应、EAG反应,鉴定出使美洲斑潜蝇产生嗅觉反应的绿色植物挥发物[3]。昆虫化学感受系统可以感受环境中的化学信号物质并作出反应,化学信号在昆虫寄主选择过程中发挥至关重要的作用,气味结合蛋白是一种主要存在于昆虫嗅觉感受器淋巴液中的一类分子量较小、水溶性的酸性蛋白[4,5,6,7],其主要功能是将疏水性的气味分子运输到感受神经树突膜上的受体部位,是连接外界信息分子与嗅觉受体的重要载体,参与昆虫专一性识别环境气味物质的过程,对嗅觉引导的昆虫取食、交配、产卵等行为发挥非常重要的作用[8,9,10,11]。昆虫气味结合蛋白是一个庞大的基因家族,通常由135—220个氨基酸组成,根据其保守的半胱氨酸数量可以分为含有6个C的典型的Classic OBPs[12,13],多于6个C的Plus-C OBPs[14,15,16,17];少于6个C的Minus-C OBPs[18,19],不同属的昆虫其OBPs序列相似性一般很低[16]。OBP在多种组织中均有表达,其表达量与部位、发育阶段、性别相关[20,21,22]。对OBP的蛋白功能研究多集中于其对不同气味物质的结合特性的研究[7,23-24]。【本研究切入点】气味结合蛋白在美洲斑潜蝇与外界化学信息交流中具有非常重要的作用,但是目前对美洲斑潜蝇气味结合蛋白无研究报道,对其嗅觉反应机制尚无了解。【拟解决的关键问题】对美洲斑潜蝇的气味结合蛋白基因进行克隆鉴定,获得高纯度的重组蛋白,对其在虫体的分布情况进行免疫定位,了解其发挥功能的部位,为美洲斑潜蝇嗅觉机制的研究打下基础。1 材料与方法
试验于2015—2017年在中国农业科学院植物保护研究所完成。1.1 供试虫源
美洲斑潜蝇为2015年采集于北京,饲养于中国农业科学院植物保护研究所实验室养虫间养虫笼(50 cm×40 cm×50 cm)中,以菜豆苗作为饲养寄主,饲养温度为(26±1)℃,相对湿度(60±5)%,光周期为16L:8D。收集不同组织(初羽化雌雄成虫的触角、头、胸、腹、足)的样品,液氮冷冻,-80℃冰箱保存待用。1.2 总RNA提取及cDNA第一链合成
将收集的虫样于液氮中冷冻研磨后,按照TRIzol®LS Reagent(Invitrogen公司)说明提取总RNA,并溶于Nuclease-Free水中,使用超微量紫外分光光度计NanoDrop 2000(Thermo公司)检测RNA浓度和纯度,-80℃保存备用。然后按照Reverse Transcription System(Promega公司)说明书反转录合成第一链cDNA,-20℃保存备用。1.3 LsatOBP13全长cDNA序列克隆
经过转录组测序及生物信息学分析,得到一条美洲斑潜蝇OBP基因。根据该片段设计特异性引物(表1,LsatOBP13-S、LsatOBP13-A),以反转录的第一链cDNA为模板进行PCR。PCR反应体系:2×PCR Taq MasterMix(博迈德公司)12.5 μL,cDNA第一条链1 μL,上下游引物各1 μL,ddH2O 9.5 μL。PCR反应条件:预变性94℃ 1 min;每个循环条件为94℃ 30 s;54℃ 30 s;72℃ 30 s,重复35次;72℃ 10 min;4℃保存。用1.2%的琼脂糖凝胶电泳检测PCR产物,将目的条带切下,使用DNA凝胶回收试剂盒回收纯化(Axygen公司),纯化产物连接到pGEM®-T Easy载体(Promega公司)上,然后转化DH5α感受态细胞(博迈德公司),经蓝白斑筛选及菌液PCR验证后,将阳性克隆进行测序验证。使用DNASTAR®Lasergene软件中的SeqMan分析,得到完整的LsatOBP13基因编码区序列。Table 1
表1
表1本试验所用引物
Table 1Primers used in this study
| 名称 Name | 序列 Sequence (5′-3′) | 扩增片段大小 PCR product size (bp) | 用途 Primer use |
|---|---|---|---|
| LsatOBP13-S | GAAGAGTGGAAACGCAAGGAAT | 462 | cDNA克隆 cDNA cloning |
| LsatOBP13-A | TTATTCTTCTTTCTTTTGGGCT | ||
| LsatOBP13-O-S | CCATGGAAGAGTGGAAACGCAAGG | 411 | 原核表达 Prokaryotic expression |
| LsatOBP13-O-A | CTCGAGTTATTCTTCTTTCTTTTGGGCT | ||
| LsatOBP13-q-S | TGTGCACTGCCACAAAGATGGGA | 151 | 实时荧光定量PCR Real-time quantitative PCR |
| LsatOBP13-q-A | TTGGTGTCCACGGAAGGCCC | ||
| β-actin-S | ACCTTCAACACACCCGCTATG | 168 | |
| β-actin-A | AGCCAAGTCCAAACGCAAGA |
新窗口打开
1.4 序列分析及进化树构建
使用DNAMAN进行蛋白质翻译及开放阅读框预测,使用SignalP 4.1在线软件(http://www.cbs.dtu. dk/services/SignalP/)进行信号肽预测,使用NCBI中BlastX数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列相似性对比分析,得到与其他基因序列对比结果,使用MEGA 6.0软件中的neighbor-joining(NJ)法(Bootsrap为1 000次)构建所有基因氨基酸序列的系统进化树。1.5 表达情况分析
选取美洲斑潜蝇β-actin为内参基因(GenBank:DQ452369.1)。设计用于荧光定量的目的基因引物(表1,LsatOBP13-q-S、LsatOBP13-q-A)及内参基因引物(表1,β-actin-S、β-actin-A)。qPCR反应体系:GoTaq® qPCR Master Mix(Promega公司)10 μL,上下游引物各0.4 μL,cDNA模板 2 μL,Nuclease-Free Water 7.2 μL。qPCR反应条件:反应采用两步法PCR反应,同时测定为记录55—95℃内每10 s上升0.5℃时反应体系的荧光强度,记录熔解曲线。每个样品均有3个生物学重复,每个生物学重复均进行3次技术重复,所有数据以各个样品对应的美洲斑潜蝇内参基因的Ct值作为对照,利用2-△△Ct法[25]分析美洲斑潜蝇气味结合蛋白基因在美洲斑潜蝇不同组织部位中的表达情况。1.6 原核表达及纯化
根据LsatOBP13及表达载体pET-30a(+)的序列,设计带有Nco I和Xho I限制性酶切位点的特异性引物(表1,LsatOBP13-O-S,LsatOBP13-O-A),使用高保真DNA聚合酶I-5TM 2×High-Fidelity Master Mix(iCloning公司)进行扩增,扩增产物回收连接至pGEM®-T Easy载体(Promega公司)上,然后转化DH5α感受态细胞(博迈德公司),提取质粒进行双酶切及测序验证。将含有目的片段的重组质粒及pET-30a(+)(Merck公司)用选定的限制性内切酶进行双酶切,回收的目标片段使用T4 DNA连接酶(TaKaRa公司)连接,然后转化DH5α感受态细胞中培养,提取质粒进行双酶切及测序验证。将验证正确的重组表达质粒pET-30a(+) /LsatOBP13转化BL21感受态细胞(博迈德公司)中,转化后菌液涂布在含有50 μg·mL-1卡那霉素的LB固体培养基平板中,37℃倒置培养16 h。挑取平板中大小适中的菌落到5 mL LB液体培养基中(含卡那霉素50 μg·mL-1),37℃ 200 r/min振荡培养过夜。
以1%的接种量将过夜培养的菌液接入100 mL的LB液体培养基中(含卡那霉素50 μg·mL-1),37℃ 200 r/min振荡培养至OD600=0.6—1.0,加入IPTG(终浓度0.5 mmol·L-1)诱导表达,28℃ 180 r/min继续振荡培养3—4 h。收集菌体,并进行破碎及分离上清及包涵体。使用SDS-PAGE电泳检测蛋白表达情况及表达形式。
使用Ni-NTA琼脂糖重力柱(上海生工生物工程有限公司)进行蛋白的纯化,并使用重组肠激酶(北京全式金生物技术公司)切除His标签,纯化的蛋白经过透析除盐和超滤浓缩后,使用BCA法测定浓度,保存于-20℃备用。
1.7 竞争性荧光结合实验
将获得的美洲斑潜蝇LsatOBP13重组蛋白用PBS缓冲液稀释至1 μmol·L-1。将荧光探针1-NPN、25种气味物质溶于色谱级甲醇中,配置成浓度为1 mmol·L-1的工作液。测定LsatOBP13与荧光探针1-NPN的结合常数时,将1 μmol·L-1的蛋白溶液加入比色皿中,加入1-NPN,使其终浓度为1—16 μmol·L-1梯度递增,使用荧光分光光度计970CRT(上海三科仪器有限公司)扫描,记录每个1-NPN浓度下的荧光强度,扫描参数为EX波长337 nm,EM范围为370—500 nm,灵敏度3。根据荧光强度的变化计算出LsatOBP13与荧光探针1-NPN的结合常数。
测定LsatOBP13与荧光探针1-NPN的结合能力时,将1 μmol·L-1的蛋白溶液加入比色皿中,加入1-NPN使其终浓度为1 μmol·L-1,并用荧光分光光度计进行扫描记录,扫描参数同上;然后在目的蛋白与1-NPN的混合物中按照梯度加入浓度为1 mmol·L-1气味物质,使其气味物质终浓度0—40 μmol·L-1梯度递增,记录荧光强度变化。每个气味物质重复3次。计算气味物质竞争结合50%的1-NPN时的浓度IC50,计算目的蛋白与标准气味配基的解离常数Ki,Ki=[IC50]/(1+[1-NPN]/ K1-NPN)[26]。
1.8 免疫定位
将纯化的重组蛋白作为抗原制备特异性多克隆抗体(晶诺科生物技术有限公司)。将健康的3日龄雄虫在体视显微镜下切下的头部,放入包埋剂中冷冻包埋,然后于冷冻切片机中将样品切成5 μm的薄片,并黏附于载玻片上,然后按照免疫染色试剂盒(碧云天公司)说明进行切片固定、组织封闭、一抗孵育、二抗孵育、封片。将制备好的玻片在激光共聚焦显微镜LMS680(Carl Zeiss公司)下进行观察并记录结果。1.9 数据统计与分析
采用SPSS19.0软件进行Tukey’s(HSD)单因素方差分析,对表达情况数据进行差异分析。用Graphpad Prism 6 软件拟合1-NPN的饱和曲线及计算目的蛋白和1-NPN的解离常数Ki。2 结果
2.1 LsatOBP13克隆及序列分析
获得一个新的美洲斑潜蝇气味结合蛋白基因,命名为LsatOBP13(GenBank登录号:KT250751)。LsatOBP13开放阅读框全长462 bp,编码153个氨基酸(图1)。预测其蛋白分子量大小为17.80 kD,等电点为5.75,N-末端的前17个氨基酸为信号肽序列。该蛋白具有4个保守的半胱氨酸位点,缺失了典型OBP的6个保守半胱氨酸中的第2位和第5位的保守半胱氨酸,符合Minus-C OBP的保守结构。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1LsatOBP13核苷酸序列及推导的氨基酸序列下划线表示信号肽,方框标内表示保守的4个半胱氨酸位点,星号表示终止密码子
-->Fig. 1Nucleotide and deduced amino acid sequences of LsatOBP13 The signal peptide sequence is underlined, four conserved cysteins are boxed, the stop codon is indicated by an asterisk
-->
2.2 LsatOBP13氨基酸序列对比及系统进化分析
利用NCBI中的blastx对美洲斑潜蝇LsatOBP13进行同源性搜索,LsatOBP13主要与双翅目昆虫具有较高的同源性,与其他昆虫的Minus-C OBP的氨基酸序列进行对比显示,这些序列都具有4个典型的保守半胱氨酸位点,此外还存在一个保守的谷氨酸位点(图2)。将LsatOBP13与其他双翅目昆虫的OBP构建系统进化树(图3),发现其与地中海实蝇CcapOBP99a- like位于同一小分支上,说明它们可能具有相同的基因起源。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2LsatOBP13与其他昆虫Minus-C OBPs的氨基酸序列对比 OBP序列来源及GenBank登录号 Origin of the OBP proteins and their GenBank accession numbers:CsupOBP1:二化螟 Chilo suppressalis,KC492498;DmelOBP99c:黑腹果蝇Drosophila melanogaster,FBgn0039682;AmelOBP14:意大利蜜蜂Apis mellifera,ABD92646.1;HarmOBP:棉铃虫Helicoverpa armigera,AEX07280。相同的氨基酸用黑色标出The identical amino acids are highlighted in dark
-->Fig. 2Alignment of deduced amino acid sequence of LsatOBP13 with Minus-C OBP of other insects
-->
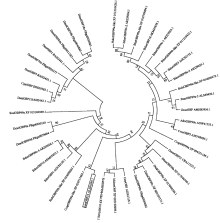 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3LsatOBP13与其他双翅目昆虫OBPs的系统发育树 OBP序列来源及GenBank登录号 Origin of the OBP proteins and their GenBank accession numbers:AfraOBP99c:南美按实蝇Anastrepha fraterculus,AOW41553.1;CcapOBP99a:地中海实蝇Ceratitis capitata,XP_004521186.1;CcapOBP99a-like:地中海实蝇C. capitata,XP_020717484.1;CvesOBP5:枣实蝇Carpomya vesuviana,AMY98995.1;BdorOBP99c-1:橘小实蝇Bactrocera dorsalis,AKI29023.1;BdorOBP99a-like:橘小实蝇B. dorsalis,XP_011210426.1;BdorOBP99c-2:橘小实蝇B. dorsalis,AKI29024.1;BdorOBP3:橘小实蝇B. dorsalis,AGC82132.1;BdorOBP99c-3:橘小实蝇B. dorsalis,AKI29025.1;BdorOBP18:橘小实蝇B. dorsalis,AKM45838.1;BdorOBP99b-like:橘小实蝇B. dorsalis,XP_011210422.1;BdorOBP1:橘小实蝇B. dorsalis,AGC82130.1;BdorOBP99c-4:橘小实蝇B. dorsalis,AKI29026.1;BdorOBP10:橘小实蝇B. dorsalis,AKM45833.1;BlatOBP99a-like:辣椒实蝇B. latifrons,XP_018799094.1;BoleOBP99a-like:橄榄果蝇B. oleae,XP_014090679.1;BoleOBP99b-like:橄榄果蝇B.oleae,XP_014090663.1;ZtauOBP99a-2:南瓜实蝇Zeugodacus tau,ALS40420.1;ZcucOBP:瓜实蝇Zeugodacus cucurbitae,AMH85956.1;DtakOBP99a:高桥氏果蝇Drosophila takahashii,XP_017000586.1;DbusOBP99a:巴氏果蝇D. busckii,XP_017846546.1;DmelOBP99c:黑腹果蝇D. melanogaster,FBgn0039682;DmelOBP99d:黑腹果蝇D. melanogaster,FBgn0039684;DmelOBP8a:黑腹果蝇D. melanogaster,FBgn0030103;DmelOBP18a:黑腹果蝇D. melanogaster,FBgn0030985;DmelOBP56b:黑腹果蝇D. melanogaster,FBgn0046880;DmelOBP84a:黑腹果蝇D. melanogaster,FBgn0011282;DmelOBP76a:黑腹果蝇D. melanogaster,FBgn0020277;GmorOBP21:采采蝇Glossina morsitans morsitans,CBA11325.1;DsimOBP99c:斑翅果蝇D. simulans,XP_002105371.1;CstyOBP:丽蝇Calliphora stygia,AID61318.1;ScalOBP99b-like:厩螯蝇Stomoxys calcitrans,XP_013097458.1;ScalOBP99a:厩螯蝇S. calcitrans,XP_013104969.1;MdomOBP:家蝇Musca domestica,XP_005192089.1;DantOBP1:葱蝇Delia antiqua,BAI82441.1;DantOBP2:葱蝇D. antiqua,BAI82442.1;DantOBP3:葱蝇D. antiqua,BAI82443.1;CquiOBP:致倦库蚊Culex quinquefasciatus,EDS29382.1
-->Fig. 3Phylogenetic tree of LsatOBP13 with OBPs from other dipteral insects
-->
2.3 LsatOBP13表达谱分析
通过qPCR的方法测定美洲斑潜蝇雌雄成虫不同组织的转录水平。结果表明,不同组织部位中(图4),以雌虫腹部的表达量为基准,LsatOBP13在触角中的表达量显著高于其他部位,在足中也有一定的表达量。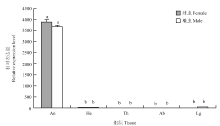 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4LsatOBP13在不同组织中的表达量 An:触角Antenna;He:头Head;Th:胸Thorax;Ab:腹Abdomen;Lg:足Leg
-->Fig. 4The relative expression level of LsatOBP13 in different adult tissues of L. sativae
-->
2.4 LsatOBP13原核表达及纯化
对成功构建的原核表达载体pET30a(+)/LsatOBP13进行双酶切和菌液PCR鉴定,电泳结果显示,酶切产物分为大小与预期相符载体片段和目的片段;菌液PCR产物条带大小符合扩增的目的片段。表达载体转入BL21感受态细胞进行诱导表达,经过条件优化,在0.5 mmol·L-1的IPTG浓度,28℃,150 r/min诱导6 h后,大量表达,超声破碎对上清和包涵体进行分离,用SDS-PAGE电泳检测,目的蛋白主要在上清中大量表达。对包涵体进行溶解后,使用Ni柱进行纯化,用SDS-PAGE电泳检测不同浓度咪唑洗脱液的蛋白情况(图5),发现在250 mmol·L-1的咪唑浓度下洗脱纯净的LsatOBP13重组蛋白,切除His标签后,再经纯化、透析、超滤浓缩后得到了高纯度的LsatOBP13重组蛋白。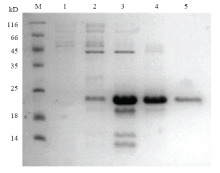 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5LsatOBP13纯化产物SDS-PAGE检测 M:蛋白分子量标准Protein molecular weight marker;1—5:分别代
-->Fig. 5SDS-PAGE analysis of purified recombinant LsatOBP13
-->
2.5 LsatOBP13的气味结合特性
测定LsatOBP13与1-NPN结合常数测定过程中拟合的饱和曲线,根据Scatchard方程的线性化(图6),根据结果可以计算出LsatOBP13与1-NPN的解离常数为(9.792±0.585)μmol·L-1,LsatOBP13与1-NPN复合体的荧光强度随着与气味性物质配基竞争性结合过程下降,使LsatOBP13与1-NPN荧光强度下降超过50%的气味配基(图7),共6种分别为反式-2-己烯醛、芳樟醇、1-辛烯-3-醇、α-紫罗兰酮、苯并噻唑、β-紫罗兰酮,它们的Ki值见表2,其中与β-紫罗兰酮亲和能力最强。LsatOBP13主要和植物中大量存在的醛、醇、酮等气味结合。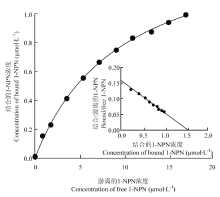 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6LsatOBP13蛋白与1-NPN的结合曲线
-->Fig. 6The binding curve of LsatOBP13 and 1-NPN
-->
Table 2
表2
表2气味配基与LsatOBP13的结合特性
Table 2Binding affinities of LsatOBP13 with specific odorant ligands
| 名称 Name | CAS编号 CAS number | IC50 (μmol·L-1) | Ki (μmol·L-1) |
|---|---|---|---|
| 棕榈酸Palmitic acid | 57-10-3 | — | — |
| 棕榈酸甲酯Methyl palmitate | 112-39-0 | — | — |
| α-紫罗兰酮α-Ionone | 127-41-3 | 30.836 | 11.224 |
| 二戊烯Limonene | 138-86-3 | — | — |
| β-紫罗兰酮β-Ionone | 14901-07-6 | 25.324 | 9.218 |
| 1-辛烯-3-醇1-Octen-3-ol | 3391-86-4 | 30.674 | 11.165 |
| 正十六烷n-Hexadecane | 544-76-3 | — | — |
| 正十八烷Octadecane | 593-45-3 | — | — |
| α-蒎烯α-Pinene | 7785-70-8 | — | — |
| 丁香酚Eugenol | 97-53-0 | — | — |
| 水杨酸甲酯Methyl salicylate | 119-36-8 | — | — |
| 吲哚Indole | 120-72-9 | — | — |
| 油酸Oleic acid | 112-80-1 | — | — |
| 亚麻酸Linolenic acid | 463-40-1 | — | — |
| 正二十七烷n-Heptacosane | 593-49-7 | — | — |
| 亚油酸Linoleic acid | 60-33-3 | — | — |
| 正二十五烷Pentacosane | 629-99-2 | — | — |
| 顺式-9-二十三烯Cis-9-Tricosene | 27519-02-4 | — | — |
| n-二十八烷Octacosane | 630-02-4 | — | — |
| 香叶烯Myrcene | 123-35-3 | — | — |
| 反式-2-己烯醛Trans-2-Hexenal | 6728-26-3 | 34.594 | 12.592 |
| β-石竹烯β-Caryophyllene | 87-44-5 | — | — |
| 苯并噻唑Benzothiazole | 95-16-9 | 22.255 | 10.366 |
| 芳樟醇Linalool | 78-70-6 | 30.208 | 10.995 |
| 4-n-庚基苯酚4-Heptylphenol | 1987-50-4 | — | — |
新窗口打开
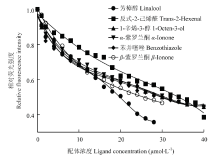 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7LsatOBP13蛋白与气味分子的竞争结合曲线
-->Fig. 7The competitive binding curve of ligands to LsatOBP13
-->
2.6 LsatOBP13的免疫定位
将制备好的经过免疫染色的玻片在激光共聚焦显微镜下进行观察。在触角鞭节横切切片中,发现LsatOBP13主要分布于毛形感器和锥形感器中(图8),在触角鞭节纵切切片中,触角芒与鞭节连接处以及嗅觉窝处有LsatOBP13的定位(图9)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8LsatOBP13在美洲斑潜蝇触角鞭节横切切片中的免疫荧光定位1、2、3为同一切片在激光共聚焦显微镜不同光照下的结果 1, 2, 3 are the same section under different illuminations of laser scanning confocal microscope;LsatOBP13在荧光共聚焦显微镜下显示绿光LsatOBP13 is reflected by the green fluorenscence under laser scanning confocal microscope;标尺Scale bar =20 μm,白色箭头指向毛形感器The white arrows point to trichoid sensilla,红色箭头指向锥形感器The red arrows point to basiconic sensilla
-->Fig. 8Immunofluorescence localization of LsatOBP13 on the cross-cut flagellum section of L. sativae antenna
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9LsatOBP13在美洲斑潜蝇触角鞭节纵切切片中的免疫荧光定位1、2、3为同一切片在激光共聚焦显微镜不同光照下的结果 1, 2, 3 are the same section under different illuminations of laser scanning confocal microscope;LsatOBP13在荧光共聚焦显微镜下显示绿光LsatOBP13 is reflected by the green fluorenscence under laser scanning confocal microscope,标尺Scale bar =20 μm,白色箭头指向嗅觉窝The white arrows point to olfactory pit,红色箭头指向触角芒与鞭节连接处The red arrows point to the joint of arista and funicular section
-->Fig. 9Immunofluorescence localization of LsatOBP13 on the straight-cut flagellum section of L. sativae antenna
-->
3 讨论
本研究克隆出一个美洲斑潜蝇气味结合蛋白基因LsatOBP13,属于非典型的气味结合蛋白Minus-C OBP,具有4个保守的半胱氨酸位点,与典型的OBP相比缺少第二位和第五位的保守半胱氨酸位点,其理化特性符合OBPs基因家族的共有特征。由于半胱氨酸形成的二硫键在蛋白高级结构的形成和稳定中发挥非常重要的作用[27],数量更多的半胱氨酸可以形成更复杂的结构,有研究推测Minus- C OBP是一类较为原始的OBP,是其他种类OBP的起源[28]。系统发育分析中,进化树显示其与地中海实蝇CcapOBP99a-like具有更近的亲缘关系,同源性较高,位于同一分支上,进化上可能具有同样的起源。通过荧光定量PCR技术研究基因在不同组织部位的表达情况是研究基因功能的基本途径。对美洲斑潜蝇LsatOBP13表达情况测定发现,在不同的组织部位中,LsatOBP13在触角中的表达量远远高于其他部位,而扫描电镜发现美洲斑潜蝇触角上具有大量的嗅觉感器[29],说明其主要在触角中发挥作用,此外,在雄虫的足中也有一定的表达,而昆虫的足上也存在着一些味觉感受器,有研究推测其主要是对非挥发性物质进行感知[29,30,31,32,33]。
为了深入研究LsatOBP13的功能,构建了其原核表达载体,对其进行诱导表达及纯化,对获得的重组蛋白进行竞争性荧光结合实验,测定了其对25种气味物质的结合能力。解离常数Ki通常被用来衡量蛋白与气味物质的结合能力,其值小于10 μmol·L-1的时候认为结合能力强[34,35,36,37]。经过测定,LsatOBP13只对25种气味物质中的6种物质有结合,说明其气味结合具有选择性[38],其中,对β-紫罗兰酮的结合能力最强,而β-紫罗兰酮是许多绿色植物中普遍存在的气味物质[39,40],且被证实是美洲斑潜蝇田间引诱剂中的关键成分[41],可能在美洲斑潜蝇对寄主植物的定向中起作用。此外,与反式-2-己烯醛有较强的结合,而反式-2-己烯醛已被证实能够引发美洲斑潜蝇触角的EAG反应[42]。这些具有较强结合的气味物质可以进一步应用于美洲斑潜蝇驱避剂的开发利用。
为了进一步探究LsatOBP13在美洲斑潜蝇组织中的分布情况及其发挥功能的位置,利用原核表达的重组蛋白制备了特异性多克隆抗体,进行免疫荧光定位。主要对其头部的触角进行了切片、免疫染色观察。美洲斑潜蝇触角上存在着多种嗅觉感器,如毛形感器、锥形感器等[29],定位结果显示,LsatOBP13主要分布于触角的毛形感器和锥形感器上,此外在嗅觉窝及触角芒与鞭节的连接处也有分布。LsatOBP13的分布情况为不同类型感器的功能研究提供了依据。
4 结论
美洲斑潜蝇OBP13为非典型的气味结合蛋白Minus-C OBP。表达情况、气味结合特性、免疫定位结果表明,OBP13主要存在于美洲斑潜蝇触角中,参与触角对绿叶植物中大量存在的气味物质的识别过程,推测其在美洲斑潜蝇嗅觉识别、寄主植物定位中发挥功能。(责任编辑 岳梅)
The authors have declared that no competing interests exist.
