海藻糖为一种非还原性糖,广泛存在于细菌、真菌、植物和无脊椎动物中,海藻糖不仅是昆虫血淋巴中的重要糖类和能量物质,而且在昆虫的生长、发育、蜕皮变态等一系列生命活动活动中具有重要作用,因此被称为昆虫的“血糖”[1,2,3]。昆虫通过海藻糖合成酶及海藻糖酶来合成和降解海藻糖,为其进行的一系列生命活动提供能源。海藻糖不仅是能量来源物质,而且是一种重要的抗逆物质,在各种环境压力条件下保护机体免受损伤[4,5,6,7]。昆虫的外骨骼主要由几丁质构成,其幼虫每生长到一定的阶段都需要蜕掉旧的表皮,形成新的表皮,这个过程由几丁质合成通路及几丁质降解途径来共同完成[8]。海藻糖酶是昆虫几丁质合成通路的第一个酶,研究表明海藻糖的合成和降解都能通过控制几丁质合成通路从而影响昆虫发育[9,10,11]。而海藻糖合成酶为海藻糖合成的限速酶,同时考虑到包括人类在内的高等哺乳动物不能自身合成海藻糖[12],海藻糖合成途径具有作为相对安全的控制靶标的潜力[13]。然而,昆虫海藻糖代谢能否且又是如何调控几丁质合成途径的?通过昆虫海藻糖代谢相关基因的功能研究,越来越多的研究结果表明当海藻糖供给平衡被打破会导致昆虫几丁质合成受阻,通路相关基因的表达显著降低、几丁质含量显著下降并产生高死亡率[9,14-16],这表明海藻糖代谢途径适合作为害虫的控制靶标[17,18]。
1 昆虫几丁质合成与海藻糖代谢
1.1 昆虫几丁质
几丁质又称甲壳素,是一种存在于昆虫和其他节肢动物表皮、气管系统、生殖器导管和各种皮肤腺体中的天然多糖[19,20,21],约占昆虫虫蜕干物质的40%[22]。几丁质是昆虫外骨骼和围食膜的主要成分,它的合成、转化和修饰与昆虫的生长发育联系紧密[8,21,23]。昆虫幼虫每生长到一定的阶段都需要蜕掉旧表皮,形成新表皮,这个过程由几丁质合成通路及几丁质降解途径共同完成[23,24,25,26,27,28,29,30,31,32],且部分表皮蛋白也参与其中[33,34,35]。除表皮外,昆虫的气管及中肠围食膜等结构的重要组成成分也为几丁质[8]。1.2 海藻糖的合成
从植物到无脊椎动物,海藻糖的合成途径并不完全相同,现有包括TPS/TPP(trehalose-6-phosphate synthase/trehalose-6-phosphate phosphatase)、TS(trehalose synthase)、TreY/TreZ(maltooligosyl trehalose synthase/ maltooligosyl trehalose trehalohydrolase)、TreP(trehalose phosphorylase)和TreT(trehalose glycosyltransferring synthase)途径在内的5种不同的海藻糖合成途径被广泛研究[36]。在昆虫体内,相关研究报道显示海藻糖主要通过TPS/TPP途径,即海藻糖合成酶和海藻糖磷酸化酶在脂肪体中合成[6,11],海藻糖合成酶催化葡萄糖-6-磷酸与UDP-葡萄糖结合生成海藻糖-6-磷酸,而海藻糖磷酸化酶则负责继续催化使之脱磷酸化形成海藻糖和磷酸[13,37],再将海藻糖释放到血淋巴中,通过淋巴循环输送到各个组织中发挥功能[14,38-39]。目前,超过50种昆虫的海藻糖合成酶基因被克隆,其包含了TPS和TPP两个保守的结构域,能够单独催化合成海藻糖[13]。2003年,科学家将果蝇的TPS导入人类HEK-293细胞,发现该细胞能够合成海藻糖并且通过减少蛋白聚集从而提高低氧条件下的存活能力[40,41]。同样,采用家蚕杆状病毒系统表达棉铃虫(Helicoverpa armigera)的TPS,能够大量提高海藻糖含量[42]。在某些物种体内已发现TPP[3],但仅含有TPS一条基因的昆虫居多。因此,根据这些结果笔者推测昆虫的海藻糖应该存在两种不同的合成途径,一条是通过TPS/TPP途径来完成;另外一条则是直接通过TPS单独完成[13]。研究结果显示,海藻糖合成酶蛋白N-末端的TPS保守结构域能够催化葡萄糖-6磷脂和UDP-葡萄糖合成海藻糖-6-磷酸;而C-末端的TPP结构域则催化海藻糖-6-磷酸转变为海藻糖[43,44]。对此,综合前人的相关研究,提出了昆虫海藻糖合成的潜在途径及与几丁质合成代谢的关联图(图1)[13]。
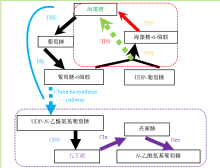 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1昆虫海藻糖供给与几丁质代谢路径
TRE:海藻糖酶Trehalase;HK:己糖激酶Hexokinase;CHS:几丁质合成酶Chitin synthase;Cht:几丁质酶Chitinase;Hex:β-N-乙酰乙糖胺酶β-N-acetylhexosamindase or β-N-acetyl-D-hexosamindase;TPS:海藻糖合成酶Trehalose-6-phosphate synthase;TPP:海藻糖-6-磷酸酯酶Trehalose-6-phophate phosphatase
-->Fig. 1The pathway of trehalose providing and chitin metabolism in insects[
-->
不仅如此,在褐飞虱(Nilaparvata lugens)和德国小蠊(Blattella germanica)中发现和克隆出两个不同的TPS,分别命名为TPS1和TPS2[11,45],采用RNAi技术对昆虫TPS的基因功能研究发现,TPS的表达下降能够引起昆虫蜕皮困难,并导致一定的死亡率[11,14,46]。同样,在NCBI数据库中,发现赤拟谷盗(Tribolium castaneum)存在两个不同的TPS(XM970683和EFA02222)。随着基因组测序等技术的发展,在褐飞虱中发现了第3条TPS,且通过序列比对分析发现摇蚊Clunio marinus(CRK87178)与前面两条TPS蛋白序列相差较大,单独成一分支,因此命名为TPS3[13,47]。与其他无脊椎动物,如秀丽隐杆线虫(Caenorhabditis elegans)和麦长管蚜(Apelenchus avenae)等物种较为相似,均含有两条及以上的TPS[48,49]。这些研究意味着昆虫的海藻糖合成进化途径更加多样化,不同昆虫的海藻糖合成途径及同一物种中不同的海藻糖合成酶基因的功能需要更加深入的研究和探索。
1.3 海藻糖的水解
海藻糖水解酶又称海藻糖酶(trehalase,TRE或Treh),最初由Bourquelot于1893年在黑曲霉(Aspergillus niger)中发现,之后发现其广泛存在于真菌、植物、昆虫和其他无脊椎动物及脊椎动物中[50]。海藻糖酶可专一地催化一分子海藻糖水解为两分子葡萄糖,产物用于各种生理及生命活动[24,51-53],并在昆虫飞行等行为活动过程中供给能量[54],另外昆虫抗逆性适应等各个方面也通过调控海藻糖含量来实现[3,55-56]。根据昆虫海藻糖酶的基因特性,其主要分为可溶性海藻糖酶(soluble trehalase,TRE1)和膜结合型海藻糖酶(membrane-bound trehalase,TRE2)两类[2,57]。1992年,从黄粉虫(Tenebrio molitor)中提取和分离出昆虫首个TRE1,它是一种胞质酶,游离于细胞质之中,负责内源性海藻糖的分解,主要存在于循环系统和消化系统中,如血淋巴、中肠和马氏管中[58]。膜结合型海藻糖酶被发现和克隆则比较晚,直至2005年才从家蚕(Bombyx mori)中克隆得到[59]。研究发现TRE2为胞外酶,主要存在于微绒毛或基侧膜上,与肌肉中的线粒体结合,负责外源性海藻糖的吸收和同化,在脂肪体、中肠和马氏管中高表达[5,9,23,50,59-64]。
近年来借助基因组测序技术,采用高通量测序技术进行转录组等研究发现昆虫TRE1不止一条编码基因存在,如褐飞虱包含TRE1-1和TRE1-2两条[10,65],赤拟谷盗有TRE1-1、TRE1-2、TRE1-3和TRE1-4 4条可溶性海藻糖酶基因[18,53],异色瓢虫(Harmonia axyridis)中存在3条或3条以上的TRE1[3,66],其中TRE1已在多种昆虫中被克隆[5,9,55,59,66-70]。这些研究结果表明在不同昆虫体内,海藻糖酶基因具有种类多样性的特点。
1.4 昆虫几丁质的合成
昆虫几丁质合成途径包括海藻糖酶和几丁质合成酶(chitin synthase,CHS)在内的8个基因共同参与,最关键且最后一步由几丁质合成酶完成[23,29,71]。昆虫的几丁质合成通路在昆虫的蜕皮和几丁质发生中起着重要作用,几丁质合成酶包括几丁质合成酶1(CHS1,又称CHSA)和几丁质合成酶2(CHS2,又称CHSB)两种类型[24-25,72]。CHS1主要负责昆虫表皮和气管中几丁质的合成[9],除豌豆蚜(Acythosiphon pisum)外已报道的相关昆虫CHS1存在可变剪切现象,两个转录子分别为CHS1a和CHS1b[73,74]。另一种是CHS2,只在中肠围食膜上负责几丁质的形成[9,75]。利用RNAi可探究两种几丁质合成酶的作用效果、阶段和范围,比如赤拟谷盗CHS1被RNAi抑制后,出现畸形幼虫、畸形蛹和畸形成虫以及蜕皮障碍,畸形蛹中的几丁质含量降低了66.9%;CHS2被RNAi抑制后,幼虫取食减少,虫体变小,中肠中的几丁质含量降低[23,76]。同样,当中华稻蝗(Oxya chinensis)的CHS1表达被抑制后,该昆虫蜕皮时间延迟、不能完成蜕皮或腹部皱缩死亡[25]。而在飞蝗(Locusta migratoria)中,CHS2表达被抑制后,取食量下降,中肠和胃盲囊长度缩短及围食膜损伤,雌雄死亡率高达78%[24]。甜菜夜蛾(Spodoptera exigua)CHS1在RNAi后,昆虫的生长发育受到抑制,出现蜕皮障碍、表皮几丁质层不能正常形成、气管发育畸形等现象[23,72]。最新研究表明褐飞虱体中可能缺乏CHS2,因此CHS1是RNAi的高效目标基因。分别向褐飞虱注射dsCHS1、dsCHS1a和dsCHS1b发现,CHS1和CHS1a的基因干扰会导致褐飞虱翅畸形、细腰、表皮皱缩并最终死亡的现象,dsCHS1b的干扰虽也会导致一定的死亡率,但其他影响不明显[74]。
2 海藻糖代谢调控几丁质合成
几丁质合成的通路始于海藻糖酶(TRE),途经己糖激酶(HK)、葡萄糖-6-磷酸异构酶(G6PI)、果糖-6-磷酸转氨酶(GFAT)、葡萄糖胺-6-磷酸-N-乙酰转氨酶(GNPNA)、磷乙酰氨基葡萄糖变位酶(PGM)和UDP-N-乙酰葡糖胺焦磷酸化酶(UAP)后,终于几丁质合成酶(CHS)[23,77-79]。海藻糖循环路径位于几丁质合成路径的起始端,TPS通过该路径合成海藻糖,TRE分解海藻糖,为几丁质的合成提供原料。研究发现海藻糖合成与分解都对昆虫几丁质合成有着重要的调控作用,具体见图1所示。2.1 海藻糖合成酶与几丁质调控
海藻糖合成酶(TPS)为海藻糖合成的关键酶类,它可以通过调控海藻糖含量的供给平衡,间接调控几丁质的合成通路中的相关基因表达[11,14]。此外,其对CHS和Cht的表达均存在一定程度的调控作用,调节几丁质的合成[9,11]。以甜菜夜蛾为研究对象,采用RNAi技术抑制TPS表达后36、48、 60和204 h,其存活率分别为53.95%、49.06%、34.86%和33.24%,显著低于对照组[14]。同样,在褐飞虱体中分别注射dsGFP、dsTPS1和dsTPS2,结果发现注射dsTPS1、dsTPS2后,TPS1与TPS2的转录量均减少、海藻糖含量却在增加,糖原含量显著降低,几丁质合成和降解通路中的各个酶活性均受到不同程度的影响[9,11,80]。其中CHS1和CHS1a的活性在48 h时抑制、72 h时增强,CHS1b的活性在48 h和72 h时均抑制;除Cht4、Cht9的活性在72 h时增强,其余Cht的活性都在不同程度上受到抑制。同时褐飞虱出现了蜕皮困难、翅畸形和近30%的虫体死亡率[11]。进而在获得褐飞虱第3条海藻糖合成酶后,发现TPS3的表达被抑制后,绝大多数的几丁质酶表达显著下降且伴随着几丁质含量的降低[47],这与赤拟谷盗TPS表达被抑制后几丁质含量降低的结果一致[46]。而采用RNAi技术抑制马铃薯甲虫(Leptinotarsa decemlineata)TPS表达后,海藻糖含量下降,导致幼虫和蛹死亡,同时几丁质含量下降[66];此外,当柑橘大实蝇(Bactrocera minax)TPS的dsRNA注射到3龄幼虫时,TPS酶活性和海藻糖含量显著下降、几丁质合成途径中的3个关键基因表达被抑制,昆虫出现畸形并死亡的比例高达52% [81]。
从现有的研究结果来看,当昆虫单个TPS表达被抑制后,CHS和Cht表达降低,TPS能够通过调控几丁质生物合成和降解通路中相关基因的表达,抑制几丁质的合成并导致昆虫蜕皮困难、产生畸形和高死亡率[11,66,81]。
2.2 海藻糖水解酶与几丁质调控
TRE是几丁质合成通路中的第一个酶,TRE催化海藻糖水解成葡萄糖,葡萄糖接着通过剩余7个酶的催化最终形成几丁质,TRE在几丁质合成中的重要性不言而喻。近年来,通过对赤拟谷盗、甜菜夜蛾、褐飞虱、马铃薯甲虫等多种昆虫的海藻糖酶-几丁质调控通路的研究,结果均表明TRE对几丁质的合成与分解存在一定的调控作用[6,9,11,53,66,70]。可溶性TRE1和膜结合型TRE2的功能还存在一些差别,TRE1与TRE2调控不同部位的几丁质合成[23]。利用RNAi技术,注射dsRNA抑制可溶性和膜结合型TRE表达后,昆虫的存活率都明显降低,同时在转录水平调控几丁质合成通路的下游基因的表达下调。TRE1的干扰对CHS1(CHSA)影响较大,对CHS2(CHSB)影响很小,因此昆虫表皮几丁质的合成受此影响较大;而TRE2对CHS2影响较大,主要影响昆虫中肠的几丁质合成[9,75]。在某些昆虫中,不同的TRE1也有细微分工。在对赤拟谷盗5个TRE进行RNA干扰的试验中,TRE1-1、TRE1-2、TRE1-3、TRE1-4和TRE2分别被干扰,观察到11种畸形表型,5个基因的抑制均导致了不同程度的死亡率,其中TRE1-1和TRE1-3的RNA干扰组中均有大量虫体因几丁质合成紊乱而死亡,TRE1-3对CHS1b、TRE2对CHS2存在着调控作用,而TRE1-1对整个几丁质合成通路有影响[52]。通过饲喂dsRNA,分别抑制赤拟谷盗TRE1-4和TRE2可导致42%和38%的死亡率[15,53]。在另一种鞘翅目昆虫马铃薯甲虫的研究中,TRE1α和TRE2表达被抑制后部分幼虫不能正常化蛹,且出现幼虫极度脱水,蜕皮困难等不同表型,特别是TRE1α低表达能够导致高达80%的死亡率[66]。同样,抑制灰飞虱(Laodelphax striatellus)TRE1和TRE2可分别导致38.89%和27.72%死亡率[70]。注射dsRNA干扰TRE1和TRE2表达可导致50%以上甜菜夜蛾死亡[9]。这些结果表明,一旦TRE的表达被抑制后,昆虫的蜕皮过程严重受到阻碍,几丁质含量显著下降[56],这也是导致昆虫死亡的最根本原因。向褐飞虱虫体注射海藻糖酶抑制剂井冈霉素,48 h后尽管3个TRE和2个TPS的表达均增加,但是2种TRE酶活性显著下降,GP、CHS1(包括它的2个转录子CHS1a和CHS1b)、6个几丁质酶(Cht3、Cht4、Cht5、Cht6、Cht7和Cht9)、HK、G6PI2、GFAT、GNPNA、PAGM1和UAP的表达均减少,同时几丁质的含量也显著减少[18]。因此,无论各个TRE具有怎样的差别,通过注射、饲喂dsTRE干扰TRE或者利用海藻糖酶抑制剂抑制酶活性,都能影响几丁质的合成和降解,并且造成一定的昆虫死亡率。
进一步的研究结果表明,干扰TRE表达后不仅阻断了几丁质合成,也抑制了几丁质降解。一方面,干扰TRE后出现了蜕皮困难等现象,这与几丁质合成酶[72,74,82-83]、几丁质酶[84]、几丁质脱乙酰酶[85,86]、β-N-乙酰乙糖胺酶[69]等几丁质合成和降解通路中相关酶被RNA干扰后的现象十分相似[87]。无论是抑制了TRE还是几丁质代谢路径中的其他酶,导致蜕皮困难最重要的原因是几丁质含量的减少。在褐飞虱幼虫中注射一定量的有效霉素48 h后几丁质含量减少了50%[18],在甜菜夜蛾体中注射dsTRE1和dsTRE2导致表皮几丁质含量显著减少,注射dsSeTRE2导致中肠几丁质含量显著减少[9]。另一方面,大多数昆虫的表皮和节肢动物的围食膜是通过TRE、CHS以及其他6个酶形成的通路来调控的[72,76,83,88-90],TRE可通过减少几丁质合成通路中一些关键酶的表达来调控几丁质的合成[9,10],例如TRE的转录和翻译水平降低可导致Cht的表达减少,从而导致蜕皮困难和较高的死亡率[18]。TRE1和TRE2可调控CHS1和CHS2[9],在褐飞虱中CHS1、CHS1a和CHS1b均在TRE调控下表达下调[10],并且同时注射3种dsTRE后己糖激酶(HK)、果糖-6-磷酸转氨酶(GFAT)、葡萄糖胺-6-磷酸-N-乙酰转氨酶(GNPNA)、UDP-N-乙酰葡糖胺焦磷酸化酶(UAP)和多个几丁质酶的含量显著下降[10]。
综上所述,当TRE表达或TRE酶活性被抑制时,大多数昆虫发育出现翅发育畸形、蜕皮困难、体重减轻、几丁质合成减少、生长受阻、飞行减少甚至死亡的现象[6,91]。TRE的低表达打破几丁质代谢平衡可能是导致昆虫蜕皮困难乃至死亡的最根本原因。
3 结论与展望
IWASA等[92]于1970年从某种链霉菌中分离得到一种海藻糖酶抑制剂有效霉素A(又称井冈霉素,validamycin)。1987年,研究表明其有效成分是糖苷配基的有效胺(validoxylamine A,VAA)[93,94],它与海藻糖的构造非常相似,但和海藻糖酶的亲和力更强,因此VAA可通过与海藻糖“争夺”海藻糖酶来实现对海藻糖酶的抑制作用,从而对昆虫产生各种影响[95,96]。最新研究发现,海藻糖酶抑制剂validamycin能够同时抑制TRE1和TRE2的蛋白活性,并通过抑制几丁质合成酶及几丁质酶在mRNA水平上的表达,从而降低几丁质含量引起昆虫蜕皮困难并大量死亡[18]。从菌类、植物等提取出的海藻糖酶抑制剂除有效霉素A外、还有Trehazolin、Salbostatin、植物碱、Suidatrestin等,它们在不同程度上抑制海藻糖的水 解[84,97-98]。昆虫中海藻糖的水解与昆虫的生理活动息息相关,若体内海藻糖的分解路径被阻断,将会影响昆虫变态发育、生殖和飞行等正常生理活动[96]。海藻糖代谢与几丁质合成具有紧密联系,并且两者均在昆虫体内具有举足轻重的作用。更为重要的是海藻糖合成在脊椎动物,特别是哺乳动物中缺失,具有成为潜在安全性害虫控制靶标途径的潜能[12]。已有研究发现化合物4-取代的2,6-二氨基-3,5-二氰基-4H-噻喃(英文名:4-substituted 2,6-diamino-3,5- dicyano-4H-thiopyrans)能够抑制TPS的活性,具有作为杀虫剂的潜能[17]。而且TPP被认为将来在抗细菌、抗真菌和抗寄生虫药物的研发中具有很大的潜力[99]。目前对TRE和TPS几丁质调控的研究证明,它们在昆虫体内的几丁质通路中起着重要的作用,通过RNA干扰TRE1、TRE2及TPS都可导致虫体不同程度的畸形和死亡。昆虫海藻糖合代谢途径相关基因的进化途径及功能仍存在许多未被研究清楚的问题。随着高通量测序技术的发展,越来越多的昆虫基因组测序完成,某些昆虫发现了2个及以上的TPS,甚至5个以上的TRE,这些相同家族的基因除了具有共同的功能外,也可能存在组织间表达的差异性或者功能上的差异。可溶性TRE1进化的多样性到底是从单个到多个,或是多个进化到多个?同物种不同的TRE1功能差异性又如何?可溶性还是膜结合型TRE具有更好的调控海藻糖降解能力,哪个更加适合作为害虫控制的靶标基因?此外,昆虫海藻糖合成途径还有待进一步的深入研究,TPS的多样性和TPP的功能研究同样值得期待。当然,从植物害虫生物防治的角度出发,继续深入研究不同的海藻糖代谢途径基因对几丁质合成及降解的调控功能,有助于推动以海藻糖代谢途径相关酶基因为靶标的绿色农药开发,为今后海藻糖酶抑制剂及海藻糖合成酶抑制剂等绿色农药的开发提供理论依据。
The authors have declared that no competing interests exist.
