0 引言
【研究意义】衰老是植物自发启动的一个细胞程序性死亡过程,受遗传和外界因子(高温、干旱、病虫害、激素和光照等)的共同调控[1]。叶片是植物发育过程中重要源器官,是植物光合作用的重要场所,为植物提供大部分能量和有机物质。水稻生物产量和经济产量的形成主要依赖于光合作用,而水稻早衰一般首先发生在叶片上,水稻叶片早衰一般涉及叶绿体发育、叶绿素降解、激素和自由基代谢等过程[2,3]。叶片早衰导致植物光合能力降低,引起作物籽粒灌浆不足、结实率下降、千粒重减小等,严重影响水稻的产量和质量[4]。因此,克隆水稻早衰相关基因对探索植物早衰机制、进行水稻遗传改良具有重要的意义。【前人研究进展】研究人员一般将衰老基因分为两类:一类是衰老下调基因,这类基因随着叶片的衰老表达受到抑制[5];第二类基因为衰老上调基因,这类基因有的在衰老期间被激活,有的在植株发育早期表达水平低,但衰老过程中基因表达量升高[6,7]。在水稻中已经定位和克隆了大量的衰老相关基因,根据这些基因参与的代谢途径与信号通路划分,大致可以分为叶绿体发育和降解的相关基因NYC1[8]、RLS1[9]、OSPAO[10]、NYC4[11]、NYC3[12]、Osh69[13]、SGR[14]、Sgr[15]和OSRCCR1[10]、蛋白质合成和降解相关基因ospse1[16]、OsSWEET5[17]和PSL2[18]、激素途径相关基因OsDos[19]和OsSAMS1[20]、细胞程序性死亡相关基因SPL28[21]和SPL33[22]及早衰和其他途径相关基因lms[23]、psd128[24]、RLS3[25]、Osl2[26]、YGL1[2]、Es7(lmes1)[27]、spl32[28]和SPL29[29]等基因。研究报道已经定位的水稻衰老相关基因有Psl1[30]、D343[31]、lst[32]、esl5[33]、esl2[34]、D101[31]、yld1[35]、Psl3[36]、Pse(t)[37]、Sms1[38]、esl6[39]、pgl3-t[40]、ES10[41]和Lad[42]等。目前,已经定位和克隆的位于第5染色体的基因有OsSAMS1[20]、OsTZF1[43]、OsRab7B3[44]、OsSWEET5[17]、esl3[45]和es-t[46]。叶片衰老是一个复杂的生物学过程:不仅涉及多类基因、多种细胞代谢途径,而且其过程极易受内外环境影响,遗传机制极其复杂。研究者们通过基因克隆和全基因组分析等技术,已构建了植物衰老的部分分子调控网络结构,但其机理仍然不够清晰。【本研究切入点】ES5的表型与目前已克隆的其他早衰基因表型明显不同,且目标区间内未有早衰相关基因报道,因此,推测ES5是一个新的早衰调控基因,克隆该基因并对其功能进行研究有利于进一步揭示水稻叶片早衰机制。【拟解决的关键问题】es5是在以嘉禾212为背景的突变体库中筛选到的一份叶片早衰突变体材料,本研究对该突变体进行形态分析、遗传分析以及基因精细定位,为该基因克隆和功能分析奠定基础。1 材料与方法
1.1 试验材料
利用EMS诱变粳稻嘉禾212,从其后代中鉴定出一个叶片早衰突变体,经多代自交后形成突变表型稳定的突变体,命名为es5。以es5为母本,籼稻中恢8015为父本,配制杂交组合得到F1,F1自交获得F2分离群体,利用F1和F2群体进行遗传分析和基因定位。所有材料2015年至2017年种植于中国水稻研究所杭州实验基地和海南陵水基地,单株种植,每行8株,株行距16.5 cm×26.5 cm,管理同大田生产。全生育期观测es5与嘉禾212的表型差异。随机选取生长一致的突变体与野生型植株各10株对株高、千粒重、结实率等农艺性状进行考察,取平均值进行数据分析。1.2 细胞组织化学染色
1.2.1 二氨基联苯胺(DAB)染色 利用二氨基联苯胺(diamino benzidine,DAB)染色可以直接观察植物组织中H2O2的积累。DAB染色参考THORDAL- CHRISTANSEN等[47]的方法。始穗当天取es5和嘉禾212倒二叶叶片浸于1 mg·mL-1的DAB染液中,抽真空室温浸泡10 h后用清水冲洗干净,然后放入95%乙醇中加热煮沸50 min脱色至叶片接近白色。脱色后叶片放入95%乙醇继续浸泡5 h后拍照。1.2.2 伊文思蓝染色 伊文思蓝染色可以直接观察植物组织中的死细胞情况。伊文思蓝染色参考KONG等[48]和LI等[49]的方法,始穗当天取es5和嘉禾212倒二叶叶片浸于0.25%染液中抽真空后浸泡10 h,清水冲洗干净后放入95%乙醇中加热煮沸50 min脱色至叶片接近白色。脱色后叶片放入95%乙醇浸泡5 h后拍照。
1.3 净光合速率和光合色素含量测定
选择晴天上午9:30—11:00,在大田随机选取具有代表性的es5和嘉禾212各3株,利用LI-6400XT便携式光合测定仪分别对其剑叶、倒二叶、倒三叶进行测定[50]。光合测定仪使用红蓝光源,开放气路。参数设置:光量子密度1 200 μmol·m-2·s-1,流速500 μmol·s-1。每株每叶重复3次算平均值作为一次重复,重复3次取平均值进行统计计算。叶绿素含量测定,参照ARNON[51]和PORRA等[52]的方法。分别取生长于大田条件下的es5和嘉禾212抽穗期剑叶、倒二叶和倒三叶叶片。去除叶片主叶脉后将其剪成0.5 cm左右的小段,分别称重0.1 g左右,放入10.0 mL 80%丙酮中,黑暗条件下浸泡24 h,每隔8 h到10 h震荡混匀一次以便光合色素充分溶解。每组3次生物学重复。将提取液在DU800可见-紫外分光光度计中进行测定,以80%丙酮为空白对照调零,分别在470、645和663 nm波长下测定光吸收值并根据已有公式计算光合色素含量。叶绿素a(Chl a)、叶绿素b(Chl b)计算公式:Chl a=(12.7OD663- 2.69OD645)×V/W;Chl b=(22.9OD645-4.68OD663)×V/W;Car=(1000 OD470×V/W-3.27chl a-104chl b)/ 198。V表示提取液的体积(10-3L),W表示叶片的重量(g)。
1.4 酶活性和衰老相关生理生化指标的测定
取es5和嘉禾212抽穗7 d后和21 d后新鲜剑叶,每份称取0.2 g,放入预冷的研钵中,加入0.1 mmol·L-1的磷酸缓冲液8 mL和少量的石英砂,进行冰浴研磨。在4℃ 3 500 r/min离心15 min,取上清液用于超氧化物歧化酶SOD(superoxide dismutase)、可溶性蛋白含量SP(soluble protein)、丙二醛MDA(malonaldehyde,MDA)含量测定。SOD活性、SP含量、MDA含量测定参照李合生[53]的方法测定。每个样品3个重复。取平均值进行统计计算。1.5 透射电镜观察
选取大田正常生长的es5和嘉禾212植株,始穗当天取es5和嘉禾212倒二叶,去除主脉,剪成约0.5 cm的小段立即置于装有2.5%戊二醛固定液的50 mL离心管中,抽真空约2 h,使叶片完全沉于管底。4℃固定1 d。脱水、渗透包埋、切块、染色及电镜观察等步骤委托浙江大学电镜中心完成。1.6 遗传分析
利用es5与籼稻材料中恢8015杂交获得F1,F1自交获得分离群体F2。观察F1和F2的表型,并统计F2群体中早衰植株与正常植株的分离情况,用SAS软件进行卡方适合性检验。1.7 基因定位
以es5与籼稻材料中恢8015为亲本杂交获得F1,F1自交得到F2定位群体,取1 280株隐性单株叶片用CTAB[54]法提取DNA。随机混合8个隐性单株DNA构建突变体基因混池,利用均匀分布于12条染色体上且在双亲间呈多态性的154对引物分别对该混池以及双亲进行基因型分析筛选连锁标记,随后用获得的连锁标记继续分析152个隐性单株基因型,对目的基因进行初步定位。根据初定位区间,从Gramene(http:// ensembl.gramene.org/genome_ browser/index.html)上下载该区间籼稻93-11和粳稻日本晴的基因组序列,比对序列寻找插入/缺失(InDel)位点,用 Primer Premiers 5.0软件开发InDel分子标记(表1),用新开发的有多态标记分析全部1 280个隐性单株基因型对目的基因进行精细定位(引物由杭州擎科生物技术有限公司合成)。PCR扩增采用杭州擎科生物技术有限公司的2×Taq PCR Mix,PCR反应体系为DNA模板2 μL、 2×Taq PCR Mix 5 μL、正向引物1 μL、反向引物1 μL和ddH2O 3 μL。反应程序为95℃ 4 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,35个循环;72℃ 8 min。PCR扩增产物经8.0%非变性聚丙烯酰胺凝胶电泳,银染后观察。候选基因分析参照水稻基因组注释信息数据库(http://rice.plantbiology.msu.edu/cgi-bin/ gbrowse/rice/)。1.8 水稻衰老相关基因表达量分析
取抽穗期es5和嘉禾212的剑叶采用QIAGEN RNeasy PlantMini试剂盒提取总RNA,提取方法参照说明书。反转录使用qPCR RT Master Mix试剂盒,反应体系及反应条件参照说明书。内参基因为Actin(GenBank登录号为 NM_001058705),利用实时荧光定量PCR分析各基因在野生型嘉禾212及突变体es5中的表达量,荧光定量PCR反应体系为cDNA模板2 μL、2×SYBR qPCR mix 10 μL、正向引物0.5 μL、反向引物0.5 μL和ddH2O 7 μL。反应程序为95℃ 30 s;95℃ 5 s,55℃ 30 s,72℃ 15 s,40个循环。每个样品3个重复。以2-△△CT计算各基因的相对表达量。荧光定量PCR所用引物见表1。Table 1
表1
表1基因定位及qRT-PCR所用的引物序列
Table 1Primers used for mapping and qRT-PCR
| 标记 Marker | 正向引物 Forward primer (5′-3′) | 反向引物 Reverse primer (5′-3′) |
|---|---|---|
| BF-20 | CCACTGAATTCCAGCTCTTTGACC | GCCTGGTGTTCTTGCTGTTGC |
| 4BF-10 | ACTACCGAGAGAGAAAACGGG | TTTCGAGGCGCATGCAGAAG |
| Osh36 | GCACGGAGGCGAACGA | TTGAGCGGTAGCACCCATT |
| Osh69 | CCACAACACGGATAACTT | GGTGAACACTATGGAACA |
| OsI85 | GAGCAACGGCGTGGAGA | GCGGCGGTAGAGGAGATG |
| SGR | AGGGGTGGTACAACAAGCTG | GGCGAGTAGTTGCAGGTGATG |
| RCCR1 | CGCATTTCCTCATGGAATTT | CTTCTCACGCTGTTTGTCCA |
| Actin | CAGGCCGTCCTCTCTCTGTA | AAGGATAGCATGGGGGAGAG |
新窗口打开
2 结果
2.1 es5表型分析
es5是嘉禾212经EMS诱变筛选获得,四叶期前es5表型与嘉禾212相比无明显差异,四叶期时es5下部叶片叶尖开始黄化衰老。同时,随着植株的生长发育,叶片的衰老面积逐渐增大,至拔节期中下部叶片衰老黄化(图1)。对es5与嘉禾212的农艺性状考察发现,由于突变体的过早衰老,其光合能力降低从而影响到整个植株的生长发育。es5的株高、有效穗数、每穗总粒数、千粒重、结实率等农艺性状都极显著下降,分别为嘉禾212的62.01%、30.91%、36.01%、90.59%和70.67%(表2)。由此可见叶片早衰严重影响株高、有效穗数、每穗总粒数、千粒重、结实率等重要的产量性状。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1野生型嘉禾212和突变体es5的表型特征
A:野生型和突变体拔节期的植株表型;B:野生型和突变体的拔节期倒三叶叶片,Scale bar=4 cm
-->Fig. 1Phenotypes of wild type Jiahe212 and mutant es5
A: Phenotype of wild type (left) and es5 (right) at elongation stage; B: Leaf phenotype of wild type (left) and es5(right) at elongation stage, Scale bar=4 cm
-->
Table 2
表2
表2野生型嘉禾212和突变体es5的主要农艺性状比较(均值±标准差,样本数=10)
Table 2Comparison of agronomic traits between wild type Jiahe212and mutant es5 (mean ±SD, n=10)
| 材料 Materials | 株高 Plant height (cm) | 每株有效分蘖数 Number of productive tillers per plant | 每穗总粒数 Total number of grain per panicle | 结实率 Seed setting rate (%) | 千粒重 1000-grain weight (g) |
|---|---|---|---|---|---|
| WT | 103.7±1.64 | 11±0.82 | 160.8±5.27 | 85.37±0.82 | 24.66±0.39 |
| es5 | 64.3±1.16** | 3.4±0.70** | 57.9±5.34** | 77.34±0.97** | 17.42±0.30** |
新窗口打开
2.2 组织化学分
叶片衰老伴随着细胞死亡,从而导致细胞中大量H2O2等活性氧的积累。伊文斯蓝溶液可以进入细胞膜损伤或者死亡细胞内并呈现出蓝色。因此,伊文思蓝染色是检测膜损伤或细胞死亡的组织化学指标。伊文思蓝染色后,可观察到es5叶片表现出深蓝色斑点,但嘉禾212叶片染色不明显(图2-A),说明es5叶片中有更多的坏死细胞。植物体内的H2O2在经过氧化物酶催化释放出的氧可以与DAB反应呈现红褐色。DAB染色结果显示,es5叶片有大面积的红褐色沉淀,而嘉禾212几乎无褐色沉淀,表明es5叶片中有大量H2O2积累(图2-B)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2野生型嘉禾212和突变体es5叶片的组织化学染色
A:伊文思蓝染色;B:DAB染色。Scale bar=1 cm
-->Fig. 2Histochemistry staining of leaves of wild type Jiahe212 and mutant es5
A: Evans blue staining of wild type and es5; B: DAB staining of wild type and es5. Scale bar=1 cm
-->
2.3 光合色素含量和光合指标测定
通过对es5和嘉禾212抽穗期剑叶、倒二叶、倒三叶的叶绿素a含量、叶绿素b含量、类胡萝卜素含量和净光合速率进行测定。结果显示,相较于嘉禾212,es5剑叶、倒二叶及倒三叶的叶绿素a、叶绿素b、类胡萝卜素含量和净光合速率均有所下降,部分指标差异极显著(图3)。表明es5叶片的提前衰老导致叶片中光合色素含量下降,光合速率极显著降低,严重影响了水稻植株的光合能力。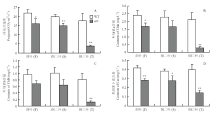 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3野生型嘉禾212和突变体es5抽穗期剑叶(F),倒二叶(S),倒三叶(T)叶片的净光合速率和光合色素含量(均值±标准差,样本数=3)
A:野生型嘉禾212和突变体es5剑叶、倒二叶、倒三叶净光合速率;B、C、D分别为野生型嘉禾212和突变体es5剑叶、倒二叶、倒三叶叶绿素a、叶绿素b及类胡萝卜素的含量。*和**分别表示在0.05和0.01水平上差异显著。下同
-->Fig. 3Net photosynthetic rate and photosynthetic pigments content of the wild type Jiahe212 and mutant es5 in the flag leaf(F), the second upper leaf (S) and the third upper leaf (T) at heading stage (means ± SD, n=3)
A: Net photosynthetic rate of wild type Jiahe212 and mutant es5 in the flag leaf, the second upper leaf and the third upper leaf; B, C, and D: The content of chlorophyll a , chlorophyll b, carotenoid of wild type Jiahe212 and mutant es5 flag leaf, the second upper leaf and the third upper leaf. *P<0.05, **P<0.01. The same as below
-->
2.4 酶活性和衰老相关参数的测量
超氧化物歧化酶(SOD)是一种活性氧清除剂,当细胞内的SOD活性降低时,细胞内的活性氧不能得到及时清除,导致活性氧在细胞内大量积累,最终引起细胞膜脂过氧化。丙二醛(MDA)是细胞膜脂过氧化的产物之一,丙二醛含量越高代表细胞膜脂的过氧化程度越高,是衰老的重要指标。植物叶片衰老还引起蛋白含量的降低,蛋白质被分解成多肽和氨基酸进而被转运到植物幼嫩组织中。取抽穗前期(7 d)和抽穗后期(21 d)es5和嘉禾212剑叶测定SOD活性、MDA含量和可溶性蛋白含量。发现从抽穗前期(7 d)到抽穗后期(21 d),es5叶片中的SOD活性均显著高于嘉禾212中SOD活性(图4-A);MDA含量在抽穗前期差异不显著,在抽穗后期es5中MDA含量显著高于嘉禾212中MDA含量(图4-B);抽穗前期和抽穗后期es5叶片中可溶性蛋白含量均极显著低于嘉禾212中可溶性蛋白含量。综上所述,es5衰老速度高于嘉禾212(图4-C)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4抽穗期野生型嘉禾212和突变体es5的生理学特征
A:过氧化物歧化酶酶活;B:丙二醛含量;C:可溶性蛋白含量
-->Fig. 4Physiological characters of wild type Jiahe212 and mutant es5 at heading stage
A: Superoxide dismutase (SOD) activity; B: Malondialdehyde content (MDA); C: Soluble protein (SP) content
-->
2.5 es5叶绿体降解加速
利用透射电镜观察es5和嘉禾212植株叶绿体超微结构,取抽穗当天es5和嘉禾212倒二叶进行透射电镜观察。结果显示,嘉禾212叶绿体呈纺锤状,叶绿体内类囊体排列整齐,片层结构清晰,基粒堆叠致密。而es5衰老部位叶肉细胞则发生了显著的变化,整个细胞死亡特征明显,其细胞质溶解,叶绿体结构异常,叶绿体膜溶解,基粒模糊,基质片层疏松,类囊体发育异常,淀粉颗粒增多(图5)。说明es5衰老部位叶肉细胞叶绿体已经发生降解,不能正常进行光合作用。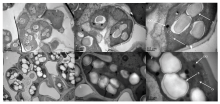 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5野生型嘉禾212和突变体es5叶片的透射电镜观察
A—C:野生型嘉禾212;D—F:突变体es5; G:基粒;S:淀粉粒;OG:嗜饿颗粒
-->Fig. 5Transmission electron microscopy (TEM) analysis of chloroplast in wild type Jiahe212 and mutant es5
A-C: Wild-type Jiahe212; D-F: Mutant es5; G: Grana; S: Starch; OG: Osmiophilic granules
-->
2.6 es5遗传分析
将es5和籼稻中恢8015杂交,F1植株叶片为正常表型。F2群体中出现性状分离。在随机挑选的250棵F2单株中,68株表现早衰表型,182株表现正常。经卡方(χ2)测验,符合3﹕1的分离比χ2=0.65<χ20.05= 3.84(表3)。表明es5早衰性状由一对核隐性基因控制。Table 3
表3
表3es5的遗传分析
Table 3Genetic analysis of es5
| 杂交组合 Hybrid combination | F1表型 The phenotype of F1 | 正常表型植株数 Number of normal plants | 突变表型植株数 Number of mutant plants | 理论比例 Ratios of theoretical | 卡方值(3﹕1) Chi-square |
|---|---|---|---|---|---|
| es5×ZH8015 | 正常Normal | 182 | 68 | 3﹕1 | 0.65 |
新窗口打开
2.7 目的基因定位
通过es5和籼稻中恢8015衍生出的F2群体来用于es5的初定位,选用均匀分布在12条染色体上且在嘉禾212和中恢8015间呈多态的154对SSR和InDel标记,分析突变体混池基因型,结果表明,位于第5染色体长臂的标记RM6841和RM5907与早衰表型连锁。从Gramene下载更多的SSR标记,通过分析152株隐性植株的基因型,将es5初步定位在RM3486和RM3664两对标记之间(图6-A)。为精细定位ES5,在RM3486和RM3664之间,新开发2对多态性好的InDel引物(表1),运用新标记和已有SSR标记进一步分析1 280个隐性单株基因型,通过连锁分析,将目的基因定位于标记BF-10和RM3664之间的52.7 kb物理区间内(图6-B)。参考水稻基因组注释计划数据库(http://rapdb.dna.affrc.go.jp),该区间内共包含8个候选基因。对候选基因的确定还有待进一步的序列分析。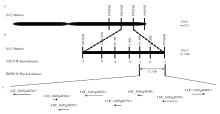 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6es5的精细定位
a:es5初定位在第5染色体RM3486和RM3664;b:es5精细定位在标记BF-10和RM3664之间52.7 kb范围内;c:es5精细定位区间内包含的ORFs
-->Fig. 6Fine mapping of es5
a: Primary mapping of es5 between markers RM3486 and RM3664; b: es5 was fine mapped to the interval between markers BF-10 and RM3664, a 52.7 kb region; c: ORFs within the fine-mapped region
-->
2.8 衰老相关基因的表达量分析
在植物衰老过程中,植物体内与衰老相关的基因会被诱导表达。利用qRT-PCR分析抽穗期es5和嘉禾212中衰老基因的表达量。Osh36[55]编码一个氨基酸转移酶与自然叶片衰老有关;Osh69[13]和OsI85[55]分别编码种子休眠蛋白和异柠檬酸裂解酶,是水稻叶片衰老的标志基因;SGR[14]和RCCR1[10]分别编码叶绿体转运肽蛋白和红色叶绿素代谢产物还原酶与叶绿体降解相关。qRT-PCR分析结果显示,es5中衰老相关基因Osh36、Osh69、OsI85和RCCR1极显著上调(图7),2个衰老的标志基因Osh69和OsI85表达量分别上调12.7和36.6倍。同时叶绿素降解相关基因SGR也显著上调(图7)。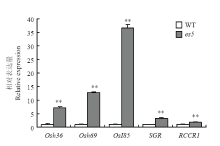 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7衰老及光合作用相关基因表达量分析
-->Fig. 7qRT-PCR analysis of senescence and photosynthesis associated genes
-->
3 讨论
目前,在水稻中已经鉴定出150多个叶色以及衰老相关基因,但被克隆的仅有50多个。已被定位的早衰相关基因在除第1、第8和第12染色体外的其他9条染色体上均有分布,其中在第5染色体上主要有ES-T和esl3(表4)。根据定位结果显示,es5与目前报道的衰老基因均不等位,为一个新的早衰基因。Table 4
表4
表4水稻中已定位早衰相关基因在染色体上的位置
Table 4The location of genes about leaf senescence on chromosomes in rice
| 基因 Gene | 染色体 Chromosome | 定位引物 Mapping markers | 正向引物 Forward primer (5’-3’) | 反向引物 Reverse primer (5’-3’) | 染色体上位置或候选基因 The location on chromosome (bp) or candidate genes |
|---|---|---|---|---|---|
| Psl1 | 2 | STS2-19 | TGCGACATCTTCTGGCTAA | CAGGCAGAAAGCGTACTAAC | 31316998 |
| STS2-25 | GATGGTGGGACTGGCTAGTGT | TGTGGTGGTTATGTTGGGAAG | 31318393 | ||
| D343 | 3 | Chr3-179-2 | GTGCTGCTGGTATTGGTG | CTAAGCCCTGGCTCTATG | 17915961 |
| Chr3-212-1 | CCCAATGAGGTCAACGAG | CAAATACCCAGCACAAC | 21240732 | ||
| lst | 3 | RM3646 | ACTAGAGCACCCTCGCTGAG | CTCAGCCACCCCATCAAC | 21997938 |
| IAC120537-1'2 | ATCTGCGCAACATATTCTCT | TTAACAAATGACGAGGCATA | 22169327 | ||
| esl5 | 3 | Indel03-1 | ACCCTAACCACAAATATCGCCTA | AGGATGTGGCGGTAGAATGCA | 14700006 |
| Indel03-2 | AGTAGGCGTCGTACTCTTCGTCGT | CCAGATCGAGGAGGAGGAGCAG | 14616710 | ||
| D101 | 4 | Chr4-220-3 | AGTAGATGGACCACAGGAAC | AATGGCAGGTAAGACAAAG | 22196715 |
| Chr4-230-1 | GTCATCGTAATCCCTCTT | CCAATCTCAATCCCACCT | 23219000 | ||
| esl2 | 4 | RM17122 | TCCGTAAACACGATCGAGAAGC | GTCCCACCTAGAGTAATTCAGAGACC | 23548840 |
| swu4-13 | ACGTGCGAAGGATTGGGATTAGT | CGCAGCAACGTGATGCTTCC | 23793058 | ||
| esl3 | 5 | RM480 | TGGTACTCACCATGCAAGTAGAACG | ATGCTCAAGCATTCTGCAGTTGG | 27155688 |
| Ind05-2 | TCTCTAGCTTCAAAGTTCTATCC | GTCAGATTTTAAAATTTAGGATT | 27489970 | ||
| es-t | 5 | P3 | CAATTAAGTCATTTGCCTAG | TAGTAACGTGTTCTTCGA | 27723205 |
| P6 | CCAAAGTCTTGTAGGGG | CATATCAAAGTTAGTTAGCG | 27768607 | ||
| yld1 | 6 | RM527 | CGGTTTGTACGTAAGTAGCATCAGG | TCCAATGCCAACAGCTATACTCG | LOC_Os06g27990 LOC_Os06g35160 LOC_Os06g29380 |
| PSL3 | 7 | c7sr1 | AACATACCTGTGTCCATACCGT | GACTGCTAACTCCTCACCTCC | 844418 |
| ID10 | GTGTGTGTGCTCCAACAAACTG | AAAGTTTGTATACATGATGCAATTTCTT | 898092 | ||
| Pse(t) | 7 | PP21 | TATCGAGGTTGCTAGTTCCA | AAGGAGTAATGCCATCACCA | 17212986 |
| SS20 | TTGAAACAATGATAACATGGTG | AAAACAAAGGGAGGGAGTAA | 17418629 | ||
| esl6 | 9 | Sind09-3 | GTGAATGGGAAACGTGTGG | GGTTGAGTGGTGCCCACT | 22185713 |
| Sind09-4 | CTGCGGAGCGGTGCTGT | CCTCGACGAAGCAATCCC | 22389200 | ||
| ES10 | 10 | M9 | GGCAAGAAGTTAAATATCCC | GAGTATCTCCTTACATTTCAAA | 16846165 |
| M10 | AGGTGACCAAGTGTTAAT | ACAGACCTTCCTTTTGAG | 16797624 | ||
| pgl3-t | 10 | c2 | CTTCAAATCCATCAAACATAGG | GCACATACAACATAATCCTTCA | 18949082 |
| c3 | TTCTTCGCCGTCTTGATTG | ATGAGGGAGAGGGGTTGG | 18966991 | ||
| Lad | 11 | SWU11-19 | GGGAAGGAGATGTGCGGTG | CCTCATAATCTACCCGCAAAGG | 21130952 |
| SWU11-5 | CATTTGATTAAAGGCAAGACAAGAAC | GGTTCGTTTCGCTTCCCTC | 23916830 |
新窗口打开
本研究中的es5四叶期下部叶片就开始黄化,抽穗期倒二叶、倒三叶衰老现象严重,倒四叶片死亡。其表型与已报道的早衰突变体psl1、psl2、psl3、pse(t)、esl2、es-t、esl3和lad均有明显的差别。psl1形态特点是自苗期叶片就开始变黄衰老,叶片全展后叶尖就开始枯萎;psl2在播种后6—8周出现早衰表型,抽穗时衰老最明显,大部分叶片黄化死亡;psl3是从第5叶叶尖开始黄化衰老,6叶期后黄化面积逐渐增大并向叶片中部扩展;pse(t)的特点是在苗期无表型,抽穗期首先在老叶上出现褐色斑点,接着整片叶子快速黄化衰老,之后叶鞘和上部叶片也开始黄化衰老,至乳熟期大部分叶片衰老枯萎;esl2孕穗期开始才从叶尖和叶缘部逐渐黄化衰老;es-t在苗期叶片就开始变黄,且有锈斑出现,其中,叶缘和叶尖表型更严重。esl3三叶期前表型不明显,三叶期后叶片发育完全后新叶叶尖表现褐化死亡,该性状一直持续到成熟;lad叶尖在第5片叶抽出前呈正常状态,当第5片叶完全抽出之后前5叶的叶尖变黄并最终枯死;此后新叶在完全抽出后叶尖也逐渐变黄并枯死。本研究中es5叶片中SOD活力和MDA含量较野生型显著性升高,可溶性蛋白含量较野生型显著性降低。es5叶片中促进衰老的基因Osh36、Osh69、OsI85、RCCR1和叶绿素降解相关基因SGR表达量极显著上调。es5叶片中叶绿体降解加速,野生型叶绿体结构正常。推测由于ES5的突变致使早衰相关基因和叶绿体降解相关基因被激活高量表达导致突变体内叶绿体降解加速,光合色素含量降低,光合能力下降,导致es5叶片黄化植株过早衰老,产量下降。
遗传分析和基因精细定位发现es5受单隐性核基因控制,该基因位于第5染色体标记BF-10和RM3664之间约52.7 kb区域内,该定位区间包含8个ORFs。ORF1和ORF3编码转座子蛋白;ORF2、ORF4、ORF5和ORF6编码未知表达蛋白;ORF7编码生长素响应Aux/IAA家族基因OsIAA19;ORF8编码糖基转移酶43家族蛋白。生长素可以直接延缓植物的衰老[56]。糖基化修饰可以改变生物活性、水溶性、在植物体内的转运特性、亚细胞定位以及与受体的识别与结合的特性,而且还能降低或消除内源和外源物质的毒性。而糖基转移酶是一种专门进行糖基化修饰的酶类。因此,糖基转移酶在调节植物的代谢、维持植物体的正常生长等方面具有重要的意义[57]。将ORF7或ORF8暂定为可能的候选基因,优先对其进行序列分析。
自然衰老过程中伴随各种营养物质和代谢产物成分的变化。在衰老过程中植物体内的营养物质再分配到生殖器官等代谢旺盛的部位,便于营养物质的再利用,有利于植物的生长繁殖,是植物长期进化过程中形成的一种适应性。正常的、适时的衰老对植物生长发育而言是有利的,但过早衰老会导致作物产量和品质下降[58]。因此分离更多的水稻早衰相关基因并阐明其生物学功能,从而有效促进水稻叶片衰老调控分子机制的研究,对于稳定水稻产量提高水稻品质具有重要意义。本研究已完成对ES5的精细定位,为克隆该基因以及深入研究该基因的功能奠定了坚实的基础。
4 结论
es5表现出光合色素含量降低,光合能力下降,植株变矮,单株有效分蘖数减少,千粒重和结实率等显著下降。es5受1对隐性核基因控制,并将该基因定位在第5染色体介于标记BF-10和RM3664之间52.7 kb的区域内。推测ES5是一个新的早衰调控基因。The authors have declared that no competing interests exist.
