0 引言
【研究意义】穗粒数、千粒重和实粒数决定了水稻产量,对于水稻增产有重要意义。穗长和枝梗数影响穗粒数,其中穗长会直接影响穗粒数,一般来说,长穗的穗粒数多于短穗,穗长的研究为水稻增产提供了一个新的方向;同时,作为影响水稻产量的三大因素之一,籽粒是遗传育种中最重要的选择性状。因此,水稻穗发育和籽粒的研究至关重要。【前人研究进展】LI等[1]证明已克隆的与穗长相关的基因SP1编码一个属于多肽转运蛋白家族的转运蛋白,决定水稻穗长。ZHU等[2]证明SRS3是驱动蛋白13亚家族的成员,在发育的器官中高表达,调控细胞伸长与水稻颖壳及其他器官如穗长、节间等的长度。DEP2编码一个未知功能的植物特有蛋白,dep2穗长变短是穗发育过程中细胞增殖减少所致[3]。目前,在水稻中已克隆了多个籽粒发育相关的基因。其中与籽粒细胞分裂和扩展相关基因有FUWA[4]、GS6[5]、GW7[6]、OSG1[7]、GW8[8]、SMG1[9]、GL7[10]、SLG[11]、AFD1[12]、GS5[13]、GS2[14]和OSNF-YB[15]等;与籽粒粒长相关的基因有PGL2[16]、SG1[17]、DEP1[18]、HGW[19]、OSGID1[20]、OSGID2[21]、OSD1[22]和GS3[23]等。这些基因的功能缺失突变体大多表现籽粒大小的变化,其中GW7编码TONNEAU1募集基序蛋白,基因表达上调促进谷粒细胞纵向分裂、减少横向分裂,从而使谷粒变得细长[6]。GW8编码一个包含SBP结构域的转录因子,能够直接与GW7启动子结合并抑制它的表达,进而调控水稻粒宽[8]。GS5是籽粒大小发育的正向调控因子,过表达通过占据OsBAK1-7的胞外富亮氨酸重复(LRR)结构域,竞争性地抑制OsBAK1-7和OsMSBP1间的互作,进而阻止OsBAK1-7通过与OsMSBP1互作而产生的胞吞作用[13]。水稻籽粒发育是一个复杂的生物学过程,除相关基因直接调控外,激素等其他因素也影响籽粒的发育。油菜素内酯是控制叶片倾角的重要植物激素,也影响株型和籽粒大小[24]。如,D1编码GTP结合蛋白α亚基,参与BR的信号传导,功能缺失突变体d1降低了对外源24-eBL的敏感性,表现植株半矮化、籽粒小而圆等特征[25]。此外,植物G蛋白复合体能通过调节异源三聚体G蛋白复合体的活性调控氮信号,这提供了基于环境可持续性增加水稻谷粒产量的新途径[26]。SAKAMOTO等[27]发现生长素(auxin,IAA)处理增加了OsBRI1的表达,进而推测生长素可能通过调节BR受体表达水平影响水稻对BR的感知,进而调控水稻株型和籽粒的发育。【本研究切入点】sps1作为dep2的一个新等位突变体,主要表现水稻株高变矮、穗长变短、籽粒变小和枝梗数目减少。前人对DEP2 的研究增加了对穗发育的认识,而sps1的探索则有利于DEP2调控水稻籽粒发育的认知,在水稻育种中有着重要的应用价值。【拟解决的关键问题】本研究通过对突变体sps1进行形态鉴定、细胞学观察、基因精细定位和qPCR分析等研究,为SPS1/DEP2的功能研究提供了一个新的方向。1 材料与方法
1.1 材料
sps1突变体来源于籼型水稻保持系西大1B的EMS诱变,经过多世代连续种植,均稳定遗传。配制缙恢10号/sps1杂交组合,对F1和F2群体进行遗传分析,2016年7月选取F2隐性群体进行基因定位。所有材料均种植于西南大学水稻研究所歇马基地。1.2 农艺性状鉴定
田间种植sps1和西大1B,成熟期测量中间10株的株高、穗长、穗粒数、穗一次枝梗数、穗二次枝梗数和千粒重等主要农艺性状。1.3 细胞学观察
抽穗期进行石蜡切片观察,即取发育完整的sps1和西大1B小花,FAA固定后,依次用一定浓度的乙醇脱水,然后二甲苯透明、石蜡包埋、切片和番红固绿染色,最后中性树胶封片,显微镜下观察并拍照;成熟期进行扫描电镜观察,分别把sps1和野生型颖壳的内外稃表皮中部置于扫描电镜下,-20℃冷冻观察、照相并统计。1.4 油菜素内酯敏感性试验
将野生型和sps1的种子催芽,露白后移到MS培养基上生长至两叶1心期。以水稻第2叶叶舌为中心,在叶片和叶鞘各1 cm处截取,测量其叶夹角后放置于不同浓度梯度的24-eBL内,离体培养3 d后再次测量叶夹角,照相并统计分析。1.5 基因定位和候选基因预测
分别取F2代分离群体中正常和突变单株各10株的叶片,等量混合后构成正常池和突变池,利用改良后的CTAB法提取亲本和基因池的DNA,进行连锁引物的筛选。选取符合3﹕1分离比例的F2代分离群体中的突变单株,采用碱煮法[28]提取基因组DNA,进行基因定位。PCR总体系为25 μL,含2.5 μL 10×PCR buffer、1.3 μL 25 mmol·L-1 MgCl2、1 μL 2.5 mmol·L-1 dNTPs、16 μL ddH2O、2 μL 10 μmol·L-1引物、2 μL模板DNA和0.2 μL 5 U·μL-1 Taq酶。PCR程序为94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。PCR产物经10%非变性聚丙烯酰胺凝胶电泳,快速银染后观察。根据Gramene和NCBI网站获得的DNA序列信息,设计引物扩增野生型和突变体的预测基因。扩增产物回收后测序,序列拼接和比对在Vector NTI Advance 10.1上进行,BLAST在Gramene和NCBI上进行。
1.6 基因表达分析
突变体sps1和野生型BR敏感性试验处理过的材料以及抽穗期发育至3—5 cm的小穗,分别放在无核酸酶的2 mL离心管后速冻于液氮中,参照天根生化科技(北京)有限公司提供的试剂盒提取RNA,反转录成cDNA后采用TaKaRa SYBR Green荧光染料进行qPCR定量分析。2 结果
2.1 sps1的形态鉴定
田间种植条件下,成熟期sps1株高变矮,由野生型的91.62 cm变为67.81 cm,缩短了25.99%,进一步研究发现sps1倒1节和倒2节节间长度显著变短;成熟期sps1的穗长为16.74 cm,极显著低于野生型的27.08 cm,缩短了38.18%;一次枝梗数目无显著差异,二次枝梗数目较野生型显著减少,结实率由野生型的88.58%下降到突变体的66.01%(图1)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1野生型西大1B(WT)和突变体(sps1)形态特征
A:野生型和sps1植株;B:野生型和sps1的倒1—倒4节间(从右至左分别为倒1节、倒2节、倒3节、倒4节);C:野生型和sps1的穗;D:野生型和sps1的株高、倒1—倒3节间长统计(PH代表株高,1st、2nd、3rd分别代表倒1节、倒2节、倒3节节间长度);E:野生型和sps1的穗长(PL代表植株穗长);F:野生型和sps1的一次枝梗、二次枝梗数目(PBN代表一次枝梗,SBN代表二次枝梗);G:野生型和sps1的结实率。A中,Bar=25.00 cm;B中,Bar=10.00 cm;C中,Bar=20.00 cm;*:在P=0.05水平差异显著;**:在P=0.01水平差异显著。下同
-->Fig. 1Morphology characteristic of the wild type (WT) and the mutant sps1
A: Phenotype of the WT and sps1; B: Internodes length of the WT (left) and the sps1 (right); C: Panicle shape of WT and sps1; D: Comparison of the plant height and internodes length of the WT and the sps1; E: Panicle length of WT and sps1; F: Primary branch number and secondary branch number of WT and sps1; G: Seed setting rate of WT and sps1. A, Bar=25.00cm;B, Bar=10.00cm;C, Bar=20.00 cm; *: Indicated the significant difference at the level of P=0.05; **: Indicated the significant difference at the level of P=0.01. The same as below
-->
2.2 sps1籽粒变短变宽
sps1的千粒重为18.01 g,显著低于野生型的20.92 g。进一步分析发现,sps1的粒长8.55 mm极显著短于野生型的10.03 mm,粒宽2.95 mm则极显著大于野生型的2.43 mm,籽粒厚度无变化(图2)。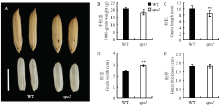 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2野生型西大1B(WT)和突变体(sps1)的籽粒
A:野生型和sps1籽粒,Bar=5.00 mm;B:野生型和sps1籽粒的千粒重统计;C:野生型和sps1籽粒的粒长统计;D:野生型和sps1籽粒的粒宽统计;E:野生型和sps1籽粒的粒厚统计
-->Fig. 2The grain of the wild type (WT) and the mutant sps1
A: The grain of WT and sps1; B: Comparison of the 1000-grain weight of the WT and the sps1; C: Comparison of the grain length of the WT and the sps1; D: Comparison of the grain width of the WT and the sps1; E: Comparison of the grain thickness of the WT and the sps1
-->
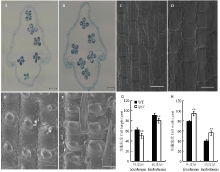
细胞学观察sps1和野生型外稃的内外表皮中部,结果发现,sps1外稃外表皮细胞长度50.70 µm,显著短于野生型的62.25 µm,缩短了18.55%,内表皮细胞长度80.43 µm,显著短于野生型的91.30 µm,缩短了10.81%;sps1外稃外表皮细胞宽度94.93 µm,显著宽于野生型的78.87 µm,上升了16.92%,内表皮细胞宽度56.52 µm,显著宽于野生型的40.22 µm,上升了28.84%。因此,认为sps1籽粒变短变宽是由于细胞大小发生改变引起。石蜡切片分析进一步验证了细胞变短变宽是导致sps1宽短粒的主要原因(图3)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3野生型西大1B(WT)和突变体(sps1)的细胞学特征
A:野生型籽粒石蜡切片;B:突变体sps1籽粒石蜡切片;C:野生型外稃的内表皮中部;D:突变体sps1外稃的内表皮中部;E:野生型外稃的外表皮中部;F:突变体sps1外稃的外表皮中部;G:野生型和sps1籽粒外稃的内、外表皮中部细胞长度统计图;H:野生型和sps1籽粒外稃的内、外表皮细胞宽度统计图。A—D,Bar=200.00 μm,E—F,Bar=100.00 μm
-->Fig. 3Cytological observation of the wild type (WT) and the mutant sps1
A: Cross section of grain in WT; B: Cross section of grain in sps1; C: SEM images of the grain endodermis of WT; D: SEM images of the grain endodermis of sps1; E: SEM images of the grain exocuticle of WT; F: SEM images of the grain exocuticle of sps1; G: Comparison of the cell length of the WT and the sps1; D: Comparison of the cell width of the WT and the sps1. A-D, Bar=200.00 μm; E-F, Bar=100.00 μm
-->
2.3 籽粒发育调控基因的qPCR分析
籽粒细胞分裂和扩展相关基因的qPCR分析发现,GL7、GS5和GS2在野生型和突变体中的表达量很低,几乎不表达,FUWA表达量相对较低;GW7、DSG1、GW8、SMG1、SLG和AFD1的表达量则相对较高。与野生型相比,DSG1和SMG1在sps1中的表达量显著上调,SLG和AFD1的表达量极显著上调,而GW7的表达量则极显著下调(图4-A)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4水稻籽粒发育相关基因的表达模式
A:籽粒相关的细胞分裂和扩展基因在WT和sps1中的表达模式;B:籽粒粒长相关的基因在WT和sps1中的表达模式
-->Fig. 4The expression patterns of genes regulating seed development in Oryza sativa L.
A: The expression patterns of the cell division and extension genes associated with grain in WT and sps1; B: The expression patterns of the length of grain genes associated with grain in WT and sps1
-->
粒长发育相关基因中,PGL2、SG1、DEP1、OSGID2、OSD1在野生型和突变体中几乎不表达,HGW、OSGID1和GS3表达量则相对较高。进一步分析发现,籽粒负调控因子HGW和GS3在突变体中的表达水平极显著高于其在野生型中的表达,OSGID1的表达量则出现下调现象(图4-B)。
2.4 基因的精细定位
利用缙恢10号和西大1B之间的多态性标记,将SPS1初步限定在水稻第7染色体ZTQ66和RM5455之间,遗传距离分别为23.60和24.61 cM。在二者之间开发新的多态性标记进一步分析338株缙恢10号/sps1的F2隐性单株,结果发现,多态性标记RM21906、sps1-1、sps1-3、sps1-2及RM21999处的交换单株分别有6、4、3、2和9个,且前3个标记的交换单株与后2个标记的交换单株不同,从而最终将SPS1定位在sps1-3和sps1-2之间134 kb的物理范围内。定位区间共有19个注释基因,其中11个编码假定蛋白,5个编码表达蛋白,其余3个分别编码DUF581蛋白、FYVE类锌指蛋白和AP2转录因子。测序发现sps1中表达蛋白编码基因Os07g0616000在外显子区域发生了一个A-T的碱基替换,造成编码的赖氨酸变成了终止密码子,初步确定为SPS1的候选基因(图5-A)。生物信息学分析发现Os07g0616000即为DEP2,因此,sps1是dep2的一个新等位突变体。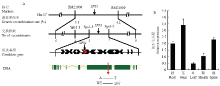 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5SPS1/DEP2的分子定位
A:SPS1/DEP2在水稻第7染色体上的分子定位;B:SPS1/DEP2在野生型中的表达模式
-->Fig. 5Molecular mapping of SPS1/DEP2
A: Molecular mapping of SPS1/DEP2 gene on rice chromosome 7; B: Expression analysis of SPS1/DEP2 in different tissues of wild type
-->
为了解SPS1/DEP2的表达模式,抽穗期取植株的根、茎、叶、鞘和穗进行qPCR分析,结果发现SPS1/DEP2在植株各个器官中均有表达,并在茎中表达量最高、叶片中的表达量最低(图5-B)。
2.5 突变体sps1对外源BR的敏感性降低
成熟期观察野生型和sps1突变体,发现sps1的倒1叶和倒3叶叶夹角分别为7.41°和28.62°,极显著低于野生型的19.02°和44.15°(图6-A)。利用不同浓度的24-eBL处理野生型和sps1,随着外源24-eBL浓度的增加,野生型的叶夹角增加幅度不断增大,而sps1的叶夹角在0.01 μmol·L-1时变化较小,在0.10 μmol·L-1浓度时,角度差增加较快,在0.10 μmol·L-1以上浓度时sps1角度差增加幅度极小。叶夹角变化表明突变体sps1对低浓度BR的敏感性降低(图6-B和图6-C)。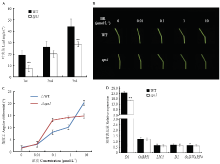 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6野生型(WT)和突变体sps1对油菜素内酯(BR)的响应试验
A:野生型和突变体三片功能叶的叶夹角;B:BR敏感性试验;C:不同浓度的外源BR处理下野生型和突变体sps1的叶夹角的角度差;D:BR相关基因在WT和sps1中的表达模式
-->Fig. 6The response test of brassinolide (BR) in the wild type (WT) and the mutant sps1
A: Comparison of the leaf angle of the WT and the sps1; B: Sensitivity test of BR; C: The differences of leaf angle between WT and sps1 under the different concentration of BR; D: Expression analysis of BR related genes in the WT and sps1
-->
qPCR结果分析发现,BR相关基因OsBRI1、LIC1、D2和OsDWARF4在野生型和突变体中表达量较低,且在二者之间表达无差异;D1在野生型和突变体中则表达量较高,且在突变体中表达量下调(图6-D)。
3 讨论
本文鉴定到一个短穗小籽粒突变体sps1,精细定位和候选基因测序发现sps1是dep2的新等位突变体。目前,已鉴定了多个dep2等位突变体。dep2-1在第6外显子上有31个碱基的缺失,dep2-2的第2内含子上有一个G-A的替换,改变了内含子的位置编辑,进而出现移码;srs1-1在第7外显子上缺失了38 bp,srs1-2在第3内含子上发生了G-T替换,srs-3则在终止密码子上出现A-G的替换;dep2-1、dep2-2、srs1-1、srs1-2和srs1-3均来自粳稻,籽粒表现为小圆粒[3,29]。ep2-1和ep2-2则来自籼稻,前者调控基因在第7外显子上有一个G-T的碱基替换,导致翻译提前终止,突变体籽粒为小圆粒,后者则在编码区出现单碱基缺失,导致移码突变,籽粒呈椭圆形[30]。与已报道的dep2等位突变体相比,sps1来自于籼稻育种材料西大1B的EMS诱变,其典型特征是穗直立,籽粒短宽导致千粒重略有下降,此外,还表现植株适度矮化、株型紧凑等特点,是一个良好的水稻育种材料。细胞变短、变宽是导致sps1籽粒宽短的主要原因,这与粒型发育一般与细胞分裂和扩张有关的结论相一致。目前,已经定位克隆了多个籽粒发育调控基因或QTLs[31,32,33],SLG编码BAHD酰基转移酶,是维持油菜素内酯平衡的一个重要调控因子,功能缺失突变体中颖壳细胞增长导致细长粒表型[11];AFD1编码一个DUF640蛋白,通过调控细胞分裂和扩展基因的表达调控籽粒的发育,功能缺失突变体内外颖的外薄壁细胞变小且数量减少,进而导致籽粒的长、厚和粒重减少[12,34];GW7则是一个调控粒长和粒宽的主要QTL,超表达能增加籽粒纵向细胞分裂并减少横向细胞分裂,进而导致谷粒细长[6,35]。qPCR分析发现,SLG和AFD1在sps1中表达极显著上调,GW7表达则极显著下调,这与sps1籽粒宽短的表型相一致。
D1[25]、OsBRI1[27]和LIC1[36]是BR信号传导途径中的关键基因,D2[37]和OsDWARF4[38]则是BR合成相关基因,同时这些基因在水稻籽粒发育中也扮演着重要的角色。qPCR分析发现,只有D1在sps1中表达极显著下降。D1编码G蛋白a亚基,功能缺失突变体表现为矮化杆粗、叶片宽短直立、叶色暗绿、直立穗和小圆粒等特征[25,39],这与dep2粳稻等位突变体的表型十分类似;同时我们发现,d1降低了对油菜素内酯的敏感性,而本研究中的sps1也降低了对油菜素内酯的敏感性。这些结果暗示SPS1/DEP2可能通过D1介导的BR信号传导途径调控水稻穗粒的发育。
SPS1作为DEP2的一个新等位基因,为DEP2的研究提供了新的思路和方向,同时对水稻分子设计育种及其他禾谷类作物的分子改良也有一定的指导意义。
4 结论
EMS诱变得到一个短穗小粒突变体sps1,株高极显著降低,穗变短且二次枝梗数极显著减少,籽粒变短变宽,千粒重显著降低,细胞变短变宽是造成sps1宽短粒的主要原因。利用缙恢10号/sps1杂交组合的F2群体最终将SPS1定位在第7染色体sps1-3和sps1-2之间134 kb的物理范围内,包含19个注释基因,测序发现sps1是DEP2的一个新等位突变体,调控基因在编码区发生了一个A-T碱基替换,造成编码的氨基酸变成了终止密码子,导致翻译提前终止。sps1对低浓度的24-eBL敏感性降低,BR信号传导途径关键基因D1的表达量显著下调,暗示SPS1/DEP2可能通过BR信号传导途径调控水稻籽粒和株型的发育。The authors have declared that no competing interests exist.
