0 引言
【研究意义】枇杷为蔷薇科(Rosaceae)枇杷属(Eriobotrya)植物,原产中国,别名卢橘。枇杷是亚热带地区的珍惜特产水果,其果实鲜美可口,柔软多汁,营养丰富,有润喉、止咳、健胃、清热等功能,被誉为保健水果,深受国内外消费者的喜爱[1]。三倍体枇杷细胞核内染色体组较二倍体增加一套,致使三倍体枇杷表现出许多二倍体枇杷所不具有的优良性状,如三倍体枇杷的叶片较二倍体变大,变厚,更加浓绿等[2]。而叶片是植物进行光合作用的重要器官,直接影响到糖分的积累,是植物形态建成的一个重要方面,在植物生长发育过程中起重要作用[3]。基因表达与调控是植物接受外界信号进行发育的关键环节,因此,分离调控枇杷叶片发育的相关基因,有助于了解三倍体枇杷旺盛生长势的分子机制,同时也为培育三倍体优质无核枇杷提供参考。【前人研究进展】植物叶片在发育过程中受多种基因调控,GROWTH-REGULATING FACTORs (GRFs)是一类调控叶片发育的转录因子家族,研究人员在拟南芥中共鉴定出9个GRFs(GRF1—GRF9)家族成员[4]。对拟南芥以及水稻的研究发现,GRFs转录因子通过结合到DNA链上以抑制或激活目标基因的表达,不但在叶片的形成过程中起重要的调节作用,而且在植物的抗性、花器官发育等过程中也起到重要的调节作用[5]。然而遗传学分析表明,在9个GRFs转录因子家族成员中,GROWTH-REGULATING FACTOR5(GRF5)对叶片形态发育的调控作用较其他8个转录因子更强,研究的也更加充分[6]。研究发现,拟南芥AtGRF5突变体由于叶片细胞数目的变少而表现出叶片狭窄,而超表达AtGRF5则促进了细胞分裂,进而使得叶片变大[7]。WERNER等[8]在对拟南芥细胞分裂素研究时发现,过表达AtGRF5的拟南芥植株随着细胞分裂素的加速降解而表现出叶片大小的回复突变,因此认为,在叶片的发育过程中,GRF5和细胞分裂素共同调控细胞的分裂进而影响叶片的大小。最近在对拟南芥AtGRF5的研究中还指出,过表达AtGRF5不仅可以促进细胞分裂,还可以加速叶绿体分裂,提高光合作用效率,延缓叶片衰老[9]。【本研究切入点】目前对GRF5研究主要集中在模式植物拟南芥上,而对木本植物GRF5转录因子的相关研究还鲜有报道。【拟解决的关键问题】本研究通过对枇杷EjGRF5转录因子基因及其启动子进行克隆并分析,采用qRT-PCR对EjGRF5在三倍体及其亲本中(4x、2x)的表达量进行分析,以明确EjGRF5及其启动子的序列特征和在不同倍性枇杷中的表达模式,为进一步研究该基因的功能奠定基础。1 材料与方法
试验于2016年11月至2017年7月在西南大学重庆市果树学重点实验室进行,田间采样于2016年8月到2016年12月在重庆市北碚区歇马镇枇杷园进行。1.1 材料
供试材料主要包括两个杂交组合所得到的三倍体植株及其相应亲本,杂交组合1:‘龙泉1号’四倍体(母本),‘贵州1号’(父本)以及杂交所获得的9株三倍体枇杷,编号为A-1、A-2.……A-9;杂交组合2:‘龙泉1号’四倍体(母本),‘贵州23号’(父本)以及杂交所获得的3株三倍体枇杷,编号为B-1、B-2、B-3。贵州1号及贵州23号均为二倍体野生枇杷,引自贵州,‘龙泉1号’四倍体为笔者实验室早年通过天然筛选得到的一株天然四倍体枇杷。取供试材料的幼嫩叶片放于液氮中,带回实验室置于-80℃超低温冰箱保存,用于后续克隆及定量分析。工程菌Escherichia coli DH5α及凝胶回收试剂盒购自北京天根公司,反转录试剂盒、克隆载体pMD19-T,Universal GenomeWalkerTM 2.0试剂盒购自Takara公司,Taq Plus DNA Polymerase 高保真聚合酶购自南京诺唯赞生物有限公司,EASYspin Plus plant RNA kit 购自北京艾德莱生物科技有限公司。
1.2 基因克隆
采用改良的CTAB法提取‘龙泉1号’四倍体枇杷基因组DNA[10]。以转录组测序拼接得到的EjGRF5序列作为参考序列设计一对特异性引物:GRF5-F:5′-ATGATGAATGGAAATCCAAGTAG-3′;GRF5-R:5′-TTAACCGTCATTAGGACCTCCAG-3′,PCR反应体系为25 μL:2.5 μL 10×TaqPlus Buffer (Mg2+ Plus),0.5 μL dNTPs, 1 μL DNA,上、下游引物(10 μmol·L-1)各1 μL,TaqPlus DNA聚合酶0.25 μL、用ddH2O补至终体积25 μL。PCR反应条件为:94℃预变性5 min;94℃ 30 s,55℃ 30 s,72℃ 60 s,35个循环;72℃延伸7 min。回收PCR产物并连接到PMD19-T载体上,构建重组质粒转化E.coli DH5α感受态细胞,筛选阳性克隆,送至成都擎科梓熙生物技术有限公司测序。测序结果在NCBI中进行Blast同源性比对,并结合转录组测序得到的GRF5参考序列进行分析,得到枇杷GRF5的CDS序列,命名为EjGRF5。1.3 启动子克隆
以‘龙泉1号’四倍体基因组DNA为模板,依据Universal GenomeWalkerTM 2.0启动子克隆试剂盒说明书,以1.2中克隆得到的EjGRF5序列及后续测序得到的部分EjGRF5启动子序列为依据,分批设计巢式引物,不断往上游扩增,直到扩增出约 2 000 bp的EjGRF5启动子序列。所用巢式引物如表1所示。Table 1
表1
表1引物用途及序列
Table 1Application of primers and sequence
| 用途 Use | 引物名称 Primer name | 上游引物序列 Primer sequence (5′-3′) | Tm值 Tm value (℃) |
|---|---|---|---|
| EjGRF5启动子克隆EjGRF5 promoter cloning | 1-EjGRF5 GSP1 | AACCACACAATTACCTTAGACACCC | 60.8 |
| 1-EjGRF5 GSP2 | ATGGGGGAAGAGTCTTGAGGAAATG | 61.7 | |
| 2-EjGRF5 GSP1 | CTAAAATGTTACCAAGACGAAG | 54.0 | |
| 2-EjGRF5 GSP2 | CCAATGGCTGTGATGATGTGTG | 51.6 | |
| 3-EjGRF5 GSP1 | TGCCACTGGCTATGCAGCTCTACAGAA | 70.4 | |
| 3-EjGRF5 GSP2 | CCACTGGGTCCAGATAGCTGCTCCTTG | 72.1 | |
| 4-EjGRF5 GSP1 | ACACAGACCACACAATCTCAACTACAT | 61.2 | |
| 4-EjGRF5 GSP2 | CTAACGATTAGAAGCGTGTCTTCATTT | 62.4 | |
| 5-EjGRF5 GSP1 | AAAATTAGATGGAAAGGGATTGTCTGC | 64.9 | |
| 5-EjGRF5 GSP2 | CTTAACCATAAAAACAGAAGGGCACAG | 64.3 | |
| qRT-PCR | qEjGRF5-F | TCAAAGTACTGCGAGAGG | 48.2 |
| qEjGRF5-R | AGGGAAGATGATGATGGT | 48.2 | |
| 内参 Reference gene | Actin-F | ATCCTTCGTCTGGACCTTGC | 58.9 |
| Actin-R | GACAATTTCCCGTTCAGCAGT | 59.2 |
新窗口打开
1.4 生物信息学分析
使用ORF finder 软件分析基因的开放阅读框(ORF)和编码氨基酸序列;采用BioEdit7.2对EjGRF5 CDS序列及其编码的蛋白理化性质进行分析;采用SignalP 4.1预测EjGRF5蛋白的信号肽;Mega7.0 软件构建EjGRF5和其他物种GRF5的系统进化树;LocTree3(https://rostlab. org/services/loctree3/)和SoftBerry ProtComp9.0(http://linux1.softberry.com/berry. phtml)进行亚细胞定位预测[11,12];采用在线软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/ plantcare/html/)进行启动子序列分析。1.5 枇杷EjGRF5的荧光定量表达分析
参照EASYspin Plus plant RNA kit试剂盒说明书提取枇杷总RNA,用反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser合成cDNA。采用Actin(笔者实验室前期筛选获得)作为实时荧光定量PCR (qRT-PCR)的内参基因。内参基因Actin的引物序列如表1所示。所用仪器为Stepone Real-Time PCR仪(ABI),所有qRT-PCR反应都设3次重复。PCR反应体系为10 μL:2×ChamQ SYBR qPCR Master Mix 5 μL,上、下游引物各0.2 μL,模板2 μL,50×ROX Refence Dye I 0.2 μL,用RNAase Free H2O补至终体积10 μL。PCR反应程序为:95℃预变性10 s,95℃ 5 s,60℃ 10 s;溶解曲线反应程序:95℃ 15 s,60℃ 1 min,60—95℃(in 0.3 inc) 15 s。试验结果采用2-ΔΔCt法对数据进行分析。2 结果
2.1 EjGRF5克隆及序列分析
从枇杷基因组DNA中扩增得到大小约1 500 bp的条带,对该条带回收、克隆、PCR鉴定和测序后,得到片段大小为1 386 bp,将测序得到的基因序列与转录组获得的EjGRF5参考序列比对后发现,枇杷EjGRF5含有3个外显子,2个内含子。内含子全长399 bp,外显子即EjGRF5 CDS序列。全长987 bp,其所编码的氨基酸序列与和核苷酸序列相对应,如图1所示。EjGRF5序列及CDS序列已提交至NCBI注册,序列号分别为:MF772342、 MF772341。EjGRF5 CDS的A+T含量为53.29%,G+C含量为46.71%,编码328个氨基酸,蛋白相对分子质量为36.5 kD,等电点为8.91。其氨基酸残基中含有30个带负电的氨基酸残基,36个带正点的氨基酸残基,76个疏水氨基酸,128个极性氨基酸。通过SignalP 4.1在线软件进行信号肽预测发现,EjGRF5蛋白无信号肽序列,为一种非分泌蛋白。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1EjGRF5核苷酸序列及其氨基酸序列
-->Fig. 1Nucleotide and amino acid sequence of EjGRF5
-->
2.2 EjGRF5进化分析
利用Mega7.0上的邻接法(neighbour-joining,NJ)对枇杷EjGRF5蛋白、GenBank数据库中有记载的20个GRF5蛋白进行进化树构建(图2),结果表明,枇杷EjGRF5与蔷薇科中的一些植物,如白梨、苹果、甜樱桃、梅花、碧桃等的亲缘关系较近,其中与白梨的亲缘关系最近,由此明确EjGRF5为蔷薇科家族成员。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2EjGRF5与其他植物GRF5蛋白的系统进化树分析(邻接法)
-->Fig. 2The neighbor-joining (NJ) tree of EjGRF5 with GRF5 proteins from other species
-->
2.3 EjGRF5亚细胞定位预测
通过在线预测软件SoftBerry ProtComp9.0对EjGRF5蛋白进行亚细胞定位预测,结果显示,EjGRF5蛋白定位在细胞核的相应预测数值最高,为9.04。采用在线预测软件LocTree3对EjGRF5蛋白亚细胞定位进行进一步预测,结果显示,EjGRF5蛋白同样定位于细胞核。由此判断,EjGRF5蛋白可能为一核蛋白。根据EjGRF5序列设计巢式引物,依据Universal GenomeWalkerTM 2.0试剂盒说明书进行巢式PCR扩增,经过5轮巢式PCR、测序以及拼接后得到了一条大小约2 200 bp的序列。采用PlantCARE在线软件对其序列(1 500 bp)进行分析后发现,EjGRF5启动子序列含有3个植物激素相应元件(ABRE、CE3、GARE-motif)、11个光响应元件(AE-box、ATCT-motif、Box4、BoxI、CAG-motif、G-Box、G-box、GA-motif、GT1-motif、MNF1、Sp1)、1个乙烯相应元件(ERE)、1个高温相应元件(HSE)等(表2),说明EjGRF5的转录表达可能受到这些因子的调控,并且对光照的变化十分敏感。
Table 2
表2
表2EjGRF5基因上游启动子顺式调控元件预测
Table 2Prediction of Cis regulatory elements in the promoter of EjGRF5
| 元件 Motif | 序列 Sequence | 功能 Function |
|---|---|---|
| ABRE | TACGTG/CACGTG | 脱落酸响应元件 Cis-acting element involved in the abscisic acid responsiveness |
| AE-box | AGAAACAT | 光响应元件 Part of a module for light response |
| ARE | TGGTTT | 厌氧诱导响应元件 Cis-acting regulatory element essential for the anaerobic induction |
| ATCT-motif | AATCTAATCT | 光响应元件 Part of a conserved DNA module involved in light responsiveness |
| Box 4 | ATTAAT | 光响应元件 Part of a conserved DNA module involved in light responsiveness |
| Box I | TTTCAAA | 光响应元件 Light responsive element |
| CAG-motif | GAAAGGCAGAC | 光响应元件 Part of a light response element |
| CE3 | GACGCGTGTC | 脱落酸和VP1转录因子响应元件 Cis-acting element involved in ABA and VP1 responsiveness |
| ERE | ATTTCAAA | 乙烯相应元件 Ethylene-responsive element |
| G-box | TACGTG/CACGTG/TGACGTGG/CACGTC | 光响应元件 Cis-acting regulatory element involved in light responsiveness |
| G-Box | CACGTA/CACGTG/CACACATGGAA | 光响应元件 Cis-acting regulatory element involved in light responsiveness |
| GA-motif | AAAGATGA | 光响应元件 Part of a light responsive element |
| GARE-motif | AAACAGA/TCTGTTG | 赤霉素响应元件 Gibberellin-responsive element |
| GT1-motif | GGTTAA/GGTTAAT | 光响应元件 Light responsive element |
| HSE | AAAAAATTTC | 高温相应元件 Cis-acting element involved in heat stress responsiveness |
| MNF1 | GTGCCC (A/T) | 光响应元件 Light responsive element |
| Sp1 | GGGCGG/CC(G/A)CCC | 光响应元件 Light responsive element |
新窗口打开
2.5 EjGRF5在亲本(2x,4x)及其三倍体子代中的表达模式
利用qRT-PCR技术,对EjGRF5在亲本(4x、2x)及其三倍体中的表达进行分析。中间亲本值(Middle- Parent-Value,MPV)是衡量杂种优势的一个重要指标,根据亲本基因组在三倍体子代中的贡献率,计算出中间亲本值(MPV),即:MPV=2/3ב龙泉1号’(4x)+1/3ב贵州1号’(2x)(‘贵州23号’(2x))。在分析三倍体EjGRF5表达量变化时,采用MPV值作为对照,将子代及其亲本的表达量与MPV进行比较,计算出2-△△Ct。分析结果显示,‘贵州1号’(2x)和‘贵州23号’2x的表达量要显著低于‘龙泉1号’(4x),如图3中箭头所示。在两个杂交组合中,仅有三倍体A-6和B-3 EjGRF5表达相对于MPV发生了下调,其他三倍体的表达量都较MPV发生了不同程度的上调,其中A-3的表达量是MPV的20倍,A-5表达量是MPV的18倍左右,中亲优势明显。且A-2、A-3及A-5的表达量还明显高于‘龙泉1号’(4x),超亲优势明显,如图3所示。这说明EjGRF5在三倍体枇杷叶片中的上调表达可能是导致三倍体枇杷叶片变大的一个重要因素。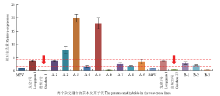 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3EjGRF5在三倍体子代及其亲本(4x, 2x)中的实时荧光定量表达分析
-->Fig. 3qRT-PCR expression analysis of EjGRF5 in triploid hybrids and parental (4x, 2x)
-->
3 讨论
近年报道的GRFs转录因子家族共有9个成员,其在叶片的生长发育过程中具有重要的调节作用,GRF5转录因子是GRFs转录因子家族中研究的较多且较充分的一个转录因子。研究指出,GRF5转录因子参与了叶片各个组织从叶原基分化后直至完全成熟这个阶段的发育调控 [13,14]。遗传学分析表明,GRF5转录因子需与转录共激活子ANGUSTIFOLIA3(AN3)相互作用,通过聚集SWI/SNF染色质重塑复合物来调节叶片的大小及性状[15,16,17]。在拟南芥中,研究人员发现,GRF5转录因子在调节叶片生长时,还能够与另外8个GRFs转录因子家族成员中的一个或多个共同调节叶片的生长[18,19]。为此,通过克隆枇杷叶片EjGRF5为进一步探究三倍体枇杷叶片生长发育特点提供理论依据。本研究克隆得到枇杷EjGRF5,同源比对发现其EjGRF5蛋白与蔷薇科中已报道的GRF5序列有较高的同源性,说明他们在进化上是高度保守的。启动子在调控基因表达中起重要的作用[20],本研究采用染色体步移的方法成功克隆到枇杷EjGRF5起始密码子上游2 200 bp的启动子片段。通过对EjGRF5启动子序列的生物信息学分析发现,其含有3个植物激素相应原件,1个高温相应元件,1个乙烯相应元件,然而,与光响应的元件达到11个,暗示光照对EjGRF5的表达可能具有重要的诱导作用[21,22]。这也为进一步研究EjGRF5在三倍体枇杷中的表达机理奠定了基础。
笔者课题组早期观察发现,三倍体枇杷的叶片较其亲本(4x,2x)表现出不同程度的变大、变厚、变绿[2,23],因此推测,三倍体枇杷EjGRF5的表达发生了上调。利用qRT-PCR对EjGRF5在亲本(2x,4x)及其三倍体中进行表达分析,结果显示,在两个杂交组合中,仅有子代A-6和B-3相对于中间亲本值(MPV)的表达发生了下调,其他三倍体的表达量都较MPV发生了不同程度的上调。然而,在所研究的三倍体中,仅有A-2、A-3及A-5的表达量明显高于‘龙泉1号’(4x),表现出明显的超亲优势,而除B-3外,几乎所有的三倍体EjGRF5表达量都高于二倍体父本。而前人的研究表明,基因的剂量效应可能对基因的表达量产生影响[24,25]。因此,不同倍性枇杷EjGRF5表达量的差异是否受到了基因剂量的影响还有待进一步的研究。除此之外,基因表达还受其他多种因素的调控,如SiRNA[26,27,28,29]、DNA甲基化[30,31]等。然而,关于EjGRF5在三倍体及其亲本中的表达差异机理目前还知之甚少,有待进一步研究。
4 结论
本研究分离了控制枇杷叶片生长发育的相关基因EjGRF5全长及其CDS序列,发现EjGRF5蛋白与蔷薇科植物中的GRF5蛋白高度同源。对EjGRF5的启动子区域分析发现,其启动子序列含有多个受光诱导的顺势调控元件。QRT-PCR发现,除A-6和B-3外,EjGRF5在三倍体枇杷中的表达量都较MPV值有不同程度的上调,研究结果为进一步探索三倍体枇杷叶片生长旺盛的相关机理奠定了基础。The authors have declared that no competing interests exist.
