0 引言
【研究意义】草莓(Fragaria×ananassa Duch)为蔷薇科(Rosaceae)草莓属(Fragaria)多年生草本植物,分布范围较广,果实营养价值和经济价值较高。在温度较低的冬春季节,低温是制约其产量和品质的主要因素,草莓能否安全越冬及培育耐寒品种是生产上急需解决的问题[1]。转CBF1/DREB1B拟南芥的研究中,成功培育出具抗寒特性的转基因株系[2]。但耐寒品种除了要增强其抗寒性外,还需要保持果实原有的品质。果实色泽,是外观品质重要指标之一,且着色程度与果实风味品质密切相关。影响着色的物质主要有花青苷、黄酮类化合物和酚类物质,色素的积累是色泽形成的基础。其中花青苷的积累水平能够评价果实品质及成熟度,还能提供有益健康的元素,具有营养药理价值[3]。【前人研究进展】CBF/DREB转录因子属于AP2/EREBP转录因子家族,通常认为其能识别并结合顺式作用元件,参与对低温、高盐和干旱等的分子应答。近年来也有研究指出,番茄中SlDREB1B的过量表达能够诱导果实成熟相关基因的表达,如SlXYL1、SlEXP1、SlPG等果实软化相关基因、SlPDS和SlCHS等色素合成相关基因,并且调控果实发育和植物生长代谢[4]。将HB柚中的CgDREB在番茄(Lycopersicon esculentum)中超表达后发现,35S-CgDREB line5和35S-CgDREB line19果实大小及单果重显著小于野生型,且转基因株系果实中有机酸、糖类和脂肪酸含量显著高于野生型番茄的含量,表明CgDREB在果实成熟过程中起调控初生代谢物含量的重要作用[5]。研究香蕉(Musa acuminata)DREB后发现,MaDREB1、MaDREB2、MaDREB3及MaDREB4在香蕉果实成熟过程中起调控作用,在乙烯诱导成熟香蕉中MaDREB1、MaDREB2、MaDREB3及MaDREB4的表达量都随着乙烯量的增加、果实成熟而不断升高[6]。甜瓜中的CMe-DREB1能与CMe-ACS2识别并结合GCCGAC序列,意味着DREB转录因子能够通过调节乙烯生物合成来调控乙烯形成[7]。将油椰子(Elaeis guineensis)中EgCBF3转入番茄中发现,果实中该基因的表达与乙烯、脱落酸合成及果实成熟相关[8]。【本研究切入点】大量研究表明,DREB转录因子能够提高植物对非生物逆境的抗性,但其转入后对转基因草莓果实的影响鲜有研究。【拟解决的关键问题】本研究以草莓品种‘红颊’及其转RdreB1BI株系为试材,对全红期的成熟果实中酚类物质、总黄酮、花青苷含量等着色物质及可溶性固形物、可溶性糖、维生素C含量、可滴定酸等风味物质进行分析,并对转录水平下差异基因的表达及差异基因的启动子进行初步研究,为RdreB1BI调控草莓果实品质提供理论基础。1 材料与方法
试验于2017年1—4月在南京农业大学果树生物技术实验室进行。1.1 试验材料
试验材料为通过潮霉素抗性筛选及分子检测的转水稻RdreB1BI草莓株系[9]及‘红颊’草莓。采收全红期(转红着色面积达到100%)转RdreB1BI株系及‘红颊’草莓果实各10个,去除果皮及种子,取65 g混合均匀的皮下2 mm厚果肉,根据各试验用量分装后液氮速冻,置于-80℃冰箱中保存备用(图1)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1野生型及转RdreB1BI‘红颊’草莓全红期果实
-->Fig. 1WT and rd29A:RdreB1BI transgenic ‘Benihoppe’ strawberry fruits in full-red stage
-->
1.2 果实大小及单果重的测定
随机选取10个全红期草莓果实,用天平称单果重,用手持式游标卡尺测出纵、横径,并记录数据。1.3 花青苷含量的测定
参照WROLSTADDE[10]的方法,用pH差示法测定花青苷含量,取5 g速冻样品,重复取样3次,分别加入10 mL 1% HCl研磨,冲洗研钵并定容至25 mL,12 000 r/min离心20 min,取上清至25 mL容量瓶,浸提至无色过滤后取滤液,定容至25 mL避光待测。分别用缓冲溶液和一水柠檬酸及十二水合磷酸氢二钠缓冲溶液混匀反应完全后,在510 nm波长下测定光密度值,重复测定3次。1.4 氨基酸含量的测定
参照杨远帆等[11]的方法并稍作修改,用茚三酮法测定氨基酸含量,取1 g速冻样品,重复取样3次,分别加入5 mL 80%乙醇研磨,80℃水浴浸提30 min,冷却后10 000 r/min离心30 min,沉淀加入80%乙醇重复上述操作,提取液用80%乙醇定容至25 mL。取1 mL于10 mL刻度试管中,加2 mL含茚三酮的柠檬酸-柠檬酸钠缓冲液及7 mL蒸馏水混匀,80℃水浴30 min,冷却后用蒸馏水定容至15 mL,以蒸馏水为对照,在570 nm波长下测定光密度值。1.5 总酚含量的测定
参考DJERIDANE等[12]的方法并稍作修改,取1.5 g速冻样品,重复取样3次,分别加入10 mL 80%乙醇及1 mL 10%三氯酸研磨,匀浆转入15 mL容量瓶,用80%乙醇定容静置30 min。过滤后吸取1 mL滤液,加5 mL蒸馏水试剂,1 mL FC显色剂及3 mL 7.5%碳酸钠溶液,混匀,常温静置2 h后,以蒸馏水为对照,在765 nm波长下测定光密度值,以没食子酸作标准曲线,计算其含量,单位为mg∙g-1。1.6 总黄酮含量的测定
参照药典[13]的方法并改进,取2 g速冻样品,重复取样3次,分别加入16 mL 95%乙醇研磨,浸提后过滤,取1 mL滤液置10 mL试管,用70%乙醇补至5 mL,然后分别加入5%亚硝酸钠溶液0.3 mL,混匀放置6 min,加入10%硝酸铝溶液0.3 mL,混匀放置6 min,再加4% NaOH溶液2 mL,混匀放置10 min后,以蒸馏水为对照,在510 nm波长下测定光密度值。以芦丁标准品作标准曲线,计算其含量,单位为mg∙g-1。1.7 可溶性糖、可溶性蛋白及可溶性固形物含量的测定
蒽酮比色法测定可溶性糖含量[14],考马斯亮蓝G-250法测定可溶性蛋白质含量[14],阿贝折射仪测定果实可溶性固形物含量。1.8 总酸及抗坏血酸含量的测定
采用2,6-二氯酚靛酚滴定法测定抗坏血酸含量,采用NaOH滴定法测定总酸含量[14]。1.9 转录水平差异表达基因分析
1.9.1 总RNA的提取及cDNA的合成 取全红期转RdreB1BI株系及‘红颊’草莓果实,采用改良CTAB法[14]提取草莓果实RNA。cDNA合成根据qPCR RT试剂盒(TaKaRa)说明书进行。将合成的cDNA用TE缓冲液稀释到统一浓度后,保存至-20℃冰箱备用。1.9.2 转录水平差异基因实时荧光定量PCR分析 在对转基因株系果实及野生型‘红颊’草莓果实进行转录组数据分析后,得到6个差异表达基因[9]。以转基因草莓株系及未转基因草莓果实cDNA为模板,以草莓保守actin-97-like作为内参基因[15],RdreB1BI为目的基因,转录水平差异基因为待测基因,分别设计引物。外源RdreB1BI及内参基因的荧光定量引物见表1。
Table 1
表1
表1荧光定量引物设计
Table 1Primer sequences for the PCR amplification
| 基因 Gene | 产物大小 Production size (bp) | 正向引物(5′-3′) Forward primer (5′-3′) | 反向引物(5′-3′) Reverse primer (5′-3′) |
|---|---|---|---|
| RdreB1BI | 251 | TTTGCTTGGCGTATGCCTCCTGTTC | TCCATACCACCGAAACGGAAACCAT |
| Fractin | 130 | GGTGACGAGGCTCAATCCAA | GGGCAACACGAAGCTCATTG |
| C4H | 199 | TGGCAATGACTTCAGGTA | GGTAGAGTGCTTCAAGATATG |
| CCR2 | 169 | TATTGGACTGTGGTGGATG | GCTTGTCGGAATAGTTGTAG |
| GST | 190 | CTGGACATTGCTCTTATCAC | GCCTCTTCTTCATCTCAAC |
| F3H | 120 | TTCGTGGTGAATCTTGGA | GTTCTGGAATGTCGCTATG |
| DFR | 169 | CAAGGGCATTGAAGATAACT | CTCCTGCTTCTCAACTCT |
| MYB306 | 123 | AGAGAACTGACAATGACATC | CCTGCTGAGAACAATTACTA |
新窗口打开
采用荧光定量PCR法测定基因表达量,PCR反应体系为:cDNA模板(50 ng∙µL-1)1 μL,SYBR® Premix Ex Taq™(TaKaRa)10 μL,上、下游引物(10 mmol∙µL-1)各0.2 μL,RNase Free ddH2O加至20 μL。每个样品设3次重复。PCR反应程序为:94℃预变性3 min;94℃变性30 s,60℃退火20 s,72℃延伸40 s,40个循环。反应结束后,在60℃进行荧光信号采集,绘制溶解曲线。数据分析采用7300 system软件和2-△△Ct方法。
1.10 数据处理
采用Microsoft Excel 2016计算试验数据标准曲线及平均值,并用SPSS 22.0统计软件,在P<0.05水平及P<0.01水平对试验结果进行方差分析,Tukey HSD多重比较和相关性分析,所有试验设3次重复。1.11 启动子序列分析
根据已知的差异表达基因,在草莓数据库中通过BLAST找到该基因ATG前约2 000 bp左右的片段,再利用GENEFINDER、PlantCARE等网站对序列进行预测分析,预测该片段是否为启动子区域,以及启动子可能包含的顺式作用元件。2 结果
2.1 RdreB1BI表达对果实大小的影响
如表2所示,各转基因‘红颊’草莓株系与野生型果实单果重的范围为11.75—15.42 g,纵径和横径的范围分别为35.12—40.42 mm及28.73—32.6 mm,仅株系8果实纵经显著大于株系7,其余指标间差异不显著。Table 2
表2
表2野生型与转基因各株系草莓果实大小指标
Table 2The fruit size parameters in WT and transgenic strawberry lines
| 株系 Line | 纵径 Vertical diameter (mm) | 横径 Transverse diameter (mm) | 单果重 Single fruit weight (g) |
|---|---|---|---|
| 野生型 WT | 39.80±1.54ab | 29.34±1.55a | 13.61±1.58a |
| 转基因株系1 Transgenic line 1 | 38.67±1.32ab | 31.41±0.72a | 13.94±0.83a |
| 转基因株系7 Transgenic line 7 | 35.12±1.32b | 29.43±1.23a | 11.75±1.24a |
| 转基因株系8 Transgenic line 8 | 40.42±1.17a | 32.60±0.97a | 15.42±1.23a |
| 转基因株系9 Transgenic line 9 | 37.68±0.98ab | 28.98±0.36a | 12.10±0.41a |
| 转基因株系10 Transgenic line 10 | 37.94±1.17ab | 28.73±0.91a | 12.66±0.67a |
新窗口打开
2.2 RdreB1BI表达对着色物质的积累
如表3所示,株系1及7全红期果实果肉的花青苷含量分别为100.74、104.09 µg∙g-1,显著高于野生型;株系1、7及8总黄酮含量分别为788.30、921.97和1 040.22 µg∙g-1,显著高于野生型;各株系的总酚含量显著或极显著高于野生型,分别为10.87、8.66、9.17、5.26及5.38 mg∙g-1(P<0.05及P<0.01)。Table 3
表3
表3野生型和转基因株系草莓果实中色素含量
Table 3The contents of pigments in fruits of control and transgenic strawberry lines
| 株系 Line | 花青苷 Anthocyanins (µg∙g-1) | 总黄酮 Flavonoids (µg∙g-1) | 总酚 Phenolic compounds (mg∙g-1) |
|---|---|---|---|
| 野生型 WT | 32.96±0.13b | 519.18±11.69d | 3.80±0.04eE |
| 转基因株系1 Transgenic line 1 | 100.74±16.74a | 788.30±6.43bc | 10.87±0.09aA |
| 转基因株系7 Transgenic line7 | 104.09±6.56a | 921.97±12.85ab | 8.66±0.07cC |
| 转基因株系8 Transgenic line 8 | 64.55±0.87b | 1040.22±54.97a | 9.17±0.06bB |
| 转基因株系9 Transgenic line 9 | 53.90±2.68b | 649.29±17.55cd | 5.26±0.06dD |
| 转基因株系10 Transgenic line 10 | 48.05±2.08b | 665.16±83.60cd | 5.38±0.05dD |
新窗口打开
随着果实的生长发育,在全红期时,花青苷累积至一定程度后,其合成速率下降,并且底物开始转化合成酚类物质和总黄酮,而总黄酮同时也在酶的催化下作用,不断转化形成花青苷。较高的酚类物质及总黄酮含量,能够延缓果实的衰老。
2.3 RdreB1BI表达对风味物质的积累
如表4所示,各转基因株系草莓成熟果实果肉中可溶性固形物、可溶性糖含量的范围分别为7.53%—11.53%和17.51—73.6 mg∙g-1 FW,转基因株系1和7 的可溶性固形物含量显著高于株系10,转基因株系1、7及8可溶性糖含量为62.35、73.6和72.8 mg∙g-1 FW,显著高于野生型的21.70 mg∙g-1 FW,为野生型的2.87、3.39和3.35倍,其中转基因株系7可溶性糖的含量最高(P<0.05)。可溶性固形物含量与可溶性糖含量之间的相关系数为0.811,且其在双侧显著性0.05上显著,因此可溶性固形物含量与可溶性糖含量之间存在显著正相关性。Table 4
表4
表4野生型和转基因株系草莓果实中营养成分含量
Table 4The contents of nutrient components in fruits of the control and transgenic strawberry lines
| 株系 Line | 可溶性固形物 Soluble solid (%) | 可溶性糖 Soluble sugar (mg∙g-1 FW) | 氨基酸 Amino acid (g/100 g FW) | 可滴定酸 Titratable acid (%) | 可溶性蛋白 Soluble protein (mg∙g-1 FW) | 抗坏血酸 Vitamin C (mg/100 g FW) |
|---|---|---|---|---|---|---|
| 野生型 WT | 10.33±0.67ab | 21.70±1.87b | 0.5151±0.0191a | 0.8147±0.0118c | 22.93±0.47bc | 92.50±3.70b |
| 转基因株系1 Transgenic line 1 | 11.53±0.74a | 62.35±4.65a | 0.3950±0.0262b | 1.1333±0.0571a | 22.40±0.37c | 168.35±16.44a |
| 转基因株系7 Transgenic line 7 | 10.73±1.20ab | 73.60±6.12a | 0.3599±0.0089b | 1.0664±0.0422ab | 22.52±0.36c | 116.55±8.48ab |
| 转基因株系8 Transgenic line 8 | 11.33±0.41a | 72.80±6.11a | 0.3887±0.0094b | 0.8977±0.0419bc | 24.29±0.43ab | 114.08±12.65ab |
| 转基因株系9 Transgenic line 9 | 8.33±0.77ab | 22.55±2.51b | 0.2824±0.0154c | 0.7595±0.0258c | 25.97±0.51a | 111.49±17.52ab |
| 转基因株系10 Transgenic line 10 | 7.53±0.44b | 17.51±1.44b | 0.2580±0.0142c | 0.7828±0.0156c | 25.86±0.3a | 125.31±10.82ab |
新窗口打开
各转基因株系草莓成熟果实果肉的氨基酸含量为0.2580—0.3950 g/100 g FW,野生型果实的氨基酸含量为0.5151 g/100 g FW,显著高于各转基因株系草莓果实,分别为其1.3、1.43、1.33、1.82和2倍;样品果肉的可滴定酸及抗坏血酸含量分别在0.7595%—1.1333%和92.50—168.35 mg/100 g FW,转基因株系1、7的可滴定酸含量为1.1333%和1.0664%,显著高于野生型的0.8147%;转基因株系1的抗坏血酸含量为168.35 mg/100 g FW,显著高于野生型的92.50 mg/100 g FW,且各转基因株系果实的抗坏血酸含量分别为野生型的1.82、1.26、1.23、1.21和1.35倍,其中转基因株系1的可滴定酸及抗坏血酸含量最高(P<0.05)。
进一步对供试样品中可溶性蛋白含量进行检测,分析后发现各转基因株系草莓成熟果实果肉 中可溶性蛋白含量在转基因株系9及10果实的含量分别为25.97和25.86 mg∙g-1 FW,显著高于野生型(P<0.05)。
2.4 RdreB1BI及转录差异基因表达分析
利用qRT-PCR技术对RdreB1BI及转录差异基因在全红期果实中的表达情况进行分析(图2)。结果表明,与野生型相比,RdreB1BI在各株系转基因草莓果实中的表达量显著高于野生型,分别为野生型的263.9、233.3、386.9、153.3和58.53倍(图2-Ⅰ)。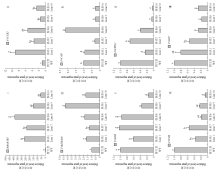 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2RdreB1BI及转录差异基因的相对表达量
-->Fig. 2The relative expression of RdreB1BI and differential expression genes
-->
研究发现,外源RdreB1BI的转入,调控了一系列与成熟、代谢、色素合成、花芽分化等相关的基因表达。为进一步分析RdreB1BI转入‘红颊’草莓后,对其果实发育的调控作用,对转录组分析差异表达基因进行分析。FvCCR2(cinnamoyl-CoA reductase 2-like)在各转基因株系中表达量分别为野生型的8.798、3.305、5.071、1.557和2.522倍,株系1及8与野生型存在显著差异(图2-Ⅱ)。FvMYB306(myb- related protein 306)在株系1、8、9及10的表达量显著高于野生型,表达量分别为野生型的1.674、1.862、4.279、1.735倍(图2-Ⅲ)。转基因株系8的全红期果实中FvC4H(cinnamate-4- hydroxylase)表达为野生型的2.127倍,差异显著(图2-Ⅳ)。FvDFR(dihydroflavonol 4-reductase)在野生型果实中的表达显著高于株系1、9及10(图2-Ⅴ);FvLWD1(WD repeat-containing protein LWD1-like)、FvF3H(naringenin, 2-oxoglutarate 3-dioxygenase)和FvGST(probable glutathione S-transferase)在野生型果实中的表达显著高于各株系(图2-Ⅵ、Ⅶ、Ⅷ)。
2.5 转录差异表达基因启动子初步分析
根据二倍体草莓参考基因组数据库,预测差异表达基因的启动子序列,运用PlantCARE(http://bioinformatics. psb.ugent.be/webtools/plantcare/html/)对差异表达基因启动子区域调控元件进行分析。如表5所示,发现其启动子区域包含多种高等植物顺势调控元件,主要有对真核生物起增强基因转录效率的CAAT-box和核心启动子元件TATA-box。同时还包含在基因转录过程中起重要调节作用的顺式作用元件G-Box、G-box、MBS、ARE、5UTR Py-rich stretch,影响各基因对光的响应,在苯丙烷代谢途径中起调节作用。Table 5
表5
表5差异表达基因启动子区的顺式作用元件序列、来源、特性及分布
Table 5Sequence, organism source, characteristic and distribution of cis-acting elements in differential expression gene promoter
| 调控元件 Regulatory element | 序列及来源 Sequence and organism source | 特性 Characteristic | 基因 Gene | 距转泵起始点的距离 Position strand |
|---|---|---|---|---|
| ARE | TGGTTT 玉米Zea mays | 厌氧诱导响应元件 Cis-acting regulatory element essential for the anaerobic induction | FvCCR2 FvMYB306 FvDFR FvF3H FvLWD1 FvC4H | -520, -1190, -889 -1203 +767 +844, -1238 +292, +1033, -300 +138, -444, -254 |
| AT-rich element | ATAGAAATCAA 大豆Glycine max | ATBP-1结合相关元件 Binding site of AT-rich DNA binding protein (ATBP-1) | FvCCR2 | +885 |
| ATCT-motif | AATCTAATCT 拟南芥 Arabidopsis thaliana AATCTGATCG玉米Zea mays | 光响应元件 Part of a conserved DNA module involved in light responsiveness | FvCCR2 FvMYB306 | -1484 -1241 |
| Box III | CATTTACACT 豌豆Pisum sativum | 蛋白结合位点 Protein binding site | FvCCR2 FvGST | +1054 -167 |
| CAT-box | GCCACT 拟南芥Arabidopsis thaliana | 分生组织特异性元件 Cis-acting regulatory element related to meristem expression | FvCCR2 FvLWD1 | -996 +1489 |
| CGTCA-motif | CGTCA 大麦Hordeum vulgare | 茉莉酸响应有关的顺式调节元件 Cis-acting regulatory element involved in the MeJA-responsiveness | FvCCR2 FvMYB306 FvF3H FvGST FvLWD1 FvC4H | +734 +965, +1479 +1178 -275, -1234, +1002, +378 +1453 -1170, +1465, +1327, +1307, +1402 |
| G-box | CACGT(T/G) 豌豆Pisum sativum CACGTT玉米Zea mays CACGTC玉米Zea mays TAACACGTAG 甘蓝Brassica oleracea CACATGG 马铃薯Solanum tuberosum TACGTG胡萝卜Daucus carota CACGTG拟南芥Arabidopsis thaliana CACGTGG甘蓝Brassica oleracea CACGAC玉米Zea mays GACACGTAGT美洲落叶松Larix laricina | 光响应元件 Cis-acting regulatory element involved in light responsiveness | FvCCR2 FvDFR FvMYB306 FvF3H FvGST FvLWD1 FvC4H | +32, +732 +109, +955, -1315, -1340, -1339 +18, +774 +718 +250, -969, +966, +1037, +451, +967 -18, +201, -200 +1335, -1171 |
| G-Box | CACGTA 金鱼草Antirrhinum majus CACGTT豌豆Pisum sativum CACGTG豌豆Pisum sativum | 光响应元件 Cis-acting regulatory element involved in light responsiveness | FvCCR2 FvDFR FvF3H FvGST FvLWD1 FvC4H | +32 +109, +955, -1315, -1340 -718 -451, +969 -18, +201 +1335 |
| GA-motif | AAGGAAGA大豆Glycine max ATAGATAA 拟南芥Arabidopsis thaliana | 光感应元件 Part of a light responsive element | FvCCR2 FvMYB306 | -675 -143 |
| GAG-motif | AGAGATG 菠菜Spinacia oleracea GGAGATG 大麦Hordeum vulgare | 光感应元件 Part of a light responsive element | FvCCR2 FvMYB306 FvF3H FvGST FvC4H | +973 -158, +1443, +549 -1163 +440 -266, -1485 |
| 续表5 Continued table 5 | ||||
| 调控元件 Regulatory element | 序列及来源 Sequence and organism source | 特性 Characteristic | 基因 Gene | 距转泵起始点的距离 Position strand |
| GARE-motif | TCTGTTG甘蓝Brassica oleracea AAACAGA甘蓝Brassica oleracea | 赤霉素响应元件 Gibberellin-responsive element | FvCCR2 FvMYB306 FvGST FvC4H | -378, -1480 -1100 -887 +65, -489, -126, -1198 |
| GC-motif | GCCCCGG玉米Zea mays | 厌氧反应顺式作用元件 Enhancer-like element involved in anoxic specific inducibility | FvCCR2 FvDFR FvC4H | -747 -1257 +1276 |
| MBS | CAACTG 拟南芥Arabidopsis thaliana TAACTG 拟南芥Arabidopsis thaliana CGGTCA 玉米Zea mays | MYB结合位点,干旱诱导响应元件 MYB binding site involved in drought-inducibility MYB结合位点 MYB Binding Site | FvCCR2 FvMYB306 FvF3H FvGST FvLWD1 FvC4H | +204, -802, +850 -700, +1186 +636, +871 -455 +156, -1286 -13 |
| Skn-1_motif | GTCAT 水稻Oryza sativa | 胚乳表达所需元件 Cis-acting regulatory element required for endosperm expression | FvCCR2 FvMYB306 FvDFR FvF3H FvGST FvC4H | +852 -995 +620, -760, +700, +969 -789, +1161, +981 +199, +1305, +1023, +639, -1233 +372, -765, -660 |
| Sp1 | CC(G/A)CCC 玉米Zea mays GGGCGG水稻 Oryza sativa | 光感应元件 Light responsive element | FvCCR2 FvF3H FvLWD1 FvC4H | +418 +856, -1373, -1353 +240, -582 -858, +1386, +1348, +1421, +1294, +1418, +1352, +1212, +1315 |
| TC-rich repeats | ATTCTCTAAC 烟草Nicotiana tabacum GTTTTCTTAC 烟草Nicotiana tabacum ATTTTCT(C/T)CA 烟草Nicotiana tabacum | 防御与胁迫响应元件 Cis-acting element involved in defense and stress responsiveness | FvCCR2 FvMYB306 FvDFR FvF3H FvLWD1 | +136 +177, -199 +21 -684 +725 |
| TCT-motif | TCTTAC 拟南芥Arabidopsis thaliana | 光感应元件 Part of a light responsive element | FvCCR2 FvDFR FvF3H FvGST FvLWD1 | -154 +25, +1475, +1101 +208 +1180 -622 |
| TGA-element | AACGAC 甘蓝Brassica oleracea | 生长素响应 Auxin-responsive element | FvCCR2 FvMYB306 FvDFR FvF3H FvLWD1 | +1271 -1419 -881 -1202 -121 |
| TGACG-motif | TGACG 大麦Hordeum vulgare | 茉莉酸甲酯响应 Cis-acting regulatory element involved in the MeJA-responsiveness | FvCCR2 FvMYB306 FvF3H FvGST FvLWD1 FvC4H | -734 -965, -1479 -1178 +275, +1234, -1002, -378, -1022 -1453 +1170, -1465, -1327, -1307, -1402 |
| 续表5 Continued table 5 | ||||
| 调控元件 Regulatory element | 序列及来源 Sequence and organism source | 特性 Characteristic | 基因 Gene | 距转泵起始点的距离 Position strand |
| chs-CMA2a | GCAATTCC 大麦Hordeum vulgare | 光感应元件 Part of a light responsive element | FvCCR2 FvF3H | -1459 +661, +1074 |
| 5UTR Py-rich stretch | TTTCTTCTCT 番茄Lycopersicon esculentum | 高水平转录调控因子 Cis-acting element conferring high transcription levels | FvMYB306 FvF3H FvC4H | +511 -705, -1473 +395 |
| Box 4 | ATTAAT 欧芹Petroselinum crispum | 光响应元件 Part of a conserved DNA module involved in light responsiveness | FvMYB306 FvF3H FvGST FvC4H | +407 +455, -1441, -1437 +611, -1272, -1244 +92, +119, -819 |
| Box I | TTTCAAA 豌豆Pisum sativum | 保守光调控元件 Light responsive element | FvMYB306 FvGST FvLWD1 | -796 +65 -376, +744 |
| HSE | AAAAAATTTC甘蓝Brassica oleracea | 热应激元件 Cis-acting element involved in heat stress responsiveness | FvMYB306 FvLWD1 FvC4H | +136, +1170, +666, +1284 +1140 +809, +1005, +990 |
| I-box | CTCTTATGCT烟草Nicotiana tabacum GATAGGG玉米Zea mays GATATGG黄菊Flaveria trinervia | 光感应元件 Part of a light responsive element | FvMYB306 FvF3H FvGST FvLWD1 FvC4H | +613 +1110 -208 -477 -155 |
| RY-element | CATGCATG向日葵Helianthus annuus | 种子特异性表达PP2C phosphatase Cis-acting regulatory element involved in seed-specific regulation | FvMYB306 FvF3H | -1412 -1274 |
| as-2-box | GATAatGATG烟草Nicotiana tabacum | 光响应及芽特异表达元件 Involved in shoot-specific expression and light responsiveness | FvMYB306 FvLWD1 | +1452 +501 |
| 4cl-CMA2b | TCTCACCAACC 欧芹Petroselinum crispum | 光响应元件 Light responsive element | ||
| ABRE | (T/C)ACGTG拟南芥Arabidopsis thaliana CGTACGTGCA大麦Hordeum vulgare TACGTG拟南芥Arabidopsis thaliana | ABA应答元件 Cis-acting element involved in the abscisic acid responsiveness | FvDFR FvF3H FvGST FvLWD1 | -109, -1315, -288, -1340 +718 -969, +451, +800 +201 |
| ACE | CTAACGTATT欧芹Petroselinum crispum | 光响应元件 Cis-acting element involved in light responsiveness | FvDFR FvC4H | -89 -1333 |
| Box-W1 | TTGACC欧芹Petroselinum crispum | 真菌激发子响应元件 Fungal elicitor responsive element | FvDFR | -546 |
| CCGTCC-box | CCGTCC拟南芥Arabidopsis thaliana | 分生组织特异性激活元件 Cis-acting regulatory element related to meristem specific activation | FvDFR | -1254 |
| GT1-motif | GGTTAAT 燕麦Avena sativa GGTTAA拟南芥Arabidopsis thaliana | 光响应元件 Light responsive element | FvDFR FvF3H FvGST | -1277, -1278 -235 -727 |
| L-box | TCTCACCAACC欧芹Petroselinum crispum | 光响应元件 Light responsive element | FvDFR FvGST | -750 +609 |
| 续表5 Continued table 5 | ||||
| 调控元件 Regulatory element | 序列及来源 Sequence and organism source | 特性 Characteristic | 基因 Gene | 距转泵起始点的距离 Position strand |
| TCA-element | CAGAAAAGGA甘蓝Brassica oleracea CCATCTTTTT烟草Nicotiana tabacum TCAGAAGAGG甘蓝Brassica oleracea | 水杨酸响应元件 Cis-acting element involved in salicylic acid responsiveness | FvDFR FvF3H FvGST FvLWD1 FvC4H | +842 +706 +876, +1012, -979 -763, -764 +265 |
| AACA_motif | TAACAAACTCCA水稻Oryza sativa | 胚乳特异抑制表达 Involved in endosperm-specific negative expression | FvF3H | +1019 |
| AE-box | AGAAACTT拟南芥Arabidopsis thaliana | 光响应元件 Part of a module for light response | FvF3H | -328, -821 |
| AuxRR-core | GGTCCAT 烟草Nicotiana tabacum | 生长素响应相关顺式作用元件 Cis-acting regulatory element involved in auxin responsiveness | FvF3H FvLWD1 FvC4H | +864 -508 +640 |
| CATT-motif | GCATTC玉米Zea mays | 光响应元件 Part of a light responsive element | FvF3H FvC4H | -536 -111 |
| CG-motif | CCATGGGG膨胀浮萍Lemna gibba | 光响应元件 Part of a light responsive element | FvDFR | -1278 |
| GATA-motif | AAGGATAAGG 马铃薯Solanum tuberosum GATAGGG豌豆Pisum sativum GATAGGA拟南芥Arabidopsis thaliana | 光响应元件 Part of a light responsive element | FvF3H FvGST | +322, +1110 -133 |
| MNF1 | GTGCCC(A/T)(A/T) 玉米Zea mays | 光响应元件 Light responsive element | FvF3H | +281 |
| MRE | CATGCATG欧芹Petroselinum crispum AACCTAA欧芹Petroselinum crispum | MYB结合位点,光响应元件 MYB binding site involved in light responsiveness | FvF3H FvC4H | +473, +776 -615 |
| AT1-motif | ATTAATTTTACA马铃薯Solanum tuberosum | 光响应元件 Part of a light responsive module | FvGST | -605 |
| CCAAT-box | CAACGG大麦Hordeum vulgare | MYBHv1结合位点 MYBHv1 binding site | FvGST | -1335 |
| ERE | ATTTCAAA康乃馨Dianthus caryophyllus | 乙烯应答元件 Ethylene-responsive element | FvGST FvLWD1 | +64 -376 |
| LTR | CCGAAA大麦Hordeum vulgare | 低温应答顺势作用元件 Cis-acting element involved in low-temperature responsiveness | FvGST | +458 |
| MSA-like | TCCAACGGT长春花Catharanthus roseus | 细胞周期调控顺式作用元件 Cis-acting element involved in cell cycle regulation | FvGST | -1334 |
| O2-site | GTTGACGTGA玉米Zea mays GATGATATGG玉米Zea mays | 玉米醇蛋白代谢途径顺式作用元件 Cis-acting regulatory element involved in zein metabolism regulation | FvGST FvC4H | -249 -155, -849 |
| chs-CMA2b | GAACCTACACAC大麦Hordeum vulgare | 光响应元件 Part of a light responsive element | FvGST | +479 |
新窗口打开
运用Plant CARE(http://bioinformatics.psb.ugent. be/webtools/plantcare/html/)对CCR2起始密码子上游长度为1 500 bp的启动子区域进行分析,结果表明,除含有核心启动子元件CAAT-box和TATA-box元件外,还包含3个ARE抗氧化反应元件、1个AT-rich element ATBP-1结合相关元件、1个CAT-box分生组织特异性元件、1个CGTCA-motif茉莉酸响应有关的顺式调节元件、2个GARE-motif 赤霉素响应元件、1个GC-motif厌氧反应顺式作用元件、3个MBS干旱诱导响应元件,MYB结合位点、1个Skn-1_motif胚乳表达所需元件、1个TC-rich repeats防御与胁迫响应元件、1个TGA-element生长素响应元件、1个TGACG-motif茉莉酸甲酯响应及大量光响应元件等多种顺式作用元件。对MYB306启动子序列进行分析后发现,其包含大量与CCR2相同的元件外,还存在1个RY-element种子特异性表达元件、1个5UTR Py-rich stretch高水平转录调控因子及Box 4、Box I、I-box、as-2-box等保守光调控及光感应顺式作用元件(表5)。
3 讨论
极低的乙烯释放量能够催化草莓果实中花青苷的合成,增加总糖含量,并调控果实成熟进程中风味、质地、色泽等果实品质[16,17]。已有研究表明,DREB转录因子能够调节乙烯生物合成来调控乙烯形成。本研究结果表明,RdreB1BI表达量和总黄酮、总酚、花青苷、可溶性固形物及可溶性糖含量呈正相关,说明RdreB1BI在转化体中的表达能够调控果实品质,与前人研究结果一致。CCR2的表达可能促进植物体内酚类物质和木质素的合成,增强植物抵御生物与非生物胁迫的能力[18,19,20]。转基因杨树中下调CCR能够通过调控可发酵糖的含量来促进木质生长[21]。高粱中SbCC2比SbCC1更能激活对香豆酰-辅酶A产生木质素以抵御病菌胁迫,提高植株对生物逆境的抗性[22]。玉米ccr突变体中木质素单体与阿魏酸结合形成木质素,并提供生物燃料底物[23]。在拟南芥[24]、三叶草[25]、洋葱[26]、苹果[27]等植物的研究中发现,R2R3-MYB蛋白中的Sg6亚家族能够激活花青苷结构基因,调控合成并积累花青苷[28,29]。转大豆GmMYBJ6烟草中的类黄酮含量显著增加[30,31]。R2R3-MYB蛋白中的Sg4亚家族中,超表达苹果MdMYB3烟草中花青苷及总黄酮的合成受到催化,花色变深[32]。草莓中MYB306研究较少,烟草MYB306的表达与程序性细胞死亡相关,其可能阻止程序性细胞死亡并协调植株对非生物逆境的抗性[33]。金鱼草中MYB340能够激活gPAL2、CHI和F3H启动子的转录[34]。有研究指出,MYB306的表达参与调控了诸如花青苷合成等生理代谢[35]。C4H是木质素合成途径的上游基因,CCR2是木质素合成途径的下游基因[36]。F3H和DFR在成熟期‘丽江山荆子’果肉中表达量最低[37]。由本研究可知,转RdreB1BI草莓全红期果实中FvF3H、FvDFR及FvC4H表达量显著低于野生型,与总黄酮、总酚类及花青苷含量存在相关性;FvCCR2和FvMYB306的表达显著高于野生型,且分别与总黄酮、总酚类及花青苷含量呈正相关(r=0.584,0.921*,0.704;r=0.310,0.585,0.314)。花青苷合成相关的结构基因DFR在野生型、转基因株系7和8全红期果实中的表达量显著高于株系1、9和10,但株系1的花青苷含量却显著高于株系8及野生型。在苹果果皮[38]和荔枝果皮[39]的研究中发现,DFR活性与花青苷的积累趋势不一致。本研究相关性分析发现,在转RdreB1BI草莓株系中,FvDFR的表达量与花青苷含量呈正相关(r=0.249),但不存在显著性,说明果实花青苷的含量与DFR活性没有密切关系。花青苷合成相关结构基因FvF3H在野生型全红期果实中的表达量显著高于转基因株系,但野生型的花青苷含量却显著低于转基因株系。猕猴桃中F′3H1的表达变化与果皮着色趋势不具有一致性,F3H2的表达与着色存在对应关系,可见在花青素合成途径中同一催化酶可能存在不同转录本[40]。本研究中FvF3H的表达量与总黄酮、总酚和花青苷含量呈负相关。这些调控差异说明,次生代谢物合成过程具有复杂的机制,同家族不同基因在功能上存在差异,具体影响有待进一步研究,由此推测转基因植株中的花青素苷的合成与F3H和DFR不存在显著相关性。
从本研究可知,转基因株系中包含大量光诱导响应元件的FvCCR2及FvMYB306上调表达,促进了碳水化合物的吸收,提高了果实中可溶性糖含量。黄酮类生物合成和光合作用通路是果实着色过程中主要的影响因子[41],含大量光诱导响应元件基因的表达促进相关物质合成,使转RdreB1BI草莓果实的风味物质含量及色泽品质优于野生型。说明外源RdreB1BI的转入能够提高光的有效性,活化FvCCR2及FvMYB306的表达,以促进着色物质在果实中的形成及积累,与前人研究一致。已有研究表明DREB转录因子能够调控乙烯形成,催化初生及次生代谢物的合成,并且光照还能进一步影响可溶性蛋白、糖、抗坏血酸等初生代谢物合成。乙烯可能与光一同调控增加了转RdreB1BI果实中可溶性糖、花青苷等风味、色泽物质含量。RdreB1BI调控相关基因参与转化体发育和成熟的进程,为深入揭示RdreB1BI功能及草莓果实成熟调控的因子及分子机理提供了理论参考。
4 结论
转RdreB1BI株系与野生型草莓果实的花青苷、总黄酮及总酚含量存在显著差异。可溶性固形物含量与可溶性糖含量成正比,转基因株系果实的可溶性糖含量显著高于野生型。转基因株系草莓成熟果实果肉的氨基酸含量显著高于转基因株系;转基因株系1和7果实的可滴定酸含量、转基因株系1果实的抗坏血酸含量、转基因株系9及10果实的可溶性蛋白含量显著高于野生型。RdreB1BI在转基因株系草莓果实中的表达量显著高于野生型;FvCCR2和FvMYB306在转基因株系中表达显著高于野生型。差异表达基因启动子区域包含多种高等植物顺势调控元件,主要有对真核生物起到增强基因转录效率的CAAT-box和核心启动子元件TATA-box。同时还包含G-Box、G-box、MBS、ARE、5UTR Py-rich stretch等能影响各基因对光的响应及在苯丙烷代谢途径中起调节作用的顺式作用元件。RdreB1BI调控相关基因参与转化体果实发育和成熟,提高光的有效性,活化黄酮类生物合成通路关键基因,差异基因中均包含大量光诱导响应元件,FvCCR2及FvMYB306的表达促进了总黄酮、酚类物质及花青苷等次生代谢物的合成。外源RdreB1BI的转入促进着色物质在果实中的形成与积累。The authors have declared that no competing interests exist.
