0 引言
【研究意义】玉米是中国第一大粮食作物,对于保证国家粮食安全具有极其重要的意义。2010年起,中国已由玉米出口国转变为玉米进口国,玉米供需矛盾日益突出。销售市场竞争的日益加剧对玉米的商品品质和加工品质提出了越来越高的要求。容重能够反映玉米的使用价值和商品价值[1,2,3],是检验籽粒商品品质的重要指标之一。在国际贸易中,容重已成为国际上玉米质量定级的重要参考[4]。此外,容重还是玉米产量的一个次级构成因子,与玉米产量密切相关[5]。影响玉米容重的诸多因素中,如玉米的形状、胚乳形态[6]、灌浆期[7]、生育期[8]等,遗传因素占主导地位[9]。但容重性状的量化测定需要的种子量较大,难以用于群体单株果穗籽粒容重的遗传分析中。比重是种子绝对重量与绝对体积的比值(g·mL-1),与容重相比,种子的比重排除了籽粒之间空隙以及杂物的影响,与种子的化学成分密切相关,是影响容重的主要因子,因此,遗传分析中多用籽粒比重的大小来反映容重的大小。【前人研究进展】目前,玉米籽粒容重的遗传研究主要集中在相关性状的QTL定位方面。DING等[10]利用玉米的F2:3群体定位到16个分布在第1、2、3、4、5、7染色体上的容重QTL。许理文等[6]用SNP芯片对240个DH系群体进行基因型分析,在4个环境下检测到5个控制玉米容重的QTL,共解释23.61%的表型变异,其中位于第1染色体的qTw1-1和第9染色体的qTW9-1贡献率最高。BEAVIS等[11]利用96个RFLP标记对B73和Mo17构建的F2:4群体的容重性状进行QTL分析,鉴定出分布在玉米第3、5、7、10染色体上的4个QTL。AJNONE-MARSAN等[12]利用B73和A7构建的F2:3群体,定位到6个容重相关QTL,分布在玉米的第1、2、3、5、9染色体上。PENG等[13]利用F2:3分离群体,结合两年三点的试验数据,共定位到4个籽粒容重相关的QTL,其中只有位于第1染色体umc1298—bnlg1671标记之间的QTL在6个环境中都被检测到,并且表现为稳定遗传的加性效应,对表型的贡献率达到7%;白光红等[14]利用综3和87-1的294个F9:10家系,鉴定出7个与玉米籽粒比重有关的QTL,其中qksg5-2对表型的贡献率达到14.06%。【本研究切入点】尽管玉米籽粒容重相关性状的QTL定位研究较多,但相关基因的精细定位和克隆尚未见报道。【拟解决的关键问题】本研究对育种选系过程中发现的导致玉米籽粒容重变化的淀粉粒密度突变体Mrd及其与常规自交系B73组配的F2和BC1分离群体进行细胞学和遗传学分析,通过标记开发和交换单株筛选实现突变基因的精细定位,为相应基因的克隆和功能验证奠定基础。1 材料与方法
1.1 试验材料与作图群体
所用材料为育种选系过程中发现的淀粉粒密度变化的自然突变体Mrd和常规自交系B73,2014年夏在河南省郑州市河南农业大学科教园区组配了B73×Mrd的杂交组合,同年冬季在海南省三亚市河南农业大学南繁基地种植淀粉粒密度自然突变体Mrd和F1种子,通过自交和回交获得了F2果穗(15穗)和BC1代果穗(300穗)。2015年春在河南省郑州市河南农业大学科教园区种植了来自同一F2果穗的所有420个籽粒和来自同一个BC1果穗上的所有475个籽粒,并对其相应的F2单株和BC1单株进行自交。2015年夏在河南省郑州市河南农业大学科教园区种植2 800个在两侧标记发生交换的BC1正常籽粒,并通过自交进一步验证是否为交换单株。2016年夏在河南省原阳县河南农业大学科教园区种植了突变体Mrd和4个来自玉米突变体库(http://maizecoop.cropsci.uiuc.edu/)的su2突变体,用于二者的等位性测验(表1)。Table 1
表1
表1su2突变体来源
Table 1Source of the su2 mutants
| 突变体 Mutant | 编号 Accession | 来源 Source |
|---|---|---|
| su2-1 | 5505R | 2007-106-1⊕ |
| su2-2 | 606I | 2006-2702-9⊕ |
| su2-3 | 608N | 2008-344-3⊕ |
| su2-4 | 609DA | 2013-2356-1⊕ |
新窗口打开
1.2 突变体籽粒的细胞学观察
为明确淀粉粒密度突变体籽粒内部性质的变化,利用日立S-3400扫描电镜对授粉后18、21、24、27、30和45 d的野生型和突变体籽粒胚乳中的淀粉粒形态进行观察;利用近红外光谱分析仪对成熟籽粒的粗淀粉和粗蛋白含量进行测定。1.3 淀粉粒密度基因的定位
将F2群体中的15个正常籽粒的单株DNA等摩尔数混合成显性池,15个突变籽粒的纯合单株DNA等摩尔数混合成隐性池[15]。利用均匀覆盖玉米全基因组的1 000对SSR引物(http://www.maizegdb.org)对双亲、显性池和隐性池进行标记分析,筛选差异标记。筛选到的差异标记用于分析已知基因型的420个F2单株,验证差异标记与目的基因是否连锁。与目的基因紧密连锁的标记用于分析38 000个BC1正常籽粒胚乳,对可能的交换单株进行自交鉴定,根据交换单株自交果穗的籽粒表型确定单株的基因型,从而确定与目的基因连锁的标记以及连锁标记与目的基因的相对位置,实现目的基因的精细定位。采用改良的CTAB法提取[16]亲本DNA、BSA混池所用的单株DNA及关键交换单株DNA,采用碱煮法提取[17]大群体籽粒样品胚乳DNA。开发SSR标记时,参考序列为B73(https://maizegdb.org/,B73 reference sequence Version3),SSR序列查找利用SSRHunter软件,SSR所在的单拷贝序列在NCBI(https://www.ncbi.nlm.nih.gov/)网站进行BLAST分析, SSR引物设计采用primer premier 5.0软件。引物设计原则:PCR产物长度100—250 bp,GC含量在40%—60%,引物无错配,引物3’端无发夹结构,退火温度在55—62℃,引物长度18—24 bp。由于切胚乳提取DNA的方法易对种子造成创伤,为了提高种子的成活率,通常会用3%的H2O2(ddH2O)对种子处理15 min进行消毒,并通过育苗移栽提高其成株率。
1.4 等位性测验和候选基因确定
精细定位的候选区段内包含前人已克隆的su2,为明确本研究的突变基因是否是su2的等位基因,用突变体和4个来自玉米突变体库的不同背景的su2突变体进行等位性测验。通过候选基因序列分析和功能预测筛选最可能的目的基因。2 结果
2.1 突变体表型鉴定
与野生型籽粒相比,淀粉粒密度自然突变体Mrd籽粒体积变小,粒长没有变化籽粒能够正常发育,且籽粒顶部较黄(图1)。比重增加(正常1.10 g·mL-1,突变1.25 g·mL-1),近红外分析表明Mrd突变体籽粒的粗蛋白含量降低(正常3.37%,突变2.83%),但粗淀粉含量没有显著变化(正常66.22%,突变66.68%)。进一步对其籽粒内部淀粉粒进行扫描电镜分析,发现突变体籽粒的淀粉粒变小(正常13.27 μm,突变8.52 μm),密度增加(图2)。授粉后不同时期突变体与野生型的籽粒淀粉粒观察结果表明,授粉后18 d开始,突变体籽粒出现不规则形状的淀粉粒,淀粉粒密度随着发育进程不断增加(图3)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1突变体和B73及其杂交组配的F1和BC1的籽粒和穗部表型
a:突变型果穗;b:B73果穗;c:F1果穗;d:BC1分离穗;e:突变籽粒和正常籽粒
-->Fig. 1Kernel and ear phenotype of mutant, B73 and their F1 and BC1
a: Mutant ear; b: B73 ear; c: F1 isolated ear; d: BC1 isolated ear; e: Kernels of mutant and wild type
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2突变型(a)和野生型(b)籽粒淀粉粒
-->Fig. 2Starch granules of mutant (a) and wild (b) kernel
-->
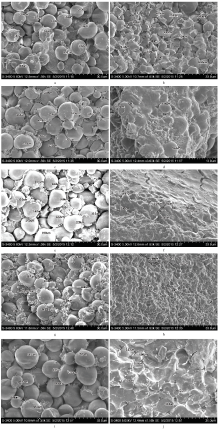 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3授粉后不同天数AA和aa淀粉粒的变化
a、c、e、g、i:授粉后18、21、24、27和30 d野生型籽粒的淀粉粒;b、d、f、h、j:授粉后18、21、24、27和30 d突变型籽粒的淀粉粒
-->Fig. 3The change of starch granules for AA and aa in different days after pollination (DAP)
a, c, e, g, i: Starch granules of wild grain phenotype in 18, 21, 24, 27, 30 DAP; b, d, f, h, j: Starch granules of mutant grain phenotype in 18, 21, 24, 27, 30DAP
-->
2.2 突变体的遗传分析
淀粉粒密度突变体Mrd和B73的杂交F1果穗、F2果穗及分离群体和BC1代果穗的自交群体的表型分析结果显示,F1果穗籽粒正常且无分离,F2果穗中正常籽粒和突变籽粒符合3﹕1(1.784<χ20.05)的分离比;420个F2单株自交后,100个单株的自交果穗与野生型相同,213个单株的自交果穗出现正常籽粒与突变籽粒3﹕1(1.784<χ20.05)的分离比,107个单株的自交果穗与突变型相同,表现1﹕2﹕1的野生型穗:分离穗:突变型穗的分离比(0.162<χ20.05);BC1代果穗中正常籽粒和突变籽粒符合1﹕1(0.162<χ20.05)的分离比;475个BC1单株自交后,249个单株的自交果穗出现正常籽粒与容重突变籽粒3﹕1(0.689<χ20.05)的分离比,226个单株的自交果穗与突变体表型一致,符合1﹕1(0.557<χ20.05)的分离穗:突变型穗的分离比(表2和表3)。遗传分析结果表明籽粒淀粉粒密度突变体Mrd的突变是由1对隐性基因控制的,将该基因命名为tw1。Table 2
表2
表2(Mrd×B73)F2和BC1群体分离情况
Table 2Segregation of the F2 and BC1 population derived from Mrd and B73
| 群体 Population | 群体大小 Population size | 籽粒正常株数 Normal individuals | 籽粒分离株数 Segregation individuals | 籽粒突变单株数 Mutant individuals | 实际比值 Observed ratio | 理论比值 Theoretical ratio | χ2检测 χ2 test |
|---|---|---|---|---|---|---|---|
| F2 | 420 | 100 | 213 | 107 | 1﹕2.13﹕1.07 | 1﹕2﹕1 | 0.162<χ20.05 |
| BC1 | 475 | 249 | 226 | 1﹕0.908 | 1﹕1 | 0.557<χ20.05 |
新窗口打开
Table 3
表3
表3(Mrd×B73)F2和BC1代果穗和群体中单株果穗的表型分析
Table 3Ear segregation of F2 and BC1 and individual of these population derived from Mrd and B73
| 材料 Material | 总粒数 Total | 正常籽粒 Normal kernels | 突变籽粒 Mutant kernels | 实际比值 Observed ratio | 理论比值 Theoretical ratio | χ2检测 χ2 test |
|---|---|---|---|---|---|---|
| F2果穗 Ear of F2 | 235 | 170 | 65 | 2.68﹕1 | 3﹕1 | 1.784<χ20.05 |
| F2:3果穗 Ear of F2:3 | 326 | 253 | 73 | 3.47﹕1 | 3﹕1 | 0.613<χ20.05 |
| BC1果穗 Ear of BC1 | 373 | 181 | 192 | 1﹕1.06 | 1﹕1 | 0.162<χ20.05 |
| BC1自交的分离果穗 Ear of BC1F2 | 285 | 205 | 80 | 2.56﹕1 | 3﹕1 | 0.689<χ20.05 |
新窗口打开
2.3 籽粒淀粉粒密度突变基因的精细定位
利用BSA方法在1 000对SSR标记中筛选到43对差异标记,其中位于bin6.04区的7对SSR标记利用包含50个单株的小群体验证后是与目的基因紧密连锁的。利用与目的基因紧密连锁的SSR标记对420个F2单株DNA进行标记分析,根据F2单株自交果穗的表现型确定交换单株,初步将目的基因定位于SSR标记umc1105和bnlg1154之间,物理距离22 Mb。在SSR标记umc1105和bnlg1154之间开发了349对SSR标记,并利用靠近目的基因左右两端的两对引物对BC1果穗中的3.8万个正常籽粒胚乳DNA进行标记分析,对筛选到的交换单株在田间自交进行验证其表型,同时对交换单株的DNA再次进行标记分析验证。通过多步交换单株筛选和标记分析,将目的基因定位于新开发的SSR标记B3(Chr.6:113 266 416)和A47(Chr.6:113 466 703)之间,物理距离200 kb(表4)。B73基因组显示该物理区间内有3个蛋白编码基因,GRMZ M2G048836、GRMZM2G042607和GRMZM2G348551(su2)(图4)。生物信息学分析结果表明,GRMZ M2G048836编码叶绿素中ATP依赖的锌蛋白酶;GRMZM2G042607编码β-1,3半乳糖基转移酶;GRMZM2G348551是su2,编码可溶性淀粉合成酶,参与淀粉和蔗糖的代谢(表5)。Table 4
表4
表4多态性标记信息
Table 4Information of polymorphic markers
| 引物 Primer | 正向引物序列 Forward primer (5′-3′) | 反向引物序列 Reverse primer (5′-3′) |
|---|---|---|
| umc1105 | ATTCCTGCATCATCATCCACTACA | GCCAACTGATCTGCTCTAGCTTC |
| bnlg1154 | GGGTGATCACATGGGTTAGG | AAATCAATGCTCCAAATCGC |
| phi031 | GCAACAGGTTACATGAGCTGACGA | CCAGCGTGCTGTTCCAGTAGTT |
| B3 | CGTCCTTCTTTGTTGTTGGC | GTGACACCTGGCACTTTGATG |
| A47 | GGTAACACCAGACCACACATACC | CCCCCTGCTCACGACTTTA |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4tw1的精细定位
-->Fig. 4Fine mapping of tw1
-->
Table 5
表5
表5候选基因预测
Table 5Information of candidate genes
| 基因编号 Gene accession | 注释功能 Annotation |
|---|---|
| GRMZM2G048836 | 叶绿素中ATP依赖的锌蛋白酶 FtsH6-Zea mays FtsH protease |
| GRMZM2G042607 | β1,3半乳糖基转移酶 Beta-1,3-galactosyltransferase GALT1 |
| GRMZM2G348551 | 可溶性淀粉合成酶2-3,叶绿体/淀粉体 Soluble starch synthase 2-3, chloroplastic/ amyloplastic |
新窗口打开
2.4 候选基因确定
候选区段内su2的4个不同遗传背景的突变体与Mrd的等位性测验结果表明,杂交当代果穗籽粒正常且无分离,说明Mrd突变体不是su2的等位突变引起的(图5)。生物信息学分析显示GRMZM2G042607基因162—359个氨基酸位置是其对碳水化合物的识别结构域,具有碳水化合物结合能力,在种子中对碳水化合物的储藏起沉积作用(图4),是本研究突变的首选目的基因。对GRMZM2G042607基因的测序结果显示目的基因的调控序列在突变体和野生型之间有5个多态性位点,启动子区的SNP1(A/G),5′UTR的InDel1(7T/8T)和InDel2(-------/GTGAAGA),3′UTR的InDel3(8T/9T),Poly A尾巴前的SNP2(G/T)。为验证GRMZM2G042607基因的效应,基于540份自然群体胚乳细胞和淀粉粒大小的分析结果,对相应淀粉粒大小的2个极端类型的自交系的GRMZM2G042607基因进行测序,结果表明,这5个多态位点都不特异,因此在下一步的试验中需要进一步分析其启动子序列。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5Mrd和su2突变体的的等位性测验
-->Fig. 5Allelism test of Mrd and su2 mutant
a:Mrd穗子t1、t1*su2-1、T2*su2-1、su2-1、su2-1⊕和su2-1⊕;b:Mrd穗子T2、T2*su2-2、T2*su2-2、su2-2、su2-2⊕和su2-2⊕;c:Mrd穗子T3、T3*su2-3、su2-3和su2-3⊕;d:Mrd穗子T4、T4*su2-4、su2-4和su2-4⊕
a: The ear of Mrd t1, t1*su2-1, T2*su2-1, su2-1, su2-1⊕, su2-1⊕; b: The ear of Mrd T2, T2*su2-2, T2*su2-2, su2-2, su2-2⊕, su2-2⊕; c: The ear of Mrd T3, T3*su2-3, su2-3, su2-3⊕; d: The ear of Mrd T4, T4*su2-4, su2-4, su2-4⊕
-->
3 讨论
3.1 淀粉粒大小影响籽粒容重
容重作为重要的玉米籽粒商品品质衡量指标,在品种选育过程中受到育种工作者的重视。玉米籽粒容重与籽粒硬度、淀粉含量、淀粉颗粒大小等因素密切相关。玉米籽粒内含物中淀粉含量占75%以上,淀粉含量与籽粒容重显著正相关[18,19,20]。淀粉粒是淀粉的主要存在形式,不同粒度的淀粉粒对籽粒容重的贡献不同,籽粒中2—10 μm的淀粉粒体积百分比与容重正相关,10—20 μm的淀粉粒体积百分比与容重负相关[21]。此外,小淀粉粒的多少决定了淀粉粒的总表面和结合的蛋白量,影响胚乳的硬度,而籽粒硬度又与籽粒容重极显著正相关[22,23,24]。可见,籽粒中淀粉粒变小,密度增加,结合的蛋白增多,籽粒容重也会相应增加。本研究中的突变体籽粒的淀粉粒变小(8.52 μm),密度增加,淀粉粒之间的间隙变小,容重变大,而且该突变体的总淀粉含量并没有显著变化,因而可以在不改变淀粉含量的前提下提高玉米商品品质。3.2 候选基因的确定
大量的研究表明,当籽粒中碳水化合物的合成受到影响时,玉米籽粒中淀粉的形态和含量会发生变化,从而导致容重及品质发生改变[18,19,20]。su1编码一种异淀粉酶,该基因突变在乳熟期阻止糖分向淀粉转化,籽粒中的还原糖和蔗糖的含量显著增高,导致突变体籽粒胚乳变小,干重降低,容重变小[25,26]。du1编码水溶性淀粉合成酶,导致突变体胚乳中碳水化合物的性质发生改变,在籽粒发育过程中糖类浓度高,淀粉含量低[27]。brittle1(bt1)编码内在包膜小蛋白BT1[28],负责把糖元从细胞质运输到淀粉体内作为糖基供体用于淀粉的合成,在乳熟期,bt1的突变导致籽粒还原糖和蔗糖含量高而水溶性多糖和淀粉含量低[29]。本研究中,tw1(GRMZM2G042607)基因编码的β-1,3半乳糖基转移酶具有碳水化合物结合能力,在种子中对碳水化合物的储藏和转运起沉积作用。前人研究表明碳水化合物结合模块中的淀粉结合域数目增加,对淀粉的亲和力也相应增加,但淀粉粒变小而淀粉特性不受影响[30]。该基因可能是导致突变体Mrd淀粉粒变小,密度增加,容重变大的主要原因。糖基化对于真核生物中蛋白质的转录修饰是十分重要的,是植物细胞维持代谢平衡的重要机制之一[31]。在水稻中,类黄酮糖基化的改变,会造成可溶性糖分的增加以及淀粉合成的减少,导致水稻结实率下降[32]。N聚糖是植物糖基化中需要的重要的低糖,水稻α-1,3-岩藻糖转移酶的缺乏造成藻糖无法参与N-糖基合成,影响水稻的分蘖角、节间和穗节长度,增加形状不规则的白垩籽粒数[33]。昆虫细胞中,β-1,3半乳糖基转移酶可以将β-1,3半乳糖转移到N聚糖中,随后参与糖基化[34]。人类中,β-1,3半乳糖基转移酶通常与细胞增殖有关,可能会导致恶性肿瘤的形成[35,36]。植物中,β-1,3半乳糖转移酶在N聚糖的延伸中起作用,能够转移β-1,3半乳糖,并在α-1,4-岩藻糖参与下形成三糖复合体Lewis a结构[37,38],参与糖基化。本研究中的目的基因编码了一个β-1,3半乳糖基转移酶GALT1。目前还没有β-1,3半乳糖基转移酶和相应糖基化对于玉米籽粒发育相关的报道,但是根据前人的研究,本文中GRMZM2G042607基因编码的β-1,3半乳糖基转移酶GALT1可能会影响N聚糖的合成,有待进一步研究。
4 结论
利用籽粒淀粉粒密度突变体Mrd定位到一个淀粉粒密度基因tw1,该基因的候选基因是编码β-1,3半乳糖基转移酶的GRMZM2G042607。The authors have declared that no competing interests exist.
