0 引言
【研究意义】提高繁殖性能是猪育种的重要目标。纯系选育和配套杂交一直是猪传统育种的重要手段,但其周期长,需耗费大量的人力、物力和财力,如丹麦用50年的时间才将长白猪的胎产仔数提高到1.0头[1],严重制约猪传统育种的发展。随着现代分子生物学技术的快速发展,利用相关技术研究影响猪繁殖性能的相关基因,寻找提高猪繁殖性能的新方法[2],对更好地了解猪的分子育种、缩短育种时间,加快育种进程具有重要的理论和实际意义。【前人研究进展】目前,国内外****已对猪繁殖性状的分子遗传改良开展了大量的研究工作,发现雌激素受体(estrogen receptor, ER)基因[3]、催乳素(prolactin receptor, PRLR)基因[4]、促卵泡素β亚基(follitropin subunit beta, FSHβ)基因[5,6]、骨桥蛋白(osteopontin, OPN)[7]、视黄醇结合蛋白4(retinol binding protein 4, RBP4)[8]等均不同程度地影响猪的繁殖效率。羰基还原酶(carbonyl reductases, CBRs)是一类在生物体内广泛存在的氧化还原酶,其重要成员——羰基还原酶1(carbonyl reductases 1, CBR1),在药物代谢[9]、细胞保护[10,11]和肿瘤发生[12,13,14,15]等众多生理过程发挥着重要作用。CBR1也在生殖系统中表达[16,17],主要参与前列腺素E2(prostaglandin E2, PGE2)向前列腺素F2-alpha(PGF2α)的转变[18,19],在动物的妊娠阶段发挥着重要作用[20,21,22]。前期研究对五指山猪基因组进行重测序[23],通过De-novo组装发现:猪CBR1基因具有4个拷贝,其中3个拷贝具有完整的开放阅读框,另一个为假基因。【本研究切入点】目前,关于人、啮齿类动物CBR1基因功能研究的报道较多,但对于猪CBR1基因的报道较少,尤其是其多个不同拷贝形式的序列及其多态性与繁殖性能间的相关性仍未见研究报道。【拟解决的关键问题】本试验选择CBR1基因作为研究影响母猪繁殖性能的候选基因,获取该基因的不同拷贝形式的编码区序列,探讨其在多态性与母猪繁殖性能的关联性,以期为猪的繁殖性能选育提供新的分子标记。1 材料与方法
试验于2014年1月至2015年12月在中国农业科学院北京畜牧兽医研究所实验室进行。1.1 试验样本
五指山猪睾丸组织样品于中国农业科学院北京畜牧兽医研究所南口基地采集,置于液氮中冻藏,用于提取组织总RNA。对江苏省常州市猪场的48头大白母猪和47头长白母猪、江苏省南通市猪场的42头大白母猪、海南省海口市猪场的46个大白母猪的耳组织进行采样,置于装有75%酒精的离心管中,用冰盒带回实验室,用于提取基因组DNA。采集样本的母猪均为随机选取,体况良好,并有繁殖性能记录。1.2 RNA和DNA提取
采用 TRlzol Reagent(Invitrogen 公司)提取五指山猪睾丸组织总RNA,采用RevertAid First Strand cDNA Synthesis Kit试剂盒(Thermo公司)进行反转录,具体方法详见说明书。反转录产物置于-20℃冰箱中保存。采用常规的酚/氯仿法提取不同猪种耳组织基因组。
1.3 RT-PCR与克隆测序
根据前期五指山猪重测序de novo拼接结果,于NCBI网站的引物设计软件(https://www.ncbi.nlm.nih. gov/tools/primer-blast/index.cgi?LINK_LOC=BlastHome)对猪CBR1基因具有完整开放阅读框的3个拷贝形式(V1、V2和V3)设计引物,引物信息见表1,并以五指山猪睾丸组织的cDNA为模板进行扩增。RT-PCR反应程序:98 ℃预变性5 min;95 ℃变性1 min、退火1 min、72 ℃延伸1 min,35个循环;最后72℃延伸10 min。PCR产物用1.5%琼脂糖凝胶电泳分离,用Gel Purification Kit 凝胶回收试剂盒(Omega公司)进行PCR产物纯化。纯化产物克隆入pMD19-T vector(TaKaRa公司),并转化到DH5α感受态细胞中;采用质粒提取试剂盒(Axygen 公司)提取质粒,送天一辉远生物科技有限公司进行测序。Table 1
表1
表1猪CBR1基因不同拷贝形式mRNA序列扩增引物
Table 1Amplification primers for the mRNA sequences of porcine CBR1 gene different copy forms
| 基因 Genes | 引物序列 Primer senquences(5′-3′) | 片段大小 Products size (bp) | 退火温度 Annealing temp (℃) |
|---|---|---|---|
| CBR1-V1 | F: TACCCTCCACTCTCCACACC | 940 | 60 |
| R: CTTTTGGGGAAATCAGGACA | |||
| CBR1-V2 | F: ACTCACACCACCCTCCACTC R:TTTTCCCTCCCTGGGATAAT | 1116 | 60 |
| CBR1-V3 | F: GGGAGAAACCAGACCCATC R:CCTTTTGGTGAAATCAGGACA | 952 | 60 |
新窗口打开
1.4 序列分析
利用DNASTAR对CBR1不同拷贝形式编码的氨基酸序列进行分析。利用DNAMAN软件分析猪CBR1基因不同拷贝形式间的序列相似度,及其与其它物种的同源性。利用ExPaSy提供的Protparam在线软件分析猪CBR1基因不同拷贝的蛋白质理化特性。部分哺乳动物CBR1基因序列均从GenBank数据库下载,包括大鼠(Rattus norvegicus, NM_019170.2)、小鼠(Mus musculus, NM_007620.2)、人(Homo sapiens, NM_ 001757.3)、猴(Macaca mulatta, XM_015132918.1)、牛(Bos Taurus, NM_001034513.1)、羊(Ovis aries, XM_004003397.3)和犬(Canis lupus, XM_847582.3)、猪(Sus scrofa, NM_214073.1)。1.5 不同猪种CBR1基因多态性分析
为了进一步检测CBR1基因不同拷贝形式的SNP位点,并分析这些SNP位点对于母猪产仔性能的影响,根据前期五指山猪重测序de novo拼接结果,于NCBI网站的引物设计软件对猪CBR1基因具有完整开放阅读框的3个拷贝形式设计了9对引物,涵盖了该基因三个拷贝的所有外显子区域(表2)。PCR反应程序:98 ℃预变性5 min;95℃变性40-60 s、退火40—60 s、72℃延伸40-60 s,35个循环;最后72℃延伸10 min。PCR产物送由天一辉远生物科技有限公司进行测序。Table 2
表2
表2CBR1基因不同拷贝形式多态性扩增引物信息
Table 2Amplification primers for the polymorphism analysis of porcine CBR1 gene different copy forms
| 基因 Genes | 引物序列 Primer senquences(5′-3′) | 片段大小 Products size (bp) | 退火温度 Annealing temp (℃) |
|---|---|---|---|
| CBR1-V1-EX1 | F: AAAGACTGCCATAGGCTGATTTG R: ACTCTCTGGGGTGCAGACTCTA | 696 | 60 |
| CBR1-V1-EX2 | F: TCCCCTGATGGTGTCAACTTAT R:GCCTGAAACCCCTTATCTTGG | 613 | 60 |
| CBR1-V1-EX3 | F: GGGTATTTCTCATTCTGGTGTTCA R: GACAGTATAAGTCTCTTTTGGGGA | 568 | 60 |
| CBR1-V2-EX1 | F: GGGAATCACAGCCCTGCTA R: CAGCACCCTCTGAACATCAGT | 598 | 61 |
| CBR1-V2-EX2 | F: TATACCCCCTTAGCCTCCCC R: TGATGGGGCTGGAGAGAGTT | 600 | 61 |
| CBR1-V2-EX3 | F: CATCTCCTAGCAAACTGGTCCTTG R: GCAAATGAATAATCTGCTCACACA | 876 | 60 |
| CBR1-V3-EX1 | F: GCGTTTGGGAGAAACCAGAC R: TGGAACCAGCCAAAGACACA | 542 | 60 |
| CBR1-V3-EX2 | F: CCCAGAAATTCACATGGGCG R: CCCATGCAGGTGACAGACTT | 618 | 60 |
| CBR1-V3-EX3 | F: ACAGAGGTAAGTCCTGTCCCA R: CAGCCAGGACTCTTTGGTTCC | 941 | 60 |
新窗口打开
1.6 统计方法
利用SPSS19.0软件的广义线性模型(GLM)对各繁殖性能值与基因型间的关系进行最小二乘法估计:繁殖性能观察值=群体均值+基因型效应+随机残差效应,结果以“最小二乘均数±标准差”的形式表示。2 结果
2.1 猪CBR1基因不同拷贝形式的扩增
鉴于CBR1基因在生殖器官中表达,本研究采集了五指山猪的睾丸组织,并进行RNA提取和反转录。以五指山猪睾丸组织cDNA为模板,利用CBR1-V1、CBR1-V2和CBR1-V3引物进行扩增,PCR扩增产物经过琼脂糖凝胶电泳检测,得到特异性良好且与目的片段大小一致的扩增片段(图1)。测序后发现扩增片段长度分别为940、1 116和952 bp,与引物设计时预期长度一致。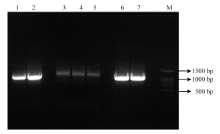 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1猪CBR1基因不同拷贝形式电泳图
1-2:V1扩增产物,3-5:V2扩增产物,6-7:V3扩增产物,M:100 bp marker
-->Fig. 1Agarose gel photograph of porcine CBR1 gene different copy forms
1-2: V1 amplification product, 3-5: V2 amplification Product, 6-7: V3 amplification Product, M: 2000bp marker
-->
2.2 猪CBR1基因不同拷贝形式编码区序列分析
将mRNA序列与前期获得的五指山猪重测序结果比对发现,V1的CDS全长为870 bp,编码289个氨基酸,含3个外显子,长度分别为289,108和473 bp。V2的mRNA序列与NCBI中的CBR1基因序列(NM_214073.1)相符,其CDS全长为870 bp,编码289个氨基酸,含3个外显子,长度分别为289,108和473 bp。V3的CDS全长为846 bp,编码281个氨基酸,含3个外显子,长度分别为289,108和449 bp。3个拷贝形式所有内含子边界均符合GT-AG规则。利用DNASTAR对CBR1不同拷贝形式编码的氨基酸序列进行分析,3个拷贝氨基端的12—18位氨基酸残基为保守的GlyXXXGlyXGly序列(图2),符合CBRs家族的结构特性[21]。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2猪CBR1基因不同拷贝形式的氨基酸序列分析
-->Fig.2Analysis of CBR1 different copy forms amino acid sequence
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3CBR1基因的同源性分析
左图:猪CBR1基因不同拷贝形式间的同源性分析;右图:猪CBR1基因拷贝V2与不同物种间的同源性分析
-->Fig.3Homology analysis of CBR1 gene
Left: Homology analysis among different copy forms of porcine CBR1 gene; Right: Homology analysis between V2 of porcine CBR1 gene and other species
-->
利用DNAMAN软件对CBR1基因的CDS序列进行比对,发现V1与V2序列的同源性高达90%,与V3的同源性高达87%。此外,CBR1基因在不同哺乳动物物种间的同源性较高,人与猴间的同源性最高,为96%,与猪之间的同源性为84%,与大鼠、小鼠间的同源性略低,但也达到了82%。
2.3 猪CBR1的蛋白质结构分析
使用ExPaSy提供的Protparam在线软件(http://web.Expasy.org/protparam)分析猪CBR1基因不同拷贝形式蛋白质序列的各项理化参数。结果发现:猪CBR1基因拷贝V1的分子式为C1397H2255N393 O425S13,分子量为31 773.43,理论等电点为6.12,消光系数为28 460,体外半衰期为30 h,不稳定系数41.21,脂肪系数为91.00,疏水性均值(GRAVY)为-0.208。猪CBR1基因拷贝V2的分子式为C1401H2243N395O419S11,分子量为31 677.28,理论等电点为7.60,消光系数为29825,体外半衰期为30 h,不稳定系数42.15,脂肪系数为87.34,疏水性均值为-0.237。猪CBR1基因拷贝V3的分子式为C1352H2183N379O408S10,分子量为30 596.10,理论等电点为7.63,消光系数为22 710,体外半衰期为30 h,不稳定系数42.31,脂肪系数为90.50,疏水性均值为-0.205。上述结果表明,CBR1基因的3个不同拷贝形式的蛋白质均较不稳定(一般认为蛋白质的不稳定系数小于40时,表示预测的蛋白稳定;大于40时,预测蛋白不稳定),且为亲水性蛋白。2.4 猪CBR1基因不同拷贝形式的多态性分析及其与繁殖性能的相关性
针对常州、南通和海口市的136头大白和47头长白繁殖母猪的进行SNP分型。所涉及的引物涵盖了3个拷贝的所有外显子区域。序列拼接结果显示,所有的大白、长白猪个体,均含有3个完整的CBR1不同的拷贝类型,序列与五指山猪一致。用于不同拷贝基因型分析的9对引物中,5对引物的扩增产物检测到多态性位点。
拷贝V1中,CBR1-V1-EX1扩增产物检测到拷贝V1启动子上游153 bp处存在A/T突变;CBR1-V1-EX2扩增产物检测到拷贝V1内含子1的836 bp处存在A/G突变;CBR1-V1-EX3扩增产物检测到拷贝V1外显子3的73 bp处存在A/G突变,赖氨酸突变为精氨酸,152 bp处均存在A/G突变,为同义突变,均编码缬氨酸,379 bp处存在C/T突变,丝氨酸突变为亮氨酸。
拷贝V2中,CBR1-V2-EX1扩增产物中检测到拷贝V2启动子上游10 bp处存在CA插入突变,外显子1的63 bp检测到C/T突变,为同义突变,均编码异亮氨酸,67 bp处均检测到C/T突变,精氨酸突变为色氨酸,内含子1的76 bp处检测出G/T突变。
拷贝V3中,CBR1-V3-EX3扩增产物检测到拷贝V3的外显子3的358 bp存在C/T突变,缬氨酸突变为丙氨酸,外显子3的374 bp存在A/G突变,为同义突变,均编码亮氨酸(图4)。
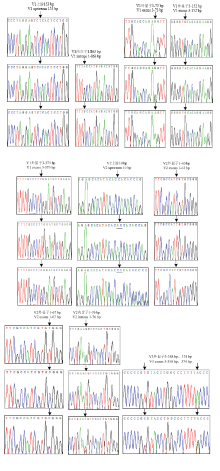 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4CBR1基因不同拷贝形式的SNP基因型
-->Fig.4SNP genotype of CBR1 different copy forms
-->
其中,CBR1不同拷贝形式的多态性与繁殖性能间的分析结果显示,各SNP位点上不同基因型的长白猪的经产仔数、经产活仔数差异均不显著(P≥0.05)。大白猪中,拷贝V1的启动子上游153bp TT基因型个体的经产活仔数显著高于AT基因型(P=0.047),外显子3—379 bp处TT基因型个体的经产活仔数显著高于CT基因型(P=0.042);拷贝V2上游10 bp处无AC插入的纯合子基因型个体的经产活仔数显著高于AC插入纯合子基因型(P=0.028),外显子1—63 bp处CC基因型个体的经产活仔数显著高于TT基因型(P=0.027),内含子1—76 bp处GG基因型个体的经产活仔数显著高于TT基因型(P=0.026,表3)。
Table 3
表3
表3CBR1基因多态性与繁殖性能相关性分析
Table 3Correlation analysis between CBR1 gene polymorphism and reproductive performance
| 位点 Loci | 基因型 Genotype | 大白猪 Yorkshire | 长白猪 Landrace | ||||
|---|---|---|---|---|---|---|---|
| 头数 No. | 经产仔数 Multiparous litter size | 经产活仔数 Multiparous alive litter size | 头数 No. | 经产仔数 Multiparous litter size | 经产活仔数 Multiparous alive litter size | ||
| V1上游153 bp V1 upstream 153 bp | TT | 99 | 11.626±0.185 | 10.946±0.181a | 46 | 11.887±0.231 | 11.357±0.202 |
| AA | 5 | 11.667±0.824 | 10.700±0.806ab | ||||
| AT | 32 | 10.919±0.326 | 10.211±0.319b | 1 | 11.333 | 11.333 | |
| V1内含子1-836bp V1 introns 1-863 bp | GG | 113 | 11.388±0.174 | 10.801±0.171 | 47 | 11.875±0.226 | 11.356±0.198 |
| AG | 23 | 11.820±0.386 | 10.581±0.380 | ||||
| V1外显子3-73 bp V1 exons 3-73 bp | GG | 2 | 11.875±1.315 | 11.542±1.289 | |||
| AG | 21 | 11.815±0.406 | 10.489±0.398 | ||||
| AA | 113 | 11.388±0.175 | 10.801±0.171 | 47 | 11.875±0.226 | 11.356±0.198 | |
| V1外显子3-152bp V1 exons 3-152 bp | AG | 9 | 11.733±0.619 | 11.050±0.607 | 11 | 11.897±0.476 | 11.473±0.418 |
| AA | 127 | 11.442±0.165 | 10.744±0.162 | 35 | 11.893±0.267 | 11.330±0.234 | |
| GG | 1 | 11.000 | 11.000 | ||||
| V1外显子3-379bp V1 exons 3-379 bp | CC | 100 | 11.620±0.184 | 10.946±0.180a | 47 | 11.875±0.226 | 11.356±0.198 |
| TT | 5 | 11.667±0.824 | 10.700±0.805ab | ||||
| CT | 31 | 10.917±0.331 | 10.186±0.323b | ||||
| V2上游10 bp处 AC插入 AC insertion in V2 upstream 10 bp | 无AC插入 | 95 | 11.653±0.188 | 10.900±0.184a | 45 | 11.810±0.229 | 11.302±0.201 |
| AC插入杂合子 | 36 | 11.127±0.306 | 10.641±0.299ab | 2 | 13.333±1.085 | 12.583±0.952 | |
| AC插入纯合子 | 5 | 10.217±0.821 | 9.067±0.802b | ||||
| V2外显子1-63 bp V2 exons 1-63 bp | CC | 94 | 11.647±0.190 | 10.905±0.185a | 45 | 11.810±0.229 | 11.302±0.201 |
| CT | 37 | 11.156±0.302 | 10.634±0.295ab | 2 | 13.333±1.085 | 12.583±0.952 | |
| TT | 5 | 10.217±0.822 | 9.067±0.802b | ||||
| V2外显子1-67 bp V2 exons 1-67 bp | CC | 110 | 11.465±0.178 | 10.789±0.174 | 46 | 11.847±0.229 | 11.342±0.202 |
| CT | 25 | 11.422±0.373 | 10.685±0.365 | 1 | 13.167 | 12.000 | |
| TT | 1 | 12.000 | 10.000 | ||||
| V2内含子1-76 bp V2 introns 1-76 bp | GG | 92 | 11.703±0.190 | 10.925±0.187a | 45 | 11.810±0.229 | 11.302±0.201 |
| GT | 39 | 11.049±0.292 | 10.600±0.287ab | 2 | 13.333±1.085 | 12.583±0.952 | |
| TT | 5 | 10.217±0.817 | 9.067±0.801b | ||||
| V3外显子3-358 bp V3 exons 3-358 bp | TT | 102 | 11.557±0.183 | 10.799±0.180 | 45 | 11.810±0.229 | 11.302±0.201 |
| CT | 34 | 11.174±0.318 | 10.659±0.312 | 2 | 13.333±1.085 | 12.583±0.952 | |
| V3外显子3-374 bp V3 exons 3-374 bp | AA | 102 | 11.557±0.183 | 10.799±0.180 | 45 | 11.810±0.229 | 11.302±0.201 |
| AG | 34 | 11.174±0.318 | 10.659±0.312 | 2 | 13.333±1.085 | 12.583±0.952 | |
新窗口打开
3 讨论
提高繁殖性能是猪育种的重要目标,国内外****已就猪繁殖性状做了大量的研究,但几乎都是从单个或者多个基因的结构、功能及其与上下游基因之间的关系进行研究[24,25,26]。关于基因不同拷贝数及其拷贝类型对于繁殖性状的影响及其作用机制却尚未见报道。本研究基于前期对五指山猪的基因组重测序的结果,针对参与繁殖性能调控的多拷贝基因——CBR1开展研究,为进一步增加对猪繁殖性状调控机制的认识提供了新的分子基础。本研究获得了CBR1基因3种不同拷贝形式的全长编码区序列,发现不同拷贝形式氨基端的12—18位氨基酸残基为保守的GlyXXXGlyXGly序列,符合CBRs家族的结构特性,可借此形成Rossman折叠,与不同辅因子结合[27]。
CBR1基因不同拷贝类型形式的CDS序列同源性达87%以上,不同哺乳动物间的CBR1基因的CDS序列同源性达82%以上,一方面说明不同哺乳动物CBR1基因在进化过程中比较保守,另一方面也说明CBR1可能在不同物种内均发挥着重要的生物学功能。
CBR1基因的3种不同拷贝形式编码的蛋白质结构相似,生理、生化特性接近,说明3个不同拷贝形式可能在体内发挥着类似的功能。同时,这3种蛋白质均不稳定,且为亲水性蛋白,可能与其发挥氧化还原作用有关。
目前,关于猪CBR1基因的SNP分型尚未见报道。本研究中,3个拷贝形式中共计检测出11个SNP位点,拷贝V1中发现5个SNP位点,拷贝V2中发现4个SNP位点,拷贝V3中发现2个SNP位点。大白猪中,拷贝V1的启动子上游153 bp处的A/T突变和外显子3—379 bp的C/T突变,拷贝V2上游10 bp处的AC插入突变、外显子1—63 bp处C/T突变和内含子1—76 bp处G/T突变与产活仔数显著相关。研究表明,在母猪发情周期、胚胎植入以及妊娠等炎性事件中,黄体变化起着重要作用[28,29],而由于PGE2和PGF2α对黄体分别具有保护和溶解功能[30],因此作为催化PGE2向PGF2α转化的关键酶[31],CBR1的表达可能受到上述SNP位点的影响而发生改变,但有待于进一步的研究证实。此外,在长白猪中,这些SNP位点上不同基因型母猪的繁殖性能间未检测到显著差异,一方面可能与品种差异性有关,另一方面也可能是本研究中长白母猪的样本数较少,导致一些基因型的检出率低所致。今后将进一步补充样本,包括采集以高产仔数而闻名的太湖猪种进行研究,进一步验证相关分子标记的准确性。
4 结论
本研究获得了猪CBR1基因3个不同拷贝形式的编码区序列,了解了其基因特征和蛋白性质。发现了5个与大白猪经产仔数显著相关的SNP位点,为大白猪的繁殖性能选育提供了理论基础和新的分子标记。The authors have declared that no competing interests exist.
