 ,1, 钱前2, 张嘉楠3, 邓兴旺1, 万建民2, 徐云碧
,1, 钱前2, 张嘉楠3, 邓兴旺1, 万建民2, 徐云碧 ,2,4
,2,4Transforming and Upgrading Off-Season Breeding in Hainan Through Molecular Plant Breeding
ZHANG Xingping ,1, QIAN Qian2, ZHANG JiaNan3, DENG XingWang1, WAN JianMin2, XU Yunbi
,1, QIAN Qian2, ZHANG JiaNan3, DENG XingWang1, WAN JianMin2, XU Yunbi ,2,4
,2,4通讯作者:
责任编辑: 李莉
收稿日期:2021-04-6接受日期:2021-05-20
| 基金资助: |
Received:2021-04-6Accepted:2021-05-20
作者简介 About authors
张兴平,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (659KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
张兴平, 钱前, 张嘉楠, 邓兴旺, 万建民, 徐云碧. 分子植物育种助推南繁种业转型升级. 中国农业科学, 2021, 54(18): 3789-3804 doi:10.3864/j.issn.0578-1752.2021.18.001
ZHANG Xingping, QIAN Qian, ZHANG JiaNan, DENG XingWang, WAN JianMin, XU Yunbi.
开放科学(资源服务)标识码(OSID):

为了加快作物的育种进程,育种家们探索了许多加速世代的方法,包括利用具有适宜光温条件的自然环境进行异地加代,或人为创造作物快速发育所需要的光温环境,或辅以幼胚离体培养、单倍体诱导等生物技术措施以缩短作物的繁殖周期、加速遗传纯合,从而缩短育种年限[1,2]。采用异地加代的方式,育种家每年在本地(目标环境,target environment)和异地(非目标环境,non-target environment)进行来回穿梭育种。可以进行异地加代的反季节育种(off-season breeding)的地点因植物而不同,但必须满足特定作物完成生长发育周期所需的基本的光照和温度条件。随着本地气温的降低,大多数栽培植物都需要向温暖的异地寻找适宜的反季节育种基地。早在1945年,诺贝尔和平奖获得者Norman Borlaug博士就开始了小麦的穿梭育种,利用墨西哥Toluca和Obregon 2个具有不同维度和海拔高度、相距约2 000 km的地点,实现一年繁殖2代,在短时间内育出多个高产抗锈病的矮化小麦品种[3,4]。在中国,著名玉米育种家吴绍骙于1961年即提出了利用南方天然光温条件加快作物种子繁殖的方法[5]。利用气候差异开展的异地繁殖加代技术已广泛用于加速育种进程。位于北半球的美国、荷兰等国家在智利、菲律宾、墨西哥等地建立了跨国的异地繁殖和育种试验站[6]。北美育种通常在气候适宜的夏威夷、瓜地马拉、墨西哥、智利、巴西、秘鲁以及泰国等地进行异地加代;而欧洲大部分地区的育种,异地加代一般在智利、巴西、危地马拉、摩洛哥和泰国进行。在北美洲和南美洲之间进行的玉米、小麦、大豆等作物的穿梭育种,大大加速了育种进程。
中国地缘辽阔、各地气候多样、栽培作物种类繁多,适合异地加代、扩繁和纯度鉴定的时间和地点差别比较大。对于不同的作物,异地加代可以分别被称为夏繁、秋繁、冬繁。如长江流域的冬播油菜,收获后可以在夏天到宁夏和甘肃等西部凉爽地区去夏繁。江浙一带的早稻收获后,可以到福建、广西、广东的一些地方去秋繁,随后再转战海南去冬繁,这样可以利用自然环境完成一年3次繁育和测试。大多数异地加代的作物,包括水稻、玉米、棉花、大豆、一部分蔬菜和瓜类作物,一般都是在大陆目标环境完成一代的试验之后到南方(主要是海南)进行冬繁,这种最常见的异地加代、扩繁和纯度鉴定被简称为南繁(off-season breeding, non-target environment breeding, or winter-nursery breeding)。
长期以来,因为异地环境条件明显不同于本地,南繁的主要目的是加速世代进程、扩繁和纯度鉴定,而无法有效地进行重要农艺性状的选择。尽管海南的条件可以满足很多作物额外2代的繁殖,但大多数情况下,一年只能加繁1代。因此,南繁育种普遍存在的共性问题之一就是重繁殖轻选择或不选择、异地只能加代一次,因为连续加繁2代有可能丢失很多重要的目标性状。其结果是海南的优良南繁条件没有得到有效地利用。随着转基因、基因编辑、分子标记辅助选择、分子设计育种以及各种快速育种技术的发展,分子植物育种将助推南繁种业转型升级,从常规的加代繁殖转变成加代和选育相结合,让异地选择实质上等同于本地选择。为推动海南自贸区的建设和南繁种业的发展,2019年12月9日—12日在三亚举办了“崖州论坛:南繁与现代育种国际论坛”,徐云碧应邀作了“分子植物育种助推南繁种业转型升级”的专题报告[7]。本文就是在该报告的基础上,结合其他作者的建议和讨论形成的。文章将讨论南繁种业现状与海南地理生态优势,南繁种业转型升级的必要性和可能性,与转型升级有关的育种理论、育种平台和分子检测技术,实现转型升级所需的整合育种体系。希望借此推进有关南繁种业转型升级的公众讨论和政府决策,从而推进种业的科技进步和现代化。
1 海南地理生态优势与南繁种业现状
中国的“南繁”始于1956年。从1956年到20世纪60年代,辽宁、湖南、山东、河南、四川等省专家及技术人员开始了南繁的探索和实践。起初南繁是在广州、南宁、湛江、海口等城市周边。随着交通运输的发展,南繁向更适宜农作物种植的区域转移。经过半个多世纪的探索与实践,南繁基地稳定在海南省三亚市及其两厢陵水和乐东两县,辅之以云南省西双版纳、元谋和广西壮族自治区北海市等地。海南省垦区作为重要的热带农业生产地区,拥有无可比拟的优势,是国家稀缺的、不可替代的战略资源。特别是正在筹建的国家南繁科技城所在地三亚市,是南繁育种的最大核心区。三亚市寒暑变化不大,年平均气温为24—25℃,1月平均气温为21.4℃,冬季如春,皆为喜温作物的活跃生长期,雨季旱季明显,阳光充足,热量丰富,光能利用率高,被誉为“天然大温室”(图1),适合农作物周年种植和生产。图1
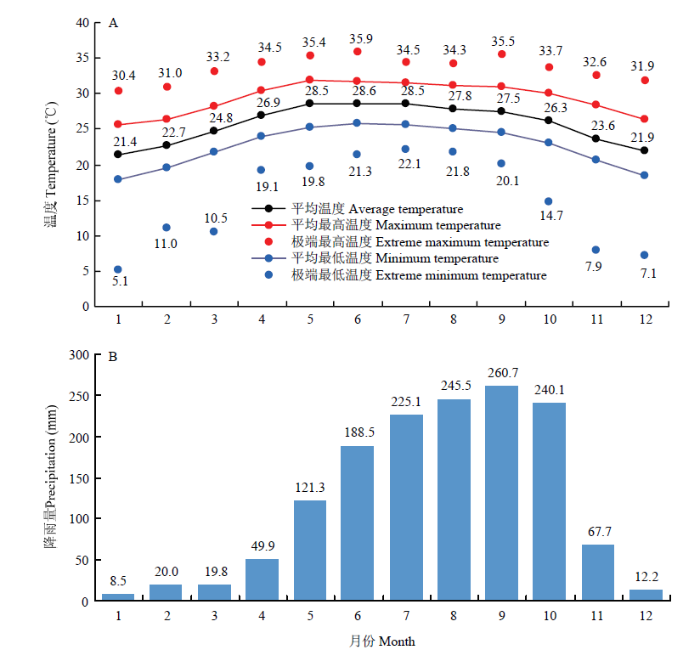 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1南繁育种核心区域三亚市的全年温度和降雨量
A:温度;B:降雨量。根据1956—2020年历史数据,
Fig. 1Temperature and precipitation in Sanya, Hainan, a core off-season breeding base for accelerating breeding in China
A: Temperature; B: Precipitation. Based on the data of 1956-2020,
海南南繁为国家种业发展和农业生产作出了巨大贡献。60多年来,全国育成的农作物新品种中,70%以上的品种都经过南繁。近几年,全国近30个省份800多家科研院所、高等院校及科技型企业约6 000多名农业科技专家、****来到海南从事南繁育种工作[8]。水稻“野败”雄性不育系就是在南繁期间发现的。1970年11月23日,袁隆平助手李必湖和南红农场职工冯克珊在崖县(现三亚市)南红农场的水沟边发现一株野生稻花粉败育型雄性不育株,这一“野败”植株的发现成为三系法杂交水稻研究的重要突破口[9]。近10年,主要农作物国家审定的品种有1 345个出自南繁,占总数的86%;省级审定的12 599个品种,育自南繁的占91%[10]。南繁作物种类目前已经扩展到水稻、棉花、小麦、烟草、蔬菜等30余种。特别是水稻育种,借助于南繁基地,育种世代从每年1—2代变为2—3代,种子扩繁加速了水稻新品种和新组合的应用和推广,纯度鉴定为全国推广品种(杂交种)提供了安全保障。海南也成为中国农作物育种应用研究与基础研究的重要基地。
南繁基地目前主要用于繁殖加代(包括种子扩繁)、纯度鉴定而不是全方位育种。海南省的地理生态优势没有得到充分和有效利用。主要原因在于:(1)异地无法进行精确的表型选择:导致只能在异地进行不加选择的繁殖1代,而非连续多代繁殖和育种。(2)土地面积小或一致性差、试验成本太高,以致无法进行大规模或周年试验,许多育种单位因为南繁成本太高正在减小南繁规模或干脆放弃南繁。(3)试验规模有限:土地和劳动力资源无法满足大规模常规育种的需求,许多南繁育种者不得已从北方雇用大量劳动人员到海南基地。(4)季节矛盾:异地与本地目标地域的生长季节冲突导致只能在海南种植一季。(5)政策定位:长期以来海南省仅仅作为繁育基地,许多单位没有稳定的基地,基础建设投入不足,种植生长条件较差。现代分子生物学和育种技术的发展正在为充分利用海南省气候资源,实现南繁种业的转型升级创造条件。
2 南繁种业的转型升级及其所需条件
实现南繁种业转型升级,就是要改变历史上单一的繁殖加代、纯度鉴定模式,实现向资源引进和评价、育种选择、品种(杂种)鉴定和品种权保护等在内的全产业链模式的转型升级,实现从海南加代向海南育种、全国测试的方向转变,实现从冬繁到全年育种的转变,实现从一年1代到一年多代的转变,将南繁基地转变为育种基地,将海南的冬天转变为育种家的春天。实现南繁种业的转型升级需要异地选择观念的转变、国家相关政策的支持、分子育种平台的支撑、生物安全防控、品种保护制度的建立和完善、资源共享和交流机制的形成(表1)。Table 1
表1
表1南繁种业转型升级所需条件
Table 1
| 领域 Fields | 所需改变 Required changes |
|---|---|
| 观念转变 Mind-set changes | 异地也可以进行评价、选择和育种 Evaluation, selection and breeding can be largely performed at or replaced by, non-target environments |
| 政策支持 Policy support | 降低租地和劳动力成本;开辟资源引进和交流绿色通道;确定南繁育种保护区 Reducing land and lab costs; providing a special channel for germplasm introduction/exchange; defining the core winter nursery reserved for breeding use |
| 平台建设 Platform development | 育种平台:分子检测、表型鉴定、快速育种、转基因和基因编辑;育种实验站建设:交通、灌溉、机械化;后勤服务体系 Breeding platforms for molecular diagnosis, phenotyping, speeding breeding, transgene and gene editing; breeding stations with well-established transportation, irrigation and mechanization systems; logistic service |
| 生物安全 Biosafety containment | 生物安全防控法治化建设;检疫性生物分子检测 Regulations and legal construction for biosafety protection; molecular diagnosis and detection of quarantine organisms |
| 品种权保护 Variety right protection | 实施与国际接轨的植物品种保护制度 Implementing plant variety protection system that matches with international regulations |
| 合作交流 Collaboration and exchange | 种质资源和信息资源的共享和交流;为东南亚育种 Sharing and exchanging germplasm and information; breeding for Southeast Asian countries |
新窗口打开|下载CSV
要完成南繁种业的转型升级首先需要转变观念,从传统的南繁加代转变为借助于分子育种技术和手段在海南进行异地评价、选择和育种。为此,需要国家在土地租用、人工使用、基地建设、种质资源引进等方面采用新的支持和优惠政策,以期降低试验成本、提高试验质量、简化管理、提高效率。同时要建立立足海南进行现代育种所需的各种平台和生态生活环境,以提供分子检测、表型鉴定、快速育种、转基因和基因编辑等现代生物技术服务。为引进跨国种业在海南扎根安家,需要在海南率先实施与国际接轨的植物品种保护制度,让国外先进的技术和种质资源能够走进来、站得住、用得好。最后要拓展动植物育种的国际国内合作空间,在实施品种保护制度的前提下,推进国内外以及海南各育种单位种质资源和信息资源的共享和交流,使南繁育种立足海南、辐射东南亚,惠及全世界。
3 南繁种业转型升级之育种理论
3.1 数量和群体遗传
南繁育种中需要选择的许多性状为数量性状。数量性状的遗传受微效多基因控制,其表现受外界环境的极大干扰。首先,经典和现代数量遗传学为复杂性状的遗传评价提供了重要的方法,包括性状遗传变异的剖分、复杂性状之间的相关分析、遗传率和选择响应的估算、综合选择指数的构建、长期和轮回选择结果的预测、基因型和环境互作的评价和检测。其次,基于分子标记选择的数量遗传学理论,即分子数量遗传学,为复杂数量性状的异地选择提供了可能性[11,12,13]。利用分子标记,采用双亲或多亲产生的分离群体进行连锁分析、自然群体或多杂种群体的连锁非平衡(关联)分析,可以定位影响复杂数量性状的多个QTL,确定其效应的大小、QTL与环境的互作、不同性状QTL之间的互作[14,15,16]。利用不同实验室、不同地点所获得的标记-性状关联信息,可以开发与目标性状相关的功能或关联标记,构建选择模型,开展多种形式、不依赖于环境的分子标记辅助选择,包括回交育种、基因累加、轮回选择和全基因组选择,从而对目标性状实现有效地异地评价和选择。
其三,根据群体遗传学的理论,可以确定群体中重要性状QTL的有利等位基因、单倍型及其相应的频率和效应。通过全基因组选择(genomic selection,GS)等群体改良技术在育种群体中进行优良等位基因的累加。GS就是利用覆盖全基因组的高密度标记进行选择育种,通过早期或异地选择缩短育种周期,提高基因组估计育种值(genomic estimated breeding value,GEBV)的准确性,从而获得更大的遗传增益。通过覆盖全基因组的分子标记估算不同染色体片段或单个标记效应值,然后将个体各个片段或标记效应值累加,获得GEBV,其理论假设是在分布于全基因组的高密度SNP标记中,至少有一个SNP能够与影响目标性状的数量遗传位点处于连锁不平衡状态,因此群体中每个QTL的效应都可以通过特定的SNP联系起来,从而更好地解释表型变异。预期GS将在异地选择育种中缩短育种周期,实现待选群体的早代选择,提高GEBV估计准确性;同时降低育种成本,减少表型鉴定的数量。对于杂种优势利用作物,还能根据亲本预测杂交后代,选择最佳杂种优势组合。
3.2 基因型与环境互作
以测序技术为基础的基因型检测技术和表型组学为现代育种提供了基因型和表现型2个维度的支撑信息。由于植物的表现型是基因型和环境共同作用的,精准地评价植物生长发育有关的外界和内部环境,可以进行更加准确的表现评价和选择。环境型鉴定就是要定量地确定各种环境因子(气候、土壤、植物冠层、伴生生物、作物管理等)的变异[17]。因此,在未来的育种实践中,环境因子及其对植物生长发育、表现型变异等的影响不再是一个无法测度的黑箱。环境型鉴定和评价将有助于深入了解和分析基因型与环境互作及其复杂性,确定基因型与环境互作、环境反应相关的基因,从而更好地将基因型与环境互作信息应用于改进选择效率,提升遗传增益[16,17]。在不同的生态地区间有计划地进行育种材料的交流、种植和选择的穿梭育种,可以把南繁基地作为其中一个生态区,评价和度量育种材料的遗传与环境互作。这种穿梭育种可以培育出具有广泛适应性与特殊适应性的2种不同类型的品种。结合不依赖于环境的标记辅助选择技术,可以对重要的农艺性状进行有效的异地评价和选择。分子标记辅助选择将彻底改变南繁育种方式,使传统的1代异地繁殖变成2代或多代的异地繁殖而不丧失选择方向或目标。植物生长发育经历从营养生长到生殖生长的转换过程。该过程受外界环境条件和植物内部生理和遗传等因素的控制,是基因型与环境相互作用的结果。外界环境条件主要是温度和光照,次要的包括水分和养分等的协同作用。植物内部因素包括影响生长发育的各种化学成分、营养元素、基因及其代谢途径。通过调控植物外界和体内影响生长发育的各个环境和遗传相关因素,可以加快植物的生长发育进程。近年来倡导的快速育种(speed breeding)理论,就是基于对各种生长发育影响因子,特别是光照和温度的调节和控制,大大加快植物的生长发育速度,从而让植物在较短的时间内完成整个生长发育周期[18]。此外,通过组织培养、胚拯救,结合双单倍体(doubled haploid,DH)育种技术,亦可大大加速世代进程和遗传纯合稳定。
在现代育种技术中,转基因、基因编辑和合成生物学等对外界环境的依赖性较弱,不需要或较少考虑基因型和环境的互作问题,特别适合于整合到南繁育种程序之中。转基因技术是将人工分离和修饰过的外源基因导入到生物体基因组中,由于导入基因的表达,引起生物体性状的可遗传修饰。其技术涉及外源基因的克隆、表达载体、受体细胞以及转基因途径等[19,20]。对目标基因进行删除、替换、插入等操作的基因编辑,可以获得植物新功能或新表型[21,22]。基于系统生物学的遗传工程和工程方法的人工生物系统研究,合成生物学实现从基因片段、DNA分子、基因调控网络与信号传导路径到细胞的人工设计与合成,实现基因元器件的人工改造与基因回路的人工合成[23,24,25]。为将合成生物学技术应用于育种,需要整合单一基因与复杂性状的元件和模块,通过人工基因线路的定制化实现高产优质、营养健康、资源节约、环境友好作物的大规模生产及应用。转基因、基因编辑和合成生物学均可整合应用于植物的遗传改良并在海南等异地实施。
3.3 分子设计和大数据
随着组学和生物信息技术的发展,以生物信息学为平台,以基因组学、表观组学、转录组学、蛋白组学、代谢组学等产生的生物信息大数据为基础,综合植物育种流程中的遗传、生理、生化、农艺、生物统计等所有学科的技术和信息,根据育种目标和环境,设计最佳方案。最初的设计育种概念,就是通过综合各种知识和计算机模拟,最终让育种家可以将所有位点最有利的等位基因以可控的方式结合起来进行超级品种的设计[26]。分子设计育种就是在解析作物重要农艺性状形成的分子机理的基础上,通过理论设计和选择,对多基因复杂性状进行定向改良,获得综合性状优异的新品种[27,28,29]。理论上,分子设计育种涉及微观水平上的基因设计、代谢途径设计和网络设计;在宏观层面上,分子设计育种则可以在个体、群体和物种水平上进行[30](表2)。近年的研究提供了与代谢途径设计相关的报道。一是利用合成生物学人工设计光呼吸通路:通过转入植物苹果酸合成酶和绿藻乙醇酸脱氢酶到叶绿体,将乙醇酸直接转化为苹果酸进入卡尔文循环。同时,利用RNA干扰抑制叶绿体上的乙醇酸/甘油酸转运蛋白PLGG1以防止乙醇酸离开叶绿体,使转基因烟草植物的生长量比野生型烟草提高40%[31]。类似研究还包括利用多基因组装和转化系统在水稻叶绿体中建立新的光呼吸旁路[32]以及第二条光呼吸代谢支路(GCGT捷径)[33]。二是以豆科模式植物百脉根为材料,通过研究赖氨酸基序(LysM)受体如何特意识别特意配体,揭示可能通过合成生物学改造非豆科植物进行固氮,为在非豆科植物中进行受体改造从而使其能识别根瘤菌提供了重要的理论指导[34]。这类分子设计育种可以很大程度在南繁等非目标环境下进行。结合基因组预测,可以在异地条件下,对所设计的育种方案、育种群体进行各种评估和预测,从而改进异地选择所能获得的遗传增益。Table 2
表2
表2微观和宏观水平的分子设计育种(根据文献[30]修改)
Table 2
| 水平 Scale | 设计 Design | 工作内容 Design contents |
|---|---|---|
| 微观水平Micro-scale | 基因设计 Gene design | 基因定点敲除、诱变与编辑、RNA干扰、转基因、分子标记辅助选择 单基因:最佳等位基因 多基因:最佳结合体(单倍型)和互作类型 Site-directed gene knockout, mutation, and gene editing; RNA interference, transgenes, marker-assisted selection Single genes: Best alleles Multiple genes: Best combinations (haplotypes) and interactions |
| 代谢设计 Metabolism design | 代谢途径的替换、修饰和改良。实例:C4水稻,高光效小麦 Substitution, modification and improvement of metabolic pathways. For example, rice with C4 pathway and wheat with high-photosynthetic efficiency | |
| 网络设计 Network design | 网络调控因子、网络结构、网络节点和边界等的设计。实例:直播稻与旱稻 Design of network regulators, network structure, network nodes and borders, etc.. For example, direct-seeding and drought-resistant rice | |
| 宏观水平Macro-scale | 个体设计 Individual design | 形态、产物分配、耐逆性、个体间相互作用、性状间互作和协调 Morphology, assimilate distribution, stress tolerance, individual interaction, trait interaction and complementation |
| 群体设计 Population design | 结构优化、生态稳定、光合效率、源库协调和补偿 Structure optimization, ecological stabilization, photosynthetic efficiency, source-sink coordination and compensation | |
| 物种设计 Species design | 结合不同物种的优良性状,适合不同环境和生态的新型农作物: 环境友好型、资源节约型、产物多样型、用途可塑型 Integration of favorable traits from different species and adaptation to different ecological environments: environment-friendly, resource-saving, product-diversified, and usage-flexible |
新窗口打开|下载CSV
为践行分子设计育种,中国科学院实施“分子模块设计育种创新体系”战略性先导科技专项[35]。该专项以水稻为主,利用多种种质资源,综合运用基因组学、系统生物学、合成生物学等手段,解析重要农艺(经济)性状的分子模块,揭示复杂性状全基因组编码规律,发展多模块非线性耦合理论和“全基因组导航”分子模块设计育种技术,以期优化多模块组装的品种设计的最佳策略。利用水稻数量性状核苷酸(quantitative trait nucleotide,QTN)图谱和遗传图,中国科学家系统分析了水稻基因组中存在的遗传累赘,并针对杂交-回交-自交、群体样本量、导入位点数等各类情形进行大数据仿真模拟,获得了育种设计路线的优化参数,最终开发出能够指导水稻育种设计的导航软件包RiceNavi[36]。该导航软件包配备了三大功能:提供用户待改良品种的全部QTN基因型,并展示实体库中具有互补等位的种质材料;根据用户需要导入的基因位点(1—4个)给出最优育种路线;育种过程每代根据中间群体的基因型挑出最有潜力的若干后代材料。RiceNavi已被用于优良籼稻品种“黄华占”的遗传改良,使其能够更好地适应密植和缩短生长期。采用RiceNavi系统,不仅改进育种进度和精确度,而且可全部或部分实现QTN的大多数预测效果。
在育种实践上,分子模块设计作为分子设计育种的一种形式,已用于水稻品种的改良[35]。值得重视的一个关键问题是分子设计育种应该站在“巨人”的肩膀上,采用新育成的最佳品种作为分子改良的底盘品种(base variety),在此基础上进行基因及其组合的优化和性状的进一步改良。一个典型的实例是以水稻品种空育131为底盘品种,通过基于分子标记辅助的回交选择和分子模块育种,结合北育和南繁,获得了一系列改良版,包括导入了抗倒和穗粒数分子模块的金黄稻1号、穗大和晚熟分子模块的金黄稻2号、粒长和晚熟分子模块的金黄稻3号、香米基因分子模块的金黄香1号和金黄香2号、低直链淀粉分子模块的金黄恋1号[37]。
4 南繁种业转型升级之育种平台
4.1 高通量精准表现型鉴定
随着表型组学技术的发展,在南繁环境下实施精准表型鉴定成为可能。鉴于一般育种单位在南繁基地的试验规模较小、育种活动复杂而各具特色,有必要建立和协调全国性的南繁表型鉴定平台和设施(包括无人机、遥感、智能化装备等),实现表型鉴定平台的共享共用、表型信息的互通、整合和综合开发利用。通过环境型鉴定采集的环境信息,根据基因型X环境互作效应,建立目标环境和异地环境之间的相互关联模式,对异地环境下所获得的精准表型进行校正,从而预测在目标环境下的可能表型。4.2 环境型鉴定
广泛采集影响植物生长发育和性状表达的各种外界和内部环境因素,进行育种环境的特征化分析和分类,是开展精准化、标准化、流程化评价和选择的关键。要像重视基因型鉴定、精准表型鉴定一样重视环境型鉴定。要对设施环境、可控的人工环境和大田自然环境进行精准的环境因子采集[17]。通过环境特征化分析建立不同环境的可比性环境评价参数,为不同环境下的育种评价和选择提供统一标准。在保持南繁基地和试验环境相对稳定的前提下,要开展环境信息的长期标准化采集、保存、分析和利用,通过积累历史数据为未来育种提供信息支撑。4.3 信息处理和网络技术
远程信息处理和互联网技术的发展为常规和异地环境下育种信息交流提供了便利。适合于异地监控、遥控遥感、远程信息采集、信息实时传输、可视化技术的进步使异地评价和选择等育种活动与目标环境保持同步和高效。4.4 决策支撑系统
建立互联网和云平台支持下的各种决策支撑系统,使异地的评价和选择得到类似于目标环境的支撑服务。相关的决策支撑系统包括遗传材料评价、QTL作图软件、遗传分析工具、育种模拟、分子和功能标记开发、多元信息处理、全基因组选择和基因组预测等(图2)。图2
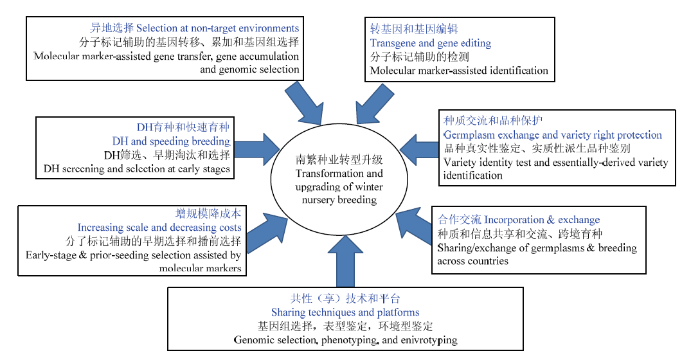 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2南繁种业转型升级所需之分子育种平台(根据文献[38]修改)
Fig. 2Molecular plant breeding platforms required for transformation and upgrading of Hainan off-season breeding industry (Revised from [38])
现代育种技术平台将在南繁种业转型升级中发挥关键作用(图2)。平台将推动以下领域的进展:异地选择(完成主要目标性状的异地评价、鉴定和选择)、分子检测(转基因性状的转移、基因编辑检测)、增规减耗(通过早期和播前选择增加规模、提高土地利用率、降低成本)、品种权利保护(品种真实性、实质性派生品种、品系和杂交种纯度检测)、DH育种(单倍体筛选、早期淘汰和选择)、快速育种(通过控制环境条件加速植物生长发育、分子标记辅助的快速筛选和鉴定)、全基因组选择和预测以及开源育种(种质资源和信息资源的共享、交流和利用)。
5 南繁种业转型升级之分子检测技术
分子检测技术以及标记辅助的选择使评价和选择不再依赖于特定的环境条件。首先,借助分子标记,可以在任何环境下对各种需要特定环境才能表达的性状进行选择,比如需要逆境才能表现的非生物胁迫抗性,需要发病条件才能表现的各种病虫害抗性,需要特定光温条件才能表现的各种光温敏感性(光、温敏不育性)和光温反应特性,需要施用除草剂才能鉴别的除草剂抗性等等。许多品质性状(例如化学成分和物理特性等)的鉴定,往往需要大量的样品和耗费大量的时间或成本,才能在实验室分析完成,而对大量样品的分析,必须等到选择材料能够产生足够样品的后期世代才能进行。利用分子标记,可以对这类需要大量样品、通过精细实验室检测才能确定的性状进行微量和非常规的分析。理论上,在条件满足时,上述所有的评价和选择可以利用从植物组织提取的少量DNA通过分子标记分析一步完成全部检测[39]。20世纪80年代到21世纪20年代,分子标记检测技术发生了革命性的变化,经历了从凝胶电泳到荧光检测、固相芯片和液相芯片的4G发展过程;而测序技术作为最根本的检测方式贯穿始终,有可能最终取代所有的其他检测技术[40,41]。检测系统本身经历了从凝胶电泳到芯片和测序的提升,检测的通量从单个标记发展到成千上万个标记的同步检测,检测分辨率从10—30 cM一个标记提高到一个基因内包含多个标记或单倍型,检测成本从过去的一个数据点几美元降低了万分之一美元或更低。
基于分子检测的基因型鉴定是分子育种的核心技术,也是现代种业必不可少的育种工具。目前广泛应用于育种的基因型检测方法主要包括以Affymetrix和Illumina为代表的固相基因芯片技术[42,43]、以LGC和Douglas为代表的微流控技术[44,45]以及荧光单标记检测技术。这些主导技术均为国外知识产权,定价权完全掌握在国外公司手中,国内服务商采购后加上检测服务费用,导致高密度固相芯片等的检测成本远远超出中国育种机构或公司所能够承受的上限。例如,基于固相芯片的55K SNP标记,其单个样品的分析成本可高达300—500元。对于一个中小公司来说,花费30万—50万元研发经费,最多只能分析1 000个样本,也就是相当于1—3个育种群体,导致难以大规模用于分子育种实践,只能用于国家经费支持的探索性研究和少数示范性项目。近二十年来,国际商业育种巨头通过高度的技术集成和大规模的商业化应用,大大降低了单个样本的分析成本,实现了分子检测技术的常规化应用。相比之下,分子检测技术在中国育种中的应用尚处于起步阶段。虽然多数种业企业及育种家已经逐步了解并意识到该技术的巨大潜力,并具有强烈的应用意愿,但由于中国种业公司规模小,投入研发的资金有限,技术平台薄弱等限制因素,导致分子育种应用进展缓慢。国家和企业投资兴建的分子育种检测平台也因为检测成本高昂未能发挥预期的作用。为了推动中国种业创新,提高种业竞争力,发展高效低成本的检测技术至关重要。因此,需要建立技术和成本均符合中国种业现状的分子检测技术服务体系。分子检测平台的建设目标是将单个样本检测的成本降低到表型鉴定的成本以下(20—30元/样品),让每个中小公司的年研发费用可以用于10个以上群体的分子检测。
近年来,中国在液相芯片检测领域实现换道超车,一举突破了成本、平台和知识产权的三重制约,在大幅度降低分子标记检测成本的同时,实现了检测平台仪器设备的标准化和分析试剂的国产化。石家庄博瑞迪生物技术有限公司开发的靶向测序基因型检测(GBTS)技术,通过GenoPlexs可以实现高达5 000对标记引物高度均一的多重PCR靶向扩增。基于液态探针捕获的靶向测序-液相芯片基因型检测技术GenoBaits,可以实现高达40K个标记检测在一个反应中完成。同时可在每一靶向目标区域内捕获多个SNP(multiple SNP,mSNP),使最大单次标记检测数增加到40K mSNP(260K SNP)。该技术可以实现一款多用,即通过控制测序深度,采用同一套标记,可以获得1K—260K不同数目的SNP标记。在相同标记和样本数目下,其价格显著低于国外同类产品[46]。GBTS适合于所有生物,包括动物、植物、微生物[41]。利用GBTS技术,现已开发了玉米20K SNP GBTS标记,并获得成本效益最大化的10K、5K和1K标记集[47]。利用来自中国、美国、CIMMYT的96份代表性玉米自交系和387份育种计划产生的中间材料、育成品系进行检测,确定了获得不同标记数目所需的测序深度。
与其他分子检测平台和技术相比,基于液相芯片的GBTS技术具有多重技术优势[41]。(1)平台广适性:适合所有二代和三代测序系统,包括Illumina、Ion Torrent和MGI,并预期将与下一代测序或其他检测设备兼容。(2)标记灵活性:适合各种标记类型,包括SNP、短SSR、长/短InDel、已知融合基因、甲基化位点等;适合不同的标记密度;一款多用。可以广泛利用单倍型、LD区段和其他标记衍生物。(3)检测高效性:可以进行样本和标记的多重化;开发和升级简便;设计、测试和检测成本低。随检测技术进步,可以实现检测的自动化、智能化和超高通量。(4)信息可加性:数据重复率高,缺失数据少;不同时间、地点、项目间的数据具有可比性和累加性;数据整合度高。且信息可加性程度随技术进步而增强。(5)支撑便捷性:不依赖专业化的生物信息团队,可以采用通用而简化的实验室信息管理系统进行信息的整合、处理和分析。且随着技术进步,信息管理将更加便捷、快速、智能。(6)应用广普性:广泛应用于动物、植物、微生物及其互作群体的进化、遗传、育种、 知识产权保护等领域。随着海量信息的累积,将拓展在群体生物学、生态学等领域的应用。目前来看,GBTS的缺点是无法达到固相芯片所能实现的标记的超高密度,不适合高精度的GWAS分析。
基于GBTS的植物液相芯片系列产品及其分子检测技术平台将在动植物分子育种中发挥重要作用。在南繁育种中,可广泛应用于亲缘关系分析、分子标记辅助选择、基因组选择、品种身份鉴定、品系和杂交种纯度检测等领域[41](图3),从而极大地提升育种相关的异地评价和选择。依赖GBTS技术,可以打造高效、低成本的分子育种全产业链服务模式。
图3
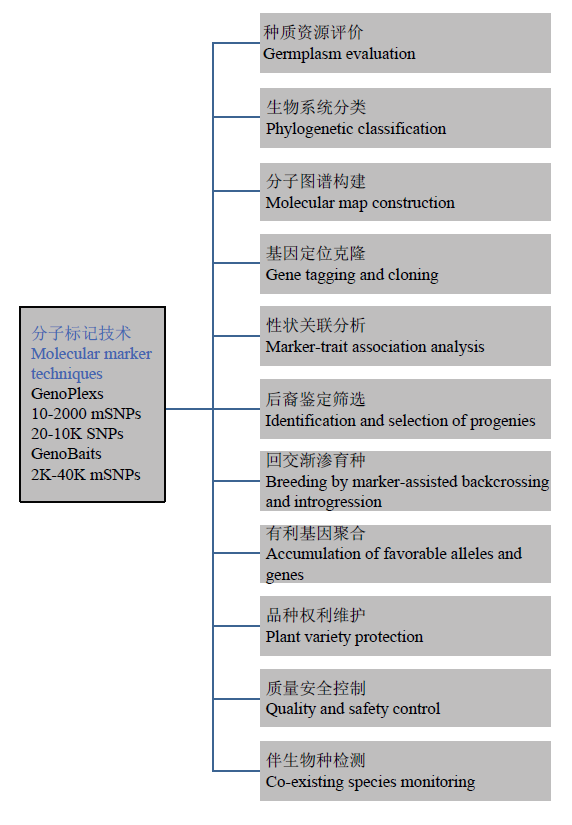 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3靶向测序-液相芯片技术在南繁种业转型升级中的应用
Fig. 3Applications of genotyping by target sequencing and liquid chip in transformation and upgrading of Hainan off-season breeding industry
作为综合育种技术体系的一部分,在海南等南繁基地搭建的分子检测平台,将为包括热带作物在内的主要农作物开发和应用不同系列和标记密度的SNP标记,推动长期被忽视的小宗作物、特种经济作物的遗传评价和分子育种。分子标记辅助育种技术的全方位大规模使用及其抗病抗虫抗逆新品种的培育,将减少目标作物产地农药和化肥的施用,提高南繁基地的使用效率,同时避免其过度使用和生态条件的恶化。
6 南繁种业转型升级之综合育种体系
6.1 综合育种体系
南繁种业转型升级需要建立完整的综合育种技术体系,也就是将各种现代育种技术整合在一起形成一条完整的链条[48]。综合育种技术体系涉及多种育种方法的综合应用,包括常规育种程序以及在此基础上整合各种现代育种技术和方法及其优化和组合形式,主要包括DH育种、GS、快速育种、基因编辑和转基因。随着各种技术的综合应用,育种周期缩短、遗传增益提升、育种效率提高、投入产出比增加(图4)。整合多种方法和技术的育种体系将变每年南繁1代为每年南育多代,同时大大降低品种的培育成本。图4
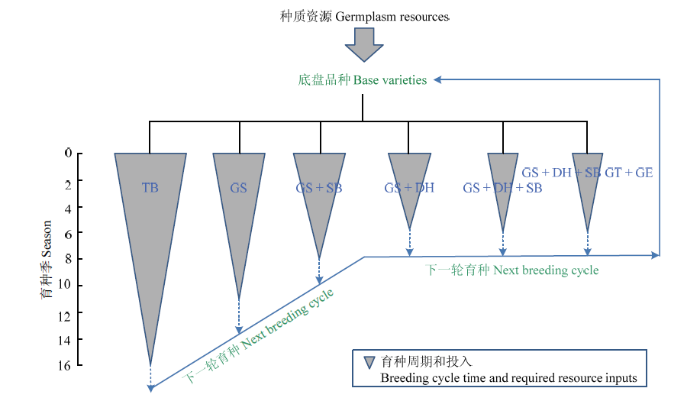 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4实现南繁育种转型升级的综合育种策略及其效率
比较了几种不同综合育种策略在海南基地的育种周期和单个品种育种所需的资源投入(包括时间、土地、人工等)。TB:传统育种;GS:基因组选择;SB:快速育种;DH:双单倍体育种;GT:转基因;GE:基因组编辑
Fig. 4Integrative breeding strategies required for transformation and upgrading of Hainan off-season breeding industry and their efficiencies
Several integrative breeding strategies are compared for their breeding cycle times and required resource inputs (time, land and lab, etc.). TB: Traditional breeding; GS: Genomic selection; SB: Speeding breeding; DH: Double haploid breeding; GT: Gene transfer; GE: Genome editing
综合育种技术体系的重要元件之一是高效育种设施,即在现代化设施和装备条件下培育适合自然条件下和设施农业种植的新品种。高效育种设施包括三大要素,一是设施农业,即通过控制植物生长发育的各种外界条件来提高资源利用效率和作物生产效率并保护环境。荷兰和以色列等国通过设施农业创造了花卉和农产品出口的奇迹。这种高效的设施农业提高了作物产量和资源利用率,降低了污染和环境影响,同时改进了产品质量(包括一致性、清洁程度、生产规模、时效且不依赖季节)。这些高端的设施农业需要优质水分和空气、污水处理、自动化和监测系统、人工智能等的支撑。未来育种需要满足设施农业条件下的作物生产需求和特定条件的作物产品[22]。高效育种设施的第二要素是现代化的育种设施和装备,包括试验和测试的全程机械化和自动化,以日益减少对人工的依赖,提高效率,降低成本,同时缓解南繁用工荒。第三要素是基于种子DNA的分子检测技术[49],即建立适合多种作物大规模和常规化种子DNA分析和检测技术,从而在播种前完成分子标记辅助选择,淘汰大部分需要进行田间测试的材料,以提高南繁基地的土地使用效率。高效育种设施的建立将更加经济有效地利用各种南繁资源,包括生态资源、土地资源、人力资源和平台设施。
第二个需要整合到综合育种体系的技术是近年来发展的快速育种(图4)。快速育种主要是通过调节光照和温度等条件迫使植物以最快速度完成其生长发育过程,以大大缩短其生育周期,从而加快育种进程[18]。
快速育种通常是在前述设施农业的条件下实现的。与自然条件下的温室相比,快速育种能够将小麦、大麦、鹰嘴豆、油菜的每年2—3代增加到4—6代。这一概念目前已经扩展到通过调节影响生长发育的所有基因,针对同一作物的不同基因型设置特定的环境条件和生长调节因子,实现其快速生殖生长[50]。更进一步,通过获得促进植物快速生长发育的最佳基因组合或单倍型,实现与分子标记辅助选择相结合的快速育种。
第三类需要整合的育种技术是转基因和基因编辑技术(图4)。在顶尖跨国公司,转基因早已成为整个育种链条的一部分,通常将最好的育种材料作为“底盘”品种用于转基因,站在“巨人的肩膀上”添砖加瓦。由于不同材料转化能力的差异,通常只用一些组织培养特性好的材料作转化系。由于转化系的某些农艺性状可能不够理想,通常采用转化的材料作供体,通过标记辅助的回交,把转基因性状转移到最好的育种材料中去。目前,大型跨国公司通过大规模分子标记辅助的回交育种,将2—7个转基因同时导入数百个不同的品系,以获得与轮回亲本高度相似的育成品系(吴坤生2017,私人通讯)。与转基因一样,基因编辑技术也较容易整合到南繁育种程序中。基因编辑所产生的优异变异也可以通过分子标记辅助的回交转移到遗传背景优良的材料中去。此外,分子标记技术亦可用于转基因转化体的检测和在基因编辑过程中大规模筛选和鉴定目标基因组区域的特定变异。
DH技术是第四类应该被整合的育种技术(图4)。采用DH育种技术,通过单倍体的诱导和加倍,可以在2代的时间内完成常规育种8—10代才能达到的稳定和纯合状态。采用胚拯救和组织培养技术可以在较小的实验室空间完成大规模的单倍体诱导和加倍,从而通过对少量材料的加倍实现常规育种条件下需要大面积繁殖和选择才能获得的稳定和纯合材料,因而极大地提高了育种效率。另一方面,对大规模稳定纯合育种材料进行分子标记辅助筛选,可以代替田间表型评价以大量淘汰不符合育种目标的DH系。结合基于种子DNA的分子标记检测,甚至可以在播种前进行DH系的筛选和评价,只保留符合育种目标的DH系。这种大规模实验室和播种前的筛选和淘汰技术特别适合于在土地资源有限的南繁育种中采用。
第五类可以整合到综合育种体系的技术是全基因组选择(图4)。该技术已广泛应用于动植物的遗传改良,特别适合复杂性状的异地选择。为了品种的环境和生态适应性,只能一个季节在本地、一个季节在异地,交替进行复杂性状的常规选择。通过全基因组选择,可以在本地构建目标性状的遗传模型,建立性状和标记之间的预测关系。然后在异地根据材料的分子标记基因型对其目标性状进行预测,从而实现异地选择。这种本地和异地交替进行的全基因组选择模式可以在育种实践中通过育种群体和数据的累积而不断完善和优化,以获得适合异地选择的全基因组选择方案。借助于全基因组选择,还可以进行连续的异地选择,将育种程序从本地一季、异地一季改变为本地一季、异地两季或多季,从而大大加快育种进程,提高育种效率。
6.2 资源共享的开源育种模式与应用
分子标记辅助育种、全基因组选择、转基因、基因编辑等在国际跨国公司已经成为常规的分子育种技术。中国由于组学支持的商业化育种起步较晚,动植物育种还分散在大学、科研机构和数目众多的中小公司。大学和研究机构现有的分子育种主要是国家项目支持下的示范性研究,无法大规模推广使用。中小种业公司因为规模小而缺乏效率,也难以实现分子育种的常规化。借鉴国际跨国公司管理大量育种站和育种项目、分享信息和资源的实践,可以考虑在中小育种公司或公共育种单位实施开源育种策略,即把各个分散的中小育种单元看作大公司下的一个育种团队或育种站, 实施与大公司内部一样的育种程序以及资源和信息共享的策略[51],以部分实现跨国种业内部的共享机制, 提高育种效率。在南繁育种中, 通过整合中小公司和育种单位之间的资源和信息, 可以实现开源育种模式下的联合育种。在国际上已经倡导和实施了开源育种计划。国际农业研究磋商组织(Consultative Group for International Agricultural Research,CGIAR)与康奈尔大学等单位合作,建立了基因组开源育种信息联盟(Genomic and Open-source Breeding Informatics Initiative,GOBii;(http://cbsugobii05.biohpc.cornell.edu/wordpress/)和卓越育种平台(Excellence in Breeding Platform, EiB)[52], 以推动基于信息平台的开源育种。在中国,已经有几个正在尝试中的类似于开源育种的项目。一是通州国际种业公司牵头组织的全基因组选择计划,组织大学、科研单位和种业公司联合开展玉米百个群体的全基因组选择, 采用共享的数据构建全基因组选择模型。二是玉米育种企业和科研单位自发组织起来成立的“中科玉九所联盟”。该联盟从2014年开始每年一月在海南省乐东县九所镇举行“九所玉米育种大会”,共享育种技术和平台,交流育种经验、分享育种材料,开展新品种联合测试。这类开源育种模式,通过共享资源和信息, 所得结果可以反馈给信息和模型构建系统, 以不断优化育种技术和选择模型。
6.3 跨动植物的共性技术、平台和应用
长期以来“动、植物遗传育种”分为相互独立和分割的两家,双方存在极少的交流和共享。这种分化反映在国家科研规划和项目的建立和实施、动植物育种专业会议的举办、专业和专家有关的微信群的交流、相关专家的朋友圈和人脉关系、动植物育种人才的培养、动植物育种和产业的成果鉴定等方面。尽管在动植物育种相关的基础领域,比如数量遗传学领域,存在比较微弱的共享和交流,但大体上也是貌合神离,缺乏充分交流和沟通。在动植物育种分化为两大类群的同时,动物和植物内部也存在很大程度的分化和隔离。例如,在分子植物育种领域,主要的学术交流和活动都以物种或生物类群为基础进行细分,由主要学会下属的相关分会组织交流。在动植物之间,完全缺乏有效的交流渠道,更没有技术、平台和资源等的共享。为推动中国动植物育种的现代化和商业化,为在现阶段追赶国际跨国育种公司,急需在全国范围内建立共享的动植物分子育种体系,以解决中国动植物育种规模小、效率低、技术落后、设备和平台分布不平衡且使用不到位等关键问题。构建全国动植物分子育种共享技术和平台,可以聚合全社会的力量,以解决动植物分子育种领域的共性理论、技术、平台和应用问题。在南繁作物育种中,建议发展跨作物的分子育种方法(基因编辑获取DH系)、技术(全基因组选择)和平台(液相芯片检测)。统筹和协调南繁分子育种资源、平台和设施,以提高建设和投资效率。同时建立统一的分子育种培训和技术保障体系。近年来,在动植物领域专家的共同努力下,召开了每年一次的前沿分子育种技术研讨会。在第一次研讨会(2019年5月15—17日,北京)上,发布了“动植物分子育种共性技术和平台合作联盟”倡议书。期待建立动植物分子育种联盟,开展共性理论的探讨,共性技术的开发,共性平台的构建,共性应用的实践。鉴于海南贸易岛的建设包括动植物引进中转基地,跨动植物的共性技术、平台和应用将推动海南种业向动植物融合的领域发展。
6.4 资源引进、监测和评价
南繁科学研究基地的建设将围绕动植物育种科技、国际种业贸易、种质资源产权交易、生态土壤肥料、种业知识产权交易、热带特色农科等六大方面展开。为打造面向世界的一流全球动植物种质资源引进中转基地,需要在资源引进、监测和评价中广泛采用分子检测技术。分子检测技术在这些领域的应用也将成为南繁种业综合育种体系的一部分。要采用分子检测技术,对引进资源中的各种伴生生物和病虫草害等进行监测;要结合表型和环境适应性鉴定,进行生物学特性和遗传变异的全基因组评价(图3)。例如,理论上,可以针对不同病虫害的生物种群或小种开发特异性的分子标记。采用一套2K的分子标记,有可能从混合样本中检测同一病虫害的多个不同生理种群或小种,或者多种不同的病虫害类型。对不同环境下采集的病虫害样本进行全方位检测,将有助于了解病虫害的发生、发展、变异和流行规律,从而制定合理的病虫害管理和防治措施[41]。6.5 资源指纹图谱、品种保护和种子质量和纯度检测
DNA指纹图谱库将成为未来重要的遗传资源。建立中国推广品种高密度、可比性强、数据可以累加和共享的高精度DNA指纹数据库,将为品种保护制度与国际接轨提供技术支撑,为品种资源交流的规范化提供保障。DNA指纹图谱数据可为育种亲本的亲缘关系提供依据,为全基因组选择育种提供背景信息,为品种保护和新品种查重、DUS鉴定等提供参照数据。通过上述开源育种和资源共享所培育的新品种,可根据材料的指纹图谱,推断不同材料对新育成品种的遗传贡献,从而根据遗传贡献的大小进行利益的分享。因此,未来的资源共享可以在全基因组指纹图谱构建和品种保护的前提下,完全实行开放式,即任何育种单位和个人都可以获得他人记录在案的育种材料用于育种或选择,只要根据指纹鉴定结果,依据亲本贡献大小按比例分享育成品种的收益即可。传统的品系和杂交种纯度鉴定方法是通过田间种植,根据表现型来进行评价和估计。为了赶在本地种植季节前完成纯度鉴定,海南成为很多作物种子纯度鉴定的基地。现已建立了一套基于DNA分子标记的纯度鉴定方法。采用近百个SNP标记对近200粒种子(大粒物种)或幼苗叶片(小粒物种)进行多重PCR和多重样本(sample-plex)检测,就能高效低成本地快速检出杂交种子的纯度。同时,采用数量更多的分子标记,还能鉴定亲本纯度以及外来花粉导致的其他混杂基因型。这种不依赖于田间表型评价的种子纯度鉴定将节省大量的耕地,使有限的南繁基地可以更多地用于育种材料的评价和选择。
7 总结:分子植物育种助推南繁种业转型升级
南繁种业转型升级所涉及的领域目前已经取得了如下重要进展:(1)倡导了支撑异地选择的环境型鉴定新概念。(2)建立和优化了作物基因组选择系统。(3)通过九所育种联盟开启了植物开源育种模式。(4)与CIMMYT等国际农业研究机构的长期合作打通了通向东南亚的国际合作育种的通道。(5)动植物共享分子育种平台的倡议为平台和资源共享提供了模式。(6)大规模基因克隆和功能标记的开发,为主基因性状分子标记辅助的异地选择奠定了基础。(7)高效低成本国产化分子检测技术体系的开发,为在海南建立分子检测技术平台、服务南繁育种奠定了基础。搭建高通量分子育种技术平台,将带动分子检测和育种在海南和南繁基地的广泛应用,推动南繁工作从低价值的繁种加代向高价值的繁殖+品种选育转化,进一步提升海南和南繁基地在中国种业发展中的战略地位。特别是将超低成本的液相芯片技术与基因组选择、快速育种、转基因、基因编辑、合成生物学等技术相结合,将导致育种领域的革命。通过多重学科和多种技术的交叉融合,推动作物育种向定向生物合成、分子设计、大数据和人工智能辅助的新一代育种模式转变。利用海南省三亚的地理优势,不难实现每年4—5个育种世代的快速育种。综合育种平台和快速育种流程的建立必将推动三亚发展成为中国种业之都,并为海南经济的发展创造新机遇。本文的讨论主要针对植物育种,但相关的分子育种理论、技术、平台和应用也适合其他生物,包括畜禽、水产等领域的生物种业和南繁育种。
致谢
感谢以下项目的资助:山东省省级科技创新基金和潍坊市“一事一议”人才引进项目;中国农业科学院农业科技创新计划;中国农业科学院作物科学研究所中央非公益类基础研究项目;比尔盖茨基金会、CGIAR MAIZE项目。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1038/s41587-019-0152-9URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s10681-007-9480-9URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
北京: 中国农业出版社,
[本文引用: 1]
Beijing: China Agriculture Press,
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.2174/138920212800543066URL [本文引用: 1]
DOI:10.1071/CP14007URL [本文引用: 2]
DOI:10.1007/s00122-016-2691-5URL [本文引用: 3]
DOI:10.1038/s41477-017-0083-8URL [本文引用: 2]
DOI:10.1016/0167-7799(94)90102-3URL [本文引用: 1]
DOI:10.1146/annurev-arplant-081519-035916URL [本文引用: 1]
DOI:10.1126/science.1231143URL [本文引用: 1]
DOI:10.1038/s41580-020-00288-9URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1038/nmeth.2926URL [本文引用: 1]
DOI:10.1016/S1360-1385(03)00134-1URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.3724/SP.J.1006.2011.00191URL [本文引用: 1]
DOI:10.3724/SP.J.1006.2011.00191URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
DOI:10.1016/j.molp.2018.11.013URL [本文引用: 1]
DOI:10.1016/j.molp.2020.10.007URL [本文引用: 1]
DOI:10.1126/science.abb3377URL [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
DOI:10.1038/s41588-020-00769-9URL [本文引用: 1]
DOI:10.3389/fpls.2019.00288URL [本文引用: 1]
DOI:10.1007/s11032-012-9699-6URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 5]
[本文引用: 5]
DOI:10.1007/s11032-017-0622-zURL [本文引用: 1]
DOI:10.1111/pbi.v18.6URL [本文引用: 1]
DOI:10.1007/s11032-013-9917-xURL [本文引用: 1]
DOI:10.1186/s12864-015-2180-2URL [本文引用: 1]
[本文引用: 1]
DOI:10.1007/s11032-019-0940-4URL [本文引用: 1]
DOI:10.1093/jxb/erx135URL [本文引用: 1]
DOI:10.1007/s11032-008-9192-4URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.3389/fpls.2020.00353URL [本文引用: 1]
