 ,, 刘语诺, 王兆昊, 彭爱红
,, 刘语诺, 王兆昊, 彭爱红 ,, 陈善春, 何永睿
,, 陈善春, 何永睿 ,西南大学柑桔研究所,重庆 400712
,西南大学柑桔研究所,重庆 400712Analysis of Resistance Mechanism of CiNPR4 Transgenic Plants to Citrus Canker
ZHANG JingYun ,, LIU YuNuo, WANG ZhaoHao, PENG AiHong
,, LIU YuNuo, WANG ZhaoHao, PENG AiHong ,, CHEN ShanChun, HE YongRui
,, CHEN ShanChun, HE YongRui ,Citrus Research Institute, Southwest University, Chongqing 400712
,Citrus Research Institute, Southwest University, Chongqing 400712通讯作者:
责任编辑: 岳梅
收稿日期:2021-02-7接受日期:2021-04-25
| 基金资助: |
Received:2021-02-7Accepted:2021-04-25
作者简介 About authors
张婧芸,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1402KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
张婧芸, 刘语诺, 王兆昊, 彭爱红, 陈善春, 何永睿. 转CiNPR4基因柑橘抗溃疡病的机制解析. 中国农业科学, 2021, 54(18): 3871-3880 doi:10.3864/j.issn.0578-1752.2021.18.007
ZHANG JingYun, LIU YuNuo, WANG ZhaoHao, PENG AiHong, CHEN ShanChun, HE YongRui.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】柑橘溃疡病是由柑橘黄单胞菌柑橘致病亚种(Xanthomonas citri subsp. citri,Xcc)引起的细菌性病害,流行于世界主要柑橘产区,每年给柑橘产业造成高达数亿美元的经济损失。柑橘溃疡病由于危害大、传播快、难防治,是国内外重要的检疫性病害[1,2,3]。培育并推广抗溃疡病的优良柑橘新品种是防治柑橘溃疡病最根本和最有效的途径,对柑橘产业的健康稳定发展具有十分重要的意义。【前人研究进展】利用抗溃疡病的柑橘品种与易感品种进行有性杂交,从杂交后代中筛选出抗溃疡病的后代,是培育抗溃疡病柑橘品种的途径之一[4]。但由于柑橘类果树的遗传背景高度杂合,基因间紧密连锁、珠心胚干扰等原因,使得杂交育种的效率较低,难以培养出抗溃疡病的优良柑橘新品种。近年来,植物基因工程的迅速发展为柑橘品种改良开辟了一条新途径,使短期内进行柑橘品种的定向改良成为可能[5,6]。植物受到病原物侵染后体内的水杨酸(salicylic acid,SA)水平上升,并由病原物侵入点向周围进行扩散,诱导植物产生系统获得性抗性(systemic acquired resistance,SAR)[7,8]。在SA介导的SAR途径中,病程相关基因非表达子1(non-expressor of pathogenesis-related genes 1,NPR1)以及两个NPR1同源物NPR3和NPR4参与了植物对病原物的防御反应[9,10,11]。植物细胞感知SA信号后,细胞内的氧化还原势发生变化,NPR1在细胞质中由寡聚体变成单体,并在其C-末端核定位信号的介导下向细胞核中进行移动。在细胞核中,NPR1与TGA转录因子结合,促进病程相关基因(pathogenesis-related gene,PR)的表达,增强植物对病原物的抗性[12,13]。通过导入拟南芥(Arabidopsis thaliana)的NPR1(AtNPR1)已获得了抗溃疡病和黄龙病的转基因柑橘[14,15]。AtNPR1与甜橙基因组中的CtNH1具有较高的同源性,通过超表达CtNH1提高了柑橘对溃疡病的抗性[16]。进一步的研究表明,超量表达AtNPR1或CtNH1组成型均提高了与防御反应相关的基因如CsPR1、CsPR2或Chi1的表达。不同于AtNPR1,AtNPR4调控植株防御反应的方式具有争议性,LIU等[17]利用反向遗传学,在研究AtNPR4的功能时发现,AtNPR4突变体npr4-1对丁香假单胞菌DC3000(Pseudomonas syringe pv. tomato DC3000)敏感;且NPR4正向调控SA和茉莉酸(jasmonic acid,JA)分别诱导的防御反应相关基因PR1和PDF1.2的表达。这些结果表明,AtNPR4正向调控了拟南芥对丁香假单胞菌DC3000的抗性。而另一个AtNPR4突变体npr4-3受丁香假单胞菌ES4326(Pseudomonas syringae pv. maculicola ES4326)和卵菌(Hyaloperonospora parasitica Noco2)诱导后,其抗性或敏感性水平并没有发生变化;但AtNPR3/4双突变体npr3-1/npr4-3却表现出比AtNPR3单突变体npr3-1更高的PR1表达水平和更强的抗丁香假单胞菌ES4326和卵菌特性,因而推测AtNPR4负向调控了植株的防御反应[18]。DING等[11]在拟南芥原生质体中超量表达AtNPR4,防御反应相关基因SARD1和WRKY70的表达水平受到了抑制,进一步证明了AtNPR4对植株防御反应的负向调控。耐黄龙病的‘Jackson’葡萄柚受到柑橘黄龙病菌侵染后,其体内的一个CiNPR4(Ciclev10031749m)上调表达[19]。研究表明,在甜橙中导入CiNPR4增加了转基因植株对柑橘黄龙病的抗性。转录组分析证实,黄龙病抗性增强的CiNPR4转基因植株中与防御反应相关的基因上调表达。这些结果表明超量表达CiNPR4提高了柑橘的内在免疫力[20]。【本研究切入点】异源表达拟南芥AtNPR1能够同时提高转基因柑橘对溃疡病和黄龙病的抗性。但AtNPR4正向还是负向调控植物防御仍具有争议性,柑橘CiNPR4与柑橘溃疡病抗性相关性鲜有研究。【拟解决的关键问题】以过表达抗黄龙病基因CiNPR4转基因晚锦橙(Citrus sinensis Osbeck)为材料进行溃疡病抗性评价,探讨CiNPR4在柑橘溃疡病菌生物胁迫信号途径中相关激素应答和抗性诱导的相关性,明确CiNPR4对柑橘溃疡病的抗性机理。1 材料与方法
1.1 植物材料
供试7个CiNPR4转基因株系(N1、N2、N8、N12、N20、N21和N28)[20]以及野生型(WT)晚锦橙均来自于西南大学柑桔研究所国家柑桔品种改良中心。试验于2020年4月开始,在西南大学柑桔研究所国家柑桔品种改良中心完成。1.2 CiNPR4转基因植株的溃疡病抗性评价
在进行溃疡病抗性评价前3 d,将Xcc菌株YN1(本实验室保存)在LB固体培养基上活化[21]。接种前1 d,挑选活化的Xcc置于LB液体培养基中,在220 r/min、28℃的摇床上振荡培养过夜。用紫外光分光光度计测量菌液的OD600值。用LB液体培养基稀释菌液,使其OD600值为0.1,继续在上述培养条件下振荡培养至OD600值为0.5。菌液置离心管中,在离心机上以5 000 r/min离心10 min,弃上清,收集菌体。加入与上清液等体积的无菌水重悬。将菌液进行连续梯度稀释1 000倍(5×105 cfu/mL)备用。选取完全展开的6个月叶龄CiNPR4转基因株系和WT植株的叶片,无菌水洗净,平铺至150 mm的培养皿中,并在叶柄处放置一块充分吸水的脱脂棉。用针头(0.5 mm)在叶脉分左右两边针刺叶片,每边针刺相同孔数,每个针孔接种1 µL上述Xcc稀释菌液。培养皿用Parafilm膜封口,于28℃、光照16 h·d-1的培养箱中培养。每天观察一次发病情况,接种后10 d观察病情并拍照。用ImageJ软件统计叶片接种点处溃疡病斑的面积。相对抗病率=转基因植株的病斑面积/WT植株的病斑面积[22]。试验3次重复。Xcc生长曲线的分析参照PENG等[22]的方法进行。分别于接种后0、1、3、5、7和9 d用直径为0.5 cm的打孔器取下转基因植株和WT植株接种区域的叶圆片,3个叶圆片为一组,放入1.5 mL的离心管中,加入200 µL的无菌水,捣碎,定容至1 000 µL,连续梯度稀释,取50 µL的菌液涂布LB平板,28℃培养2 d,统计菌斑个数。每平方厘米叶片组织中的Xcc细胞=(菌斑个数×稀释倍数×1000)/[50×π(直径/2)2 ×3]。试验3次重复。
1.3 内源SA和JA含量的测定
按上述1.2中的方法准备OD600值为0.5的Xcc菌液。采取健康的转基因植株和WT植株充分展开的叶片,参照DUAN等[23]的方法将OD600为0.5的Xcc菌液用1 mL去针头的注射器接种转基因植株和WT植株叶片,于28℃、光照16 h·d-1、相对湿度85%的培养箱中培养。接种后0、3和5 d分别采集0.5 g的叶片。叶片收集后迅速用液氮速冻,用植物激素SA和JA酶联免疫试剂盒(Sinobestbio,上海,中国)分别测定SA和JA的含量。SA和JA含量测定由赛诺生物科技有限公司(上海,中国)完成。试验3次重复。1.4 RNA的提取和表达分析
按照上述1.3中的方法对CiNPR4转基因植株和WT植株的叶片进行Xcc接种。分别收集未处理和接种Xcc 后0、3和5 d的叶片50 mg,叶片收集后迅速投入液氮中,利用RNA快速提取试剂盒(RN09,Aidlab,北京,中国)提取总RNA,方法参照说明书。对RNA样品浓度和质量测定后,将500 ng的RNA用iScriptTM cDNA Synthesis Kit试剂盒反转录成cDNA。使用ABI 7500荧光定量PCR仪(PE Applied Biosystems,Foster City,CA,USA)进行CsPR1和CsPDF1.2的表达分析。CsPR1、CsPDF1.2和内参基因Actin的表达分析引物见表1。反应体系(12 µL):6 µL荧光染料试剂iTaqTM Universal SYBR® Green Supermix(Bio-Rad,Hercules,CA,USA),上、下游引物各0.3 µL,cDNA模板1 µL,加ddH2O至12 µL。采用2-ΔΔCt法[24],以各自健康的植株为参照,Actin为内参基因,分别计算相应的转基因植株和WT植株感病后的CsPR1和CsPDF1.2表达水平。试验3次重复。Table 1
表1
表1本研究所用引物
Table 1
| 引物名称 Primer name | 引物序列 Primer sequence (5′→3′) | 用途 Usage |
|---|---|---|
| CsPR1-f | AAATGTGGGTGAATGAGAAAGC | CsPR1的表达分析 Expression analysis of CsPR1 |
| CsPR1-r | ATTATTGTTGCACGTCACCTTG | |
| CsPDF1.2-f | CAGTGGCAGAAGCAAAACAA | CsPDF1.2的表达分析 Expression analysis of CsPDF1.2 |
| CsPDF1.2-r | CCGGGGAAGTCGTAGTGGC | |
| Actin-f | CATCCCTCAGCACCTTCC | 柑橘actin的表达分析 Expression analysis of citrus actin |
| Actin-r | CCAACCTTAGCACTTCTCC | |
| CiNPR4-f | CATGGAGGCCGAATTATGGTTGAGAAGGCTCTCGTGG | CiNPR4的cDNA扩增 Amplification of cDNA from CiNPR4 |
| CiNPR4-r | GGATCCCCGGGAATTTTAATTGCTCGCTGCCGAGG | |
| CsTGA2-f | GCCATGGAGGCCAGTGAATTCATGGAGAATGCTGTTGACCT | CsTGA2的cDNA扩增 Amplification of cDNA from CsTGA2 |
| CsTGA2-r | GCAGCTCGAGCTCGATGGATCCTCACTCCCGTGGCCGGGCCA | |
| CsTGA6-f | GCCATGGAGGCCAGTGAATTCATGCCGAGCTTTGATTCTC | CsTGA6的cDNA扩增 Amplification of cDNA from CsTGA6 |
| CsTGA6-r | GCAGCTCGAGCTCGATGGATCCTCACTCTCTTGGGCGGGC |
新窗口打开|下载CSV
1.5 酵母双杂交分析
根据CiNPR4蛋白与TGA转录因子相互作用网络,预测CiNPR4分别与Ciclev10005080m和Ciclev10001081m基因编码的蛋白互作[19]。以甜橙为参考基因组,将这两个基因在https://www. citrusgenomedb.org/网站上进行blastx分析[25],找到与Ciclev10005080m和Ciclev10001081m基因编码的氨基酸序列相同或者相似性较高的基因,这些基因所编码的蛋白为候选蛋白。以CiNPR4的cDNA序列设计引物对CiNPR4-f/ CiNPR4-r(表1),以pUC57:CiNPR4质粒(本实验室保存,此质粒含有CiNPR4的cDNA序列)为模板,扩增获得CiNPR4的cDNA序列。对酵母载体pGBKT7进行EcoR I单酶切,回收产物与CiNPR4的cDNA序列通过同源重组试剂盒(Cat639648,TaRaKa,大连,中国)进行同源重组并进行测序验证,cDNA序列正确的质粒确认为诱饵质粒pGBKT7: CiNPR4。
根据与CiNPR4互作的候选蛋白的cDNA序列以及pGADT7质粒序列,以EcoR I和BamH I为酶切位点,按上述方法设计同源重组引物(表1)。按照上述1.4中的方法提取WT植株的RNA,并反转录成cDNA。以晚锦橙的cDNA序列为模板,利用同源重组引物对分别进行扩增。参照上述诱饵质粒的构建方法将候选蛋白的cDNA序列插入pGADT7中,获得猎物质粒pGADT7:候选蛋白。
诱饵质粒和猎物质粒在酵母菌株Y2HGold中的共转化以及共转化子的筛选参照Matchmaker® Gold Yeast Two-Hybrid System(TaKaRa)试剂盒的操作方法进行。此试剂盒中包含载体pGBKT7和pGADT7、酵母菌株Y2HGold、标准的阳性对照(pGBKT7-53和pGADT7-T)和阴性对照(pGBKT7-Lam和pGADT7-T)。
1.6 数据处理
数据使用IBM SPSS 19统计学软件(SPSS Inc.,Chicago,IL,USA)进行邓肯方差分析,结果以平均值±标准差显示,P<0.05表示差异显著。2 结果
2.1 CiNPR4转基因植株的溃疡病抗性分析
对7个转基因株系(N1、N2、N8、N12、N20、N21和N28)进行溃疡病的离体抗性分析。针刺法离体接种Xcc,以WT植株为对照,3 d后转基因植株和WT植株叶片针刺点有轻微的损伤,针刺孔中有白色且形似愈伤样的组织。随着感染时间的延长,白色愈伤样的组织突出针刺孔,但不同的转基因株系白色愈伤样组织团的大小存在差异(图1-A)。接种Xcc 10 d 后,统计植株叶片针刺点的病斑面积,转基因株系N1、N2、N12、N21和N28的叶片溃疡病病斑面积显著低于对照(图1-B)。根据病斑面积计算相对抗病率后显示,转基因株系N8和N20与WT的相对抗病率无显著性差异,但N1、N2、N12、N21和N28转基因株系的相对抗病率显著低于WT植株,分别为WT植株的79.3%、58.5%、65.4%、49.3%和55.6%(图1-C),表明过表达CiNPR4能够显著提高晚锦橙对柑橘溃疡病的抗性。图1
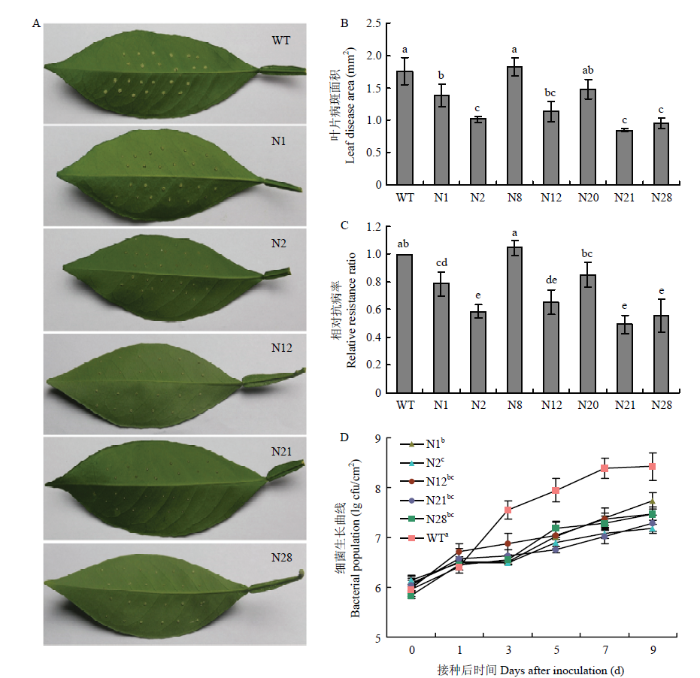 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1CiNPR4转基因植株的溃疡病抗性评价
A:Xcc接种10 d后,CiNPR4植株叶片上柑橘溃疡病的症状Citrus canker symptoms on leaves of CiNPR4 transgenic plants at the 10 d after inoculation;B:Xcc接种10 d后,CiNPR4植株叶片上溃疡病斑的面积The disease area on leaves of CiNPR4 transgenic plants at the 10 d after inoculation;C:Xcc接种10 d后,CiNPR4植株对柑橘溃疡病的相对抗病率Relative resistance ratio of CiNPR4 transgenic plants to citrus canker at the 10 d after inoculation;D:CiNPR4植株叶片上的Xcc生长Growth of Xcc in leaves of CiNPR4 transgenic plants
WT:野生型植株Wild-type plants;N1—N28:CiNPR4转基因株系CiNPR4 transgenic lines;不同字母表示不同CiNPR4转基因和WT植株两两比较差异显著(P<0.05)Different letters represented significant differences from CiNPR4 transgenic and WT plants in pairwise comparison at P<0.05 according to Duncan’s test。
Fig. 1Evaluation of the resistance of CiNPR4 transgenic plants to citrus canker
分析溃疡病菌接种后0、1、3、5、7和9 d,5个转基因株系(N1、N2、N12、N21和N28)晚锦橙叶片内细菌的生长。结果显示,WT植株接种Xcc后至第7天,接种部位Xcc细菌总量急剧上升,而N1、N2、N12、N21和N28转基因株系接种部位Xcc细菌总量在整个观察期的增长较为缓慢。Xcc接种9 d后,对5个转基因株系和WT植株叶片接种部位的Xcc细菌总量进行方差分析,结果显示,5个转基因株系叶片内Xcc细菌总量显著低于WT植株;N2转基因株系中Xcc细菌总量显著低于N1株系。这些结果表明CiNPR4的过表达降低了Xcc在寄主上的生长能力,与表型一致(图1-D)。
2.2 CiNPR4转基因植株中SA和JA含量的变化
接种Xcc 0、3和5 d后,测定植株叶片内SA和JA含量。处理0 d时,转基因株系N1、N2、N12、N21和N28体内的SA含量与野生型无显著差异。处理3 d时,N1、N12、N21和N28转基因植株叶片中SA含量急剧上升,与WT植株相比达到显著的差异水平,随着诱导时间的延长,SA水平进一步增加;N2转基因植株在处理3 d时SA含量达到最高,在处理5 d时SA含量有所下降但仍保持较高水平;而WT植株在整个观察期间SA的水平基本保持不变(图2-A)。图2
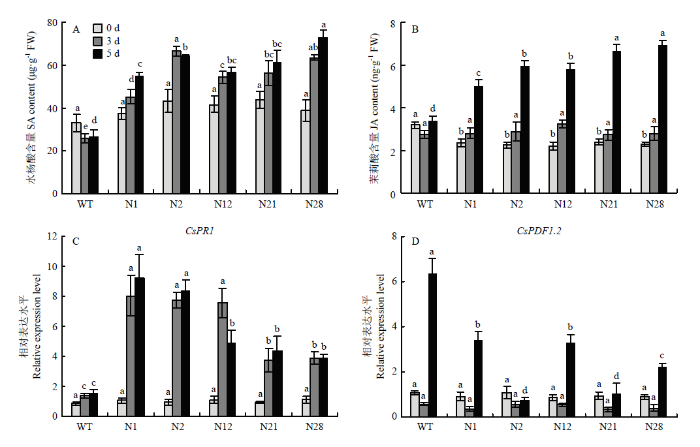 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2SA和JA含量及其信号转导途径中防御反应相关基因在CiNPR4转基因植株中的表达分析
Fig. 2Analyses of SA and JA content and expression of defense response related genes in their signal transduction pathways in CiNPR4 transgenic plants
对于转基因植株体内的JA含量来说,Xcc诱导0 d时,所有检测的转基因植株体内含量显著低于WT植株的JA含量;Xcc诱导3 d时,JA含量在转基因植株体内稍微上升,达到与WT植株无显著差异的水平;Xcc诱导5 d时,JA含量在转基因植株体内急剧上升,达到比WT植株显著高的水平;而WT植株在整个观察期间JA含量无显著差异(图2-B)。结果表明,受Xcc诱导后,CiNPR4的过表达显著上调晚锦橙叶片内SA和JA含量,对SA和JA在体内的积累有着正向调控作用。
2.3 CsPR1和CsPDF1.2的表达分析
CsPR1和CsPDF1.2分别是SA和JA介导的植物防御反应途径中的标志性基因。为了进一步分析CiNPR4在Xcc生物胁迫信号途径相关激素应答和抗性诱导过程中的作用,对Xcc诱导后5个转基因株系和WT植株叶片中CsPR1和CsPDF1.2的表达情况进行分析。以各自健康的植株为参照,Xcc处理0 d时,所有检测的转基因株系和WT植株中CsPR1的表达水平无明显变化;Xcc处理3 d时,转基因株系N1、N2、N12、N21和N28中CsPR1的表达水平迅速上升,与WT植株相比存在显著差异;Xcc诱导5 d时,CsPR1的表达水平在转基因株系N1、N2和N21中继续上升,而在N12转基因株系中有所下降,在N28转基因株系中基本保持不变,但所有检测的转基因株系中CsPR1的表达水平仍然显著高于WT植株;而WT植株中的CsPR1的表达在Xcc诱导后无显著性变化(图2-C),上述结果表明CiNPR4正向调控转基因植株体内CsPR1的表达。同样,以各自健康的植株为参照,Xcc处理0 d时,所有检测的转基因株系和WT植株中CsDF1.2的表达水平无明显变化;Xcc处理3 d时,CiNPR4过表达株系和WT植株中CsDF1.2下调表达,且转基因株系与对照之间无显著差异;Xcc诱导5 d,CsPDF1.2在所有的CiNPR4转基因株系和WT植株中的表达水平均上升,但WT植株的CsPDF1.2表达水平显著高于CiNPR4转基因株系(图2-D),上述结果表明CiNPR4抑制了转基因植株体内CsPDF1.2的表达。
2.4 酵母双杂交分析
通过CiNPR4蛋白与TGA转录因子相互作用网络分析,CiNPR4可能的诱饵蛋白是Ciclev10005080m和Ciclev10001081m,以甜橙基因组为参考,通过氨基酸序列比对,Cs5g11160和Cs1g16230为甜橙中的同源基因,编码的氨基酸序列具有100%和98.9%的相似性。Cs1g16230和Cs5g11160蛋白分别属于TGA6和TGA2蛋白,因而在本研究中,分别将Cs1g16230和Cs5g11160命名为CsTGA6和CsTGA2。诱饵质粒pGBKT7-CiNPR4分别与猎物质粒pGADT7-CsTGA2和pGADT7-CsTGA6共转入Y2HGold,并将共转化子分别涂布在DDO和QDO/X/ABA培养基上。结果表明,所有的共转化子在DDO培养基上都生长白色菌斑,而只有CiNPR4与CsTGA2组合在QDO/X/ABA培养基上长出蓝色菌斑(图3-A)。猎物质粒pGADT7-CsTGA6和pGADT7-CsTGA2分别与pGBKT7空载杂交后在QDO/X/ABA培养基上没有出现蓝色菌斑,表明猎物蛋白本身并不能自激活(图3-B)。阳性对照pGBKT7-53与pGADT7-Rec存在互作,共转化后在QDO/X/ABA培养基上长出蓝色菌斑,而阴性对照pGBKT7-Lam与pGADT7-Rec不存在互作,共转化后在QDO/X/ABA培养基上不能生长(图3-C)。结果表明,CiNPR4与CsTGA2蛋白存在互作。
图3
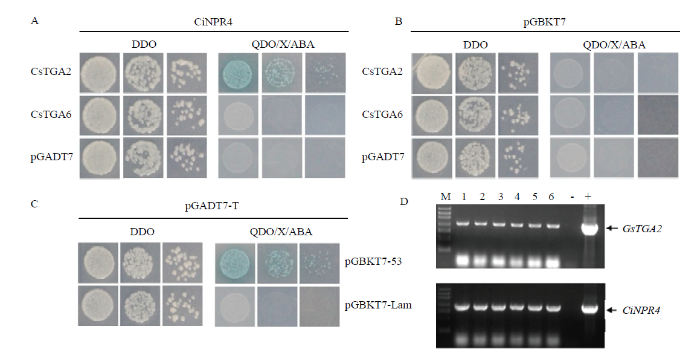 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3酵母双杂交分析
A:CiNPR4与CsTGA2和CsTGA6的酵母双杂交分析Yeast-two-hybrid assay of CiNPR4 with CsTGA2 and CsTGA6, respectively;B:CsTGA2和CsTGA6与空载pGBKT7的酵母双杂交分析Yeast-two-hybrid assay of CsTGA2 and CsTGA6p with the empty pGBKT7 vector, respectively;C:阳性对照(pGBKT7-53和pGADT7-Rec)和阴性对照(pGBKT7-Lam和pGADT7-Rec)的酵母双杂交分析Yeast-two-hybrid assay of positive (pGBKT7-53 and pGADT7-Rec) and negative (pGBKT7-Lam and pGADT7-Rec) controls;D:酵母双杂交阳性克隆的PCR验证Confirmation of the positive clones of CiNPR4 and CsTGA2 by PCR
DDO:缺少色氨酸和亮氨酸的SD培养基 SD/-Trp and -Leu;QDO/X/ABA:缺少腺嘌呤和组氨酸,添加α-半乳糖苷酶和金担子素的DDO培养基DDO/-Ade/-His + X-α-Gal and aureobasidin A;M:DNA Ladder;1—6:阳性克隆Positive clone;-:水对照H2O control;+:CsTGA2(上)和CiNPR4(下)质粒CsTGA2 (upper) and CiNPR4 (below) plasmids
Fig. 3Yeast-two-hybrid interaction assays
为了进一步证实互作的真实性,对CiNPR4与CsTGA2共转化子在QDO/X/ABA培养基上长出的蓝色菌落进行PCR分析,分别扩增CiNPR4与CsTGA2的基因片段。结果显示,在CiNPR4与CsTGA2共转化的酵母菌落中分别能扩增出CiNPR4和CsTGA2基因片段(图3-D),表明CiNPR4与CsTGA2确实存在互作。
3 讨论
在NPR基因家族中,NPR4调控了植物对病原物的防御反应。研究表明,NPR4调控植株的防御反应与其氨基酸序列C-末端的VDLNETP基序有关[11]。分别来源于甜橙和草莓的NPR4蛋白CsNPR4和FvNPRL-1氨基酸序列的C-末端分别含有IDLNETP和VDLNETP基序[20],这两种蛋白负向调控植物对病原物的防御反应[26,27]。将NPR4的VDLNETP基序中‘DLN’3个氨基酸突变成与NPR1相同的‘GVK’后,会导致NPR4的抑制功能丧失[11]。与AtNPR1类似,CiNPR4蛋白氨基酸序列的C-末端完全缺失VDLNETP基序[20],[28]。在柑橘黄龙病易感品种晚锦橙中导入CiNPR4增加了转基因植株对柑橘黄龙病的抗性,表明不含VDLNETP基序的CiNPR4正向调控了植株的防御反应[20]。在本研究中,过表达CiNPR4抗黄龙病的转基因晚锦橙,同时也获得了溃疡病抗性,进一步证明了CiNPR4能够正向调控植物防御反应。柑橘溃疡病与细菌性白叶枯病的病原菌同属于黄单胞菌,研究表明,JA信号转导增加了玉米对细菌性白叶枯病的抗性[29]。相似地,在本研究中,野生型晚锦橙受Xcc感染后,尽管其体内的JA含量并没有发生显著变化,但JA信号转导途径中防御反应相关基因CsPDF1.2在感染Xcc 5 d后显著上调表达,而SA信号转导途径中的防御反应基因CsPR1的表达水平在Xcc诱导期间无显著变化,表明野生型晚锦橙启动JA信号转导途径抵抗Xcc的入侵。这种现象发生的原因可能是野生型晚锦橙受Xcc诱导后调控了JA信号而非JA水平,与OsNPR1调控SA和JA介导的信号而不是它们的水平提高水稻中防御反应相关基因的表达水平结果一致[30]。但是,在晚锦橙中导入CiNPR4后,在Xcc的诱导下,SA和JA的水平都显著提高,相应地,SA介导的防御反应相关基因CsPR1的表达水平显著上升,而CiNPR4转基因植株体内高水平的JA并未强烈地诱导CsPDF1.2的表达,在Xcc诱导5 d时,CiNPR4转基因植株拥有显著低于WT植株的CsPDF1.2表达水平,这些结果表明CiNPR4促进了SA介导的CsPR1表达,而抑制了JA介导的CsPDF1.2表达,此研究结果不同于AtNPR4正向地调控SA和JA信号转导途径中的防御反应相关基因PR-1和PDF1.2的表达[17],而与AtNPR1正向地调控SA信号而抑制JA信号途径中相关基因的表达结果相同[31]。这种现象的出现可能是因为CiNPR4的C-末端不含有AtNPR4氨基酸序列C-末端的VDLNETP基序,而与AtNPR1的C-末端具有某些相似性。
研究表明,NPR类蛋白不能直接结合DNA,需要通过与TGA转录因子互作,调控SA下游基因的表达[11,32]。本研究表明,柑橘CiNPR4通过与CsTGA2转录因子互作,对SA和JA分别介导的防御反应相关基因的表达水平进行调控,从而增强转基因植株对柑橘溃疡病的抗性。但CiNPR4与CsTGA2形成的复合物是否结合在CsPR1和CsPDF1.2的启动子上还需进一步的研究。
4 结论
黄龙病抗性增强的CiNPR4转基因植株获得了增强的柑橘溃疡病抗性。CiNPR4与CsTGA2转录因子互作,在Xcc的诱导下,通过正向调控SA而抑制JA信号转导途径中防御反应相关基因的表达水平,从而提高CiNPR4转基因植株对柑橘溃疡病的抗性。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1038/hortres.2015.42URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1146/annurev.phyto.35.1.235URL [本文引用: 1]
DOI:10.1111/jipb.2011.53.issue-6URL [本文引用: 1]
DOI:10.1038/nature11162URL [本文引用: 1]
DOI:10.1016/j.celrep.2012.05.008URL [本文引用: 1]
DOI:10.1016/j.cell.2018.03.044URL [本文引用: 5]
DOI:10.1016/S0092-8674(03)00429-XURL [本文引用: 1]
DOI:10.1105/tpc.12.2.279URL [本文引用: 1]
DOI:10.1007/s10658-010-9633-xURL [本文引用: 1]
DOI:10.1371/journal.pone.0137134URL [本文引用: 1]
DOI:10.1016/j.pmpp.2013.07.002URL [本文引用: 1]
DOI:10.1111/tpj.2005.41.issue-2URL [本文引用: 2]
DOI:10.1111/tpj.2006.48.issue-5URL [本文引用: 1]
[本文引用: 2]
DOI:10.1007/s00299-020-02648-3URL [本文引用: 4]
DOI:10.37855/jah.2003.v05i01.15URL [本文引用: 1]
DOI:10.1007/s11240-015-0799-yURL [本文引用: 2]
DOI:10.1111/mpp.2018.19.issue-8URL [本文引用: 1]
DOI:10.1006/meth.2001.1262URL [本文引用: 1]
DOI:10.1038/ng.2472URL [本文引用: 1]
DOI:10.1111/mpp.2017.18.issue-9URL [本文引用: 1]
DOI:10.1371/journal.pone.0205790URL [本文引用: 1]
DOI:10.3390/ijms20235974URL [本文引用: 1]
DOI:10.1093/pcp/pcs145URL [本文引用: 1]
DOI:10.1111/pbi.2007.5.issue-2URL [本文引用: 1]
DOI:10.1105/tpc.009159URL [本文引用: 1]
[本文引用: 1]
