 ,, 李倩, 孙钰佳, 孔冬冬, 刘良玉, 侯聪聪
,, 李倩, 孙钰佳, 孔冬冬, 刘良玉, 侯聪聪 ,, 李乐攻
,, 李乐攻 ,首都师范大学生命科学学院/植物基因资源与低碳环境生物技术北京市重点实验室,北京100048
,首都师范大学生命科学学院/植物基因资源与低碳环境生物技术北京市重点实验室,北京100048OsCSC11 Mediates Dry-Hot Wind/Drought-Induced Ca2+ Signal to Regulate Stamen Development in Rice
REN ZhiJie ,, LI Qian, SUN YuJia, KONG DongDong, LIU LiangYu, HOU CongCong
,, LI Qian, SUN YuJia, KONG DongDong, LIU LiangYu, HOU CongCong ,, LI LeGong
,, LI LeGong ,College of Life Sciences, Capital Normal University/Key Laboratory of Plant Gene Resources and Biotechnology for Carbon Reduction and Environmental Improvement, Beijing Municipal Government, Beijing 100048
,College of Life Sciences, Capital Normal University/Key Laboratory of Plant Gene Resources and Biotechnology for Carbon Reduction and Environmental Improvement, Beijing Municipal Government, Beijing 100048通讯作者:
责任编辑: 李莉
收稿日期:2021-03-21接受日期:2021-04-14网络出版日期:2021-05-16
| 基金资助: |
Received:2021-03-21Accepted:2021-04-14Online:2021-05-16
作者简介 About authors
任志杰,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (6692KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
任志杰, 李倩, 孙钰佳, 孔冬冬, 刘良玉, 侯聪聪, 李乐攻. 水稻CSC11介导干热风/干旱诱导的钙信号调控雄蕊发育[J]. 中国农业科学, 2021, 54(10): 2039-2052 doi:10.3864/j.issn.0578-1752.2021.10.001
REN ZhiJie, LI Qian, SUN YuJia, KONG DongDong, LIU LiangYu, HOU CongCong, LI LeGong.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】干热风或水分胁迫是阻碍作物生长和产量形成的重要逆境因子之一,作物在干热风或水分等非生物胁迫下,进化出一套完整而复杂的应对机制,Ca2+被认为是启动这类复杂反应的通用第二信使或干旱逆境因子,例如:渗透势的改变、水分的变化、温度的变化、机械刺激都会引起细胞钙离子浓度的特征性反应,这种变化启动了细胞内生理生化过程,传递和放大干旱逆境信号的作用[1,2,3],因此,筛选鉴定水稻中感受干热风的钙离子通道及相关基因不仅对研究水稻传导干热风信号具有重要的生物学意义,同时也为培育耐干热风水稻的分子育种提供重要的基因资源和遗传材料。【前人研究进展】尽管早期已经发现了介导钙离子内流的基因家族,如:谷氨酸受体类通道(glutamate receptor-like,GLRs)、环核苷酸门控离子通道(cyclic nucleotide-gated channels,CNGCs)和膜联蛋白类通道(Annexins)等[4,5],也发现了介导水分进出细胞的水通道家族(plasma membrane intrinsic proteins,PIPs)[6]等。但是,上述通道本身没有受体功能,也不能对细胞的水分变化做出直接的应对反应[4,5]。2014年HOU等[7]首次发现,模式植物拟南芥中存在一类受体类型的钙离子通道,它们属于DUF221家族且广泛存在于真核生物中,可以被渗透势或机械门控激活,能够感应渗透/机械力的变化,这一结论后续被多个结构和神经生物学研究者证实[8,9,10],另外还发现果蝇的钙离子透过性胁迫反应阳离子通道家族(CSCs)感应粗粒食物介导适口性的功能[11],也发现小鼠的CSCs感应声波变化,缺失导致严重耳聋[12],该家族基因的功能成为神经生物学研究者追逐的热点。拟南芥兼具水分受体感应和通道转运功能的CSCs家族的发现,为分析水稻的水分变化感应分子提供了线索和良好的研究基础[7]。干热风是一种高温、低湿并伴有一定风力的农业气象灾害,不定时发生,难以预测,严重影响农作物产量[13,14,15,16],在水稻的扬花期偶遇干旱或高温也会导致产量的急剧下降,这类干热风逆境的共同之处就是严重影响作物细胞,尤其是防护性能不强的生殖细胞,造成细胞快速失水而导致花粉发育异常、结实率降低[17,18,19,20,21,22,23,24,25]。【本研究切入点】作物的CSCs家族研究刚刚起步,水稻中CSCs的同源基因有11个,其中只有OsCSC4被证明异源表达在拟南芥中具有类似AtCSC1的功能[26]。但是,到目前为止,水稻响应干热风胁迫的受体或通道均未见报导,也未发现水稻生殖细胞感应干热风的分子基础和调控机理。【拟解决的关键问题】本研究分析水稻CSC11的钙离子转运活性及调控活性的分子结构域,获得oscsc11突变体并分析干热风条件下的表型变化,这一分子功能的发现为理解作物响应干热风伤害的分子机理研究提供了新思路。1 材料与方法
1.1 材料
植物材料:水稻(Oryza sativa L.)品种为日本晴(Nipponbare),由中国农业科学院生物技术研究所路铁刚研究员课题组提供,拟南芥生态型Col-0;菌株:大肠杆菌(Escherichia coli)感受态细胞Trans10购自北京全式金生物技术有限公司,农杆菌(Agrobacterium tumefaciens)菌株GV3101由首都师范大学李乐攻教授实验室保存;动物材料:雌性成熟非洲爪蟾(Xenopus laevis)购自美国Nasco公司。基因敲除突变体和GUS表达株系的遗传转化工作在中国农业科学院路铁钢研究员课题组水稻转化平台完成,遗传材料的扩繁和表型分析工作在中国农业科学院廊坊实验基地和北京首都师范大学实验楼完成。1.2 水稻总RNA提取和荧光定量PCR分析
分别取野生型日本晴水稻不同组织,用Trizol法(赛默飞)提取总RNA,利用反转录试剂盒SuperScript ?II(赛默飞)体外反转录合成cDNA(具体步骤参见说明书)。实时荧光定量PCR引物见表1,以水稻LOC_Os03g50885为内参基因,每个样品3个重复,根据公式2-ΔΔCT方法计算相对表达量[27]。Table 1
表1
表1本研究所用的引物
Table 1
| 引物名称 Primer name | 引物序列 Primer sequence (5′-3′) | 用途 Purpose |
|---|---|---|
| CSC11-BamHⅠ-F | CGGGATCCATGGGGCCGACCGCGCCGCCGCCGGACGCCG | 蛙卵表达载体构建 Vector construction for oocyte expression |
| CSC11-EcoRⅠ-R | GGAATTCTCAGGATTGATACAGGCTCCAATCC | |
| CSC11ΔTM1-3-BamHⅠ-F | CGGGATCCATGGAGGACGCCCTTCGCA | |
| ProCSC11- Hind Ⅲ-F | CCCAAGCTTTATAGAATGGGTCATCATAGCA | p1300-proCSC11-GUS表达载体构建 Construction of of p1300-proCSC11-GUS vector |
| ProCSC11- BamHⅠ-R | CGGGATCCCGCCGGGGGACGGGGACGTGAC | |
| CSC11- EcoRⅠ-F | GGAATTCATGGGGCCGACCGCGCCGCCGCCGGACGCCG | GFP融合表达载体 GFP-CSC11 expression vector |
| CSC11-BamHⅠ-R | CGGGATCCGGATTGATACAGGCTCCAATCC | |
| CSC11ΔTM1-3-EcoRⅠ-F | GGAATTCATGGAGGACGCCCTTCGCA | |
| Target-F | GCGGCGGGGAGCCGGAGGCG | 基因敲除载体 Gene editing |
| Target-R | CGCCTCCGGCTCCCCGCCGC | |
| CSC11-CRI-F | ACCTCGCGTGATCTAGCCCCACC | 靶点检测及测序引物 Target detection and sequencing primer |
| CSC11-CRI-R | GCTTCTCTCAAGCTGGAGCTCC | |
| 11-qRT-F | GGGCATTCCCAAGACGCT | qRT-PCR检测引物 Primers used for qRT-PCR |
| 11-qRT-R | CCAAGAAATCCTGTTCCGCA | |
| OsACTIN1-F | TCCATCTTGGCATCTCTCAG | |
| OsACTIN1-R | GTACCCGCATCAGGCATCTG |
新窗口打开|下载CSV
1.3 载体的构建和水稻转基因植株的获得
依据水稻基因组数据库Rice Genome annotation project(1.4 GUS报告基因活性分析
在不同发育时期,取稳定表达ProCSC11-GUS转基因植物的不同组织进行GUS染色观察,方法参考文献[29],使用莱卡倒置显微镜和蔡司体式显微镜SV11对染色组织进行拍照记录。1.5 亚细胞定位分析
利用聚乙二醇(PEG4000)介导的拟南芥原生质体瞬时转化方法将表达重组蛋白35S::OsCSC11-GFP和对照组35S::GFP的质粒载体分别转入拟南芥原生质体细胞,具体方法参考文献[30]。通过基因枪法[31]将上述质粒载体瞬时转化洋葱表皮细胞,在激发光为488 nm的蔡司780激光共聚焦显微镜下,对表达GFP荧光蛋白的细胞进行拍照记录。1.6 双电极电压钳技术方法
将全长OsCSC11和删除N端156氨基酸后(OsCSC11ΔTM1-3)的基因序列分别构建到蛙卵表达载体pGEMHE和pGEMHE-GFP中,以线性化的质粒为模板,利用体外转录试剂盒Ambion mMESSAGE mMACHINE T7(购自赛默飞)进行体外转录,合成成熟的cRNA(Capped-RNA),并稀释到500 ng·μL-1的浓度备用。通过显微注射向每个蛙卵中注射32 nL的cRNA,对照组注射等体积的RNase-free ddH2O,在ND96(96 mmol·L-1 NaCl、2 mmol·L-1 KCl、1 mmol·L-1MgCl2、1.8 mmol·L-1 CaCl2和10 mmol·L-1 HEPES/NaOH, pH7.4)溶液中,18℃孵育至少48 h待蛋白表达。采用TEV200A放大器、Digidata 1440 A/D数模转换器(Dagan公司)和pCLAMP10.4软件(Axon Instruments)对数据进行记录[32,33,34],记录时电极液为3 mol·L-1 KCl。刺激激活的通道活性分析所用的基础溶液为ND96,高渗溶液为ND96+500 mmol·L-1 Mannitol,电压钳制在-100 mV;组成型离子通道活性分析时在基础灌流液(2 mmol·L-1 KCl、1 mmol·L-1 MgCl2和10 mmol·L-1 MES-Tris,pH5.6)中分别加入20 mmol·L-1的K+、Na+、Mg2+、Ca2+进行离子选择性分析,用D-甘露醇调节渗透势至220 mosmol·kg-1,电压从-140 mV递增至+40 mV,每次递增10 mV,钳制电位设置为0,电压刺激持续时间设置为2 s。1.7 花粉粒的活力测定
在授粉前,将成熟期颖花的雄蕊取下,且每种材料取3株独立的株系进行I2-KI染色,在蔡司体式显微镜SV11下进行观察记录。2 结果
2.1 OsCSC11蛋白序列是具有特异结构域(Motifs)的独立亚家族
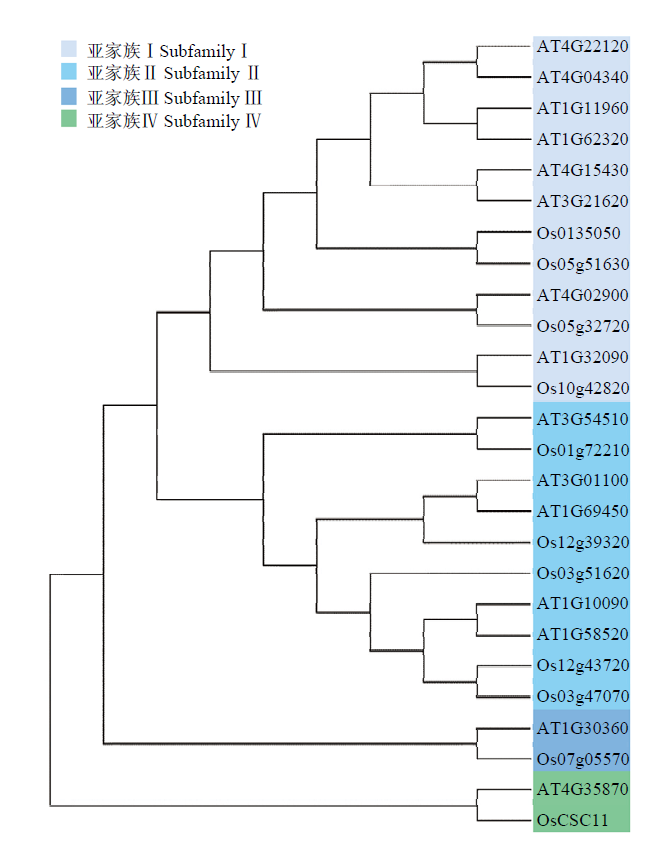
钙离子透过性胁迫反应阳离子通道家族(CSCs)是近年发现的一种类似动物瞬时受体电位通道(transient receptor potential channels,TRPs)的兼具受体和通道双重功能的离子通道[7],它们广泛存在于真核生物中。模式植物拟南芥有15个成员,水稻有11个成员,经序列比对(图1),拟南芥和水稻的CSCs成员分别归属4个亚家族,其中,水稻OsCSC11和拟南芥AtCSC15同属较为独立的第四亚家族,与其他成员的同源性较低。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1水稻和拟南芥CSCs家族进化树分析
Fig. 1The phylogenetic tree of CSCs family in Arabidopsis and rice
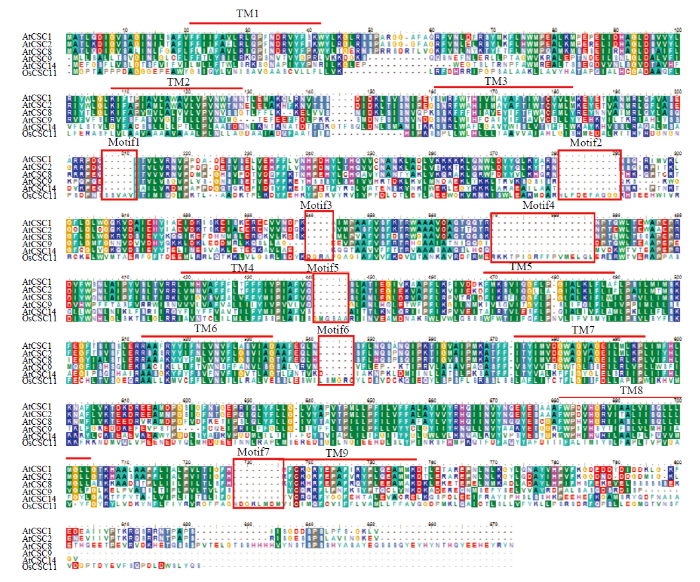
蛋白质序列分析显示CSCs家族蛋白具有8—10个跨膜结构域(transmembrance domain,TM),并且都具有DUF221功能结构域,是一类典型的膜蛋白。将OsCSC11与已报道的5个拟南芥CSCs成员进行蛋白序列比对分析发现,它们同源性较高,在N端3个TMs(包含Loop的区域)、第六至第九TMs(不包含Loop区)和DUF221功能区都很保守,推测OsCSC11很可能与拟南芥CSCs具有类似的功能。而OsCSC11在第三个TM和第九个TM之间有较特异的7个结构域(图2),这些较独特的结构,在进化过程中可能赋予了OsCSC11不同于其他同源蛋白的特有功能,纵观全长蛋白序列,这一家族特有的前3个TMs,可能是这种受体类通道的受体结构域,而其余的部分则非常类似典型的6个跨膜离子通道,如:Shaker-type钾离子通道或CNGCs等。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2水稻CSC11和拟南芥部分CSCs蛋白序列比对分析
Fig. 2Protein alignment of OsCSC11 and part of AtCSC members
2.2 OsCSC11在叶片和花药中表达量相对较高
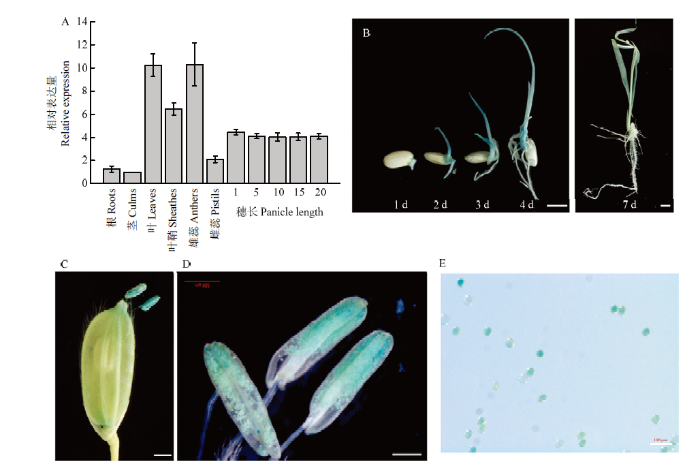
基因的组织或时空表达模式与其功能直接相关。取野生型水稻不同组织的cDNA作为模板,利用qRT-PCR方法检测OsCSC11的表达,发现该基因在叶片、叶鞘和雄蕊中表达量相对较高,在根、茎以及不同发育时期的穗组织中相对较低(图3-A)。对稳定表达ProCSC11-GUS转基因植物的不同组织进行GUS染色,结果发现,OsCSC11的启动子在幼苗地上部分、叶片,以及雄蕊的花粉粒中活性较高(图3-B—图3-E),表明OsCSC11很可能主要在叶片和雄蕊发育过程中发挥重要作用。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3OsCSC11的表达模式
A:qRT-PCR检测水稻不同组织OsCSC11的表达;根、茎、叶、叶鞘来自抽穗前的野生型水稻,数字:小穗抽出的长度(cm);B—E:稳定表达ProCSC11-GUS转基因水稻的GUS染色,B:萌发1、2、3、4和7 d的小苗,标尺为0.5 cm;C:授粉时期的颖花,标尺为0.1 cm;D:成熟的雄蕊,标尺为0.05 cm;E:成熟花粉粒,标尺为100 μm
Fig. 3The expression pattern of OsCSC11
A: Expression of OsCSC11 in various organs analyzed by qRT-PCR; Roots, culms, leaves, and sheathes were harvested from WT plants before heading. Anthers and pistils from spikelet hulls were collected two days before fertilization. Numbers of 1, 5, 10, 15 and 20 stand for different lengths (cm) of the heading panicles. B-E: GUS staining of various tissues from ProOsCSC11-GUS transgenic plants. B: Seedlings grow for 1 day, 2 day, 3 day, 4 day and 7 day were represented (scale bar=0.5 cm); C: Rice floret during pollination (scale bar=0.1 cm); D: Anthers (scale bar=0.05 cm); E: Pollens (scale bar=100 μm)
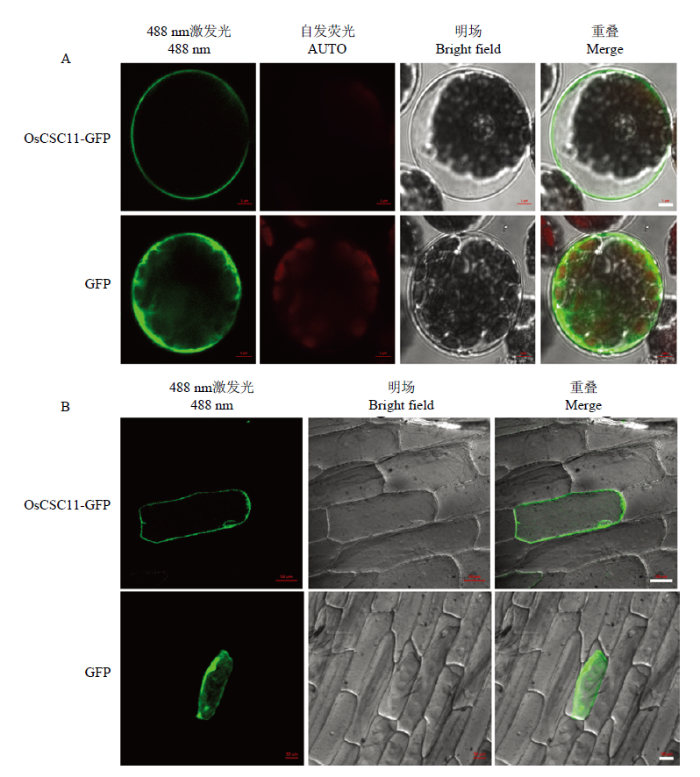
2.3 OsCSC11定位于细胞质膜
蛋白的亚细胞定位有助于理解和分析OsCSC11的功能。将构建好的重组质粒35S-OsCSC11-GFP和对照质粒35S-GFP通过瞬时转化拟南芥原生质体及洋葱表皮细胞。在488 nm激发光下检测,发现表达OsCSC11-GFP融合蛋白的原生质体在细胞质膜上有较强的GFP荧光信号,表达对照组质粒的原生质体中,荧光信号在胞质内和细胞质膜上均可检测到(图4-A);同时,洋葱表皮细胞瞬时转化的结果也显示OsCSC11-GFP定位于细胞质膜,而表达对照质粒的洋葱表皮细胞在胞质和质膜上也可检测到荧光信号(图4-B),表明OsCSC11是一个细胞质膜蛋白。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4OsCSC11的亚细胞定位
A—B:拟南芥原生质体细胞(A)和洋葱表皮细胞(B)中瞬时转化重组载体35S-OsCSC11-GFP和对照载体35S-GFP,A标尺为5 μm,B标尺为50 μm
Fig. 4Subcellular localization of OsCSC11
Transient expression in Arabidopsis mesophyll protoplasts (A) and onion epidermal cells (B) with 35S-OsCSC11-GFP and 35S-GFP (Scale bar = 5 μm in A, and Scale bar = 50 μm in B)
2.4 OsCSC11介导干旱诱导的钙信号
2.4.1 OsCSC11全长处于静息状态被高渗透溶液激活 已有报道发现CSCs家族一些成员是被高渗胁迫/机械刺激激活的离子通道,那么OsCSC11是否也有类似的通道活性呢?通过显微注射,将OsCSC11-GFP融合蛋白表达在非洲爪蟾卵母细胞中,荧光显微镜下观察发现卵母细胞质膜上有特异的GFP荧光信号(图5-D),与其在植物细胞中的质膜定位结果一致。利用双电极电压钳方法,在蛙卵表达系统中验证OsCSC11的电生理功能,结果发现表达OsCSC11的蛙卵在外加高渗溶液时(模拟机械刺激/膜扰动)产生了(4.27±1.50)μA的内向电流,而对照组注射水的蛙卵在相同条件下只能检测到(0.19±0.02)μA的背景电流(图5-A和图5-B),这表明OsCSC11全长蛋白的转运活性可以被高渗溶液激活。图5
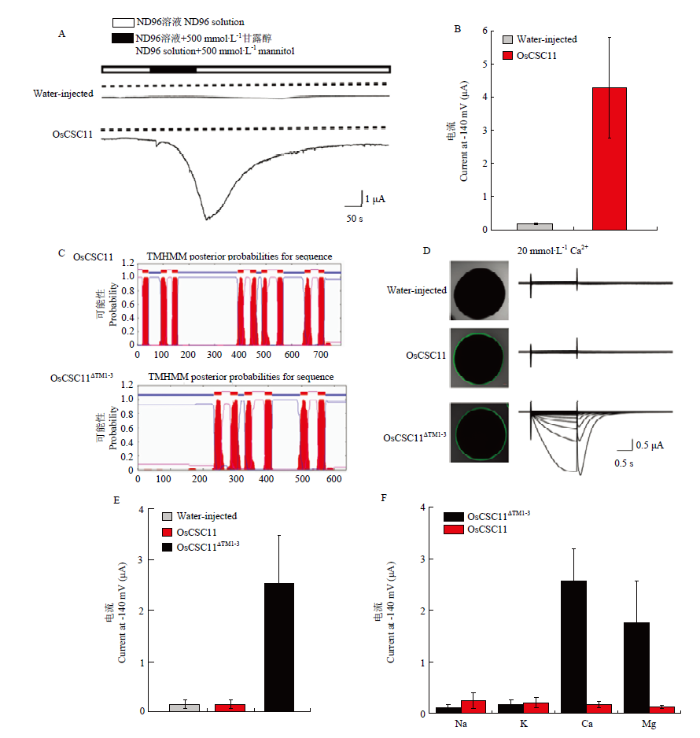 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5OsCSC11的电生理学分析
A:全细胞记录方式检测表达OsCSC11的蛙卵和对照组注射等体积水的蛙卵在高渗胁迫时产生的电流,电压钳制在-100 mV,横坐标表示记录时间,纵坐标表示电流大小,实线表示电流示踪,虚线表示0 μA电流;B:统计分析A图中记录到的被高渗溶液激活的电流最大值,n>3;C:OsCSC11和OsCSC11ΔTM1-3蛋白的跨膜结构预测;D:OsCSC11和OsCSC11ΔTM1-3蛙卵细胞中的定位以及电生理活性检测,注射水的蛙卵作为对照;E:统计分析图B中钳制电压为-140 mV时的电流最大值,n>5;F:OsCSC11和OsCSC11ΔTM1-3的离子选择性分析,n>5;B、E和F图中的数值由平均值±标准差表示
Fig. 5Electrophysiological analysis of OsCSC11
A: Whole-cell recording of OsCSC11-expressing Xenopus laevis oocytes and the water-injected control oocytes perfused with hyperosmotic solution containing 500 mM D-mannitol. The holding potential was at -100 mV. The X-axis represents the recording time and the Y-axis represents the current. The solid and dotted lines indicate traces and 0 μA current, respectively. B: Current amplitudes evoked by the application of hyperosmotic stress (n> 3) C: Prediction of transmembrane helices in OsCSC11 and OsCSC11ΔTM1-3. D: Electrophysiological activity of OsCSC11and OsCSC11ΔTM1-3 in oocytes, and the oocytes injected with water as a control. E: Statistic analysis of the maximum currents at holding potential of -140 mV as in B (n > 5). F: Selectivity analysis of OsCSC11 and OsCSC11ΔTM1-3 (n >5). The data are shown as mean ± SD in B, E and F
2.4.2 删除N端跨膜域/受体结构域的OsCSC11ΔTM1-3具有组成性的钙通道活性 结合研究较多的典型离子通道(CNGC、GLR家族)的蛋白结构特征,进一步对OsCSC11蛋白序列分析,发现OsCSC11蛋白在TM3和TM9之间有7个未知功能的结构域(图2),为了进一步探索OsCSC11蛋白作为离子通道的特性,将OsCSC11的N端3个跨膜域(第1—156个氨基酸)删除并命名为OsCSC11ΔTM1-3,将OsCSC11ΔTM1-3和OsCSC11ΔTM1-3-GFP的cRNA注射表达在卵母细胞中,发现删除N端3个跨膜域的OsCSC11ΔTM1-3仍然在质膜上表达(图5-D),电生理试验结果发现,在未施加高渗溶液刺激的情况下,表达了OsCSC11ΔTM1-3的蛙卵就可以记录到非常明显的组成型钙离子内流信号(3 μA),而对照组和OsCSC11全长蛋白在同样条件下未检测到明显的电流(0.2 μA背景电流)(图5-C—图5-E)。对OsCSC11ΔTM1-3的离子选择性进行分析,发现OsCSC11ΔTM1-3可以同时转运二价钙离子和镁离子,对一价金属离子钠离子和钾离子没有明显的转运活性(图5-F)。上述结果发现OsCSC11ΔTM1-3具有钙离子的转运特性,而全长OsCSC11蛋白在无高渗胁迫刺激时检测不到活性,由此推测OsCSC11的TM1-3结构域有可能具有受体功能,感应高渗或机械胁迫,而OsCSC11ΔTM1-3形成具有钙离子转运活性的通道,当TM1-3结构域感受到外界高渗或机械刺激时,引起通道结构域的激活,介导钙离子的内向转运。
2.5 利用CRISPR/Cas9基因编辑方法获得oscsc11突变体
体外功能研究表明OsCSC11蛋白可以直接响应高渗刺激介导钙离子的内流,为了进一步探究该蛋白在植物体内的生理功能,利用CRISPR/Cas9基因编辑技术构建OsCSC11功能缺失的突变体。在OsCSC11序列的N端选取一段靶序列作为编辑位点(图6-A),构建CRISPR/Cas9敲除载体,通过农杆菌介导的愈伤组织转化法获得了不同编辑类型的水稻突变体,利用靶点检测引物CSC11-CRI-F/ CSC11-CRI-R(表1)对Target上下游区域进行PCR扩增,PCR产物测序比对发现,在84株转基因阳性苗中有53株Target靶点位置发生了编辑。经过T2代分离鉴定获得了2种类型突变体株系,分别命名为oscsc11-1和oscsc11-2,其中oscsc11-1在ORF第178—179 bp之间插入一个碱基T,也就是在野生型的第179 bp处插入了碱基T;oscsc11-2在ORF第178 bp(G)和第179 bp(T)处缺失了2个碱基。2种突变体的等位基因均造成移码突变、提前终止。图6
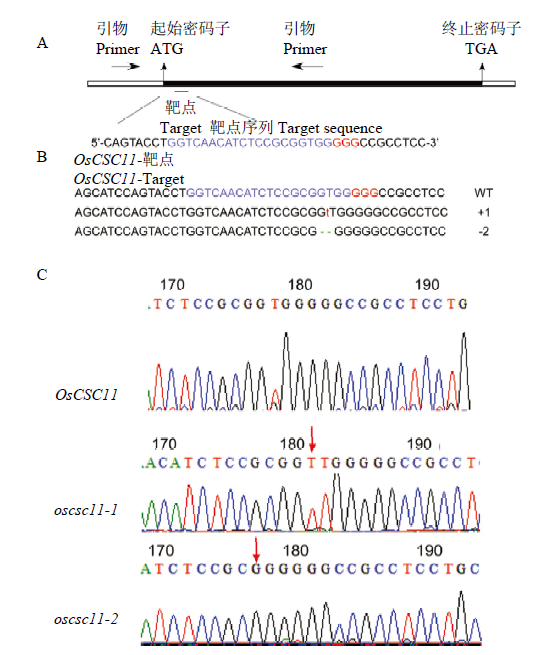 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6基因编辑靶点设计和oscsc11突变体鉴定
A:OsCSC11的结构和靶点位置,蓝色字体为靶序列,红色字体为PAM序列,水平的箭头表示突变体鉴定引物所在的位置;B:CRISPR/Cas9基因编辑阳性植株的突变类型,红色小写字体表示插入碱基,绿色虚线表示缺失碱基,+1表示插入一个碱基,-2表示缺失2个碱基;C:纯合突变体测序峰图,红色箭头表示碱基插入的位置
Fig. 6Diagram of the sgRNA design and identification of oscsc11 mutants
A: The diagram of OsCSC11 and the sgRNA. The target and PAM sequences are in blue and red respectively. B: Identification of mutation types in gene-edited plants. The inserted bases are shown in red and the deleted bases are indicated by green dotted lines. +1 means 1-bp-insertion and -2 means 2-bp-deletion. C: The sequencingmap of homozyg mutants. The red arrows indicate insertion or deletion positions
2.6 oscsc11突变体雄蕊的耐干旱性显著下降
2.6.1 oscsc11突变体花药弯曲与干热风诱导的表型类似 体外电生理学分析证明了OsCSC11是高渗胁迫(模拟干旱或机械刺激)激活的离子通道,那么OsCSC11在水稻中生理功能如何?进一步对已获得的oscsc11突变体进行表型分析,发现oscsc11突变体在苗期和营养生长期与野生型水稻没有明显差异,而在生殖生长期时oscsc11突变体雄蕊不能正常顶出颖壳(图7-A和图7-B),剥开颖壳后发现oscsc11突变体的雄蕊发育异常,花药较野生型短,且部分出现一定程度的卷曲,花药颜色与野生型相比较浅(图7-C和图7-D)。通常在水稻抽穗开花期较多为高温多风天气,野生型水稻的花药偶遇长时间的干热风刺激时,雄蕊的花药组织会因脱水导致卷曲现象,oscsc11突变体雄蕊的表型与野生型雄蕊长时间受到干热风刺激脱水之后的表型类似。为了更进一步确定OsCSC11的功能与干热风造成的雄蕊脱水相关,对野生型和突变体的花粉含水量进行了测量,结果显示,oscsc11突变体花粉的含水量(花粉细胞中水组分的质量占比)只有(12.87±2.2)%,而野生型含水量为(39.97±2.4)%,相比野生型,突变体的含水量下降了60%以上,表明oscsc11可能会对干热风表现出更敏感的表型。结合前面体外功能研究证实OsCSC11在高渗刺激(模拟干旱脱水环境)下通道活性可以被激活,传导高渗刺激或模拟干旱信号的结果,可以推测:在水稻抽穗期,oscsc11突变体很可能是由于失去感受外界干热风的胁迫信号和离子通道功能,使得突变体不能将此信号有效地传递,导致生理应对反应缺失,因而出现干旱脱水的表型,由于生殖细胞更为敏感,花药的表型变化更加剧烈。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7野生型和oscsc11突变体小穗的表型分析
A—B:授粉时期野生型和突变体的小穗,A标尺为1 cm,B标尺为0.5 cm;C:授粉前颖花、雄蕊和雌蕊,标尺为0.2 cm和0.1 cm;D:授粉前的雄蕊,标尺为0.1 cm;E:成熟花粉的含水量测定,每组试验取100个颖花,图中的数值由平均值±标准差表示,n=4
Fig. 7Phenotype analysis of the spikelets in wild type and oscsc11 mutant
A: The spikelet of WT and oscsc11 at stage of pollination, Scale Bar = 1 cm in A and 0.5 cm in B; C: morphological observation of spikelets, stamen and pistils before pollination, Scale Bar = 0.2 cm in upper panel and 0.1 cm in lower panel; D: The stamen of WT and oscsc11 before pollination, Scale Bar = 0.1 cm; E: The moisture content of mature pollens, every sample contains one hundred spikelets, the data are shown as mean ± SD, n=4
2.6.2 oscsc11突变体的花粉出现较多败育现象 表达模式分析的结果表明OsCSC11在花粉中的表达量极高,且oscsc11突变体花粉含水量低,进一步对野生型和oscsc11突变体的花粉进行了花粉活力的测定。野生型、oscsc11-1和oscsc11-2各取3株不同的植株,每株至少取3个颖花的花粉,通过I2-KI染色试验发现,野生型的花粉有95%以上能被I2-KI很好着色,而oscsc11-1和oscsc11-2突变体只有30%—40%的花粉能被I2-KI着色(图8-A和图8-B),通过对花粉形态的观察发现,突变体的花粉呈现不规则的形态(图8-A)。同时,oscsc11的花粉含水量比野生型减少了60%以上(图7-E),表明oscsc11-1和oscsc11-2突变体的花粉活力降低以及形态异常可能是由于严重脱水造成的。电生理结果表明OsCSC11是一类高渗刺激(模拟干旱脱水环境)激活的钙离子通道,钙离子在花粉的发育以及延伸过程中具有非常重要的作用,由此推断钙离子在花粉发育的每一个生理过程中都有着不可替代的特殊作用,而oscsc11-1和oscsc11-2敏感表型则大多出现在中午水稻开花时期,推测OsCSC11缺失导致植株难以感受环境干热等不利刺激,没有启动相应的钙离子信号和生理应对过程,因此影响了水稻花粉正常发育。
图8
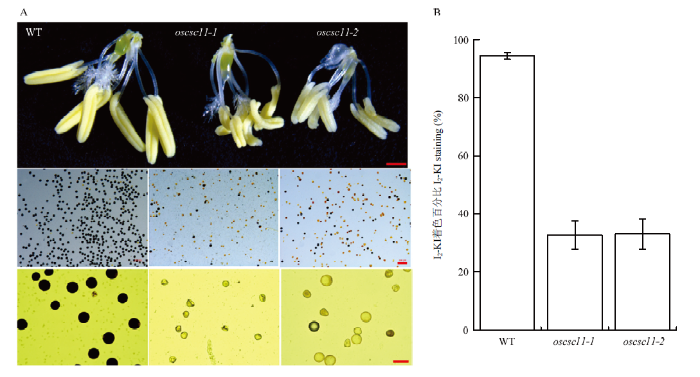 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8水稻野生型和oscsc11突变体花粉I2-KI染色
A:野生型和oscsc11-1、oscsc11-2突变体在开花前1 d的雄蕊形态观察及花粉I2-KI染色分析,标尺从上到下依次为0.2 cm、200 μm和50 μm;B:I2-KI染色统计分析,图中的数值由平均值±标准差表示,每个计数样品包含100—200个花粉粒
Fig. 8I2-KI staining of pollens in wild type and oscsc11 mutants
A: The morphological observation of stamen and I2-KI staining of pollen in WT oscsc11-1 and oscsc11-2 one day before flowering. The scale bars are 0.2 cm, 200 μm and 50 μm in the up, middle and bottom panel, respectively. B: Statistic analysis of I2-KI staining. The data are shown as mean ± SD, about 100-200 pollens were counted in each sample
3 讨论
钙离子作为通用的第二信使,参与了干旱、高温、冷害和盐害等多种非生物胁迫的逆境信号传导[3,4],钙通道分子可以将胞外不同的逆境刺激转化为胞内特定的钙信号[35,36],进而通过钙信号解码分子,如:钙调素、CBLs、CDK、CIPKs调控相应的生理过程[3,37]。植物的钙信号编码器分子与哺乳动物产生钙信号的分子类似,大致分为两类,一类是单纯的通道,如:CNGCs[38]、GLRs[37,39]等,2019年以来,人们已经报道了3种钙信号编码复合体,如CNGC8/7-CNGC18- CaM2/3互作组成的分子开关,能维持花粉管顶端的钙波动[33];而CNGC2-CNGC4-CaMs互作编码病理原初反应的钙信号[34];另外CNGC15-NRT1.1组成硝酸根门控的钙编码器感应硝态氮浓度的变化[40],这些都是以CNGCs为骨架装配而成的钙信号编码器。另一类是2014年发现的受体类型的钙离子通道CSCs/OSCAs, 它是植物中第一个感受高渗反应的受体类蛋白CSCs家族[7]。同年,另外一个研究组也确认了这一结果并将其命名为OSCAs[41],随后引起了结构生物学家和动物神经生物学家的追逐与关注。近几年,发现了拟南芥CSCs家族中的AtCSC1、AtCSC2、AtCSC8、AtCSC9和AtCSC14 5个成员,都属于机械或牵张刺激敏感的阳离子通道[9,10]。目前,有关水稻CSCs家族蛋白功能的研究很少,只有OsCSC4被报道与拟南芥CSC1具有类似的转运功能[26]。本研究鉴定了OsCSC11的功能,明确了OsCSC11作为受体功能结构域和通道功能结构域的差别,发现了受体结构域抑制通道本身活性的特点,细胞膜的牵张可以消除这种抑制作用,使处于静息状态的OsCSC11通道被激活,这一现象类似动物TRPs蛋白[42,43,44,45,46],温度或压力变化产生瞬时钙电流或信号,将受体功能与通道功能整合到同一个分子中。这一发现揭示了作物受体类钙通道产生或编码钙信号的完美分子基础[47,48],也为钙信号编码的研究提供了更为简洁的分子开关模式。另外,本研究所取得的进展和结论为理解干热风造成的作物不育和减产提供了新的研究思路,由于干热风的不可预测性,它是造成小麦等农作物减产的重要原因之一,对开花到乳熟期间的小麦危害极大,水稻在扬花期偶遇干热风也会造成不可逆转的伤害。干热风造成的危害主要是3种物理性的逆境刺激引起,可以分解为干(即干旱)、热(高温)和风(机械刺激),都影响细胞膜的稳定性。因此,干热风造成的伤害实际上是一种扰动细胞膜的机械伤害,从现有的报道已经发现动物CSCs介导粗粒食物的适口性[11],哺乳动物的听觉信号[12],酵母、人与拟南芥和水稻的CSCs功能类似[7,9,26],可以被高渗溶液激活,这些特征背后的本质功能就是传递机械力造成细胞膜形变效应,也就是说物理性刺激导致的任何膜的压力或动态变化都有可能激发CSCs蛋白的通道活性。虽然我们在离体的条件下,只研究了模拟干旱/高渗溶液激活的OsCSC11,结合已经报道的同源蛋白的功能研究和结构解析,有理由推测OsCSC11也很可能被干热风,这类导致细胞膜型变的物理因素激活。当然,这需要进一步的研究将干热风这类混合的物理性刺激细分为干旱、高温和机械刺激,再进一步分辨出这三因素中其中谁是调控OsCSC11的主要刺激因素或者三者的综合效应都共同起作用。由于oscsc11突变体植株表现的雄蕊弱小、花药表面蹙皱、弯曲以及花粉败育等特征与已经多次报导的水稻或小麦等作物遭遇干热风的伤害表型非常相似,因此,有理由相信OsCSC11的缺失阻断了干热风逆境的感应和信号传递,不能启动相应的快速应对机制,使水稻对抗干热风的能力减弱,因此,造成配子体发育异常的表型,这种干热风造成的快速失水现象与花粉成熟过程中的脱水是2个不同的生理反应,前者是逆境刺激后的被动过程,而后者缓慢的脱水过程属于自发的主动反应,OsCSC11是否参与主动过程的脱水反应尚需进一步研究。这一机制的揭示不仅解释了水稻雄蕊受干热风伤害,导致减产的原因,也为其它更易被干热风危害的作物,如小麦等作物应对不可预测的干热风造成的危害,提供了基因操作候选分子和研究思路。
4 结论
OsCSC11通常处于静息状态,可被高渗溶液激活介导钙离子内流,具有受体和通道双重功能的作用方式,调控花药水分含量和花粉发育,可能参与了水稻雄蕊应对干热风的原初感应过程。致谢:
中国农业科学院生物技术研究所路铁刚研究员课题组在水稻遗传转化方面给予的帮助,在此感谢。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1105/tpc.11.4.691URL [本文引用: 1]
DOI:10.1038/35067109URL [本文引用: 1]
[本文引用: 3]
DOI:10.1111/nph.14966URL [本文引用: 3]
DOI:10.1104/pp.113.220855URL [本文引用: 2]
DOI:10.1016/j.tplants.2012.12.003URL [本文引用: 1]
DOI:10.1038/cr.2014.14URL [本文引用: 5]
DOI:10.1038/s41594-018-0117-6URL [本文引用: 1]
DOI:10.7554/eLife.41844URL [本文引用: 3]
DOI:10.7554/eLife.41845URL [本文引用: 2]
DOI:10.1016/j.cub.2020.09.070URL [本文引用: 2]
DOI:10.1016/j.celrep.2020.107596URL [本文引用: 2]
URL [本文引用: 1]
[本文引用: 1]
DOI:10.1111/ppl.v169.4URL [本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.envexpbot.2018.08.021URL [本文引用: 1]
DOI:10.1016/j.plaphy.2017.03.011URL [本文引用: 1]
DOI:10.1016/S1672-6308(12)60055-9URL [本文引用: 1]
DOI:10.1626/jcs.47.6URL [本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1626/jcs.66.449URL [本文引用: 1]
DOI:10.1626/jcs.47.6URL [本文引用: 1]
DOI:10.1626/pps.4.90URL [本文引用: 1]
DOI:10.1016/j.ceca.2020.102261URL [本文引用: 3]
DOI:10.1006/meth.2001.1262URL [本文引用: 1]
[本文引用: 1]
DOI:10.1038/342837a0URL [本文引用: 1]
DOI:10.1038/nprot.2007.199URL [本文引用: 1]
DOI:10.1007/s002990050743URL [本文引用: 1]
DOI:10.1016/j.molp.2017.02.007URL [本文引用: 1]
DOI:10.1016/j.devcel.2018.12.025URL [本文引用: 2]
DOI:10.1038/s41586-019-1413-yURL [本文引用: 2]
DOI:10.1105/tpc.109.072686URL [本文引用: 1]
DOI:10.1038/35036035URL [本文引用: 1]
DOI:10.1093/aob/mcf228URL [本文引用: 2]
DOI:10.2174/1389202917666160331202125URL [本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.molp.2021.02.005URL [本文引用: 1]
DOI:10.1038/nature13593URL [本文引用: 1]
[本文引用: 1]
DOI:10.1038/39807URL [本文引用: 1]
DOI:10.1016/S0092-8674(02)00652-9URL [本文引用: 1]
DOI:10.1038/nature719URL [本文引用: 1]
DOI:10.1038/s41585-021-00428-6URL [本文引用: 1]
[本文引用: 1]
DOI:10.1016/S0092-8674(03)00071-0URL [本文引用: 1]
