 ,1,2, 武强2,3, 杨念婉2, 黄聪3, 刘万学2, 钱万强3, 万方浩
,1,2, 武强2,3, 杨念婉2, 黄聪3, 刘万学2, 钱万强3, 万方浩 ,1,2,3
,1,2,3Gene Cloning, Expression Pattern and Molecular Characterization of Chitin Deacetylase 2 in Cydia pomonella
SHI GuoLiang ,1,2, WU Qiang2,3, YANG NianWan2, HUANG Cong3, LIU WanXue2, QIAN WanQiang3, WAN FangHao
,1,2, WU Qiang2,3, YANG NianWan2, HUANG Cong3, LIU WanXue2, QIAN WanQiang3, WAN FangHao ,1,2,3
,1,2,3通讯作者:
责任编辑: 岳梅
收稿日期:2020-05-27接受日期:2020-07-3网络出版日期:2021-05-16
| 基金资助: |
Received:2020-05-27Accepted:2020-07-3Online:2021-05-16
作者简介 About authors
石国良,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (2146KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
石国良, 武强, 杨念婉, 黄聪, 刘万学, 钱万强, 万方浩. 苹果蠹蛾几丁质脱乙酰基酶2的基因克隆、表达模式和分子特性[J]. 中国农业科学, 2021, 54(10): 2105-2117 doi:10.3864/j.issn.0578-1752.2021.10.007
SHI GuoLiang, WU Qiang, YANG NianWan, HUANG Cong, LIU WanXue, QIAN WanQiang, WAN FangHao.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】苹果蠹蛾(Cydia pomonella)属鳞翅目卷蛾科,寡食性害虫,主要以幼虫钻蛀苹果、梨、桃和杏等水果的果实危害,该虫原产欧洲,20世纪50年代入侵我国,是我国重要的检疫对象[1,2,3]。几丁质普遍存在于许多无脊椎动物以及大多数真菌和藻类的细胞壁中,昆虫几丁质主要存在于表皮、围食膜和气管等组织中,对维持外骨骼和组织的形状和大小以及蜕皮过程的顺利完成起着至关重要的作用[4,5]。昆虫蜕皮和生长发育必须经历周期性去旧表皮和合成新表皮的过程,这一过程伴随着几丁质的合成和降解[6]。几丁质代谢酶参与昆虫表皮和围食膜中几丁质的形成,在昆虫蜕皮发育等生命活动中具有重要的生理功能[7,8,9,10]。因此,着手于参与昆虫几丁质代谢途径的酶的研究以开发新型杀虫剂成为研究热点[11,12,13,14],如除虫脲是几丁质合成抑制剂,已经被用作杀虫剂广泛使用[15]。【前人研究进展】几丁质脱乙酰基酶(chitin deacetylase,简称CDA,EC 3.5.1.41)是一种催化几丁质转化为壳聚糖的修饰酶,在几丁质代谢系统中发挥重要作用[16]。根据功能域和系统发育关系CDA可分为5大类,第1类和第2类都含有几丁质结合域(ChBD)、低密度脂蛋白受体(LDLa)和催化域(CDA)3个功能域,第3类和第4类都含有催化域CDA,但其他功能域部分或全部缺失,第5类只含有CDA功能域[17,18],各类CDA基因分布于昆虫不同组织/器官并且在不同时期差异表达,表明其在昆虫各发育时期发挥着不同的生理功能[19]。另外,蜕皮激素(20E)对昆虫的发育、变态和繁殖等起着至关重要的作用,几丁质酶的活性也受蜕皮激素诱导的反应的调节,在一些鳞翅目昆虫中,几丁质酶基因受到20E的影响,在家蚕(Bombyx mori)CDA2的研究中,经蜕皮激素诱导后BmCDA表达量上调[20]。其中CDA2属于第1类,在多种昆虫中其CDA2存在两个可变剪切转录本,通过RNAi技术抑制云杉卷叶蛾(Choristoneura fumiferana) [21]和美国白蛾(Hyphantria cunea)[22]幼虫中CDA2两个剪切体的表达后,其幼虫的生长发育均受到抑制甚至死亡;而对中华稻蝗(Oxya chinensis)[6]CDA2的研究发现,该基因的两个剪切体中只有OcCDA2a在其蜕皮过程中发挥重要作用,OcCDA2b则对其正常发育无显著影响。【本研究切入点】苹果蠹蛾作为我国重要的入侵害虫,近年来呈现出快速扩张的趋势,对我国苹果产业构成了严重威胁,亟需开发更加高效的防控技术。而CDA作为几丁质合成代谢的关键酶,对昆虫的生长发育具有重要功能,是新型杀虫剂的重要作用靶标之一,对苹果蠹蛾CDA2的研究有助于防控苹果蠹蛾新型农药的开发。【拟解决的关键问题】鉴定苹果蠹蛾CDA2的序列及其可变剪切情况,分析其基因结构并检测在不同发育时期、组织以及注射蜕皮激素后两个剪切体(CpCDA2a和CpCDA2b)的表达情况,比较二者的蛋白结构、性质和功能,为后续筛选和开发以几丁质合成相关通路为靶标的新型杀虫剂提供理论依据。1 材料与方法
试验于2019—2020年在中国农业科学院植物保护研究所完成。1.1 供试昆虫
苹果蠹蛾原始种群于2013年11月从甘肃省酒泉市果园采集,使用人工饲料在室内饲养并建立稳定种群,已连续饲养60余代。饲养温度为(26±0.5)℃,相对湿度为(70 ±10)%,光周期为16L:8D。1.2 试验试剂
总RNA提取所需试剂为组织/细胞RNA快速提取试剂盒,购于北京金百特生物技术有限公司;cDNA第一链合成所需试剂为Hifair?Ⅲ 1st Stand cDNA Synthesis SuperMix for qPCR反转录试剂盒,购于上海翊圣生物科技有限公司;RT-qPCR所需试剂为Hieff? qPCR SYBR Green Master Mix(Low Rox),购于上海翊圣生物科技有限公司;PCR扩增所需试剂为TransStart Taq DNA Polymerase、10×TransStart Taq Buffer、dNTPs,均购于TransGen Biotech;凝胶回收试剂盒购于北京天漠科技开发有限公司;克隆试剂盒pClone007 Simple Vector Kit和感受态细胞Tsurbo Chemically Competent Cell购于北京擎科新业生物技术有限公司;引物合成和测序均由上海生工生物工程股份有限公司(简称生工)完成。1.3 目的基因的鉴定、扩增和克隆测序
在NCBI网站下载部分已发表的昆虫CDA2蛋白序列,然后以这些蛋白序列为查询序列(query),通过本地BLAST在苹果蠹蛾转录组数据中进行比对,鉴定苹果蠹蛾CDA2的全长CDS序列。根据其序列信息,使用Vector NTI软件设计其基因全长克隆引物(表1)。采用RNA提取试剂盒提取苹果蠹蛾5龄幼虫的总RNA,使用反转录试剂盒合成第一链cDNA,然后进行PCR扩增,程序为95℃预变性5 min,然后进行如下循环,95℃变性30 s,50℃退火1 min,72℃延伸2 min,共35个循环;最后72℃延伸10 min。PCR产物经过1%琼脂糖凝胶电泳分离出含有目的条带的胶块,使用凝胶回收试剂盒对PCR产物进行纯化,然后按照试剂盒说明书将纯化后的PCR产物连接到pClone007 Simple Vector载体上,用移液枪吸取5 μL连接产物轻轻加入置于冰上并刚解冻的50 μL感受态细胞中,轻轻混匀,冰上放置5 min,42℃水浴热激45 s,迅速转移至冰浴中,静置2 min,加入500 μL不含抗生素的LB液体培养基,然后取200 μL均匀涂布到含氨苄青霉素的LB固体培养基上,37℃培养箱倒置过夜培养,从平板中挑选单克隆菌落,通过菌落PCR筛选阳性克隆,摇菌培养后送生工测序。
Table 1
表1
表1本研究中所用引物信息
Table 1
| 基因名称 Gene name | 引物序列 Primer sequence (5′-3′) | 产物长度 Product length (bp) | 用途 Application |
|---|---|---|---|
| CpCDA2a/CpCDA2b | F: CAGTCCTCGGCGAGCGTTAT | 1858/1841 | cDNA克隆 cDNA cloning |
| R: CCACGCAAAAGGCATTCCAA | |||
| CpCDA2a | qFc: TGTTGCTTGCTTGCTTCGTTAG | 176 | 荧光定量PCR RT-qPCR |
| qRa: GTTCTCGCCGCCCTTGTC | |||
| CpCDA2b | qFc: TGTTGCTTGCTTGCTTCGTTAG | 233 | |
| qRb: CCAGTCGCAGGTTTGTTTATCG | |||
| Cpβ-tubulin | qF: GCGGGAACCAGATTGGAGCTAA | 267 | |
| qR: ACTGGCCGAACACGAAGTTGTC |
新窗口打开|下载CSV
1.4 生物信息学分析
CpCDA2a和CpCDA2b的CDS序列分别通过本地BLAST与苹果蠹蛾基因组数据比对得到外显子和内含子的位置信息,并用IBS1.0软件绘制基因结构示意图。通过Pfam网站(1.5 荧光定量PCR(RT-qPCR)
基于CpCDA2a和CpCDA2b的可变剪切分析,使用Vector NTI软件分别设计基因的RT-qPCR引物(表1),上游共同引物在第2个外显子上,下游引物分别在其差异外显子上(图1-A)。将cDNA稀释10倍作为模板,反应体系为Hieff?qPCR SYBR Green Master Mix(Low Rox)10 μL,模板1 μL,上游和下游定量引物分别0.4 μL,ddH2O 8.2 μL。扩增程序为95℃ 5 min,95℃ 10 s,60℃ 34 s,共40个循环,熔解曲线程序为95℃ 15 s,60℃ 1 min,95℃ 30 s。每个样本设置3个技术重复,以Cpβ-tubulin作为内参基因,采用2-ΔΔCt方法对数据进行分析,使用R version 3.5.1软件单因素方差分析(one-way ANOVA)的LSD法进行显著性分析,使用GraphPad Prism6.0软件进行作图。1.6 不同发育时期和幼虫不同组织的相对表达量分析
通过苹果蠹蛾不同发育时期,包括卵、1—3龄幼虫、4龄早期幼虫、4龄中期幼虫、4龄晚期幼虫、5龄早期雌雄幼虫、5龄中期雌雄幼虫、1日龄雌雄蛹、5日龄雌雄蛹、9日龄雌雄蛹、雌雄成虫的转录组测序数据(未发表),采用RSEM(RNA-Seq by Expectation Maximization)方法计算各样本中CpCDA2a和CpCDA2b的FPKM(Fragments Per Kilobase per Million)值,作为苹果蠹蛾不同发育时期的相对表达量。收集苹果蠹蛾4龄第2天幼虫,在解剖镜下快速解剖收集表皮、头、中肠、马氏管、唾液腺、血淋巴和脂肪体,迅速冻于液氮中,共设置3个生物学重复。采用RNA提取试剂盒分别提取7个组织部位的总RNA,以1 μg总RNA为模板使用反转录试剂盒去除基因组DNA后合成第一链cDNA。采用RT-qPCR技术检测CpCDA2a和CpCDA2b在苹果蠹蛾幼虫不同组织的相对表达量。1.7 注射蜕皮激素(20E)后CpCDA2a和CpCDA2b的表达分析
选取5龄第2天苹果蠹蛾幼虫进行20E处理。先将20E溶于含0.1%二甲基亚砜(DMSO)的PBS缓冲液,配置成1 μg·μL-1的溶液,将此浓度的20E溶液采用显微注射方法注射到幼虫胸足位置。对照组注射等体积的PBS缓冲液,分别于注射后24 h和48 h取样,提取总RNA,反转录并进行RT-qPCR检测,分析CpCDA2a和CpCDA2b在注射20E后不同时间的表达动态。采用GraphPad Prism6.0软件的独立样本T检验(T-test)进行差异显著性分析。2 结果
2.1 CpCDA2a和CpCDA2b的基因结构及其蛋白结构域分析
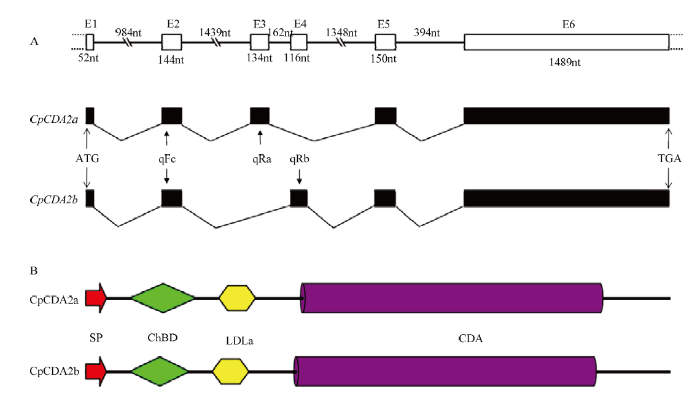
基于已知昆虫的CDA2序列信息,通过同源比对在苹果蠹蛾转录组数据中获得了苹果蠹蛾CDA2的两个不同转录本,分析发现与其他昆虫中类似,这两个转录本也是可变剪切体,将其分别命名为CpCDA2a和CpCDA2b。通过PCR扩增和克隆测序,发现测序结果与转录组中的序列一致,两个基因的CDS长度分别为1 629和1 611 bp,分别编码542和536个氨基酸。基因结构分析显示,两个基因均包含5个外显子和5个内含子,其中第3个外显子存在差异(图1-A)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1CpCDA2a和CpCDA2b基因结构和蛋白结构域分析
A:CpCDA2基因结构和CpCDA2a、CpCDA2b的选择性剪切,白色框和黑色线段分别表示外显子和内含子,黑色实心方框表示编码序列,ATG和TGA分别表示起始和终止密码子Gene structure of CpCDA2 and alternatively spliced CpCDA2a, CpCDA2b, white boxes and black lines indicate exons and introns, black solid boxes indicate coding sequence, ATG and TGA indicate start and end codons;B:红色箭头为信号肽,绿色菱形为几丁质结合域,黄色六边形为低密度脂蛋白受体域,紫色圆柱为催化功能域The red arrow indicates signal peptide (SP), green diamond indicates chitin binding domain (ChBD), yellow hexagon indicates low density lipoprotein receptor class A domain (LDLa), purple cylinder indicates chitin deacetylase catalytic domains (CDA)
Fig. 1Genome structure and protein domain analysis of CpCDA2a and CpCDA2b
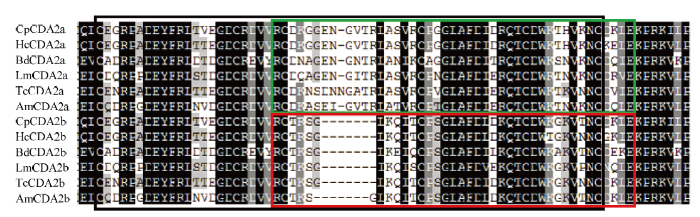
功能域分析表明,CpCDA2a和CpCDA2b蛋白均具有信号肽(SP)、几丁质结合域(ChBD)、低密度脂蛋白受体域(LDLa)和几丁质脱乙酰基催化域(CDA)功能域,其中仅有ChBD存在差异,CpCDA2a和CpCDA2b的ChBD分别包含62个和56个氨基酸(图1-B)。另外,通过不同昆虫CDA2蛋白两个剪切体差异区域序列比对发现,各昆虫两个剪切体的差异序列大部分在ChBD结构域中,其中CpCDA2a和CpCDA2b共有18个差异氨基酸序列,均分布于ChBD结构域中(图2)。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同昆虫CDA2部分氨基酸序列的多重比对
黑色方框代表几丁质结合域,绿色方框代表第3个外显子(E3),红色方框代表第4个外显子(E4)
Fig. 2Multiple alignment of CDA2 with partial amino acid sequences among different insects
The black box indicates chitin binding domain (ChBD), green box indicates the 3rd exon (E3), red box indicates the 4th exon (E4)
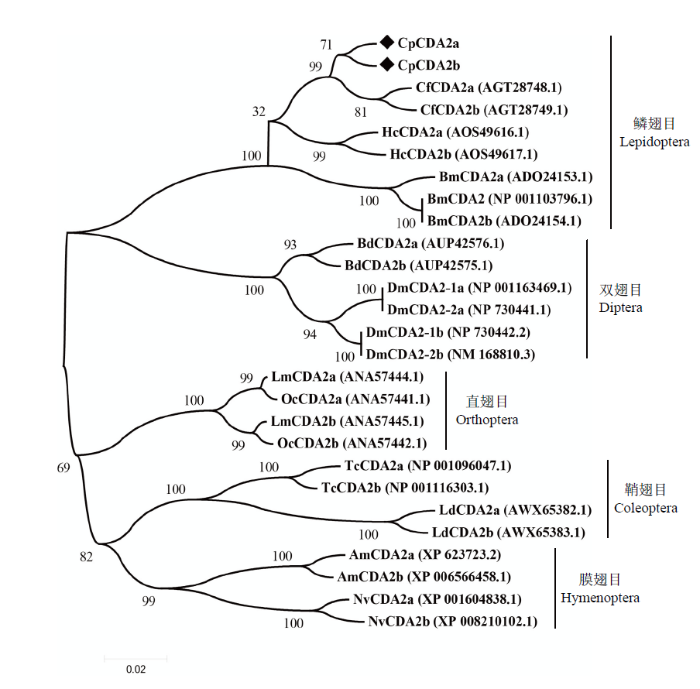
2.2 CDA2蛋白聚类进化分析
选取不同昆虫CDA2氨基酸序列构建系统发育树,结果显示相同目昆虫的CDA2均以较高的置信度聚为一支,其中苹果蠹蛾CpCDA2a和CpCDA2b与云杉卷叶蛾CfCDA2a 和CfCDA2b进化关系最近。并且除直翅目的两种昆虫外,本研究所选其他昆虫均为本物种的CDA2a和CDA2b首先聚为一支,再与近缘种聚到一起,而直翅目中的飞蝗(Locusta migratoria)和中华稻蝗首先是不同物种的同一剪切类型分别聚为一支,然后两种剪切类型再聚到一起(图3),对其序列分析发现这可能与本研究所选取的不同目中的不同昆虫间亲缘关系的远近程度有关。另外,黑腹果蝇(Drosophila melanogaster)中两个剪切体分别又存在两个不同的亚型,可能是在基因组上发生了扩增现象,这在进化上值得进一步深入分析。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3不同昆虫CDA2氨基酸序列的进化关系分析
Cp:苹果蠹蛾Cydia pomonella;Lm:飞蝗 Locusta migratoria;Hc:美国白蛾Hyphantria cunea;Cf:云杉卷叶蛾Choristoneura fumiferana;Tc:赤拟谷盗Tribolium castaneum;Bm:家蚕Bombyx mori;Bd:橘小实蝇Bactrocera dorsalis;Dm:黑腹果蝇Drosophila melanogaster;Am:西方蜜蜂Apis mellifera;Nv:丽蝇蛹集金小蜂Nasonia vitripennis;Ld:马铃薯甲虫Leptinotarsa decemlineata;Oc:中华稻蝗Oxya chinensis
Fig. 3Analysis of evolutionary relationship among CDA2 amino acid sequences of different insects
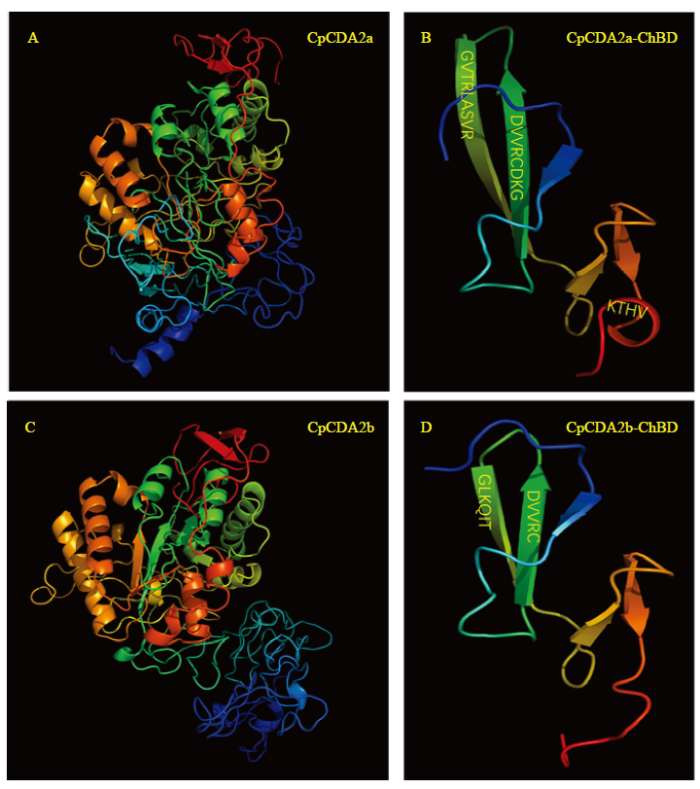
2.3 CpCDA2a和CpCDA2b的蛋白三维结构预测
利用Phyre2在线网站和PyMol软件构建CpCDA2a和CpCDA2b蛋白三维结构模型。从图中可以看出,苹果蠹蛾两个CDA2蛋白的三维结构整体上十分相似(图4-A、4-C)。根据多序列比对结果可知,两个CDA2蛋白间的差异序列位于ChBD功能域,所以将两个蛋白该区域的序列分别独立构建了三维结构模型(图4-B、4-D),发现两者的ChBD功能域均含有5个β-转角,但CpCDA2a的ChBD比CpCDA2b多了1个α-螺旋,并且CpCDA2a的ChBD中有2个β-转角均比CpCDA2b的ChBD对应的2个β-转角长约3个氨基酸,其中1个的氨基酸序列差异较大,这些结构上的差异会导致其分子特性发生变化,也可能会造成其功能上的分化。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4CpCDA2a和CpCDA2b的蛋白三维结构
A:CpCDA2a蛋白全长三维结构Overall structure of CpCDA2a protein;B:CpCDA2a蛋白中ChBD功能域三维结构ChBD domain structure of CpCDA2a protein;C:CpCDA2b蛋白全长三维结构Overall structure of CpCDA2b protein;D:CpCDA2b蛋白中ChBD功能域三维结构ChBD domain structure of CpCDA2b protein
Fig. 4Three-dimensional structure of CpCDA2a and CpCDA2b proteins
2.4 CpCDA2a和CpCDA2b的蛋白理化性质
CpCDA2a和CpCDA2b蛋白的氨基酸长度分别为542和536 aa,两个蛋白的分子量相近、等电点相同,均具有2个相同的N-糖基化位点和5个相同的O-糖基化位点,但CpCDA2a在差异位置(T37)比CpCDA2b多1个O-糖基化位点(表2)。Table 2
表2
表2CpCDA2a和CpCDA2b蛋白性质
Table 2
| 蛋白性质 Protein property | 蛋白名称 Protein name | |
|---|---|---|
| CpCDA2a | CpCDA2b | |
| 氨基酸长度Amino acid length | 542 aa | 536 aa |
| 分子量Molecular weight | 61.58354 kD | 60.94991 kD |
| 等电点Theoretical pI | 5.30 | 5.30 |
| N-糖基化位点N-glycosylation | N30, N296 | N30, N290 |
| O-糖基化位点O-glycosylation | S19, T37*, T174, T273, S274, T383 | S19, T168, T267, S268, T377 |
新窗口打开|下载CSV
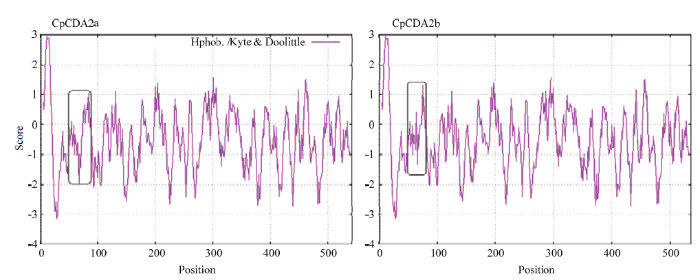
亲/疏水分析发现,两个蛋白亲水和疏水氨基酸都在整个肽链中的分布比较均匀,分别占总氨基酸的65.10%和34.90%,第11位氨基酸分值最高2.967,第28位分值最低为-3.144。而两者在61—76区域亲/疏水性有较大差异(图5),如图中灰色方框所示,在此区域其氨基酸亲/疏水分值最高峰都在第76位,CpCDA2a为0.667,而CpCDA2b则高达1.322;最低峰都在第67位,CpCDA2a为-1.956,远低于CpCDA2b的-1.333;并且从61—67位两者氨基酸亲/疏水分值都呈下降趋势,但CpCDA2a的下降趋势更剧烈,且该区段其每个氨基酸亲/疏水分值都小于CpCDA2b所对应位置的氨基酸分值。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5CpCDA2a和CpCDA2b蛋白亲/疏水性分析
灰色方框表示CpCDA2a和CpCDA2b蛋白差异区域,横坐标为序列位置,纵坐标为氨基酸的标度值(>0表示疏水性,<0表示亲水性)
Fig. 5Hydrophilic/hydrophobic analysis of CpCDA2a and CpCDA2b
Gray boxes indicate the difference of CpCDA2a and CpCDA2b, the abscissa is the sequence position and the ordinate is the scale value of the amino acid (>0 means hydrophobicity, <0 means hydrophilicity)
2.5 CpCDA2a和CpCDA2b在苹果蠹蛾不同发育阶段的差异表达分析
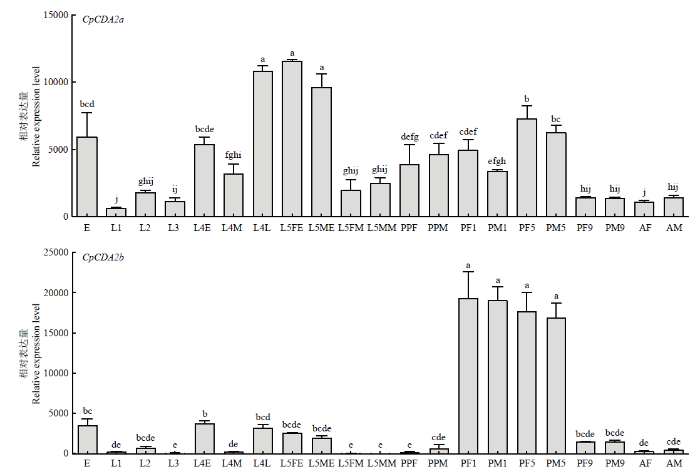
CpCDA2a和CpCDA2b在苹果蠹蛾各发育阶段均有表达,且相同基因在不同发育阶段的雌、雄虫间的表达量均无显著差异,其中CpCDA2a在幼虫期的蜕皮前后(4龄末期、5龄初期和4龄初期)、卵期以及蛹中期显著高表达,而幼虫各龄期的中期以及蛹末期和成虫中表达量较低;CpCDA2b在蛹的前期和中期显著极高表达,幼虫期的蜕皮前后和卵期显著高表达,而幼虫各龄期的中期以及蛹末期和成虫中表达量均较低。另外,CpCDA2a在4龄末和5龄初幼虫中高表达,且其表达量显著高于CpCDA2b,约为其3—5倍;而CpCDA2b在蛹前期和中期高表达,且其表达量显著高于CpCDA2a,约为其2—5倍,值得注意的是在预蛹期时CpCDA2b的表达量极低,化蛹第1天急剧升高,除此之外,在其他发育阶段两个基因的表达量基本无明显差异(图6)。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6CpCDA2a和CpCDA2b在苹果蠹蛾不同发育时期的表达量
E:卵Egg;L1—L3:1—3龄幼虫 1st-3rd instar larva;L4E—L4L:4龄早、中、晚期幼虫 Early, mid, late 4th instar larva;L5FE、L5ME:5龄早期雌、雄幼虫 Early 5th instar female, male larva;L5FM、L5MM:5龄中期雌、雄幼虫Mid 5th instar female, male larva;PPF、PPM:雌、雄虫预蛹Female, male prepupa;PF1、PM1:1日龄雌、雄蛹 1-day-old female, male pupa;PF5、PM5:5日龄雌、雄蛹 5-day-old female, male pupa;PF9、PM9:9日龄雌、雄蛹 9-day-old female, male pupa;AF、AM:雌、雄成虫 Female, male adult
β-tubulin为内参,柱上不同字母代表同一基因在不同样本间的表达水平差异显著(P<0.05)。下同
Fig. 6The relative expressions of CpCDA2a and CpCDA2b at different developmental stages of C. pomonella
β-tubulin is the reference, different letters on the bars mean significant difference of the same gene among different samples (P<0.05). The same as below
2.6 CpCDA2a和CpCDA2b在苹果蠹蛾幼虫不同组织特异表达分析
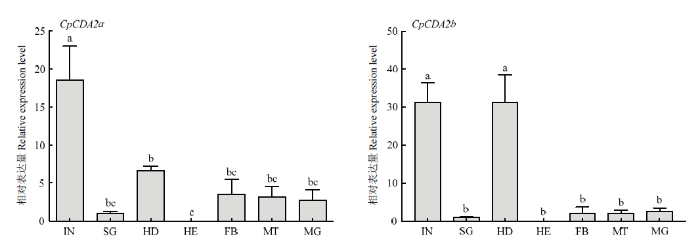
CpCDA2a和CpCDA2b在7个组织中均有表达,且都是在表皮中表达量最高,头部次之,但CpCDA2b在头部的表达量与表皮相差较小,无显著差异,而CpCDA2a在头部的表达量显著低于表皮;其他组织中两个基因的表达量均较低,而在血淋巴中几乎不表达,这与其生物学功能是相符的(图7)。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7CpCDA2a和CpCDA2b在苹果蠹蛾4龄幼虫不同组织部位的表达量
IN:表皮 Integument;SG:唾液腺Salivary gland;HD:头部 Head;HE:血淋巴 Hemolymph;FB:脂肪体Fat body;MT:马氏管 Malpighian tubule;MG:中肠 Midgut
Fig. 7The relative expressions of CpCDA2a and CpCDA2b in different tissues of C. pomonella 4th instar larvae
2.7 注射20E后CpCDA2a和CpCDA2b的表达分析
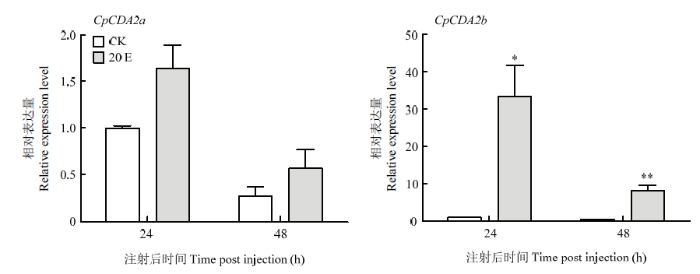
为了分析CpCDA2a和CpCDA2b的表达是否受蜕皮激素的影响,选取5龄第2天苹果蠹蛾幼虫,分别注射20E溶液和对照缓冲液,采用RT-qPCR技术检测两个基因的表达情况(图8)。结果显示,与对照相比在注射20E后两个基因表达量均呈现出上调趋势,但CpCDA2a在注射20E后24 h和48 h的表达量与对照相比差异均不显著,而注射20E后CpCDA2b在两个时间点的表达量均显著高于对照,在24 h为对照的40倍左右,48 h时其表达量有所回落,但仍达到对照表达量的20倍。图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8注射20E不同时间后CpCDA2a和CpCDA2b的表达量
*: P<0.05; **: P<0.01
Fig. 8Gene expression levels of CpCDA2 and CpCDA2b after 20E injection
3 讨论
几丁质脱乙酰基酶(CDA)是一种糖酯酶家族的金属酶,它能够催化几丁质β-1,4糖苷键连接的N-乙酰基葡糖胺的乙酰胺基水解,形成脱乙酰几丁质(即壳聚糖),在几丁质代谢中起重要作用[23,24,25]。CDA已在真菌、细菌和昆虫等物种中被广泛发现并研究,在昆虫中CDA可通过使几丁质脱乙酰基形成壳聚糖来参与昆虫发育过程中表皮、气管和肠道等器官的形成,调节其幼虫蜕皮过程,还具有抵抗病原菌的功能[16,20,26]。在赤拟谷盗(Tribolium castaneum)[18]中根据包含功能域的不同,将其9个CDA分为5类,其中CDA1和CDA2属于第1类,而且CDA2包含两个可变剪切转录本,并且已在多种昆虫中被鉴定和研究[6,21-22,27]。与其他昆虫的CDA2相似,苹果蠹蛾CDA2也存在两个可变剪切转录本,分别命名为CpCDA2a和CpCDA2b,两者的蛋白序列均包含信号肽以及几丁质结合域(ChBD)、低密度脂蛋白受体域(LDLa)和几丁质脱乙酰基催化域(CDA)3个功能域。蛋白质的结构与其功能密切相关,个别关键位置氨基酸的差异都可能导致其功能活性方面的较大变化,CpCDA2a和CpCDA2b仅在ChBD功能域区域有18个氨基酸的差异,通过对其三维结构的模拟与比较发现,该结构域的三维结构存在较大差异,这很可能导致其可以结合并催化水解的几丁质类型间的不同,从而使其在功能上存在较大差异。进一步分析了两者亲/疏水性、等电点和糖基化修饰位点等,其中亲/疏水性在差异区域有显著区别,这可能与其需结合催化的几丁质类型相适应;而且该差异区中CpCDA2a比CpCDA2b多一个O-糖基化位点,糖基化是一种重要的蛋白修饰类型,对维持蛋白的空间构象和保护其免受蛋白水解酶的降解具有重要意义,这表明两个蛋白间发挥功能的环境和条件可能也存在差异。
CDA在昆虫的不同发育阶段和组织中的表达模式存在多样性,这与其所发挥的生物学功能相关。目前,研究者已对褐飞虱(Nilaparvata lugens)[28]、橘小实蝇(Bactrocera dorsalis)[29]、马铃薯甲虫(Leptinotarsa decemlineata)[30]、云杉卷叶蛾[21]、家蚕[19]、中华稻蝗[6]及美国白蛾[22]等多种昆虫中CDA2的发育阶段和组织表达情况进行了研究。对中华稻蝗CDA2的研究发现,OcCDA2a在前肠中表达量最高,其次是表皮和后肠,而OcCDA2b在表皮中表达量最高,其次是前肠,根据其不同的表达特点,推测其功能发生了分化[6]。本研究中苹果蠹蛾CDA2的两个剪切体都是在表皮中表达量最高,其中CpCDA2a仅在表皮中特异性显著高表达,而CpCDA2b除在表中显著高表达外,头部的表达量也与其相近,推测该基因的两个剪切体在幼虫的发育过程中所发挥的功能也有一定程度的差异。在发育阶段表达方面,多种昆虫中CDA2两个剪切体均在蜕皮第1天后表达量最高,之后逐渐下降,可能参与新表皮的鞣化和骨化[6],本研究中苹果蠹蛾CDA2两个剪切体在幼虫期都是蜕皮前后的表达量最高,推测其在昆虫蜕皮和新表皮的形成过程发挥重要作用,而且它们在不同发育阶段的总体表达模式也有较大差异,CpCDA2a主要在幼虫期高表达,而CpCDA2b主要在化蛹前期和中期高表达,因此CpCDA2b对苹果蠹蛾蛹壳中几丁质的合成和代谢具有更重要的作用。另外,对5龄幼虫注射20E后,两个剪切体均表现出不同程度的上调,其中CpCDA2b显著且剧烈上调,结合其不同发育阶段中幼虫蜕皮前后的表达量显著高于幼虫龄期中间阶段,表明其在幼虫蜕皮过程中也发挥重要作用,而CpCDA2a的上调趋势不显著,其在幼虫蜕皮过程中的作用有待通过RNAi等技术进一步深入研究。
在其他昆虫中开展的RNAi试验结果也验证了昆虫CDA2不同剪切体的功能特异性。如通过RNAi降低赤拟谷盗TcCDA2a的表达量后,主要影响其股胫关节的运动,而TcCDA2b表达量下调则导致背侧褶皱[13];在马铃薯甲虫中,干扰LdCDA2a既不影响食物摄取,也不影响发育时间,而干扰LdCDA2b后幼虫生长发育迟缓,发育期延长,不能正常蜕皮最终死亡[30]。在美国白蛾、中华稻蝗和飞蝗中,干扰CDA2a的表达会导致非正常生物型和高死亡率,而CDA2b表达降低后不影响昆虫的正常生长发育[6,22,31]。另外,赵盼等从酶学角度研究了飞蝗CDA2两个剪切体的差异[32],为RNAi后导致飞蝗表型不同可能是由于它们催化功能不同的推断提供了理论支持。但由于苹果蠹蛾RNAi效果很差且不稳定[33],无论通过注射还是饲喂CDA2的dsRNA,均不能显著降低其表达量(未发表数据),后续可通过RNAi技术体系的优化来进一步验证两个剪切体的生物学功能。
4 结论
克隆并验证了苹果蠹蛾CDA2的全长cDNA序列,该基因存在两个可变剪切体CpCDA2a和CpCDA2b;通过综合分析CpCDA2a和CpCDA2b分子特性、发育阶段和组织表达谱、以及注射蜕皮激素后表达动态等,推测两者可能都参与了苹果蠹蛾蜕皮和新表皮形成过程,但由于可变剪切序列差异所导致的蛋白结构和理化性质上的差异,造成了两者在功能上的分化,该研究结果为苹果蠹蛾绿色新型农药开发中的靶标选择提供了科学依据。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1038/s41467-019-12175-9URL [本文引用: 1]
DOI:10.1006/frne.2002.0228URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 7]
[本文引用: 7]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1128/JVI.01860-09URL [本文引用: 1]
DOI:10.1016/S0965-1748(97)00078-7URL [本文引用: 2]
DOI:10.1074/jbc.RA119.007597URL [本文引用: 1]
DOI:10.1016/j.ibmb.2011.12.008URL [本文引用: 1]
DOI:10.1016/S0167-7799(00)01462-1URL [本文引用: 2]
DOI:10.1016/j.ibmb.2009.02.002URL [本文引用: 1]
DOI:10.1016/j.ibmb.2007.12.002URL [本文引用: 2]
[D].
[本文引用: 2]
[D].
[本文引用: 2]
DOI:10.3390/ijms20071679URL [本文引用: 2]
DOI:10.1016/j.ibmb.2013.04.005URL [本文引用: 3]
DOI:10.1016/j.gene.2018.05.069URL [本文引用: 4]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.cub.2005.11.072URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/imb.2014.23.issue-6URL [本文引用: 1]
DOI:10.1016/j.cbd.2018.04.005URL [本文引用: 1]
DOI:10.1111/imb.v28.1URL [本文引用: 2]
DOI:10.1074/jbc.M116.720581URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.gene.2015.07.006URL [本文引用: 1]
