 ,浙江大学动物科学学院/浙江省动物预防医学重点实验室,杭州 310058
,浙江大学动物科学学院/浙江省动物预防医学重点实验室,杭州 310058The Expression Pattern and Ligand Binding Ability of Hc-FAR-4 Protein of Haemonchus contortus
WEI HaiDian, CHEN XueQiu, HUANG Yan, SHI HengZhi, ZHOU JingRu, WU Fei, DU AiFang, YANG Yi ,College of Animal Science, Zhejiang University/Key Laboratory of Animal Preventive Medicine of Zhejiang Province, Hangzhou 310058
,College of Animal Science, Zhejiang University/Key Laboratory of Animal Preventive Medicine of Zhejiang Province, Hangzhou 310058通讯作者:
责任编辑: 林鉴非
收稿日期:2018-12-6接受日期:2019-02-26网络出版日期:2019-09-01
| 基金资助: |
Received:2018-12-6Accepted:2019-02-26Online:2019-09-01
作者简介 About authors
韦海典,E-mail:757559545@qq.com。

摘要
关键词:
Abstract
Keywords:
PDF (2206KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
韦海典, 陈学秋, 黄艳, 时恒枝, 周静茹, 吴飞, 杜爱芳, 杨怡. 捻转血矛线虫Hc-FAR-4蛋白的表达特性及其与配体结合能力分析[J]. 中国农业科学, 2019, 52(17): 3059-3068 doi:10.3864/j.issn.0578-1752.2019.17.013
WEI HaiDian, CHEN XueQiu, HUANG Yan, SHI HengZhi, ZHOU JingRu, WU Fei, DU AiFang, YANG Yi.
0 引言
【研究意义】捻转血矛线虫(Haemonchus contortus)成虫寄生在牛羊等反刍动物的皱胃中是反刍动物常见的胃肠道线虫之一,属毛圆科(Trichostrongylidae)、血矛属(Haemonchus),其引起的捻转血矛线虫病主要症状为贫血、消瘦,感染严重可引起患病动物大批死亡[1,2]。捻转血矛线虫病在我国全国性流行,其感染率为26.4%—80%[3,4]。目前防控捻转血矛线虫病的方法仍是以药物防控为主,但抗药性问题日益凸显[5]。在世界范围内,越来越多的抗药虫株被相继报道[6,7,8]。因此,需要研发新型抗线虫药,而药物作用靶标的筛选已成为药物开发的主要方向,并且理想的药物靶标通常为病原体感染、存活以及繁殖过程中所必需,而与宿主有明显区别的代谢通路中[9,10,11]。捻转血矛线虫生长经历两个阶段,第一个是需氧的自由生活阶段,第二个是微氧的寄生生活阶段。这两个阶段生活条件的不同决定了其有不同的能量代谢与脂肪酸代谢方式。这独特的能量代谢方式为新型药物的研发提供了潜在的药物靶位点。【前人研究进展】在线虫体内存在两类特有的与脂结合有关的蛋白,脂肪酸视黄醇结合蛋白(fatty acid- and retinol-binding proteins,FARs)和线虫聚合蛋白抗原(Nematode polyprotein allergens/antigens,NPAs)[12]。其中第一个FAR蛋白是在旋盘尾丝虫(Onchocerca volvulu)中发现的,其被命名为Ov-far-1,之后****对其结构和功能进行了研究[13,14]。接下来在犬钩口线虫、秀丽隐杆线虫、锡兰钩口线虫等线虫体内相继发现了FAR蛋白[15,16,17]。直到2009年,框丽萨利用蛋白组学和生物信息学技术分析,才发现在捻转血矛线虫体内也存在FARs蛋白并且预测在捻转血矛线虫体内至少存在6种脂肪酸视黄醇结合蛋白[18]。【本研究切入点】目前对捻转血矛线虫Hc-FAR-4蛋白的功能研究较少,本研究拟利用荧光分析法、荧光定量PCR技术、免疫组织荧光技术对Hc-FAR-4蛋白的生物学功能进行探讨。【拟解决的关键问题】对原核表达的 rHc-FAR-4 蛋白进行体外配体结合试验,确定 rHc-FAR-4 蛋白的脂肪酸与视黄醇结合能力;利用荧光定量PCR技术对捻转血矛线虫生长发育过程中各个时期Hc-far-4的转录水平进行检测,并制备鼠源多克隆抗体,对Hc-FAR-4蛋白在捻转血矛线虫中的表达特性进行探讨。研究结果将为进一步研究Hc-far-4的生物学功能奠定基础。1 材料与方法
试验于2017年3月至2018年9月在浙江大学预防兽医研究所寄生虫病理生物学研究室进行。1.1 虫体、菌株与质粒
捻转血矛线虫ZJ株成虫在桐乡屠宰场获得并由浙江省动物预防医学重点实验室保存;E. coli TOP10菌株、E. coli BL21(DE3)菌株和 pET-30a(+)vector质粒由本实验室制备并保存;pMD19-T vector质粒购买于TaKaRa。1.2 试剂与试剂盒
限制性内切酶 BamHI和 HindIII、T4 DNA连接酶、LA TaqTM酶等均购自宝生物工程(大连)有限公司(TaKaRa)。DNA 凝胶回收试剂盒、质粒抽提试剂盒购自Axygen 公司。DAUDA购买自Cayman公司。Bio-Rad 蛋白浓度测定试剂盒、Millipore 超滤管(Promega)。Ni-NTA 亲和色谱树脂、考马斯亮蓝购自 Qiagen 公司。油酸、视黄醇、HRP标记的山羊抗小鼠IgG抗体、抗His标签鼠源单克隆抗体、羊抗鼠IgG H&L(Alexa Fluor? 488)均购自美国Sigma公司。1.3 捻转血矛线虫Hc-far-4 基因的克隆
根据序列设计特异性扩增引物,引物序列为 Hc- far-4-F:CGCGGATCCATGATCCGTCCGGTTGCTGCT(下划线BamHI的识别位点)Hc-far-4-R:CCCAAGC TTCTAGTTGTTGATCAGCATCCTCGCCT(下划线为HindIII的识别位点),生工生物工程(上海)有限公司负责合成。提取捻转血矛线虫成虫 RNA,并反转录为cDNA作为扩增模板,用LA TaqTM酶进行特异性扩增,PCR 反应程序:95℃ 3 min;95℃ 30 s,60℃ 30 s,72℃ 1 min ,共30个循环;72℃ 10 min。回收并纯化后PCR 产物与pMD19-T载体进行过夜连接,然后转入 E. coli TOP10 感受态细胞中挑取阳性克隆送到测序公司进行测序分析。1.4 捻转血矛线虫 Hc-FAR-4 原核表达载体的构建及原核表达
用限制性内切酶BamHI和HindIII同时对测序准确pMD19-T-far-4质粒与原核表达pET-30a 质粒进行双酶切,T4 DNA 连接酶过夜连接,转入 E. coli TOP10 感受态细胞,挑取阳性克隆进行双酶切鉴定。鉴定准确的原核表达质粒转化至Ecoli BL21(DE3),挑取阳性克隆,-80℃冻存。保存的BL21菌液1﹕100比例加入600 mL的含卡那霉素的 LB培养液中,37℃恒温摇床培养大概3 h到对数期,OD值0.6。IPTG(1 mol·L-1)按照1﹕1000的比例稀释并添加到600 mL LB液体培养基中,摇床200 r/min,37℃,诱导6 h。在4℃条件下 8 000×g 离心 5 min富集、去上清。用5×PBS缓冲液(pH = 7.4)重悬细菌,冰浴下进行超声波破碎。12 000×g,4℃离心 10 min,收集上清。取10 μL上清进行 SDS-PAGE 电泳检测诱导表达情况。1.5 捻转血矛线虫 rHc-FAR-4蛋白的分离纯化和Western Blot 鉴定
收集含有 rHc-FAR-4蛋白的上清液,加入镍琼脂糖凝胶柱中,流速约为 1 mL·min-1,过柱3次。用含有不同咪唑浓度的缓冲液进行洗脱,流速约为 2 mL·min-1,收集洗脱液。含有目的蛋白含量最多的洗脱液用超滤管进行超滤除去咪唑并浓缩蛋白,检测蛋白浓度。最后进行Western Blot 鉴定,将纯化后的rHc-FAR-4蛋白经SDS-PAGE电泳后,转至聚偏二氟乙烯膜上,5%脱脂乳(TPST配制)封闭过夜,一抗为抗 His 标签鼠源单克隆抗体(1﹕1 000)室温孵育2 h,二抗为HRP -羊抗小鼠 IgG(1﹕5 000)室温孵育1 h,最后用增强化学发光法(ECL)进行显色。1.6 重组蛋白与配体的结合能力
根据荧光物质retinol与脂肪酸类似物DAUDA在极性和非极性溶液中,在某一波长的激发光激发下,所发出的荧光光谱随之变化的特性,利用荧光分析法,通过荧光光谱的变化判断rHc-FAR-4蛋白是否具有与DAUDA、retinol结合的能力[18]。再在体系中加入非荧光长链脂肪酸油酸,根据荧光光谱的变化情况判定油酸能否分别与DAUDA、retinol竞争目的蛋白的脂肪酸结合位点,间接说明目的蛋白能否与非荧光脂肪酸油酸结合[19]。用乙醇把DAUDA(Cayman)、 油酸(Sigma)、视黄醇(Sigma)配成储存液,浓度为10 mmol·L-1,-20℃保存并且尽快使用。纯化好的蛋白,再用超滤管超滤以除去咪唑。重组蛋白与DAUDA的结合试验分为4个组,一是空白对照组:DAUDA + PBS;二是蛋白配体结合组:DAUDA + rHc-FAR-4 + PBS;三是竞争结合组:DAUDA + rHc-FAR-4 + 油酸 + PBS;四是阴性对照组:DAUDA + rTg-PME + PBS。重组蛋白与retinol的结合试验也分为4个组,一是空白对照组:retinol + PBS;二是蛋白配体结合组:retinol + rHc-FAR-4 + PBS;三是竞争结合组:retinol + rHc-FAR-4 + 油酸 + PBS;四是阴性对照组:retinol + rTg-PME + PBS。试验体系为:96孔板中每孔重组蛋白的终浓度为3 μmol·L-1,其他配体的终浓度都为10 μmol·L-1,总体积为100 μL,重复3个复孔,试验重复3次。其中rTg-PME蛋白是来源于弓形虫的一个重组蛋白,其与脂肪酸视黄醇转运无关,故用来做阴性对照。DAUDA由345 nm的激发光进行激发,retinol由350 nm的激发光进行激发[19]。激发之后进行全波长扫描记录发射光谱的变化。实验仪器为荧光酶标仪 Synergy H1(Biotek)。1.7 不同发育时期表达特性
从浙江桐乡湖羊屠宰场采集湖羊第四胃皱胃,在皱胃壁及胃内容物中挑出捻转血矛线虫成虫。取出捻转血矛线虫雌虫剖开子宫取出虫卵并铺于琼脂板中28℃培养。每天添加适量的D-hank’s液培养。虫卵孵化后为一期幼虫(L1),培养3 d后为二期幼虫(L2),培养7 d后发育为三期幼虫(L3),收集L3幼虫对湖羊进行攻虫,分别剖胃收集四期幼虫(L4)与成虫。收集各个时期的捻转血矛线虫提取RNA并逆转录为cDNA。根据目的基因序列设计荧光定量PCR引物Hc-far4-QF:CGCCTTTGTCTCCTCGTTCA,Hc-far4-QR:CCGTACTTCTTTGCGACCTCC。qRT- PCR(25 μL)使用SYBR Green预混液(TOYOBO)按照说明书进行操作,荧光定量仪为ABI 7300 (Thermo)。荧光定量 PCR 反应程序:50℃ 3 min,95℃ 1 min 1个循环,95℃ 15 s,60℃ 15 s,72℃ 30 s,40个循环,最后一个循环产生熔解曲线。样品设置3个重复,取平均阈值(CT值)进行分析。相对定量计算方法采用CT值比较法。使用Graphpad prism 6.01进行统计分析。内参基因为β-tubulin,其引物序列为:β-tubulin-QF TGTTCCATCACCCAAGGTATCC;β-tubulin-QR TGACAGACACAAGGTGGTTGAGAT。1.8 多克隆抗体的制备与Western Blot 鉴定
纯化的rHc-FAR-4-His蛋白与弗氏完全佐剂1﹕1混合、手动乳化,免疫昆明小鼠的蛋白用量为50 μg/只,腹部皮下注射进行首次免疫。第7天,将rHc-FAR-4-His蛋白与弗氏不完全佐剂1﹕1混合、手动乳化,终浓度为25 μg/只,腹部皮下注射进行二次免疫。第14天,以同样的方法进行第三次免疫。第21天,采血,ELISA检测血清抗体效价,效价达到要求即可收集血清,-80℃保存。然后进行Western Blot 鉴定,确认制备的鼠源多克隆抗体是否能够特异性识别天然Hc-FAR-4蛋白,并且以鼠源阴性血清作为阴性对照。其过程为,提取捻转血矛线虫全虫蛋白并将全虫蛋白经SDS-PAGE电泳后,转至聚偏二氟乙烯膜上,5%脱脂乳(TPST配制)封闭过夜,一抗为自制鼠源多克隆抗体(1﹕2 000)室温孵育2 h,二抗为HRP -羊抗小鼠 IgG( 1﹕5 000)室温孵育1 h,最后用增强化学发光法(ECL)进行显色。1.9 石蜡包埋
将捻转血矛线虫雌性四期幼虫用现配的4%多聚甲醛4℃固定 24 h,流水冲洗过夜[20]。脱水:50%乙醇溶液脱水30 min、75%乙醇溶液脱水30 min、80%乙醇溶液脱水30 min、95%乙醇溶液脱水30 min、100%Ⅰ乙醇溶液脱水5 min、100%Ⅱ乙醇溶液脱水5 min,逐级脱水。透明:置于二甲苯乙醇(1﹕1)溶液5 min,二甲苯透明 5 min[21,22]。浸蜡:透明好的样品置于液态石蜡中浸泡1—2 h再进行包埋。1.10 免疫组织荧光
切片:25 μm粗切,切到组织后切换为5 μm细切,将切好的组织放入到42℃的水浴锅中展片,玻片捞取。烤片:切片置于60℃烘箱3—6 h。脱蜡:二甲苯Ⅰ、二甲苯Ⅱ溶液中各浸泡5 min。脱水:酒精逐级脱水。抗原修复:切片烤好后置于0.01 mol·L-1柠檬酸盐缓冲液,开水浴20 min[23]。封闭:3% 的BSA 4℃封闭过夜。一抗孵育:鼠多抗(自制)用PBS 1﹕200 稀释,37℃孵育1 h。洗涤:PBS 缓冲液清洗3次。二抗孵育:Alexa Fluor? 488 nm羊抗鼠IgG用PBS 1﹕400稀释,37℃避光孵育1 h。洗涤:PBS缓冲液清洗3次。核染:DAPI 37℃染色30 min。洗涤:PBS缓冲液清洗3次。封片:激光共聚焦显微镜拍照(Zeiss LSM 780,德国)。2 结果
2.1 Hc-far-4 基因的克隆及其鉴定
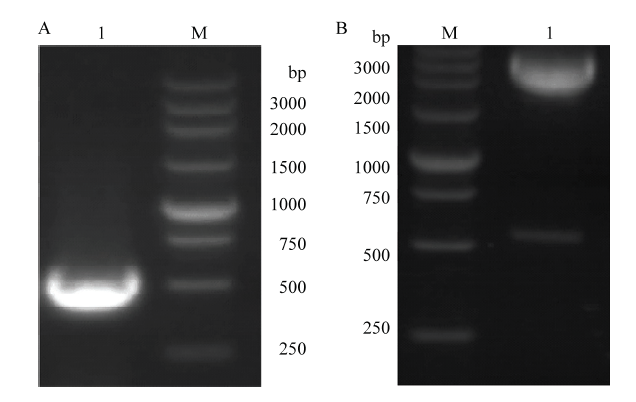
以捻转血矛线虫成虫的cDNA作为扩增模板,进行特异性PCR 扩增 Hc-far-4片段。1%琼脂糖凝胶电泳结果显示,在500 bp附近有一条清晰的条带(图 1-A)。回收连接后进行测序,结果与 Sanger数据库中公布的Hc-far-4序列(>HCISE00908800.t1)相似度为 99.9%。 挑选pET-30a-Hc-far-4阳性克隆用BamHI和HindIII限制性内切酶进行双酶切鉴定。双酶切后切出一条约500 bp的短片段与约4 000 bp的长片段(图 1-B)。证明Hc-far-4已成功转入pET-30a中。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1Hc-far-4 序列扩增结果及 pET-30a-Hc-far-4酶切鉴定
A.Hc-far-4序列扩增结果;B. pET-30a-Hc-far-4 酶切鉴定结果。M:DL250 DNA Maker;A-1:Hc-far-4 PCR 产物;B-1:pET-30a-Hc-far-4双酶切产物
Fig. 1Cloning of Hc-far-4 gene fragment and identification of pET-30a-Hc-far-4 by digestion
A. Amplification result of Hc-far-4; B. Enzyme digestion identification result of pET-30a-Hc-far-4. M: DL250 DNA marker; A-1: PCR product of Hc-far-4; B-1: Enzyme digestion product of pET-30a-Hc-far-4 plasmid
2.2 rHc-FAR-4蛋白的表达,纯化及其鉴定
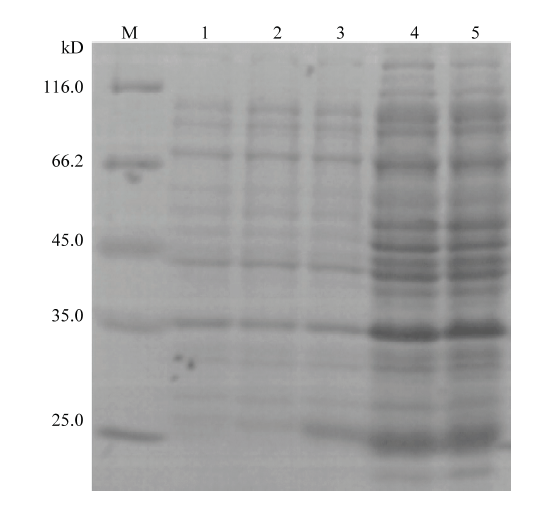
2.2.1 rHc-FAR-4蛋白诱导表达 将含有pET-30a- Hc-far-4重组质粒的 E. coli BL21 扩大培养约600 mL菌液,然后 IPTG在37℃环境中诱导8 h,收集菌,5×PBS(pH7.4)重悬,冰浴条件下超声波破碎,离心收集上清进行SDS-PAGE分析[24](图2)。根据EditSeq软件的蛋白分子量预测与结合pET-30a 质粒图谱推测重组蛋白分子量大小约为25 kD。SDS-PAGE 结果显示蛋白条带大小与推测的结果一致,在上清中表达。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2rHc-FAR-4蛋白在E. coli BL21菌株中的诱导表达情况
M:蛋白 Marker;1:pET-30a 空白对照;2:pET-30a-Hc-far-4 未诱导阴性对照;3:pET-30a-Hc-far-4 诱导4 h;4:pET-30a-Hc-far-4 诱导6 h;5:pET-30a-Hc-far-4 诱导8 h
Fig. 2rHc-FAR-4 protein expressed in E. coli BL21
M: Protein marker; 1: pET-30a empty plasmid; 2: pET-30a-Hc-far-4 were inducted for 0 h; 3: pET-30a-Hc-far-4 were inducted for 4 h; 4: pET- 30a-Hc-far-4 were inducted for 6 h; 5: pET-30a-Hc-far-4 were inducted for 8 h
2.2.2 rHc-FAR-4蛋白分离纯化及鉴定 rHc-FAR-4 蛋白纯化后用SDS-PAGE进行检测,了解蛋白纯化的情况。经纯化并超滤的 rHc-FAR-4 蛋白如图3-A,蛋白大小为25 kD左右与推测的大小相似。rHc-FAR-4 蛋白以抗His 血清作为一抗进行WB验证,其结果显示该蛋白带有His标签,并且大小与推测的一致约为25 kD(图3-B)。蛋白浓度检测按照试剂盒的操作步骤进行,测得浓缩后rHc-FAR-4 蛋白浓度为2.0 μg·μL-1。
图3
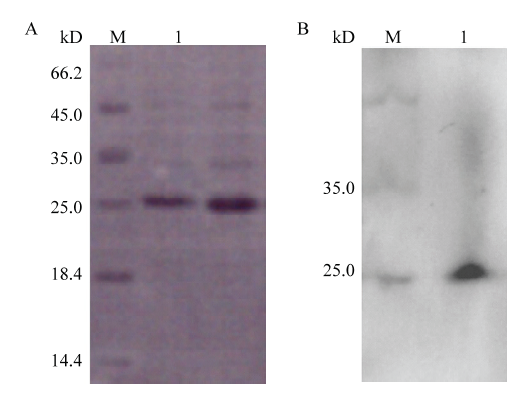 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3rHc-FAR-4纯化后的 SDS-PAGE 分析及Western Blot 鉴定
A. Hc-FAR-4重组蛋白的 SDS-PAGE 分析结果;B. rHc-FAR-4 Western Blot 鉴定结果。M:蛋白 Marker;A-1、B-1:rHc-FAR-4 蛋白
Fig. 3SDS-PAGE analysis of purified protein and its Western blot analysis
A. SDS-PAGE analysis result of rHc-FAR-4 protein; B. Western Blot identification result of rHc-FAR-4 protein. M: Protein molecular weight marker; A-1, B-1: rHc-FAR-4 protein
2.3 重组蛋白与配体的结合能力
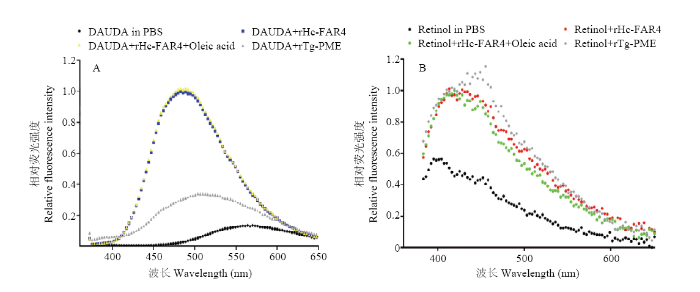
在rHc-FAR-4与DAUDA结合能力的检测中,用 345 nm 激发光激发仅含有 10 μmol·L-1 DAUDA 的 PBS 溶液后,发射光谱的波峰位于 570 nm 处,且荧光强度较弱;而当加入 3 μmol·L-1 rHc-FAR-4蛋白后,荧光强度对比空白对照组和阴性对照组都明显增强,且波峰移至 488 nm(图4-A);加入油酸和DAUDA竞争与rHc-FAR-4蛋白结合的位点,结果显示加入油酸后荧光强度没有明显变化。在rHc-FAR-4与retinol结合能力的检测中用350 nm 激发光激发PBS+10 μmol·L-1 retinol组成的空白对照组,其发射光谱的波峰位于 400 nm 处,且荧光强度较弱,而当加入 3 μmol·L-1 rHc-FAR-4蛋白后,发射光谱的波峰右移至420 nm处,荧光强度对比空白对照组增强了但是和阴性对照组的荧光强度差不多;加入油酸和DAUDA竞争与rHc-FAR-4蛋白结合的位点,结果显示加入油酸后荧光强度没有明显变化(图4-B)。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4配体溶液中加入 rHc-FAR-4 蛋白后荧光光谱的变化
A:DAUDA配体结合试验;B:Retinol配体结合试验
Fig. 4The change of fluorescence emission spectra induced by the addition of rHc-FAR-4 proteins into ligand solution
A: DAUDA binding experiment of rHc-FAR-4 protein; B: Retinol binding experiment of rHc-FAR-4 protein
2.4 rHc-FAR-4 鼠多抗的特异性检测
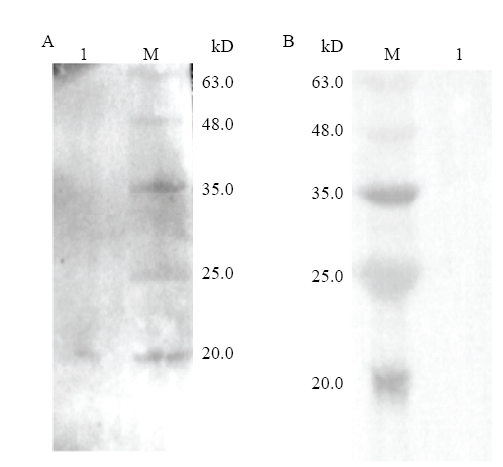
用目的蛋白对昆明小鼠进行三次免疫之后,用间接酶联免疫吸附测定(enzyme-linked immuno-sorbent assay,ELISA)法检测昆明小鼠血清抗体效价,结果显示效价较高达到1﹕1 024 000—1﹕2 048 000,可用于后续试验。收集的多克隆抗体利用Western blot方法鉴定其与全虫蛋白的亲和性,并用鼠阴性血清作为对照(图5)。结果显示制备的多克隆抗体能够识别捻转血矛线虫全虫蛋白中的天然Hc-FAR-4蛋白,条带约为20 kD,比重组蛋白小一些。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5Western Blot分析小鼠多克隆抗体的特异性
A:制备的鼠源多克隆抗体作为一抗;B:鼠源阴性血清作为一抗。M:蛋白marker,A-1、B-1:捻转血矛线虫全虫蛋白
Fig. 5Western Blot analysis of the specificity of mouse polyclonal antibody
A: Anti-rHc-FAR-4 mouse polyclonal antibody do as primary antibody; B: Negative serum of mouse do as primary antibody. M: protein marker; A-1, B-1: Whole worm protein of H. contortus
2.5 不同发育时期表达特性
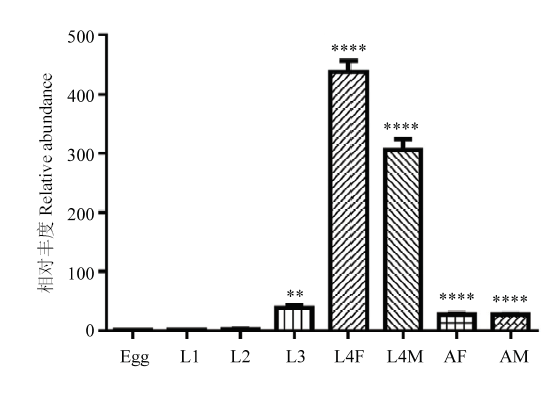
收集捻转血矛线虫的各个时期虫体,提取RNA,逆转录形成cDNA。用荧光定量技术进行各个时期Hc-far-4转录水平的检测。以虫卵期的Hc-far-4转录水平为参考,三期幼虫(L3)、雌性四期幼虫(L4F)、雄性四期幼虫(L4M)、雌性成虫(AF)、雄性成虫(AM)这些时期的转录水平都极显著提高(t-test:t(4) =8.166,P=0.0012;t(4) = 23.28,P<0.0001;t(4) = 16.49,P<0.0001;t(4) = 19.98,P<0.0001;t(4) =71.77,P<0.0001)。结果显示Hc-far-4在L3期幼虫的时候转录水平开始显著上升,在L4期幼虫的时候达到峰值,然后在成虫阶段转录水平又开始下降(图6)。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6 Hc-far-4 在各个时期的转录水平
Fig. 6Transcriptional levels of Hc-far-4 at different developmental stages of H. contortus
2.6 免疫组织荧光
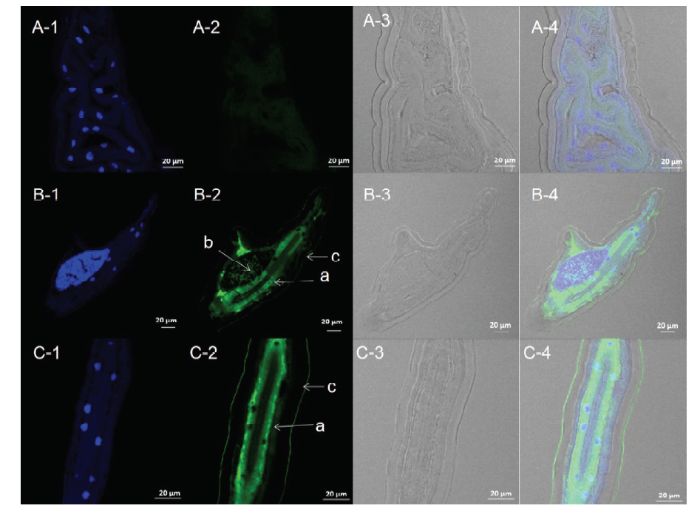
为了确定Hc-FAR-4的表达部位,收集Hc-far-4转录水平最高的时期即L4期雌虫进行石蜡包埋与切片,然后进行免疫组织荧光染色。由试验结果可以看出Hc-FAR-4的表达部位主要集中在捻转血矛线虫的肠壁中,在其性腺、角皮也有少量表达(图7)。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7Hc-FAR-4在捻转血矛线虫四期雌虫中的表达部位
A:阴性对照;B:虫体横切;C:虫体纵切。a:肠壁;b:性腺;c:角皮;列1:DAPI核染色;列2:异硫氰酸荧光素信号;列3:透射光拍照;列4:图片组合
Fig. 7Expression location of Hc-FAR-4 in L4F of H. contortus
A: Negative control; B: transection of H. contortus; C: longitudinal cutting of H. contortus. a: Intestinal wall; b: Gonads; C: cuticle; Column 1: DAPI; Column 2: FITC; Column 3: DIC; Column 4: Merge
3 讨论
捻转血矛线虫的生活史存在两个阶段,自由生活阶段与寄生生活阶段。其在寄生生活阶段的营养物质摄取涉及自身能否在宿主体内生存和能否满足自身繁殖需要,所以在营养物质的摄取特别是在寄生生活阶段的营养物质摄取显得尤为重要。其在摄取的营养物质中脂肪酸与视黄醇的吸收与转运意义重大。因为线虫体内缺乏脂肪酸和视黄醇的从头合成能力,因此需要从寄主或环境中获取这些物质,为体内的脂类合成或其它生理活动提供底物和能量[17, 25]。脂结合蛋白历来受到科研人员的重视,其可能对宿主组织进行修饰从而使寄生虫逃避宿主的免疫;除此之外由于脂肪酸视黄醇不易溶于水,而且容易氧化,在游离状态下会对细胞膜造成损害,所以脂肪酸、视黄醇的运输一般都是与脂蛋白结合再进行转运的[19]。脂结合蛋白能够结合宿主体内的视黄醇和长链脂肪酸,促进寄生虫对这些营养物质的吸收,弥补寄生线虫合成长链脂肪酸能力的不足[26]。本次研究采用了荧光分析法,首次分析了捻转血矛线虫rHc-FAR-4与DAUDA和视黄醇的结合情况,并且对试验方法进行了改良。仪器使用荧光酶标仪H1而不是紫外分光光度计,使试验更加简单便捷的同时,根据配体结合试验中空白对照组DAUDA与retinol的发射光谱进行分析,发现其光谱的峰值分别在570 nm和400 nm处,与文献报道的发射光谱趋势一致[19,25],说明试验方法的改良取得成功。在检验rHc-FAR-4能否与DAUDA结合的试验中,蛋白配体结合试验组荧光强度峰值对比空白对照组和阴性对照组的荧光强度峰值都明显增强,且波峰移至 488 nm(图4-A),这现象说明 rHc-FAR-4蛋白能够结合 DAUDA且结合能力要比rTg-PME强。而蛋白结合试验组与竞争结合试验组的荧光发射光谱并没有明显的差别,说明油酸无法把DAUDA从rHc-FAR-4蛋白结合位点中置换出来,从而说明rHc-FAR-4与油酸的结合能力较弱。在检验rHc-FAR-4能否与retinol结合的试验中,蛋白配体结合试验组荧光强度峰值比空白对照组强且波峰移至 420 nm处(图4-A),但是和阴性对照组无明显差别,说明rHc-FAR-4能够与retinol结合,但是结合能力较弱,与rTg-PME的结合能力相近。蛋白结合实验组与竞争结合试验组的荧光发射光谱并没有明显的差别,说明油酸无法把retinol从rHc-FAR-4蛋白结合位点中置换出来,再次验证rHc-FAR-4与油酸的结合能力较弱。这研究结果与脂结合蛋白能够结合宿主体内的视黄醇和长链脂肪酸促进寄生虫对这些营养物质的吸收以弥补寄生线虫合成长链脂肪酸能力的不足,并为体内的脂类合成或其它生理活动提供底物和能量等结论相符[17,25-26]。
通过荧光定量PCR技术检测了捻转血矛线虫各个发育时期虫体中Hc-far-4的转录水平,发现其在营自由生活的虫卵、L1、L2阶段表达量很低,但是在开始营寄生生活前期即L3阶段开始显著增加,在营寄生生活的L4阶段达到峰值,在营寄生生活的成虫阶段表达量也相对较高。说明Hc-FAR-4蛋白在捻转血矛线虫的入侵宿主的过程中扮演重要角色。这与研究报道中的脂结合蛋白能对宿主组织进行修饰从而使寄生虫逃避宿主免疫的推测相吻合[27,28]。
在此之前对捻转血矛线虫体内蛋白定位都是对L1—L3幼虫进行免疫荧光定位的[29,30,31],因为这些时期的幼虫生活在体外,容易培养与获得。但是存在以下几个弊端:一是有的蛋白在这几个时期表达量不高甚至不表达故无法检测;二是由于捻转血矛线虫虫体有厚厚的鞘所包裹,即使有脱鞘的方法,但是存在较难脱鞘或者是脱鞘不完全情况;三是即使脱掉鞘,进行免疫荧光定位也无法准确指出所表达的具体部位。本次试验对试验方法进行改良,对四期幼虫、成虫甚至L3期幼虫虫体进行石蜡包埋,切片,进行IHF试验,就能探究蛋白在这些时期的表达部位。并且根据组织形态的不同,可以较为准确地指出蛋白的具体表达部位。本试验选择了Hc-far-4转录水平最高的四期雌性幼虫进行包埋,探究Hc-FAR-4在这个时期虫体中的定位。在纵切组图与横切组图中,可以看到绿色荧光物质标记了的羊抗鼠二抗主要结合在捻转血矛线虫的肠壁,少量结合在性腺、角皮且对照组并没有发现绿色荧光,说明制备的鼠源多抗能够特异性结合捻转血矛线虫体内的Hc-FAR-4蛋白。推测Hc-FAR-4蛋白主要参与了营寄生生活阶段的脂肪酸与视黄醇的转运,为捻转血矛线虫的生长发育与生殖提供营养物质,同时Hc-FAR-4蛋白在角皮也有表达,可能与防止捻转血矛线虫机体被宿主体内游离的脂肪酸、视黄醇所损伤有关。
4 结论
本研究利用 E. coli BL21对 Hc-far-4进行了原核表达,配体结合试验结果表明该重组蛋白rHc-FAR-4能够结合脂肪酸类似物DAUDA和视黄醇,但是与油酸的结合能力较弱。IHF结果表明Hc-FAR-4蛋白主要表达在肠壁,在性腺、角皮中也有少量表达。荧光定量PCR结果显示Hc-Far-4在进行营寄生生活阶段表达量达到峰值。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.3864/j.issn.0578-1752.2017.08.017Magsci [本文引用: 1]

【目的】捻转血矛线虫(<em>Haemonchus contortus</em>)是反刍动物主要的胃肠道线虫之一,该病在中国呈全国性流行。为研究捻转血矛线虫(<em>Haemonchus contortus</em>)脂肪酸代谢相关蛋白DAF-22的生化特性,对其基因进行了克隆、原核表达,并对重组蛋白进行了体外酶活性测定。以期了解捻转血矛线虫Hc-DAF-22蛋白在过氧化物酶体脂肪酸β氧化中的作用。 【方法】 根据NCBI公布的<em>H. contortus</em> ZJ株daf-22 cDNA序列(GenBank:HQ738470.1)设计特异性引物,克隆Hc-daf-22基因并构建重组质粒pET-22b-Hc-daf-22, 经测序鉴定正确后将其转化<em>E. coli</em> BL21,经终浓度为0.1 mmol·L<sup>-1</sup> IPTG(isopropyl-β-d-thiogalactoside)诱导表达4h,离心菌液,50 mmol·L<sup>-1</sup>浓度的PBS溶液重悬菌体溶液,冰浴超声破碎后上清沉淀分别进行SDS-PAGE分析。超声破碎后产物以镍柱亲和色谱法分离纯化重组蛋白Hc-DAF-22,并用SDS-PAGE检测蛋白纯化情况及以抗His血清作为一抗Western Blot鉴定。纯化后蛋白用超滤管浓缩除去盐分,并按照蛋白浓度测定试剂盒进行蛋白浓度测定。利用天然状态下的乙酰乙酰CoA(AcAc-CoA)分子会发生酮-烯醇互变形成烯醇化合物特性,酶活试验以乙酰乙酰辅酶a为底物建立标准曲线。硫解酶体外测活体系为(50 mmol·L<sup>-1</sup> Tris-Cl pH 8.1,20 mmol·L<sup>-1</sup> MgCl<sub>2</sub>,60 μmol·L<sup>-1</sup> CoA,10 μmol·L<sup>-1</sup> AcAc-CoA,加入约0.1 μg蛋白),通过记录反应过程中由于底物(AcAc-CoA)的减少而引起303 nm波长下的吸收值的变化,从而计算出硫解反应的初始反应速率,最终确定复性后的Hc-DAF-22的硫解酶活性。在相同条件下,取AcAc-CoA底物浓度为10 μmol·L<sup>-1</sup>的反应体系(50 mmol·L<sup>-1</sup> Tris-Cl pH 8.1,20 mmol·L<sup>-1</sup> MgCl<sub>2</sub>,60 μmol·L<sup>-1</sup> CoA,10 μmol·L<sup>-1</sup> AcAc-CoA,加入约0.1 μg蛋白于室温起始反应),分别调节反应体系的温度及pH梯度,确定Hc-DAF-22最佳酶活反应温度及pH条件。【结果】成功克隆Hc-daf-22基因,测序结果与NCBI已公布的<em>H. contortus</em> ZJ株Hc-daf-22基因序列比对基因相似度为99.9%,并实现重组子pET-22b-Hc-daf-22在<em>E. coli</em> BL21体内进行表达,表达产物经 SDS-PAGE和Western Blot检测显示,pET-22b-Hc-daf-22基因在大肠杆菌中成功表达,呈部分可溶性,融合蛋白的分子量约为59 kD,测得蛋白浓度为1.70 μg·μL<sup>-1</sup>;针对该表达产物的酶活分析结果表明,原核表达的Hc-DAF-22具有一定的硫解酶活性,其最适反应pH为8.0,最佳反应温度为37℃,酶学常数K<sub>m</sub>值和V<sub>max</sub>值分别为33.765 μmol·L<sup>-1</sup>和1 784 nmol·L<sup>-1</sup>·min<sup>-1</sup>。【结论】捻转血矛线虫DAF-22是过氧化物酶体脂肪酸β氧化的关键酶之一,本试验通过体外酶活试验成功测定Hc-DAF-22蛋白的酶活性,证明Hc-DAF-22具有一定硫解酶活性,但与秀丽隐杆线虫(<em>Caenorhabditis elegans</em>)同源蛋白相比硫解酶活性较低。
DOI:10.3864/j.issn.0578-1752.2017.08.017Magsci [本文引用: 1]

【目的】捻转血矛线虫(<em>Haemonchus contortus</em>)是反刍动物主要的胃肠道线虫之一,该病在中国呈全国性流行。为研究捻转血矛线虫(<em>Haemonchus contortus</em>)脂肪酸代谢相关蛋白DAF-22的生化特性,对其基因进行了克隆、原核表达,并对重组蛋白进行了体外酶活性测定。以期了解捻转血矛线虫Hc-DAF-22蛋白在过氧化物酶体脂肪酸β氧化中的作用。 【方法】 根据NCBI公布的<em>H. contortus</em> ZJ株daf-22 cDNA序列(GenBank:HQ738470.1)设计特异性引物,克隆Hc-daf-22基因并构建重组质粒pET-22b-Hc-daf-22, 经测序鉴定正确后将其转化<em>E. coli</em> BL21,经终浓度为0.1 mmol·L<sup>-1</sup> IPTG(isopropyl-β-d-thiogalactoside)诱导表达4h,离心菌液,50 mmol·L<sup>-1</sup>浓度的PBS溶液重悬菌体溶液,冰浴超声破碎后上清沉淀分别进行SDS-PAGE分析。超声破碎后产物以镍柱亲和色谱法分离纯化重组蛋白Hc-DAF-22,并用SDS-PAGE检测蛋白纯化情况及以抗His血清作为一抗Western Blot鉴定。纯化后蛋白用超滤管浓缩除去盐分,并按照蛋白浓度测定试剂盒进行蛋白浓度测定。利用天然状态下的乙酰乙酰CoA(AcAc-CoA)分子会发生酮-烯醇互变形成烯醇化合物特性,酶活试验以乙酰乙酰辅酶a为底物建立标准曲线。硫解酶体外测活体系为(50 mmol·L<sup>-1</sup> Tris-Cl pH 8.1,20 mmol·L<sup>-1</sup> MgCl<sub>2</sub>,60 μmol·L<sup>-1</sup> CoA,10 μmol·L<sup>-1</sup> AcAc-CoA,加入约0.1 μg蛋白),通过记录反应过程中由于底物(AcAc-CoA)的减少而引起303 nm波长下的吸收值的变化,从而计算出硫解反应的初始反应速率,最终确定复性后的Hc-DAF-22的硫解酶活性。在相同条件下,取AcAc-CoA底物浓度为10 μmol·L<sup>-1</sup>的反应体系(50 mmol·L<sup>-1</sup> Tris-Cl pH 8.1,20 mmol·L<sup>-1</sup> MgCl<sub>2</sub>,60 μmol·L<sup>-1</sup> CoA,10 μmol·L<sup>-1</sup> AcAc-CoA,加入约0.1 μg蛋白于室温起始反应),分别调节反应体系的温度及pH梯度,确定Hc-DAF-22最佳酶活反应温度及pH条件。【结果】成功克隆Hc-daf-22基因,测序结果与NCBI已公布的<em>H. contortus</em> ZJ株Hc-daf-22基因序列比对基因相似度为99.9%,并实现重组子pET-22b-Hc-daf-22在<em>E. coli</em> BL21体内进行表达,表达产物经 SDS-PAGE和Western Blot检测显示,pET-22b-Hc-daf-22基因在大肠杆菌中成功表达,呈部分可溶性,融合蛋白的分子量约为59 kD,测得蛋白浓度为1.70 μg·μL<sup>-1</sup>;针对该表达产物的酶活分析结果表明,原核表达的Hc-DAF-22具有一定的硫解酶活性,其最适反应pH为8.0,最佳反应温度为37℃,酶学常数K<sub>m</sub>值和V<sub>max</sub>值分别为33.765 μmol·L<sup>-1</sup>和1 784 nmol·L<sup>-1</sup>·min<sup>-1</sup>。【结论】捻转血矛线虫DAF-22是过氧化物酶体脂肪酸β氧化的关键酶之一,本试验通过体外酶活试验成功测定Hc-DAF-22蛋白的酶活性,证明Hc-DAF-22具有一定硫解酶活性,但与秀丽隐杆线虫(<em>Caenorhabditis elegans</em>)同源蛋白相比硫解酶活性较低。
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 2]
[本文引用: 4]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 3]
[D].
[本文引用: 3]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
