 ,1,2
,1,2One-Step Duplex Rapid Identification Technique of Frankliniella occidentalis Greenhouse and Lupin Races Based on Species-Specific COI Marker
ZHANG Rong1, WANG YuSheng1, YANG LiMei3, WAN FangHao1,2, ZHANG GuiFen ,1,2
,1,2通讯作者:
收稿日期:2019-03-27接受日期:2019-06-6网络出版日期:2019-08-16
| 基金资助: |
Received:2019-03-27Accepted:2019-06-6Online:2019-08-16
作者简介 About authors
张蓉,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (993KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
张蓉, 王玉生, 杨丽梅, 万方浩, 张桂芬. 基于种特异性COI标记的西花蓟马温室品系和羽扇豆品系一步双重快速鉴定技术[J]. 中国农业科学, 2019, 52(16): 2809-2823 doi:10.3864/j.issn.0578-1752.2019.16.007
ZHANG Rong, WANG YuSheng, YANG LiMei, WAN FangHao, ZHANG GuiFen.
0 引言
【研究意义】西花蓟马(Frankliniella occidentalis)又称苜蓿蓟马,属缨翅目(Thysanoptera)蓟马科(Thripidae)花蓟马属(Frankliniella),是一种世界性检疫性害虫,也是我国重要的对外对内检疫对象。西花蓟马包括两个品系,即温室品系(greenhouse race,GR)和羽扇豆品系(lupin race,LR),二者在寄主植物范围[1]、生存环境[2]、抗药性[3]等方面均有明显差异。相较于羽扇豆品系,温室品系具有更广的寄主植物范围(温室品系60余科,500余种[4,5,6];羽扇豆品系18科,20余种[1,7-11])、更强的杀虫剂抗性[3],更喜欢在温暖干燥的环境下生存[2],以及更强的繁殖能力和更快的发育速率[12]。西花蓟马温室品系和羽扇豆品系的快速检测鉴定,对西花蓟马的检疫监管及其靶向性防控具有重要意义。【前人研究进展】西花蓟马原产于美国西北部[13],是美国加州常见害虫,之后随花卉产业发展以及国际贸易活动迅速扩散,目前,在以色列[14]、南非[15]、马来西亚[16]、日本[17]、澳大利亚[18]、韩国[19]、印度[20]等均有发生的报道。西花蓟马为多食性害虫,寄主植物有60余科500多种,包括蔬菜、果树、花卉及园林植物等,既可直接锉吸危害,亦可通过传播植物病毒间接危害,严重影响产品的质量和产量以及花卉园林植物的观赏价值,已成为一种世界性农业和园艺作物害虫[21,22]。2000年中国昆明国际花卉节上,我国首次在来自缅甸的盆景植物上检疫到了西花蓟马[23],2003年在北京市郊的温室大棚中首次发现其严重危害辣椒[4],目前已在我国北京、山东[24]、贵州[25]、湖南[26]、江苏[27]、新疆[28]、西藏[29]、四川[30]及河北、山西、内蒙古、辽宁、吉林、黑龙江、河南、云南、陕西、甘肃、宁夏[9,31]19个省(自治区、直辖市)发生危害。其中温室品系在上述19个省(自治区、直辖市)发生危害,而羽扇豆品系目前仅在北京、山东、辽宁、吉林、黑龙江、云南、陕西、宁夏、甘肃9个省(自治区、直辖市)有发现[8-9,31]。西花蓟马个体微小,雌成虫体长1.4—1.7 mm,雄成虫体长1—1.15 mm,且体色多变[21,32]。有研究认为,深色型的西花蓟马更有可能是羽扇豆品系[1]。然而,鉴于烟蓟马(Thrips tabaci)的体色变化与温度有关,温度越低、体色越深[33];因此,多数****认为温度应该是昆虫体色变化的主要诱因[34]。显然,基于成虫外部特征的传统形态学鉴定法无法满足植物检疫和检测监测的基本需求,尤其当样本为幼体或残体时。基于mtDNA COI[1-2,8-9,11,35]和COII基因[11]、rDNA 28S D2基因[1,8],以及基于核蛋白编码基因EF1α[1]等标记技术,曾用于西花蓟马温室品系和羽扇豆品系的识别鉴定。【本研究切入点】然而上述标记技术,或鉴定流程复杂、成本较高,或鉴定结果不稳定、重复性差。如基于COI和COII基因标记的鉴定技术,需要对PCR产物进行碱基序列测定以及系统发育分析[1-2,24,29-31];基于rDNA 28S D2基因的品系特异性检测,虽然无需碱基序列测定和系统发育分析[1],但实际应用中却发现重复性差,无法扩增出理想的品系特异性靶标片段。【拟解决的关键问题】以西花蓟马温室品系和羽扇豆品系为靶标,以田间常见的其他14种蓟马为参照,采用基于线粒体DNA细胞色素C氧化酶亚基I(mitochondrial DNA cytochrome c oxidase subunit I,mtDNA COI)基因的种特异性(species-specific COI,SS-COI)PCR法,研究建立西花蓟马品系特异性一步双重快速检测技术体系。1 材料与方法
试验于2017年7月至2019年2月在中国农业科学院植物保护研究所完成。1.1 供试虫源
西花蓟马温室品系和羽扇豆品系为室内饲养种群,田间常见的其他14种蓟马包括花蓟马(Frankliniella intonsa)、禾花蓟马(Frankliniella tenuicornis)、黄胸蓟马(Thrips hawaiiensis)、大蓟马(Thrips major)、棕榈蓟马(Thrips palmi)、烟蓟马、普通大蓟马(Megalurothrips usitatus)、豆喙蓟马(Mycterothrips glycines)、草木樨近绢蓟马(Sussericothrips melilotus)、蔗腹齿蓟马(Fulmekiola serrata)、稻简管蓟马(Haplothrips aculeatus)、榕端宽管蓟马(Mesothrips jordani)、榕母管蓟马(Gynaikothrips ficorum)和横纹蓟马(Aeolothrips fasciatus)均采自田间,具体信息详见表1。Table 1
表1
表1蓟马样本信息
Table 1
| 编号 No. | 物种名称 Species | 地点 Location | 寄主 Host plant | 时间 Date | 采集人 Collector |
|---|---|---|---|---|---|
| 1 | 西花蓟马温室品系 F. occidentalis greenhouse race | 北京延庆,室内饲养 Yanqing, Beijing; indoor rearing | 市售芸豆 Phaseolus vulgaris; marketed | 2017-07 | 魏书军 WEI ShuJun |
| 2 | 西花蓟马羽扇豆品系 F. occidentalis lupin race | 北京延庆,室内饲养 Yanqing, Beijing; indoor rearing | 市售芸豆 P. vulgaris; marketed | 2017-07 | 魏书军 WEI ShuJun |
| 3 | 花蓟马 F. intonsa | 宁夏吴忠 Wuzhong, Ningxia | 月季 Rosa chinensis | 2016-08 | 田虎 TIAN Hu |
| 4 | 禾花蓟马 F. tenuicornis | 甘肃张掖 Zhangye, Gansu | 葱 Allium fistulosum | 2016-08 | 田虎 TIAN Hu |
| 5 | 黄胸蓟马 T. hawaiiensis | 山东烟台 Yantai, Shandong | 未知种 Unidentified species | 2016-11 | 田虎 TIAN Hu |
| 6 | 大蓟马 T. major | 青海西宁 Xining, Qinghai | 月季 R. chinensis | 2016-08 | 田虎 TIAN Hu |
| 7 | 棕榈蓟马 T. palmi | 浙江温州 Wenzhou, Zhejiang | 西瓜 Citrullus lanatus | 2018-07 | 薛延韬 XUE YanTao |
| 8 | 烟蓟马 T. tabaci | 贵州安顺 Anshun, Guizhou | 茼蒿 Chrysanthemum coronarium | 2018-04 | 杜素洁 DU SuJie |
| 9 | 普通大蓟马 M. usitatus | 广东河源 Heyuan, Guangdong | 芸豆 P. vulgaris | 2017-12 | 毛苗苗 MAO MiaoMiao |
| 10 | 豆喙蓟马 M. glycines | 山东滨州 Binzhou, Shandong | 大豆 Glycine max | 2018-06 | 薛延韬 XUE YanTao |
| 11 | 草木樨近绢蓟马 S. melilotus | 北京西城 Xicheng, Beijing | 白三叶 Trifolium repens | 2018-07 | 张桂芬 ZHANG GuiFen |
| 12 | 蔗腹齿蓟马 F. serrata | 山东青岛 Qingdao, Shandong | 白茅 Imperata cylindrica | 2018-07 | 薛延韬 XUE YanTao |
| 13 | 稻简管蓟马 H. aculeatus | 山东青岛 Qingdao, Shandong | 芦苇 Phragmites australis | 2018-07 | 薛延韬 XUE YanTao |
| 14 | 榕端宽管蓟马 M. jordani | 广东深圳 Shenzhen, Guangdong | 榕树 Ficus microcarpa | 2018-07 | 薛延韬 XUE YanTao |
| 15 | 榕母管蓟马 G. ficorum | 福建漳州 Zhangzhou, Fujian | 榕树 F. microcarpa | 2018-07 | 薛延韬 XUE YanTao |
| 16 | 横纹蓟马 A. fasciatus | 天津滨海新区 Binhai New District, Tianjin | 大豆 G. max | 2018-06 | 薛延韬 XUE YanTao |
新窗口打开|下载CSV
1.2 DNA提取
以西花蓟马温室品系和羽扇豆品系以及田间常见的其他14种蓟马为对象,取单头雌成虫,参照乔玮娜等[36]的方法提取DNA,以20 μL超纯水复溶,充分溶解后以超微量分光光度计(NanoPhotometerTM P330,Implen,Munich,Germany)测定DNA浓度,-20℃保存备用。1.3 COI基因扩增与序列测定
分别以西花蓟马温室品系、羽扇豆品系,以及上述14种其他蓟马共16种/品系蓟马DNA为模板,以DNA条形码通用型引物LCO1490(GGTCAACAAAT CATAAAGATATTGG),HCO2198(TAAACTTCAGG GTGACCAAAAAATCA)[37]进行PCR扩增,扩增片段大小约为710 bp。PCR反应体系为25 μL,其中DNA模板2 μL,上游引物和下游引物各0.5 μL,10×Buffer 2.5 μL,dNTPs(2.5 mmol·L-1)0.5 μL,TaqDNA聚合酶(5 U·μL-1)0.2 μL,ddH2O补足至25 μL。扩增条件:94℃预变性5 min;94℃ 30 s,51℃ 30 s,72℃ 1 min,35个循环;72℃延伸5 min。取5 μL扩增产物,加1 μL上样缓冲液,以DNA Marker为参照,在含有染色剂Gel stain(北京全式金生物技术有限公司)的1%琼脂糖凝胶上进行电泳分离25 min(150 V),以凝胶成像系统(Gel DocTM XR+ Imaging System Universal Hood II,Bio-Rad,USA)分析检测结果;每种蓟马分别检测10头。电泳检测质量合格的PCR产物,直接送生工生物工程(上海)股份有限公司进行双向碱基序列测定。1.4 一步双重品系特异性引物设计、筛选与体系优化
DNAMAN(DNAMAN Version 9)比对分析显示,西花蓟马两个品系的碱基序列相似度为96.67%,碱基差异位点19个。以本研究获得的其他14种蓟马以及数据库中已公开的蓟马COI基因序列(包括西花蓟马所有单倍型)为参照,在两个品系所有单倍型碱基序列相似度比较高的区段设计通用上游引物和通用下游引物各1条;然后,在两个品系所有单倍型碱基序列差异位点比较集中且差异位点在同一品系不同单倍型间较保守的区段,分别靶向温室品系和羽扇豆品系,设计6条品系特异性上游引物和3条品系特异性下游引物。即品系通用引物共计2条,其中品系通用上游引物1条,品系通用下游引物1条,分别命名为TF6和TR3。品系特异性引物共计18条,其中温室品系特异性上游引物6条、下游引物3条,分别命名为GF1-GF6和GR1-GR3;羽扇豆品系特异性上游引物6条、下游引物3条,分别命名为LF1-LF6和LR1-LR3;并据此构建一步双重PCR反应体系。体系构建时引物组合方式为,1条通用上游引物与2条特异性下游引物(温室品系和羽扇豆品系各1条)或1条通用下游引物与2条特异性上游引物(温室品系和羽扇豆品系各1条)组合,共计获得组合45种。其中30种组合对两个品系的扩增片段大小基本一致,其混合扩增产物无法在凝胶电泳上有效分离,不符合一步双重PCR快速检测的基本要求[38],予以舍弃。对其余15种引物组合进行品系特异性预实验验证和引物优化(基于特异性引物设计中GC含量需>40%的原则,进行AT→GC碱基转换。优化后品系特异性下游引物,温室品系命名为GR32,羽扇豆品系命名为LR12;优化后品系特异性上游引物,温室品系命名为GF62,羽扇豆品系命名为LF52)以及再验证,对优化后依然不能进行品系特异性扩增的引物组合予以舍弃,最终确定TF6/GR32/LR12为西花蓟马品系特异性一步双重PCR检测的最佳引物组合,其对温室品系和羽扇豆品系的特异性扩增片段大小分别为362和541 bp(表2)。然后,以该组合引物为靶标进行引物比例和退火温度优化。Table 2
表2
表2西花蓟马品系特异性引物序列及扩增产物
Table 2
| 品系 Race | 引物名称 Primer name | 碱基序列 Primer sequence (5′-3′) | 扩增片段长度 Fragment length (bp) |
|---|---|---|---|
| 温室品系 Greenhouse race | TF6/GR32 | CGACTTAATAACATAAGATTTT/ GATGTATCTAAGTCTCGGTCT | 362 |
| 羽扇豆品系 Lupin race | TF6/LR12 | CGACTTAATAACATAAGATTTT/ GCATAGCATAGATTAGTCCC | 541 |
新窗口打开|下载CSV
1.5 一步双重品系特异性PCR检测体系的建立与优化
为确定一步双重品系特异性PCR检测的最佳反应体系,对组合引物的比例和退火温度进行优化研究。PCR反应体系为25 μL,引物组合共计11种,即TF6/GR32/LR12分别以1.0/0/1.0、1.0/0.1/0.9、1.0/0.2/0.8、1.0/0.3/0.7、1.0/0.4/0.6、1.0/0.5/0.5、1.0/0.6/0.4、1.0/0.7/0.3、1.0/0.8/0.2、1.0/0.9/0.1、1.0/1.0/0 μL的比例进行组合(引物浓度为10 μmol·L-1),10×Buffer 2.5 μL,dNTPs(2.5 mmol·L-1)0.5 μL,Taq DNA聚合酶(5 U·μL-1)0.2 μL,DNA模板1 μL,ddH2O补足至25 μL。扩增条件:94℃预变性5 min;94℃ 30 s,梯度退火温度(36—54℃)1 min,72℃ 1 min,35个循环;72℃延伸5 min。电泳检测方法同1.3。1.6 品系特异性组合引物的种/品系特异性检测
分别以西花蓟马温室品系和羽扇豆品系以及其他14种田间常见蓟马DNA为模板,以优化的反应体系进行PCR扩增,检测组合引物的种/品系特异性。PCR反应体系为25 μL,其中10×Buffer 2.5 μL,dNTPs(2.5 mmol·L-1)0.5 μL,最佳配比组合引物TF6/GR32/LR12共计2.0 μL,Taq DNA聚合酶(5 U·μL-1)0.2 μL,DNA模板1 μL,ddH2O补足至25 μL。扩增条件:94℃ 5 min;94℃ 30 s,最佳退火温度 1 min,72℃ 1 min,35个循环;72℃延伸5 min。电泳检测方法同1.3。每种/品系蓟马分别检测10头。1.7 品系特异性组合引物对不同虫态的扩增效果
以品系特异性组合引物为靶标,以提取的单一品系不同虫态(卵、1龄和2龄幼虫、预蛹和蛹)与不同性别(雄成虫、雌成虫)DNA,以及混合品系(1﹕1)各虫态/性别DNA为模板,进行PCR扩增,电泳检测方法同1.3。每种性别或虫态分别检测10头。1.8 品系特异性组合引物的检测阈值
分别取两个品系单头雌成虫DNA模板10 μL,以2倍递减梯度稀释至2-12倍,其中温室品系初始DNA模板浓度为(18.38±5.40)×103 pg·μL-1,最终稀释浓度为4.49 pg·μL-1;羽扇豆品系初始DNA模板浓度为(18.81±5.71)×103 pg·μL-1,最终稀释浓度为4.59 pg·μL-1。分别取1 μL作为DNA模板进行PCR扩增,电泳检测方法同1.3。分别检测10头。1.9 不同地理种群西花蓟马的检测
以采自我国宁夏、陕西、山东、甘肃、吉林、云南、北京、河北8个省(自治区、直辖市)10个不同地区的西花蓟马(表3)成虫DNA(1 μL)为模板,以品系特异性组合引物TF6/GR32/LR12进行PCR扩增,电泳检测方法同1.3。根据标本采集获得情况,每个地理种群分别检测2—25头。电泳检测质量合格的PCR产物,送生工生物工程(上海)股份有限公司进行碱基序列测定。然后,用DnaSP 5.10软件分析不同地理种群西花蓟马的单倍型组成。Table 3
表3
表3不同地理种群西花蓟马样本信息
Table 3
| 采样地点 Location | 种群代码 Population code | 寄主植物 Host plant | 采集时间 Collection date | 测序个体数量 Number of sequenced |
|---|---|---|---|---|
| 宁夏银川 Yinchuan, Ningxia | YC | 美人蕉 Canna indica | 2015-08 | 21 |
| 陕西宝鸡 Baoji, Shaanxi | BJI | 月季 R. chinensis | 2015-08 | 18 |
| 山东烟台 Yantai, Shandong | YT | 蜀葵 Althaea rosea | 2015-07 | 25 |
| 甘肃敦煌 Dunhuang, Gansu | DH | 月季 R. chinensis | 2015-08 | 8 |
| 吉林四平 Siping, Jilin | SP | 美人蕉 C. indica | 2014-09 | 2 |
| 吉林长春 Changchun, Jilin | CC | 金盏菊 Calendula officinalis | 2014-09 | 9 |
| 云南临沧 Lincang, Yunnan | LC | 白三叶 T. repens | 2015-04 | 12 |
| 甘肃兰州 Lanzhou, Gansu | LZ | 辣椒 Capsicum annuum | 2015-08 | 21 |
| 北京延庆 Yanqing, Beijing | YQ | 辣椒 C. annuum | 2014-07 | 8 |
| 河北廊坊 Langfang, Hebei | LF | 辣椒 C. annuum | 2015-07 | 3 |
| 合计Total | 10 | 127 |
新窗口打开|下载CSV
2 结果
2.1 蓟马类昆虫线粒体DNA COI基因序列扩增与分析
以西花蓟马温室品系和羽扇豆品系及其他14种田间常见蓟马DNA为模板,以DNA条形码通用型引物 LCO1490/HCO2198进行PCR扩增。电泳检测结果显示,16种/品系蓟马均能扩增出一条清晰的靶标片段(图1),扩增片段大小为629—681 bp,与数据库中对应蓟马种类的碱基序列同源性为98.7%—100%。表明所有蓟马种类的mtDNA提取无误,可以用于后续PCR扩增反应。图1
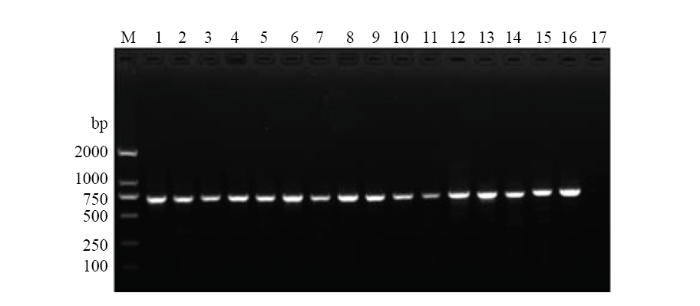 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1DNA条形码通用型引物LCO1490/HCO2198对西花蓟马温室品系和羽扇豆品系以及其他14种田间常见蓟马的扩增电泳图
Fig. 1Gel images of PCR amplifications of DNA from F. occidentalis greenhouse and lupin races, and other 14 common thrips species in the field using COI gene universal primers LCO1490/HCO2198
M:标准DNA分子质量 DNA ladder;1:西花蓟马温室品系F. occidentalis greenhouse race;2:西花蓟马羽扇豆品系F. occidentalis lupin race;3:花蓟马F. intonsa;4:禾花蓟马F. tenuicornis;5:黄胸蓟马T. hawaiiensis;6:大蓟马T. major;7:棕榈蓟马T. palmi;8:烟蓟马T. tabaci;9:普通大蓟马M. usitatus;10:豆喙蓟马M. glycines;11:草木樨近绢蓟马S. melilotus;12:蔗腹齿蓟马F. serrata;13:稻简管蓟马H. aculeatus;14:榕端宽管蓟马M. jordani;15:榕母管蓟马G. ficorum;16:横纹蓟马A. fasciatus;17:阴性对照(模板为超纯水)Negative control (ultrapure water)
2.2 一步双重品系特异性PCR检测体系建立
2.2.1 组合引物比例的优化 以筛选出的品系通用上游引物TF6以及温室品系特异性下游引物GR32和羽扇豆品系特异性下游引物LR12为靶标,设置不同比例的引物组合,以两个品系DNA为模板分别进行PCR扩增。结果显示,当组合引物TF6/GR32/LR12以1.0/0.2/0.8的比例进行组合时,无论是温室品系(图2-A)还是羽扇豆品系(图2-B)均能扩增出清晰的靶标条带。图2
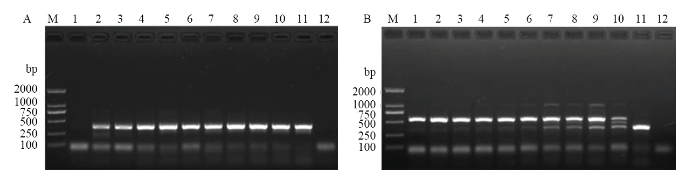 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2西花蓟马一步双重品系特异性引物TF6/GR32/LR12不同比例组合对温室品系(A)和羽扇豆品系(B)的扩增
Fig. 2Amplification pattern of different ratios of race-specific combination primers TF6/GR32/LR12 on DNA of F. occidentalis greenhouse (A) and lupin (B) races
M:标准DNA分子质量 DNA ladder;1—11:TF6/GR32/LR12比例分别为The ratios of TF6/GR32/LR12 are 1.0/0/1.0, 1.0/0.1/0.9, 1.0/0.2/0.8, 1.0/0.3/0.7, 1.0/0.4/0.6, 1.0/0.5/0.5, 1.0/0.6/0.4, 1.0/0.7/0.3, 1.0/0.8/0.2, 1.0/0.9/0.1, and 1.0/1.0/0 μL, respectively;12:阴性对照(模板为超纯水)Negative control (ultrapure water)
2.2.2 退火温度的优化 分别以两个品系DNA为模板,以优化后的品系特异性引物组合(TF6/GR32/LR12配比为1.0/0.2/0.8),比较36—54℃不同退火温度下的扩增效果。结果显示,当退火温度为44℃时,扩增效果最好,扩增出的分别靶向温室品系(图3-A)或羽扇豆品系(图3-B)的特异性条带最为清晰。
图3
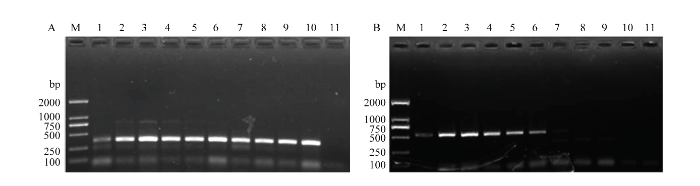 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3西花蓟马温室品系(A)和羽扇豆品系(B)一步双重特异性组合引物TF6/GR32/LR12 PCR扩增的退火温度优化
Fig. 3Optimization of annealing temperature of the one-step race-specific combination primers TF6/GR32/LR12 for DNA of F. occidentalis greenhouse (A) and lupin (B) races
M:标准DNA分子质量 DNA ladder;1—10:退火温度分别为 Annealing temperatures are 36, 38, 40, 42, 44, 46, 48, 50, 52, 54℃, respectively;11:阴性对照(模板为超纯水)Negative control (ultrapure water)
2.3 组合引物的种/品系特异性检验
以西花蓟马温室品系和羽扇豆品系以及田间常见的其他14种蓟马DNA为模板,以优化的一步双重PCR反应体系,检验组合引物TF6/GR32/LR12的种/品系特异性。电泳检测结果显明,该组合引物的特异性强,当以温室品系为靶标时,只扩增出362 bp的温室品系特异性条带,当以羽扇豆品系为靶标时,只扩增出541 bp的羽扇豆品系特异性条带,对田间常见的其他14种蓟马没有扩增效果(图4),表明该组合引物为西花蓟马的品系特异性引物。图4
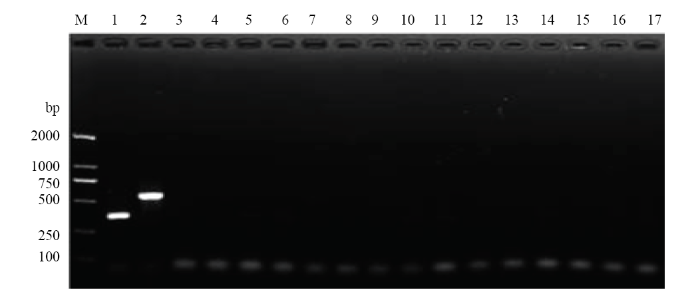 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4西花蓟马品系特异性组合引物TF6/GR32/LR12对温室品系和羽扇豆品系及其他14种田间常见蓟马的PCR扩增
Fig. 4Amplification pattern of DNA of F. occidentalis greenhouse and lupin races, and other 14 common thrips species in the field using race-specific combination primers TF6/GR32/LR12
M:标准DNA分子质量DNA ladder;1:西花蓟马温室品系F. occidentalis greenhouse race;2:西花蓟马羽扇豆品系F. occidentalis lupin race;3:花蓟马F. intonsa;4:禾花蓟马F. tenuicornis;5:黄胸蓟马T. hawaiiensis;6:大蓟马T. major;7:棕榈蓟马T. palmi;8:烟蓟马T. tabaci;9:普通大蓟马M. usitatus;10:豆喙蓟马M. glycines;11:草木樨近绢蓟马S. melilotus;12:蔗腹齿蓟马F. serrata;13:稻简管蓟马H. aculeatus;14:榕端宽管蓟马M. jordani;15:榕母管蓟马G. ficorum;16:横纹蓟马A. fasciatus;17:阴性对照(模板为超纯水)Negative control (ultrapure water)
2.4 品系特异性组合引物对不同虫态的扩增效果
分别以单一品系不同虫态(卵、1龄和2龄幼虫、预蛹和蛹)和不同性别(雄成虫、雌成虫)DNA,以及混合品系(1﹕1)各虫态/性别DNA为模板,以品系特异性组合引物TF6/GR32/LR12进行一步双重PCR扩增。电泳检测结果显示,当以单一品系DNA为模板时,温室品系各虫态/性别均能稳定扩增出清晰的362 bp特异性条带,羽扇豆品系各虫态/性别均能稳定扩增出清晰的541 bp特异性条带(图5-A);当以混合品系DNA为模板时,各虫态/性别均能稳定地同时扩增出分别靶向温室品系和羽扇豆品系的特异性条带(图5-B)。图5
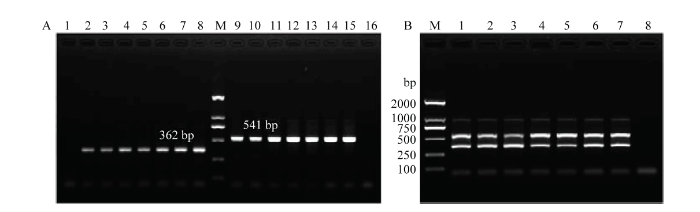 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5西花蓟马品系特异性组合引物TF6/GR32/LR12对单一品系(A)和混合品系(B)不同虫态和性别的PCR扩增结果
Fig. 5Amplification pattern of different development stages and genders of F. occidentalis in single race (A) and mixed races (B) using race-specific combination primers TF6/GR32/LR12
A:单一品系Single race;2—8:温室品系Greenhouse race;9—15:羽扇豆品系Lupin race;M:标准DNA分子质量DNA ladder;2、9:卵Egg;3、10:1龄幼虫1st instar larva;4、11:2龄幼虫2nd instar larva;5、12:预蛹Pre-pupa;6、13:蛹Pupa;7、14:雄成虫Male adult;8、15:雌成虫Female adult;1、16:阴性对照(模板为超纯水)Negative control (ultrapure water)。B:混合品系Mixed races;M:标准DNA分子质量DNA ladder;1:卵Egg;2:1龄幼虫1st instar larva;3:2龄幼虫2nd instar larva;4:预蛹Pre-pupa;5:蛹Pupa;6:雄成虫Male adult;7:雌成虫Female adult;8:阴性对照(模板为超纯水)Negative control (ultrapure water)
2.5 品系特异性组合引物的检测阈值
分别以不同浓度西花蓟马温室品系和羽扇豆品系的雌成虫DNA为模板,进行最低检测阈值测定。结果表明,当以温室品系为检测靶标时,其最低检测浓度为35.90 pg·μL-1,相当于1/10 240头雌成虫(图6-A);当以羽扇豆品系为检测靶标时,其最低检测浓度为146.95 pg·μL-1,相当于1/2 560头雌成虫(图6-B)。图6
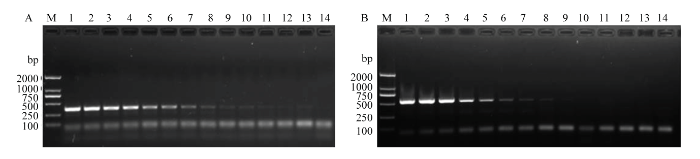 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6西花蓟马品系特异性组合引物TF6/GR32/LR12对温室品系(A)和羽扇豆品系(B)最低检测阈值的测定
Fig. 6The detection threshold for F. occidentalis greenhouse race (A) and lupin race (B) diluted female adult mtDNA using race-specific combination primers TF6/GR32/LR12
A:温室品系 Greenhouse race;M:标准DNA分子质量 DNA ladder;1—13:18.38×103, 9.19×103, 4.60×103, 2.30×103, 1.15×103, 574.38, 287.19, 143.59, 71.80, 35.90, 17.95, 8.97, and 4.49 pg·μL-1, respectively;14:阴性对照(模板为超纯水)Negative control (ultrapure water)。B:羽扇豆品系 Lupin race;M:标准DNA分子质量 DNA ladder;1—13:18.81×103, 9.41×103, 4.70×103, 2.35×103, 1.18×103, 587.81, 293.91, 146.95, 73.48, 36.74, 18.37, 9.18, and 4.59 pg·μL-1, respectively;14:阴性对照(模板为超纯水)Negative control (ultrapure water)
2.6 不同地理种群西花蓟马的检测鉴定
以采自我国8个省(自治区、直辖市)10个不同地区的127头西花蓟马成虫DNA为模板,以品系特异性组合引物TF6/GR32/LR12进行PCR扩增。检测结果显示,各地理种群均能扩增出或靶向温室品系(362 bp)、或靶向羽扇豆品系(541 bp)的COI基因片段,部分种群个体(10个地理种群45个个体)电泳检测结果如图7所示。其中,114头被鉴定为温室品系,来自全部10个地理种群;13头被鉴定为羽扇豆品系,分别来自宁夏银川、陕西宝鸡、山东烟台、吉林四平和吉林长春。进一步的碱基序列测定和比对分析显示,温室品系和羽扇豆品系的碱基序列与数据库中对应品系碱基序列的同源性分别为98.33%—100%和98.34%—100%;品系单倍型分析结果表明,114头温室品系包含有3种单倍型,13头羽扇豆品系包含有2种单倍型(表4)。图7
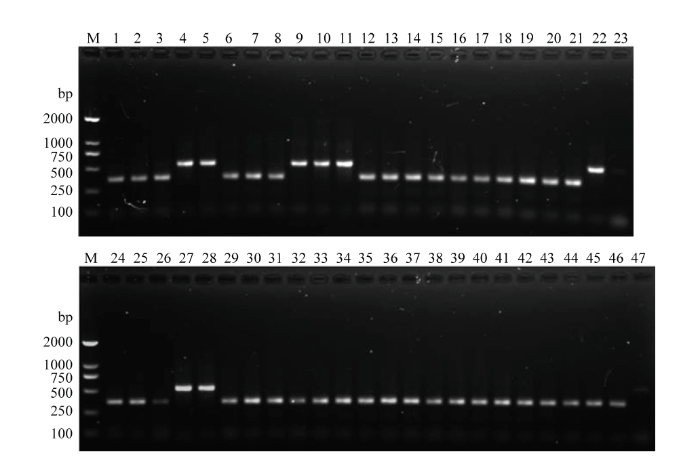 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7西花蓟马品系特异性组合引物TF6/GR32/LR12对10个不同地理种群西花蓟马的检测
Fig. 7Amplification pattern of F. occidentalis collected from 10 different areas of China using race-specific combination primers TF6/GR32/LR12
M:标准DNA分子质量 DNA ladder;1—5:银川YC;6—10:宝鸡BJI;11—15:烟台YT;16—20:敦煌DH;21、22:四平SP;24—28:长春CC;29—33:临沧LC;34—38:兰州LZ;39—43:延庆YQ;44—46:廊坊LF;23、47:阴性对照(模板为超纯水)Negative control (ultrapure water)
Table 4
表4
表4基于mtDNA COI基因的各单倍型在西花蓟马10个地理种群中的分布
Table 4
| 种群 Population | 单倍型 Haplotype | |||||
|---|---|---|---|---|---|---|
| 温室品系Greenhouse race | 羽扇豆品系Lupin race | |||||
| GHap-1 | GHap-2 | GHap-3 | LHap-1 | LHap-2 | ||
| YC | 14 | 1 | 5 | 1 | ||
| BJI | 15 | 1 | 2 | |||
| YT | 20 | 3 | 1 | 1 | ||
| DH | 7 | 1 | ||||
| SP | 1 | 1 | ||||
| CC | 6 | 3 | ||||
| LC | 12 | |||||
| LZ | 19 | 2 | ||||
| YQ | 7 | 1 | ||||
| LF | 3 | |||||
| 总计 Total | 104 | 9 | 1 | 12 | 1 | |
新窗口打开|下载CSV
3 讨论
蓟马类为小型昆虫,其物种鉴别主要依据成虫外部形态特征,对于非专业从事蓟马分类的人员而言难以实现,而近年来随着分子生物学技术的迅速发展,这一难题迎刃而解。目前,已有多种DNA标记技术用于蓟马类昆虫的识别与鉴定,包括随机多态性DNA(random amplified polymorphic DNA,RAPD)标记技术[39]、基于线粒体DNA COI/COII/COIII基因的DNA序列测序法[40,41,42]、基于COI和ITS-1/ITS-2序列的限制片段长度多态性(restriction fragment length polymorphism,RFLP)标记技术[40,43-45]、特征序列扩增区域(sequence characterized amplified regions,SCAR)标记技术[46]、种特异性PCR(species-specific PCR,SSP)扩增技术[47,48]、实时荧光定量PCR(real-time quantitative PCR,qPCR)技术[49,50,51]、DNA条形码技术[35-36,52-54]、基因芯片技术[55]等,并取得了显著成效。其中,基于线粒体DNA COI基因的DNA条形码技术在蓟马类以及其他昆虫类群的识别鉴定中起到了重要作用[56,57]。线粒体DNA为多拷贝基因,具有分子量小、进化速度快、遗传自主性和严格的母系遗传等特性,基于线粒体DNA细胞色素C氧化酶亚基Ⅰ(mtDNA COI)基因的DNA条形码技术即由此发展而来[58],目前已广泛应用于个体识别鉴定、生物分类,以及分子进化、遗传结构和亲缘关系分析等[56,57]。本研究采用基于线粒体DNA COI基因的SS-COI标记技术,研发出了靶向西花蓟马温室品系和羽扇豆品系的一步双重特异性组合引物TF6/GR32/LR12及其快速检测鉴定方法。该组合引物特异性强,只对西花蓟马的温室品系和羽扇豆品系具有扩增效果,只需一步PCR反应,即可获得分别靶向温室品系(362 bp)和羽扇豆品系(541 bp)的特异性条带,对田间常见的14种其他种类蓟马(包括两种花蓟马属蓟马)不具有扩增能力(图4)。同时,该技术体系的检测灵敏性高,无论单一品系还是混合品系,既对成虫具有良好的扩增效果,也对单粒卵、初孵幼虫、2龄幼虫、预蛹及蛹具有同样的扩增效能(图5);靶向温室品系,其最低检测阈值为35.90 pg·μL-1,相当于1/10 240头雌成虫,靶向羽扇豆品系其最低检测阈值为146.95 pg·μL-1,相当于1/2 560头雌成虫(图6)。进一步的田间样本检测分析显示,该技术体系能快速鉴定出来自不同省(自治区、直辖市)的西花蓟马(包括不同的单倍型)所属的品系类型。此外,数据库同源性比对分析结果表明,没有任一同属(Frankliniella)近缘种蓟马(包括东方花蓟马F. tritici、花蓟马、首花蓟马F. cephalica、禾花蓟马、佛罗里达花蓟马F. bispinosa、褐花蓟马F. fusca、梳缺花蓟马F. schultzei、澳洲花蓟马 F. australis、西印花蓟马F. insularis、单色花蓟马 F. unicolor,以及F. aztecus、F. borinquen、F. brunnea、F. citripes、F. fortissima、F. gardeniae、F. minuta、F. panamensis、F. rostrata 等19种)或其他种类的蓟马或昆虫的DNA序列与西花蓟马温室品系或羽扇豆品系特有的362 bp(同源性<88%)或541 bp(同源性<85%)片段完全一致,显示该技术体系完全可用于西花蓟马品系的快速鉴定,以及国际国内农产品(包括水果、蔬菜和花卉)贸易或调运过程中的检验检疫和监管。同时,还可用于指导田间西花蓟马品系靶向性防控措施的制定,如靶向抗性比较强的温室品系单优地域种群[3],应少用或不用化学农药;而靶向品系混发地域种群,应采用剂量控制、合理用药(轮用、混用等)等措施,延缓抗药性产生。此外,两个品系在危害程度、传播病毒能力等方面是否存在差异,尚不得而知,而本研究的品系特异性快速检测技术体系的建立,为单一品系种群建立及其后续研究提供了技术支撑。
一步多重PCR(multiplex PCR)又称多重引物PCR或复合PCR,是指在同一PCR反应体系中添加两对以上引物,同时扩增出多个核酸片段的PCR反应,且每对引物只对应一个靶标片段[59],与常用的RAPD技术(一对引物对应多个扩增产物)[38]全然不同。多重PCR技术可用于病原微生物、昆虫、软体动物等的检测鉴定,所用的靶标基因主要有COI基因、16S rDNA基因[60,61,62,63,64]和ITS基因[65]等。如基于16S rDNA[60,61]、EF1α[66]等基因的一步双重/多重PCR技术常用于细菌鉴定;基于病毒保守基因(DNA/RNA)的一步多重PCR技术常用于5种病毒的快速检测[67,68]。同时,多重PCR技术在外来入侵种的检测监测中亦发挥了重要作用[69]。如ZHANG等[70]基于SCAR标记技术,研究构建了靶向烟粉虱(Bemisia tabaci)B隐种和西花蓟马的一步双重快速检测鉴定技术体系,只需一步PCR反应,即可将两种同域发生的重大入侵种区分开,无需碱基序列测定和比对分析;KURATA等[61]以COI基因为靶标构建一步多重PCR扩增体系,只需一步扩增反应即可有效区分入侵种烟粉虱(MEAM1,MED Q1,MED Q2隐种)和本地种烟粉虱(Asia II 6隐种);NAKAMURA等[63]以COI基因为靶标构建了一步多重PCR引物组合体系,用以快速鉴定5种斑潜蝇属(Liriomyza)害虫(包括L. bryoniae、葱斑潜蝇L. chinensis、南美斑潜蝇L. huidobrensi、美洲斑潜蝇L. sativae和三叶草斑潜蝇L. trifolii等),并且针对美洲斑潜蝇存在隐存种或进化支的现象,分别设计了靶向支系A和L的特异性上游引物,与潜蝇属通用下游引物组合成新的多重PCR引物组合,用于鉴定美洲斑潜蝇的3个隐存种,取得了预期效果;COOKE等[62]以COI基因为靶标构建多重PCR技术体系,无需测序即可快速鉴别入侵种福寿螺(Pomacea canaliculata)与当地两种同属近缘种蜗牛,即淡水苹果蜗牛(P. insularum)和P. bridgesii。基于SS-PCR技术的种特异性一步双重/多重PCR检测鉴定技术,只需一步PCR扩增反应,即可根据靶标片段的大小快速地鉴定物种,无需碱基序列测定与比对分析,具有操作简便,经济、高效、系统性强等特性,适用于区分近缘种、隐存种等[38]。
本研究研发的一步双重品系特异性SS-COI组合引物TF6/GR32/LR12及其快速检测技术体系,提高了西花蓟马温室品系和羽扇豆品系检测鉴定的准确性和灵敏度,节约了检测时间,在西花蓟马品系检测监测及其靶向性防控中具有重要应用价值。将本研究获得的靶标序列与数据库中已有序列进行同源性比对,结果显示,本研究温室品系的靶标片段与数据库[71]中温室品系其他单倍型(105种)的同源性为98.33%—100%,与羽扇豆品系(包括不同的单倍型)的同源性为95.03%—96.13%,而与其他近缘种的同源性<87.68%;本研究羽扇豆品系的靶标片段与数据库中羽扇豆品系其他单倍型(104种)的同源性为98.34%—100%,与温室品系(包括不同的单倍型)的同源性为96.12%—96.30%,而与其他近缘种的同源性<84.73%。表明该检测技术完全可以用于西花蓟马的温室品系或羽扇豆品系鉴定,并且在同一品系不同单倍型间具有较好的通用性,在不同品系之间具有良好的特异性(图7)。不过蓟马类昆虫种类比较多,且同一种类(如西花蓟马)包含多种单倍型,有一些常见的种类/种群/单倍型本研究没有涉及,因此该组合引物的特异性,尤其靶向同一品系不同单倍型的通用性以及靶向不同品系不同单倍型的特异性,还需进一步验证;而有关该组合引物对温室品系和羽扇豆品系最低检测阈值的差异,可能与其扩增的两个品系靶标片段的大小不同有关。
4 结论
采用种特异性SS-COI标记法建立了西花蓟马品系一步双重特异性快速检测鉴定技术体系。该检测鉴定技术体系特异性强,仅对西花蓟马的温室品系和/或羽扇豆品系具有扩增能力,对田间常见的其他14种蓟马不具有扩增效能。灵敏度高,无论单一品系还是混合品系,或同一品系不同单倍型,不仅对成虫、预蛹和蛹具有良好的扩增效果,对单粒卵、1龄和2龄幼虫亦具有同等的扩增能力;对温室品系的最低检测阈值为35.90 pg·μL-1,相当于1/10 240头雌成虫,对羽扇豆品系的最低检测阈值为146.95 pg·μL-1,相当于1/2 560头雌成虫。该检测鉴定技术体系的建立对西花蓟马的检疫监管、有效阻截西花蓟马两个品系的进一步传播扩散及其靶向性防控措施制定具有重要意义。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 8]
[本文引用: 4]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
Magsci [本文引用: 1]

<p> 利用PCR技术克隆西花蓟马(Frankliniella occidentalis)的rDNA ITS2和COⅠ基因5'末端的部分序列,结合GenBank中相应序列对两者的突变类型、核苷酸多态性、单倍型多态性、种内平均遗传距离以及系统进化等进行比较分析.结果表明,COⅠ基因较rDNA ITS2更适合于F. occidentalis的种内遗传分析;F. occidentalis可能是由两个(或多个)株系或隐存种组成的复合体;入侵我国的F. occidentalis以温室系(greenhouse strain)为主体,也存在一定数量的羽扇豆系(lupin strain).据此,推测F. occidentalis最先是被传播至云南,再从云南扩散至北京、哈尔滨等地.本研究结果对了解我国F. occidentalis的遗传多样性、株系组成以及入侵机制具有一定意义.</p>
Magsci [本文引用: 1]

<p> 利用PCR技术克隆西花蓟马(Frankliniella occidentalis)的rDNA ITS2和COⅠ基因5'末端的部分序列,结合GenBank中相应序列对两者的突变类型、核苷酸多态性、单倍型多态性、种内平均遗传距离以及系统进化等进行比较分析.结果表明,COⅠ基因较rDNA ITS2更适合于F. occidentalis的种内遗传分析;F. occidentalis可能是由两个(或多个)株系或隐存种组成的复合体;入侵我国的F. occidentalis以温室系(greenhouse strain)为主体,也存在一定数量的羽扇豆系(lupin strain).据此,推测F. occidentalis最先是被传播至云南,再从云南扩散至北京、哈尔滨等地.本研究结果对了解我国F. occidentalis的遗传多样性、株系组成以及入侵机制具有一定意义.</p>
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 3]
[D].
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
//
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
Magsci [本文引用: 2]

蓟马类害虫种类多、 体型小, 传统的形态学鉴定方法难以快速准确识别。本研究利用DNA条形码通用型引物, 以我国田间常见的25种蓟马为靶标扩增其线粒体DNA细胞色素C氧化酶亚基Ⅰ (mitochondrial cytochrome c oxidase subunit Ⅰ gene, mtDNA COⅠ) 基因 (约650 bp), 通过对靶标片段碱基序列的测序及比对分析, 以邻接法 (NJ法) 构建系统发育树, 并以Kimura双参数模型计算种内、 种间遗传距离。结果表明: 聚类分析与形态学鉴定结果一致, 表现为较长的种间分支和较短的种内分支, 每个单系分支对应一个物种, 同一物种不同单倍型的最初分支自展值均为100%。25种蓟马的种内平均遗传距离为0.0027, 种间平均遗传距离为0.2757, 种间遗传距离为种内遗传距离的102.1倍; 而且种内、 种间遗传距离没有重叠区域。结果说明基于COⅠ基因的DNA条形码技术可以用于不同种类蓟马的快速准确鉴别。
Magsci [本文引用: 2]

蓟马类害虫种类多、 体型小, 传统的形态学鉴定方法难以快速准确识别。本研究利用DNA条形码通用型引物, 以我国田间常见的25种蓟马为靶标扩增其线粒体DNA细胞色素C氧化酶亚基Ⅰ (mitochondrial cytochrome c oxidase subunit Ⅰ gene, mtDNA COⅠ) 基因 (约650 bp), 通过对靶标片段碱基序列的测序及比对分析, 以邻接法 (NJ法) 构建系统发育树, 并以Kimura双参数模型计算种内、 种间遗传距离。结果表明: 聚类分析与形态学鉴定结果一致, 表现为较长的种间分支和较短的种内分支, 每个单系分支对应一个物种, 同一物种不同单倍型的最初分支自展值均为100%。25种蓟马的种内平均遗传距离为0.0027, 种间平均遗传距离为0.2757, 种间遗传距离为种内遗传距离的102.1倍; 而且种内、 种间遗传距离没有重叠区域。结果说明基于COⅠ基因的DNA条形码技术可以用于不同种类蓟马的快速准确鉴别。
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 2]
Magsci [本文引用: 1]

<DIV>用PCR产物直接测序法对入侵害虫西花蓟马和其他8种蓟马的线粒体 COⅠ基因433 bp片段测序,获得62个个体的序列。分子数据分析显示: 种内个体间平均遗传距离在0~0.005之间,2003年在北京发现的西花蓟马与欧洲等地区报导的西花蓟马不存在明显的遗传差异; 9种蓟马种间平均遗传距离为0.213。构建的NJ树可以很好的显示蓟马的聚类,物种各单元型最初分支自展值均达到100%。结果表明,基于PCR及直接测序技术的分子鉴定可以达到准确鉴定蓟马物种之目的。</DIV>
Magsci [本文引用: 1]

<DIV>用PCR产物直接测序法对入侵害虫西花蓟马和其他8种蓟马的线粒体 COⅠ基因433 bp片段测序,获得62个个体的序列。分子数据分析显示: 种内个体间平均遗传距离在0~0.005之间,2003年在北京发现的西花蓟马与欧洲等地区报导的西花蓟马不存在明显的遗传差异; 9种蓟马种间平均遗传距离为0.213。构建的NJ树可以很好的显示蓟马的聚类,物种各单元型最初分支自展值均达到100%。结果表明,基于PCR及直接测序技术的分子鉴定可以达到准确鉴定蓟马物种之目的。</DIV>
Magsci [本文引用: 1]

<DIV><FONT size=3><SPAN >美洲棘蓟马</SPAN><I ><SPAN lang=EN-US >Echinothrips americanus</SPAN></I><SPAN lang=EN-US > Morgan, 1913</SPAN><SPAN >是新入侵我国</SPAN><SPAN >的种类。本文</SPAN><SPAN >报道了该虫各发育阶段的外部形态和分子鉴定</SPAN><SPAN >结果。首先利用体视显微镜对美洲棘蓟马不同虫态的外部形态进行了观察和拍照</SPAN><SPAN >;再选择线粒体</SPAN><SPAN lang=EN-US >CO</SPAN><SPAN lang=EN-US >Ⅰ</SPAN><SPAN >基因中一段约</SPAN><SPAN lang=EN-US >430 bp</SPAN><SPAN >的序列进行</SPAN><SPAN lang=EN-US >PCR</SPAN><SPAN >扩增和测序,将所得序列用于蓟马种类的分子</SPAN><SPAN >鉴定。使</SPAN><SPAN >用不同的矩阵和系统发育构建方法对待鉴定的蓟马以及另外</SPAN><SPAN lang=EN-US >38</SPAN><SPAN >种蓟马进行了聚类分析,结果表明:基于线粒体</SPAN><SPAN lang=EN-US >CO</SPAN><SPAN lang=EN-US >Ⅰ</SPAN><SPAN >基因第</SPAN><SPAN lang=EN-US >1</SPAN><SPAN >和</SPAN><SPAN lang=EN-US >2</SPAN><SPAN >编码位点,利用</SPAN><SPAN lang=EN-US >NJ</SPAN><SPAN >法构建的系统发育树可以较好地区别不同蓟马种类,可作为调查我国蓟马种类和分布的快速方便</SPAN><SPAN >方法。最</SPAN><SPAN >后对美洲棘蓟马的基本生物学特性和防控对策进行</SPAN><SPAN >了综述。</SPAN></FONT></DIV>
Magsci [本文引用: 1]

<DIV><FONT size=3><SPAN >美洲棘蓟马</SPAN><I ><SPAN lang=EN-US >Echinothrips americanus</SPAN></I><SPAN lang=EN-US > Morgan, 1913</SPAN><SPAN >是新入侵我国</SPAN><SPAN >的种类。本文</SPAN><SPAN >报道了该虫各发育阶段的外部形态和分子鉴定</SPAN><SPAN >结果。首先利用体视显微镜对美洲棘蓟马不同虫态的外部形态进行了观察和拍照</SPAN><SPAN >;再选择线粒体</SPAN><SPAN lang=EN-US >CO</SPAN><SPAN lang=EN-US >Ⅰ</SPAN><SPAN >基因中一段约</SPAN><SPAN lang=EN-US >430 bp</SPAN><SPAN >的序列进行</SPAN><SPAN lang=EN-US >PCR</SPAN><SPAN >扩增和测序,将所得序列用于蓟马种类的分子</SPAN><SPAN >鉴定。使</SPAN><SPAN >用不同的矩阵和系统发育构建方法对待鉴定的蓟马以及另外</SPAN><SPAN lang=EN-US >38</SPAN><SPAN >种蓟马进行了聚类分析,结果表明:基于线粒体</SPAN><SPAN lang=EN-US >CO</SPAN><SPAN lang=EN-US >Ⅰ</SPAN><SPAN >基因第</SPAN><SPAN lang=EN-US >1</SPAN><SPAN >和</SPAN><SPAN lang=EN-US >2</SPAN><SPAN >编码位点,利用</SPAN><SPAN lang=EN-US >NJ</SPAN><SPAN >法构建的系统发育树可以较好地区别不同蓟马种类,可作为调查我国蓟马种类和分布的快速方便</SPAN><SPAN >方法。最</SPAN><SPAN >后对美洲棘蓟马的基本生物学特性和防控对策进行</SPAN><SPAN >了综述。</SPAN></FONT></DIV>
[本文引用: 1]
[本文引用: 1]
Magsci [本文引用: 1]

西花蓟马<I>Frankliniella occidentalis</I> (Pergande)是一种世界性入侵害虫,寄主范围广,危害严重,2003年首次在我国发生危害,并有进一步扩散蔓延的趋势。针对蓟马类害虫虫体微小、形态相似,难以准确快速区分的问题,采用特征序列扩增区域(SCAR)标记技术,以西花蓟马及与之同域发生的其他种类蓟马为对象,筛选出1对西花蓟马特异性引物(FOMF/FOMR),其扩增片段大小为320 bp。种特异性检测结果显示,该对引物只对西花蓟马的基因组DNA具有扩增能力,对同域发生的花蓟马<I>F. intonsa </I>(Trybom)、禾花蓟马<I>F. tenuicornis </I>(Uzel)、烟蓟马<I>Thrips tabaci </I>L. 等41种蓟马不具有扩增效果。该对引物不仅对不同虫态的西花蓟马具有扩增能力,而且在西花蓟马发生地的寄主植物组织内亦检测到了其卵的存在。同时,该检测技术灵敏度高,对成虫的最低检出阈值为1/160头。本检测技术在口岸检疫以及花卉、蔬菜和种苗调运中的害虫检测和监测中具有重要意义。
Magsci [本文引用: 1]

西花蓟马<I>Frankliniella occidentalis</I> (Pergande)是一种世界性入侵害虫,寄主范围广,危害严重,2003年首次在我国发生危害,并有进一步扩散蔓延的趋势。针对蓟马类害虫虫体微小、形态相似,难以准确快速区分的问题,采用特征序列扩增区域(SCAR)标记技术,以西花蓟马及与之同域发生的其他种类蓟马为对象,筛选出1对西花蓟马特异性引物(FOMF/FOMR),其扩增片段大小为320 bp。种特异性检测结果显示,该对引物只对西花蓟马的基因组DNA具有扩增能力,对同域发生的花蓟马<I>F. intonsa </I>(Trybom)、禾花蓟马<I>F. tenuicornis </I>(Uzel)、烟蓟马<I>Thrips tabaci </I>L. 等41种蓟马不具有扩增效果。该对引物不仅对不同虫态的西花蓟马具有扩增能力,而且在西花蓟马发生地的寄主植物组织内亦检测到了其卵的存在。同时,该检测技术灵敏度高,对成虫的最低检出阈值为1/160头。本检测技术在口岸检疫以及花卉、蔬菜和种苗调运中的害虫检测和监测中具有重要意义。
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
Magsci [本文引用: 2]

DNA条形码技术是通过对一段标准化基因DNA序列的分析来实现对生物物种准确、快速鉴定的技术。自2003年提出以来,DNA条形码技术便备受关注,不仅被广泛地应用于生物分类学研究,也为生态学等学科的发展带来了机遇。昆虫是动物界的最大类群,目前条形码数据库中超过65%的序列都来自昆虫纲,DNA条形码的发展无疑为昆虫学带来了勃勃生机。本文综述了DNA条形码的产生、发展、优势及局限,总结并展望了DNA条形码技术在昆虫学基础研究与实践方面的应用。
Magsci [本文引用: 2]

DNA条形码技术是通过对一段标准化基因DNA序列的分析来实现对生物物种准确、快速鉴定的技术。自2003年提出以来,DNA条形码技术便备受关注,不仅被广泛地应用于生物分类学研究,也为生态学等学科的发展带来了机遇。昆虫是动物界的最大类群,目前条形码数据库中超过65%的序列都来自昆虫纲,DNA条形码的发展无疑为昆虫学带来了勃勃生机。本文综述了DNA条形码的产生、发展、优势及局限,总结并展望了DNA条形码技术在昆虫学基础研究与实践方面的应用。
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
Magsci [本文引用: 2]

【目的】目前发现,北京枣园中的凹缘菱纹叶蝉<em>Hishimonus sellatus</em> (Uhler)和片突菱纹叶蝉 <em>Hishimonus lamellatus </em>Cai混同发生。已知凹缘菱纹叶蝉可以传播枣疯病,而片突菱纹叶蝉是否携带枣疯病植原体尚待证明。正确鉴别区分枣园中菱纹叶蝉的种类并测定其体内感染枣疯病植原体情况有助于阐明田间枣疯病的流行规律,从而提出有效的预防枣疯病及其媒介昆虫措施显得十分重要。传统形态学鉴定两种菱纹叶蝉种类的方法局限于雄性成虫外生殖器,本研究目的在于建立一种快速的分子生物学方法,在区分枣园中两种枣菱纹叶蝉的同时,可检测虫体内的枣疯病植原体。【方法】以凹缘菱纹叶蝉和片突菱纹叶蝉的COI基因以及枣疯病植原体的16S rDNA为扩增目标,分别设计引物,建立一种包含3对引物的多重PCR体系。测试该多重PCR体系对叶蝉总DNA的灵敏度、准确性,以及当两种叶蝉DNA同时存在时的辨别能力和对枣疯病植原体16S rDNA的灵敏度。【结果】该多重PCR可以准确区分凹缘菱纹叶蝉和片突菱纹叶蝉,并对虫体内枣疯病植原体实现检测,其对昆虫总DNA的灵敏度达到0.012 ng,对枣疯病植原体16S rDNA模板的灵敏度达到900拷贝。【结论】该方法极大方便了对枣菱纹叶蝉的田间种群发生动态及虫体中枣疯病植原体感染的监测。
Magsci [本文引用: 2]

【目的】目前发现,北京枣园中的凹缘菱纹叶蝉<em>Hishimonus sellatus</em> (Uhler)和片突菱纹叶蝉 <em>Hishimonus lamellatus </em>Cai混同发生。已知凹缘菱纹叶蝉可以传播枣疯病,而片突菱纹叶蝉是否携带枣疯病植原体尚待证明。正确鉴别区分枣园中菱纹叶蝉的种类并测定其体内感染枣疯病植原体情况有助于阐明田间枣疯病的流行规律,从而提出有效的预防枣疯病及其媒介昆虫措施显得十分重要。传统形态学鉴定两种菱纹叶蝉种类的方法局限于雄性成虫外生殖器,本研究目的在于建立一种快速的分子生物学方法,在区分枣园中两种枣菱纹叶蝉的同时,可检测虫体内的枣疯病植原体。【方法】以凹缘菱纹叶蝉和片突菱纹叶蝉的COI基因以及枣疯病植原体的16S rDNA为扩增目标,分别设计引物,建立一种包含3对引物的多重PCR体系。测试该多重PCR体系对叶蝉总DNA的灵敏度、准确性,以及当两种叶蝉DNA同时存在时的辨别能力和对枣疯病植原体16S rDNA的灵敏度。【结果】该多重PCR可以准确区分凹缘菱纹叶蝉和片突菱纹叶蝉,并对虫体内枣疯病植原体实现检测,其对昆虫总DNA的灵敏度达到0.012 ng,对枣疯病植原体16S rDNA模板的灵敏度达到900拷贝。【结论】该方法极大方便了对枣菱纹叶蝉的田间种群发生动态及虫体中枣疯病植原体感染的监测。
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
