 ,西北农林科技大学园艺学院/旱区作物逆境生物学国家重点实验室/农业部西北地区园艺作物生物与种质创制重点实验室,陕西杨凌 712100
,西北农林科技大学园艺学院/旱区作物逆境生物学国家重点实验室/农业部西北地区园艺作物生物与种质创制重点实验室,陕西杨凌 712100Expression of Stilbene Synthase Gene and Resistance to Powdery Mildew Analysis of Chinese Wild Vitis quinquangularis
LIU MengQi, WU FengYing, WANG YueJin ,College of Horticulture, Northwest A & F University/State Key Laboratory of Crop Stress Biology in Arid Areas/Key Laboratory of Horticultural Plant Germplasm Resource Utilization in Northwest China, Ministry of Agriculture, Yangling 712100, Shaanxi
,College of Horticulture, Northwest A & F University/State Key Laboratory of Crop Stress Biology in Arid Areas/Key Laboratory of Horticultural Plant Germplasm Resource Utilization in Northwest China, Ministry of Agriculture, Yangling 712100, Shaanxi通讯作者:
责任编辑: 岳梅
收稿日期:2019-03-22接受日期:2019-04-24网络出版日期:2019-07-16
| 基金资助: |
Received:2019-03-22Accepted:2019-04-24Online:2019-07-16
作者简介 About authors
刘梦琦,E-mail: mengqil@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (5684KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
刘梦琦, 吴凤颖, 王跃进. 中国野生毛葡萄芪合成酶基因表达与抗白粉病分析[J]. 中国农业科学, 2019, 52(14): 2436-2449 doi:10.3864/j.issn.0578-1752.2019.14.005
LIU MengQi, WU FengYing, WANG YueJin.
0 引言
【研究意义】葡萄是一种具有重要经济价值的世界性水果[1,2]。据2017年世界粮农组织FAO(http://www.fao.org/home/zh/)数据统计,葡萄全球种植面积达693.14万公顷,产量达7 427.66万吨。欧洲葡萄(Vitis vinifera)是栽培葡萄最重要的一个种,因产量高、果实品质佳,被广泛用于鲜食或酿酒,但其对真菌性病害抗病性较弱,尤其是白粉病,可造成其产量下降,品质受损[1,3-4]。由于欧洲葡萄基因高度杂合,通过杂交育种提高欧洲葡萄抗病性易导致杂交后代性状分离、品质下降[5],严重制约着欧洲葡萄的品质及产量。而使用化学农药则容易使病原菌产生抗性或变异形成新的病害,并对环境有一定影响。定性改良欧洲葡萄的抗病能力,选育抗病新品种已成为葡萄育种的重要目标之一[6]。中国野生葡萄具有良好的生物及非生物抗性,为葡萄育种提供了优质的种质资源[3]。中国野生毛葡萄‘丹凤-2’(V. quinquangularis accession Danfeng-2)对白粉病具有较强的抗性[7],且白藜芦醇(resveratrol)含量较高[8]。研究中国野生毛葡萄‘丹凤-2’及其携带的芪合成酶(stilbene systhase,STS)基因的作用,可为定向改良欧洲葡萄品种白粉病抗性与增加芪类物质含量提供种质资源与基因资源,对抗病育种具有重要意义。【前人研究进展】白藜芦醇不仅作为植保素在植物防御反应中发挥着重要作用[9],而且在人类抗肿瘤、抗氧化等方面具有重要的医疗保健功能[10,11]。芪合成酶是白藜芦醇合成途径的关键酶[12,13]。1981年,HART[14]首次报道芪合成酶催化合成芪类物质,是具有抑制真菌活性的次级代谢产物。PARAGE等[15]分析了葡萄芪合成酶家族基因的分子进化、结构与功能,表明芪合成酶家族基因具有多样性,可以编码具有活性的蛋白。目前,已经在烟草[16,17]、水稻[18]、番茄[19]、拟南芥[20]、苹果[21]等多个物种中对遗传转化STS进行了研究,表明异源转化STS可以提高植株抗病性,同时在转化植株中可以检测到芪类物质的合成。在葡萄中,课题组前期已通过农杆菌转化法获得了VpSTS29转基因无核白、VpSTS29转基因霞多丽、VqSTS6转基因无核白[22,23]。芪合成酶家族基因不同成员在葡萄中的表达具有时空特异性,VANNOZZI等[24]对欧洲葡萄黑比诺不同发育时期、生物与非生物胁迫条件下芪合成酶家族基因进行了表达分析,发现VvSTS不同成员表达模式不同;SHI等[25]研究发现,中国野生毛葡萄STS(VqSTS)的表达存在组织特异性,且不同VqSTS对白粉病菌(Uncinula necator)的响应程度不同。【本研究切入点】利用同源克隆技术,对课题组前期获得的中国野生毛葡萄‘丹凤-2’41个STS,选择在果实中表达较高的VqSTS26与幼叶中表达较高的VqSTS32[25]进行克隆分离,利用农杆菌介导的遗传转化技术,将VqSTS26、VqSTS32转至欧洲葡萄无核白(V. vinifera cv. Thompson Seedless)品种,并分析转基因无核白与野生型无核白STS表达、产物量及对白粉病抗性的差异。【拟解决的关键问题】通过农杆菌介导法获得稳定转化VqSTS26、VqSTS32的葡萄植株,分析比较VqSTS26、VqSTS32转基因植株在人工接种白粉病菌前后STS表达及其产物芪类物质积累的差异,并对转基因植株进行抗病性分析,探索STS表达在葡萄抗白粉病中发挥的作用,以期获得既抗白粉病同时芪类物质含量高的葡萄新种质。1 材料与方法
试验于2016年12月至2018年12月在西北农林科技大学旱区作物逆境生物学国家重点实验室和西北农林科技大学园艺学院葡萄种质资源圃完成。1.1 材料
中国野生毛葡萄‘丹凤-2’和欧洲葡萄品种无核白定植于西北农林科技大学园艺学院葡萄种质资源圃。转基因受体材料欧洲葡萄品种无核白组培苗培养于西北农林科技大学旱区作物逆境生物学国家重点实验室人工气候室。研究所用pGEM-T-easy购自TaKaRa公司,E. coli Top10购自北京天根公司,农杆菌GV3101菌株为本实验室保存。
1.2 VqSTS26与VqSTS32的生物信息学分析
利用NCBI数据库(https://www.ncbi.nlm.nih.gov/)下载中国野生毛葡萄‘丹凤-2’的VqSTS26(JQ868666)、VqSTS32(JQ868672)基因序列,比对至欧洲葡萄基因组网站(http://plants.ensembl.org/Vitis_vinifera/Info/ Index)下载同源序列并使用MEGA7.0中的Clustal W进行序列比对;聚类分析所用序列信息来自于NCBI与欧洲葡萄基因组网站,采用maximum likelihood(ML)法,bootstrap值设为1 000。1.3 基因克隆与植物表达载体构建
参照E.Z.N.A Plant RNA Kit试剂盒(Omega R6827)说明书方法提取中国野生毛葡萄‘丹凤-2’叶片RNA,cDNA反转录参照FastKing RT Kit(With gDNase)试剂盒(天根KR116)说明书。以毛葡萄‘丹凤-2’叶片cDNA为模板,分别以对应VvSTS序列为依据设计引物(表1),5′部分添加SacI酶切位点序列,3′反向互补部分添加XbaI酶切位点序列,通过同源重组进行基因克隆并构建包含从毛葡萄扩增出的目的STS与GFP融合的植物稳定表达载体pCAMBIA35S:: VqSTSs:: GFP。Table 1
表1
表1本研究所用引物
Table 1
| 基因 Gene | 引物序列 Primer sequence | 目标大小 Target size (bp) |
|---|---|---|
| VqSTS26 (Vector construction, PCR detection) | F: AGAACACGGGGGACGAGCTCATGGCTTCAGTTGAGGAATTTAGAAACG R: ACCATGGTGTCGACTCTAGAATTTGTAACTGTAGGAATGCTATGCAGC | 1179 |
| VqSTS32 (Vector construction, PCR detection) | F: AGAACACGGGGGACGAGCTCATGGCTTCAATTGAGGAAATTAGAAACGC R: ACCATGGTGTCGACTCTAGAATTTGTAACCATAGGAACGCTATGCAG | 1179 |
新窗口打开|下载CSV
用于克隆的载体为pGEM-T-easy,克隆菌株为大肠杆菌感受态细胞E. coli Top10,植物表达载体为pCAMBIA2300,用于植物遗传转化的农杆菌菌株为GV3101。
1.4 器官发生途径遗传转化
以无核白单芽茎段为材料,通过器官发生途径诱导分生愈伤组织用于农杆菌介导的遗传转化。步骤如下:农杆菌二次活化(28℃,150 r/min),5 000 r/min离心并用MS液体培养基(含20 mg·L-1乙酰丁香酮和3%的蔗糖)重悬,培养3—4 h(28℃,150 r/min),使菌液浓度达到OD600=0.8,用于转化。分生愈伤切成0.5 cm3的块状,农杆菌重悬液中侵染15 min,于共培养培养基(IM3+100 μmol·L-1 AS,pH 5.8)上培养2 d(25℃,暗培养)后,用1/2 MS液体培养基(含有800 mg·L-1 Cef和800 mg·L-1 Carb)脱菌2次,每次10—15 min,无菌水冲洗2—3次,转至筛选培养基上(IM3+75 mg·L-1 Kan+300 mg·L-1 Cef+200 mg·L-1 Carb,pH 5.8)培养(25℃,光照培养),每月继代一次。抗性愈伤通过器官再生途径再次诱导成苗,具体方法参照XIE等[26]。1.5 转基因植株的分子鉴定
葡萄叶片的gDNA采用CTAB法提取,用于PCR检测的特异性引物如表1所示。取转基因植株的叶片用于Western blot检测。蛋白提取参考鲍睿[27]的方法:取待测样品0.5 g,液氮中充分研磨,加入250 μL蛋白裂解液充分涡旋,冰敷15 min,4℃ 12 000×g离心15 min,取上清并加入上样缓冲液,沸水浴5 min,冷却至室温,10 000×g离心3 min,用于SDS-PAGE。参照HEART SDS-PAGE凝胶配制试剂盒说明书制作SDS-PAGE胶;用半干转膜法在PVDF膜(罗氏 3010040001)上印迹;用抗GFP标签鼠单克隆抗体(全式金HT201)与HRP-羊抗小鼠IgG(H+L)二抗(全式金HS201)进行免疫检测;显色试剂盒为PierceTM ECL Western Blotting Substrate(Thermo 32109)。
1.6 VqSTS26和VqSTS32转基因株系的白粉病抗性分析
1.6.1 葡萄白粉病菌接种处理 白粉病菌取自西北农林科技大学园艺学院葡萄种质资源圃易感病的欧洲葡萄叶片,采用压片法接种于培养在人工气候培养箱的野生型欧洲葡萄叶片上继续培养,用于后期的葡萄白粉病菌接种处理。采用压片法将感病葡萄叶片上的白粉病菌接种于移栽炼苗8周后的待接菌植株上[7]。接种时,选择茎尖的第3—4片充分展开且生长良好的叶片进行接种。1.6.2 葡萄叶片上白粉病菌菌丝生长过程的显微观察 通过染色[28]对接菌后的葡萄叶片进行显微观察,具体方法:将样品剪成1 cm×2 cm长条置于10 mL离心管中,加入3 mL台盼蓝染液,沸水浴10 min后避光条件下过夜染色,水合氯醛脱色两次(过夜一次),于荧光显微镜下观察白粉病菌的生长情况,统计接菌1、2、3和7 dpi葡萄叶片白粉病菌孢子萌发、初级菌丝、次级菌丝及分生孢子梗形成数,3次生物学重复。
1.6.3 实时荧光定量PCR(qRT-PCR) 取接菌后0—7 dpi葡萄叶片,参照1.3的方法提取cDNA,作为qRT-PCR分析的模板,以VvGAPDH为内参基因,用于qRT-PCR的引物设计参照CHENG等[23,25]。qRT-PCR分析采用三步法,参照NovoStart?SYBR qPCR SuperMix Plus说明书(Novoprotein E096)。3次生物学重复,每个重复3次技术重复。
1.6.4 液相色谱分析 取接菌0、7 dpi葡萄叶片进行高效液相色谱分析(HPLC),方法参照ZHOU等[8],通过标准曲线上的保留时间确定样品中的目标物质,通过标准峰面积和样品峰面积的比值计算样品中芪类物质的含量,3次生物学重复。
1.7 芪合成酶代谢相关基因表达分析
取转基因与野生型无核白葡萄叶片,对芪合成酶代谢途径中的VqSTS及5个相关基因包括VqSTS相关的转录因子MYB14和MYB15、上游苯丙氨酸脱氨酶基因(PAL)、下游糖基转移酶基因(RSGT)以及与芪合成酶存在底物竞争关系的查尔酮合成酶基因(CHS)进行qRT-PCR分析,方法参照1.6.3,引物设计参照CHENG等[23,25]。3次生物学重复,每个重复进行3次技术重复。1.8 数据分析
数据表示为平均数±标准差(SD),n=3。显著性分析通过SPSS23.0(SPSS Inc,Chicago,IL,USA)统计软件,采用One-way ANOVA分析的LSD法和Tukey法。2 结果
2.1 VqSTS26、VqSTS32定位与序列分析
序列分析得出VqSTS26和VqSTS32的编码序列全长为1 179 bp,编码392个氨基酸,分子量大小为43 kD。以欧洲葡萄基因组V. vinifera cv. Pinot Noir clone P40024为依据,对中国野生毛葡萄‘丹凤-2’的VqSTS26、VqSTS32进行序列比对,VqSTS26定位于16号染色体反向16 710 281—16 711 809位置(图1-A),对应欧洲葡萄的位点基因是VvSTS48,两者存在5个位点的氨基酸不同,存在差异的氨基酸位点在VqSTS26中从N端至C端依次为苯丙氨酸、异亮氨酸、甘氨酸、甘氨酸和异亮氨酸,在VvSTS48中依次为丝氨酸、缬氨酸、谷氨酸、天冬氨酸和缬氨酸;VqSTS32位于16号染色体正向16 335 707—16 337 233位置(图1-A),对应欧洲葡萄的位点基因是VvSTS15,两者存在3个不同的氨基酸位点,分别为VqSTS32位于N端的亮氨酸和缬氨酸不同于VvSTS15位于N端的丝氨酸和异亮氨酸,以及VqSTS32位于C端的天冬氨酸不同于VvSTS15位于N端的谷氨酸(图1-B)。对不同植物的STS进行聚类分析,发现VqSTS26、VqSTS32分别与欧洲葡萄中的VvSTS48、VvSTS15相似度最高,分别为98.72%和99.23%;其次是高粱(Sorghum bicolor)和花生(Arachis hypogaea),分别为87.94%和87.93%(图1-C)。图1
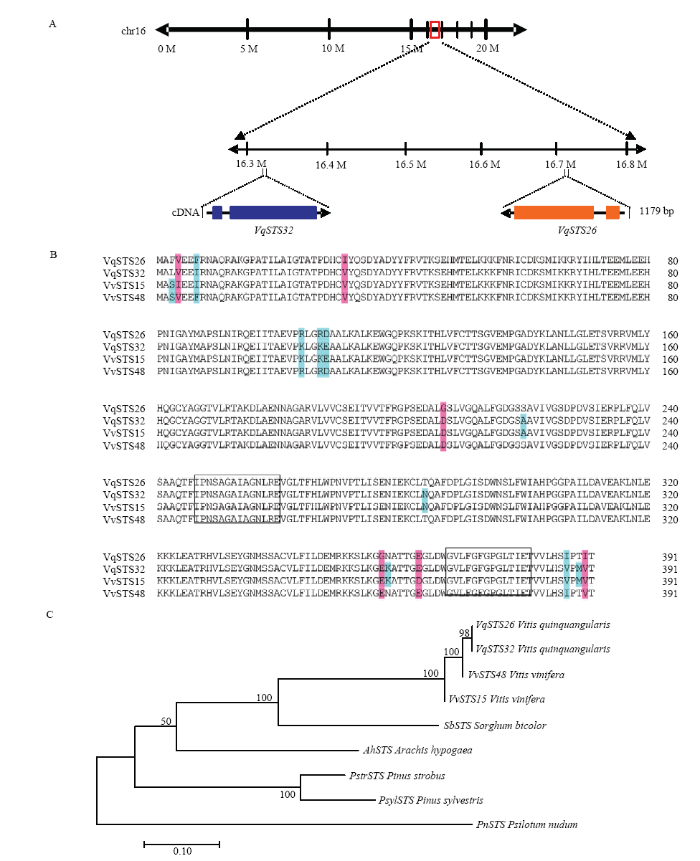 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1‘丹凤-2’VqSTS26、VqSTS32的定位、序列比对及聚类分析
A:VqSTS26、VqSTS32的染色体定位分析Chromosome localization analysis of VqSTS26, VqSTS32;B:VqSTS26、VqSTS32与欧洲葡萄同源蛋白氨基酸序列比对;阴影部分为差异位点,方框部分为保守序列Amino acid sequence alignment of homologous proteins between VqSTS26, VqSTS32 and STS genes from V. vinifera, the shading is the difference site and the box part is the conservative sequence;C:VqSTS26、VqSTS32与欧洲葡萄、高粱、花生、白松、樟子松和松叶兰芪合成酶基因氨基酸序列聚类分析,VqSTS26(AFM56643.1)、VqSTS32(AFM56649.1)、VvSTS15(XP_002268756.1)、VvSTS48(NP_001267934.1)、SbSTS(AAL49965)、AhSTS(BAA78617)、PstrSTS(CAA87012)、PsylSTS(CAA43165)、PnSTS(BAA87924)Cluster analysis of STS amino acid sequence from VqSTS26, VqSTS32 and V. vinifera, Sorghum bicolor, Arachis hypogaea, Pinus strobus, Pinus sylvestris, Psilotum nudum
Fig. 1Localization, sequence alignment and cluster analysis of VqSTS26 and VqSTS32 from ‘Danfeng-2’
2.2 VqSTS26、VqSTS32克隆、遗传转化与转基因植株的鉴定
以毛葡萄‘丹凤-2’叶片cDNA为模板,通过同源克隆获得VqSTS26、VqSTS32并构建至植物过表达载体pCAMBIA2300-GFP,随后转入GV3101农杆菌中并经过菌液PCR验证(图2-A);以诱导的分生愈伤组织作为遗传转化的受体材料,进行农杆菌介导的遗传转化(图2-B);获得PCR检测与Western blot检测均为阳性的转基因植株共13株,其中转VqSTS26无核白株系8株;转VqSTS32无核白株系5株(图2-C)。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2转VqSTS26、VqSTS32无核白的遗传转化过程与转基因植株的鉴定
A:基因克隆与过表达载体构建Gene cloning and vector construction。a:pCAMBIA35S:: VqSTSs:: GFP载体 pCAMBIA35S:: VqSTSs:: GFP vector;b:VqSTS26、VqSTS32目的基因扩增Gene amplification of VqSTS26 and VqSTS32;c:VqSTS26、VqSTS32基因连接表达载体pCAMBIA2300的双酶切检测,CK为pCAMBIA2300的空载体对照 Double enzyme digestion detection of recombinant plasmid, CK was the empty vector as control;d:VqSTS26、VqSTS32转化农杆菌GV3101的PCR检测,CK1、CK2分别为每个基因重组质粒的阳性对照 PCR detection of agrobacterium GV3101 transformed with VqSTS26 and VqSTS32. CK1 and CK2 were positive controls of recombinant plasmid for each gene。M:Trans 2k plus DNA maker。B:无核白分生愈伤组织的诱导(a—d)、遗传转化(e—h)与转化后的诱导成苗、扩繁与移栽炼苗(i—n) Induction (a-d) and genetic transformation (e-h) of Thompson Seedless meristem callus and induction into seedlings after transformation (i-n)。C:无核白葡萄转VqSTS26、VqSTS32抗性株系的PCR检测和Western blot检测PCR amplification and Western blot detection of Thompson Seedless transgenic lines with VqSTS26 and VqSTS32
Fig. 2Transformation and identification of transgenic VqSTS26 and VqSTS32 Thompson Seedless mutant plants
2.3 转基因株系白粉病抗性分析
2.3.1 转基因株系白粉病菌发育进程的显微观察与统计 为了研究转基因株系的白粉病抗性,选择Western blot鉴定蛋白印迹较明显的OEVqSTS26-L6、OEVqSTS26-L8两个VqSTS26转基因株系和OEVqSTS32-L3、OEVqSTS32-L4两个VqSTS32转基因株系,以野生型无核白为对照,进行白粉病菌接种试验(图3-A)。通过显微观察(图3-B),统计葡萄叶片接菌1、2、3和7 dpi每100个孢子的萌发数、初级菌丝与次级菌丝的生长数,以及接菌3和7 dpi的每100个孢子分生孢子梗的形成个数,结果表明转基因株系可以抑制白粉病菌的发育进程(表2),具体表现在株系OEVqSTS26-L6和株系OEVqSTS26-L8在接菌1 dpi几乎未观察到次级菌丝的生成,而野生型在1 dpi已经开始形成次级菌丝,转基因株系次级菌丝生长率在接菌2 dpi和3 dpi均显著低于野生型无核白;转基因株系在接菌3 dpi未观察到分生孢子梗的形成,而野生型无核白于接菌3 dpi已经开始形成分生孢子梗。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3转基因植株葡萄白粉病抗性分析
A:用于接菌的转基因植株和白粉病菌诱导7 dpi的叶片Transgenic plants used for induction and leaves with induction at 7 dpi;B:白粉病菌在葡萄叶片上生长进程的显微观察,标尺=100 μm Microscopic observation on the growth process of U. necator on grape leaves, scale=100 μm
Fig. 3Analysis of the resistance to powdery mildew in transgenic VqSTS26 and VqSTS32 plants
Table 2
表2
表2葡萄叶片每100个孢子萌发数、初级菌丝数、次级菌丝数和分生孢子梗数统计
Table 2
| 株系 Line | 1 dpi | 2 dpi | 3 dpi | 7 dpi | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 萌发数 Germination | 初级菌 丝数 Primary hyphae | 次级菌 丝数 Secondary hyphae | 萌发数 Germination | 初级菌 丝数 Primary hyphae | 次级菌 丝数 Secondary hyphae | 萌发数 Germination | 初级菌 丝数 Primary hyphae | 次级菌丝数 Secondary hyphae | 分生孢子梗数 Conidiophore | 分生孢子 梗数 Conidiophore | |
| 野生型 Wide type | 42.67± 3.51a | 21.67± 2.08a | 4.33± 1.53a | 22.67± 2.08a | 8.67± 1.15c | 50.33± 3.51a | 6.33± 1.53c | 12.67± 1.53c | 69.00± 4.00a | 15.33±1.53a | 195.33± 12.66a |
| OEVqSTS26-L6 | 32.33± 2.52bc | 7.33± 1.53b | 0.33± 0.58b | 16.33± 0.58b | 11.67± 1.53c | 14.33± 2.08c | 30.67± 1.53a | 13.33± 1.53c | 16.33± 2.52c | 0 | 92.67± 7.37b |
| OEVqSTS26-L8 | 26.00± 1.00c | 12.00± 2.00b | 0.33± 0.58b | 17.33± 1.53b | 17.67± 2.52b | 10.33± 1.53c | 31.67± 3.51a | 11.00± 1.73c | 23.00± 2.65c | 0 | 42.00± 3.00c |
| OEVqSTS32-L3 | 35.00± 1.53b | 17.67± 2.52a | 3.33± 1.53ab | 17.00± 1.00b | 25.00± 1.00a | 22.67± 1.53b | 13.33± 2.52b | 18.00± 1.00b | 34.33± 3.06b | 0 | 110.33± 14.29b |
| OEVqSTS32-L4 | 35.33± 1.53b | 19.67± 1.53a | 3.67± 1.53a | 13.67± 1.53b | 21.00± 2.00ab | 26.33± 1.53b | 18.33± 1.53b | 23.00± 2.00a | 32.33± 2.08b | 0 | 58.33± 2.08c |
新窗口打开|下载CSV
2.3.2 转基因植株人工接种白粉病菌后STS及其产物表达分析 为了研究转基因与野生型无核白在人工接种白粉病菌前后STS表达的动态变化,对接菌0—7 dpi转基因与野生型无核白STS表达量进行qRT-PCR分析(图4-A、4-B)。结果表明白粉病菌诱导后STS表达上调且转基因株系STS表达量均高于野生型无核白。总体趋势为STS表达量在接菌1 dpi时显著升高,随之在2—6 dpi轻微波动,最后在7 dpi达最高值。其中,OEVqSTS26-L6转基因株系在接菌1、4、5 和7 dpi STS表达量极显著高于野生型;OEVqSTS26-L8转基因株系STS表达量在接菌1—5和7 dpi极显著高于野生型;OEVqSTS32-L3转基因株系在接菌3、6 dpi STS表达量显著高于野生型,在0、2、4和5 dpi极显著高于野生型;OEVqSTS32-L4转基因株系在接菌1、2、4和7 dpi STS表达量极显著高于野生型。接菌7 dpi时,OEVqSTS26-L6和OEVqSTS26-L8转基因株系STS表达量分别是同时期野生型无核白的26倍和29倍;OEVqSTS32-L3和OEVqSTS32-L4转基因株系STS表达量分别是同时期野生型无核白的7倍和12倍。不同的是OEVqSTS32-L3转基因株系接菌后STS表达量的明显上调出现在接菌2 dpi。
图4
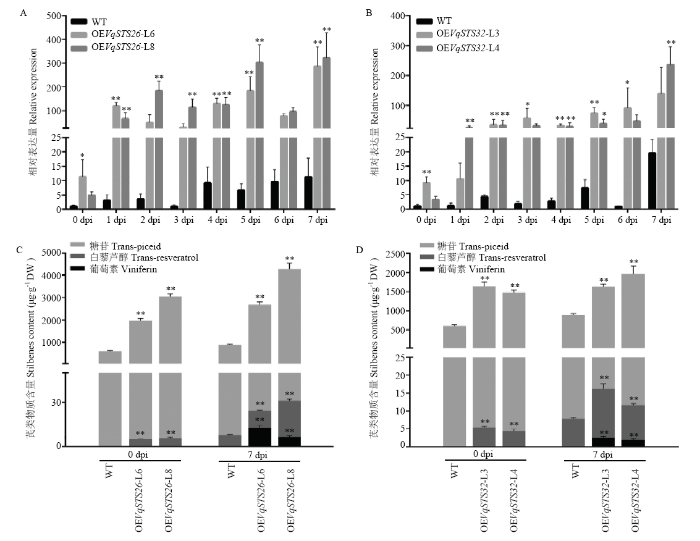 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4人工接种白粉病菌后转基因植株与野生型无核白STS表达及芪类物质含量分析
A、B:qRT-PCR分析VqSTS26(A)和VqSTS32(B)转基因与野生型无核白接菌0—7 dpi叶片STS的表达量 qRT-PCR analysis of STS expression between transgenic grapes with overexpression VqSTS26 (A) and VqSTS32 (B) and wild-type Thompson Seedless under U. necator induction at 0-7 dpi;C、D:HPLC分析VqSTS26(C)和VqSTS32(D)转基因与野生型无核白接菌前后芪类物质含量的变化HPLC detection of stilbenoids content in transgenic grapes with overexpression VqSTS26 (C) and VqSTS32 (D) and wild-type Thompson Seedless under U. necator induction at 0 and 7 dpi. *P<0.05,**P<0.01
Fig. 4Analysis of STS expression and stilbenoids content between transgenic plants and wild-type Thompson Seedless after U. necator induction
进一步分析接菌前后芪类物质含量的变化,对接菌0、7 dpi的转基因与野生型无核白进行HPLC分析(图4-C、4-D)。结果表明接菌0 dpi时,在葡萄中主要检测到的芪类物质为糖苷且转基因株系的糖苷含量极显著高于野生型无核白,白藜芦醇仅在转基因株系中检测到。接菌7 dpi时,在转基因株系中可以检测到糖苷、白藜芦醇和葡萄素3种芪类物质,而在野生型无核白中未检测到葡萄素,且转基因株系中糖苷与白藜芦醇的含量均极显著高于野生型无核白。接菌后葡萄叶片白藜芦醇和葡萄素的含量相较于接菌前均有所提高。接菌7 dpi时OEVqSTS26-L6株系葡萄素含量最高,为12.71 μg·g-1 DW;OEVqSTS26-L8株系白藜芦醇和糖苷含量最高,分别为24.62和4 256.86 μg·g-1 DW,是该株系接菌前的4.4倍和1.4倍,相较于接菌7 dpi的野生型无核白分别提高了2.5倍和3.8倍。
2.4 转基因植株芪合成酶代谢相关基因表达分析
为研究转基因植株芪合成酶代谢相关基因的表达变化,对获得的13个转基因株系进行qRT-PCR分析,包括转入的芪合成酶基因VqSTS26和VqSTS32以及与STS相关的转录因子MYB14和MYB15、上游苯丙氨酸脱氨酶基因(PAL)、下游糖基转移酶基因(RSGT)、与芪合成酶存在底物竞争关系的查尔酮合成酶基因(CHS)(图5)。结果表明,VqSTS26与VqSTS32 表达量分别在相应转基因株系中上调,上调水平极显著的是OEVqSTS26-L3、OEVqSTS26-L4、OEVqSTS26- L6和OEVqSTS32-L4株系。其中OEVqSTS26-L6和OEVqSTS32-L4株系相较于野生型分别提高了17倍和13倍。RSGT和PAL上调表达[29],其中RSGT的表达量在OEVqSTS26-L8、OEVqSTS32-L3和OEVqSTS32- L4中分别提高了13、9和9倍,大多数转基因植株中PAL的表达量上调,仅OEVqSTS26-L7和OEVqSTS26- L2株系PAL的表达量轻微下调。CHS与STS存在底物竞争关系[30],其表达量下调。MYB14与MYB15表达量无显著变化。图5
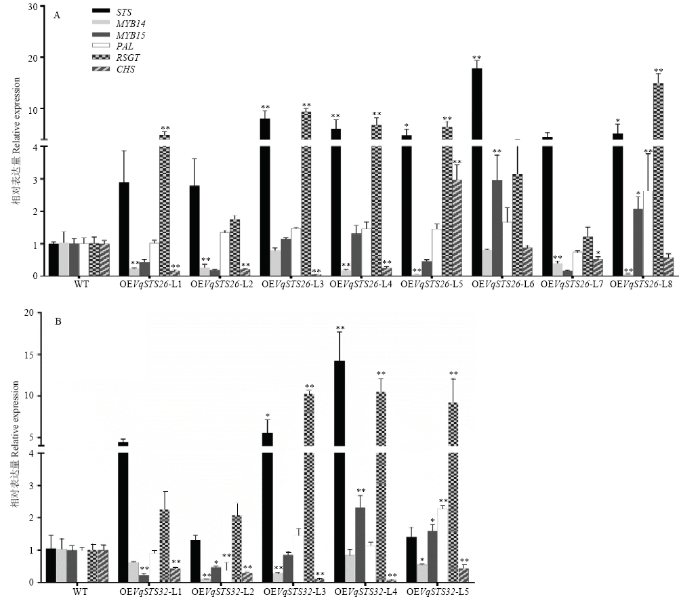 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5转基因植株芪合成酶代谢相关基因表达的qRT-PCR分析
A:8个转VqSTS26株系的qRT-PCR分析 qRT-PCR analysis of 8 VqSTS26 transgenic lines;B:5个转VqSTS32株系的qRT-PCR分析 qRT-PCR analysis of 5 VqSTS32 transgenic lines。*P<0.05,**P<0.01
Fig. 5qRT-PCR analysis of STS metabolic pathway related gene expression in transgenic lines
3 讨论
葡萄是国内外公认的最重要的经济作物和广泛栽培的水果种类之一。FAO 2017年数据显示,葡萄种植面积居世界水果种植面积首位。在中国,葡萄种植面积为77.86万公顷,占世界葡萄总种植面积的11.23%,位居世界第二位。白粉病是葡萄栽培面临的世界范围的灾难性病害[31]。葡萄抗病基因的发掘及抗病育种在葡萄生产中具有不可取代的重要意义。研究表明葡萄对白粉病的抗性与芪合成酶(STS)的积累有关[32]。本研究中,接菌处理后STS表达上调,转基因植株STS表达量显著高于野生型无核白(图4-A、4-B),这说明过表达VqSTS26和VqSTS32可以促进白粉病菌诱导下STS的表达,然而诱导调控的机理仍待进一步研究。芪合成酶是白藜芦醇合成的关键酶,大量研究表明白藜芦醇作为植保素可以响应真菌病害的诱导[33,34]。ROMERO-PÉREZ等[35]研究指出,葡萄果实受白粉病菌感染后芪类物质的含量显著增加。在植物体内,白藜芦醇可以生成云杉新苷、葡萄素、紫檀芪等衍生物,已有研究证明葡萄素可以响应葡萄霜霉病[36],并且它们具有与白藜芦醇相似的生物活性与医疗保健作用[37]。本研究中,转基因株系和野生型株系葡萄叶片受白粉病菌诱导7 d后芪类物质含量增加,且转基因株系芪类物质无论从种类还是含量上均优于野生型无核白(图4-C、4-D)。因此,过表达VqSTS26和VqSTS32可以促进无核白在白粉病菌诱导条件下芪类物质的积累。芪合成酶代谢通路属于苯丙氨酸代谢途径[38],芪合成酶与查尔酮合酶高度同源,均以香豆酸辅酶A为底物,前者是白藜芦醇代谢途径的关键酶,后者是黄酮类代谢途径的关键酶[39]。本研究中自然条件下转基因株系中CHS的表达量下调(图5),可能是由于STS与CHS存在底物竞争关系造成的。PAL作为STS的上游基因,是催化合成香豆酸辅酶A的关键酶[40]。PAL在转基因株系中上调表达可能是由于STS的高表达加速了对香豆酸辅酶A的消耗,从而引起PAL表达量提高。RSGT是STS的下游基因,可以催化白藜芦醇合成云杉新苷[29]。转基因株系中RSGT的表达量显著提高(图5),这与HPLC分析中转基因株系云杉新苷的含量显著高于野生型无核白相对应(图4-C、4-D),原因可能是转基因株系中STS的高表达促进白藜芦醇的合成,作为糖基转移酶的催化底物,白藜芦醇含量增加引起RSGT表达上调,从而促进白藜芦醇向云杉新苷的代谢。在其他转STS研究中也得到相似的结果,如转STS可以提高猕猴桃果实中云杉新苷的含量[41];将葡萄STS转入啤酒花中,云杉新苷的含量提高[42]。MYB14和MYB15是调控STS启动子的转录因子,而在转基因株系中未有明显的表达趋势(图5),可能是因为转入的STS受载体CaMV35S启动子调控引起。这说明,过表达VqSTS26和VqSTS32可以提高转基因植株STS表达量,并引起其代谢通路上RSGT的显著上调,因而促进芪类物质的积累。
芪合成酶基因家族不同成员在葡萄中的表达具有时空特异性。VvSTS在葡萄叶片衰老过程中和浆果枯萎过程中表达量提高[24]。‘丹凤-2’叶片受白粉病菌诱导后VqSTSs表达量均有所上调,但响应程度有所不同[25]。本研究中,接菌后转基因葡萄叶片STS的定量分析表明白粉病诱导条件下,STS的表达量有不同程度的上调,其中OEVqSTS26-L8株系STS上调水平最为显著,而OEVqSTS32-L3转基因株系则在接菌2 dpi才出现STS表达量的显著升高(图4-B),存在个体差异性。VANNOZZI等[24]通过对欧洲葡萄黑比诺STS家族预测蛋白进行聚类分析将其分为group A、group B和group C 3类,其中group B的家族成员表现出对胁迫处理的高度响应。通过‘丹凤-2’与黑比诺芪合成酶家族氨基酸序列的聚类分析,发现VqSTS26和VqSTS32与group B的家族成员高度同源。综上所述,可以解释本研究中VqSTS26和VqSTS32均可以响应白粉病菌诱导又存在个体差异的现象。
转基因技术是研究基因功能与作物改良的有效手段,在培育高品质、高产量的农作物与经济作物方面具有十分重要的应用价值。关于葡萄遗传转化最早的报道是1990年MULLINS等以体细胞胚为受体材料首次获得含GUS报告基因转基因葡萄植株[43]。STS遗传转化最早的报道是HAIN等[16]将从花生克隆的STS导入烟草原生质体并发现了白藜芦醇的积累,随后又将葡萄STS转入烟草,增强了烟草对灰霉菌的抗性,这是通过遗传转化外源植保素基因提高植物抗性的首次报道[17]。CHENG等[23]将中国野生毛葡萄VqSTS6转入欧洲葡萄无核白,验证VqSTS6可以提高转基因无核白芪类物质含量并增强对白粉病抗病性,这说明中国野生毛葡萄STS在改善欧洲葡萄抗病性与提高品质方面具有可实践的应用价值。然而关于转基因植株接菌前后STS表达与产物特性的对比分析尚未见报道。本研究不仅利用器官发生途径创建了STS高表达、芪类物质高积累的葡萄新种质;更重要的是对比了接菌前后转基因植株与野生型无核白在STS表达与芪类物质积累的差异,证明了转基因植株STS及其产物可以更有效地响应白粉病菌诱导,提高葡萄对白粉病的抗性,为STS及芪类物质参与葡萄抗白粉病提供了重要的理论依据。
4 结论
中国野生毛葡萄芪合成酶基因VqSTS26、VqSTS32转入欧洲葡萄品种无核白后,不仅提高了STS表达,而且促进了芪类物质的积累,增强了欧洲葡萄无核白对白粉病抗性。因此,中国野生毛葡萄及其携带的VqSTS26、VqSTS32是重要的抗病种质资源与基因资源,利用这种资源与欧洲葡萄品种杂交育种创造新的抗病种质,进行欧洲葡萄品种抗性的定向改良与增加芪类物质积累是可行的。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1007/BF00265585 [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
URLMagsci [本文引用: 2]

1983-1987年通过田间自然鉴定、田间接种鉴定和室内离体接种鉴定的方法,研究了起源于我国的葡萄属18个种或变种、88个株系对葡萄霜霉病、黑痘病、白腐病和炭疽病的抗性。结果表明,原产我国的葡萄属野生种对这4种真菌病害有极强和强的抗性,种内株系间存在着抗病性的差异。一些种和株系抗两种病害,另一些种和株系抗多种病害。抗病类型的分布与地理起源无关。本文还初步探讨了与葡萄属野生种抗病有关的机制。
URLMagsci [本文引用: 2]

1983-1987年通过田间自然鉴定、田间接种鉴定和室内离体接种鉴定的方法,研究了起源于我国的葡萄属18个种或变种、88个株系对葡萄霜霉病、黑痘病、白腐病和炭疽病的抗性。结果表明,原产我国的葡萄属野生种对这4种真菌病害有极强和强的抗性,种内株系间存在着抗病性的差异。一些种和株系抗两种病害,另一些种和株系抗多种病害。抗病类型的分布与地理起源无关。本文还初步探讨了与葡萄属野生种抗病有关的机制。
[本文引用: 1]
[本文引用: 1]
DOI:10.1038/nature01018 [本文引用: 1]
[本文引用: 2]
DOI:10.1080/01140671.2015.1010547URL [本文引用: 2]
DOI:10.1016/j.pmpp.2008.07.002URL [本文引用: 1]
DOI:10.1002/mnfr.v55.8URL [本文引用: 1]
DOI:10.1126/science.275.5297.218URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1146/annurev.py.19.090181.002253URL [本文引用: 1]
DOI:10.1104/pp.112.202705URL [本文引用: 1]
[本文引用: 2]
DOI:10.1038/361153a0 [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1021/jf060249lURL [本文引用: 1]
[本文引用: 1]
[本文引用: 4]
DOI:10.1186/1471-2229-12-130URL [本文引用: 3]
[本文引用: 5]
DOI:10.1007/s11240-016-1023-4URL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.plantsci.2009.05.012URL [本文引用: 2]
DOI:10.1016/j.plaphy.2007.12.009URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/S0031-9422(00)94358-9URL [本文引用: 1]
[本文引用: 1]
DOI:10.1021/jf000745oURL [本文引用: 1]
DOI:10.1016/j.pmpp.2005.03.002URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1515/znc-1990-1-202URL [本文引用: 1]
DOI:10.1016/S1369-5266(98)80113-1URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
