 ,, 时成俏, 郑加兴, 覃永嫒, 黄安霞广西农业科学院玉米研究所,南宁 530007
,, 时成俏, 郑加兴, 覃永嫒, 黄安霞广西农业科学院玉米研究所,南宁 530007QTL Mapping and Genetic Analysis of a Gene with High Resistance to Southern Corn Rust
WANG BingWei, QIN JiaMing ,, SHI ChengQiao, ZHENG JiaXing, QIN YongAi, HUANG AnXiaMaize Research Institute, Guangxi Academy of Agricultural Science, Nanning 530007
,, SHI ChengQiao, ZHENG JiaXing, QIN YongAi, HUANG AnXiaMaize Research Institute, Guangxi Academy of Agricultural Science, Nanning 530007通讯作者:
责任编辑: 李莉
收稿日期:2019-02-3接受日期:2019-04-21网络出版日期:2019-06-16
| 基金资助: |
Received:2019-02-3Accepted:2019-04-21Online:2019-06-16
作者简介 About authors
王兵伟,E-mail: sfsh515@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (854KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
王兵伟, 覃嘉明, 时成俏, 郑加兴, 覃永嫒, 黄安霞. 一个高抗玉米南方锈病基因的QTL定位及遗传分析[J]. 中国农业科学, 2019, 52(12): 2033-2041 doi:10.3864/j.issn.0578-1752.2019.12.002
WANG BingWei, QIN JiaMing, SHI ChengQiao, ZHENG JiaXing, QIN YongAi, HUANG AnXia.
0 引言
【研究意义】玉米南方锈病(Southern Corn Rust)是一种全球流行的气传病害,在热带、亚热带、温带(包括非洲、东南亚、澳洲、南美洲、美国南部、环南印度洋国家等)地区均有发生的踪迹[1,2,3,4]。在中国,由南向北多个玉米产区病情均有过报道[5,6]。南方锈病病原为多堆柄锈菌Puccinia polysora Underw。与普通锈病不同,南方锈病一旦大流行,严重时会造成40%—80%的产量损失,甚至颗粒无收[6,7,8,9,10]。因此,研究定位玉米抗南方锈病基因对玉米分子遗传育种有重要意义。【前人研究进展】已报道的南方锈病至少有13个生理小种[11]、13个抗性基因。完全显性基因Rpp1抗生理小种EA1,不完全显性基因Rpp2对生理小种EA1、EA2均有一定抗性,Rpp1和Rpp2间的遗传距离约12 cM,但染色体位置未知[12,13]。JINES等[14]在2007年通过鉴定4个不同环境中143份重组自交系对南方锈病的抗性,定位了1个抗玉米南方锈病的主效QTL,位于第10染色体上,在SSR引物umc1380和bnlg1451之间,能够解释83%的表型变异。KITTI等[15]则通过鉴定2个不同环境中89份重组自交系对南方锈病的抗性,定位了15个QTL,其中1个位于第1染色体的主效QTL,能够解释41.8%的表型变异。国内则先后报道定位了5个玉米抗南方锈病的显性单基因,均位于第10染色体的短臂上。陈翠霞等[4]将自交系齐319所携带的抗南方锈病单显性基因RppQ定位在SSR标记phi041和AFLP标记AF1之间,与这两个标记的遗传距离分别为2.45和3.34 cM;ZHOU等[16]进一步用相同的材料把RppQ的染色体位置缩小在SCAR标记MA7和AFLP标记M-CCG/E-AGA157之间,与2个标记的距离分别为0.46和1.71 cM。刘章雄等[17]以玉米自交系P25构建的F2:3分离群体,利用SSR标记技术将P25中的抗南方诱病的主效基因定位在第10染色体,与标记phi059相距5.8 cM。ZHAO等[18]对高抗玉米南方锈病自交系P25携带的单显性抗病基因RppP25进行了精细定位,位于bin10.01上物理距离约40 kb的标记P091和M271之间,并开发了2个共分离标记M214和M019,预测GRMZM2G060884为该抗病基因的候选基因。【本研究切入点】2008年,广西农业科学院玉米研究所玉米品种筛选鉴定研究室从泰国引进种质经自交选育出一个优良自交系S313,属热带血缘,经多年田间观察(种植基地为锈病疫区,锈病连年高发)和两年四季人工接种鉴定,确定其高抗玉米南方锈病且抗性一直保持稳定,而同时同地播种的自交系齐319(中国首例育成对南方锈病免疫的玉米自交系[19])却观察到有发病现象(1级—5级),表明齐319经多年种植,抗性下降,对南宁本地的锈病生理小种不表现高抗,用S313组配获得的品种兆丰588和很多新组合对南方锈病达到免疫,这表明此自交系中存在抗玉米锈病的显性基因。而用热带种质作为抗玉米南方锈病基因的研究报道极少,因此,有必要研究该种质抗玉米南方锈病基因与已知抗玉米南方锈病基因是否为同一基因。【拟解决的关键问题】本研究以S313× PHW52的F2群体为试验材料,利用SNP分子标记及复合区间作图定位方法,对玉米抗南方锈病基因进行QTL定位分析,研究其遗传规律,为进一步克隆玉米南方锈病抗性基因提供基础。1 材料与方法
1.1 试验材料
1.1.1 病原菌 供试的玉米南方锈病病原菌来自于广西农业科学院明阳基地,由玉米品种筛选鉴定研究室在应季种植的高感玉米南方锈病品种活体植株叶片上采集而来。1.1.2 玉米材料 共6个玉米自交系材料,高抗玉米南方锈病自交系S313、高感自交系TS647、PHW52、ZD415和368M(由玉米品种筛选鉴定研究室分离选育而成),以及抗病自交系齐319(由广西农业科学院玉米研究所植保研究室提供)。
2015年秋季,在广西农业科学院明阳基地(试验地点下同)同时播种以上6个自交系,高抗自交系S313与4个高感自交系正反交,齐319与TS647仅正交,S313(父本)与齐319(母本)杂交,共得到10份F1代杂交种子。
2016年春季,同期播种上述6个玉米自交系及10个杂交种各一行,在花期,对这16个材料各选择15株左右进行套袋、自交,成熟后按单穗收获,并分开脱粒保存。同时在抽雄期、抽雄期后7 d和抽雄期后14 d等3个时期对全部植株进行病原菌喷洒接种,记载其抗病性。
2016年秋季,把10个杂交F2群体各1个单穗的种子单粒全部播种,各群体播种量在300—500株。各群体相应的亲本各1行约20株种在旁边作抗、感对照。2017年春,把S313与3个感病亲本TS647、PHW52和ZD415正交F2群体各1—2个单穗的种子单粒全部播种。
2017年秋,种植从100个F2果穗(源自S313×PHW52正交F2群体,各20个1、3、5、7、9病级的F2果穗)自交而来的F2:3家系,每个家系种1行(21株)。同样在上述3个时期对全部植株进行病原菌喷洒接种,然后记载其抗病性。
2017年秋,种植6 705株F2(S313×PHW52)大群体和4 206株的F2(S313×TS647)大群体,抽雄前对所有单株叶片取样,-80℃低温保存,3次病原菌喷洒接种后鉴定记载各单株抗病性,两群体分别取出1 721个和1 024个感锈病单株叶片进行DNA提取。
1.2 芯片检测与SNP标记的筛选、开发
2017年春季,利用Affymetrix公司的56K玉米芯片对2个亲本自交系S313和PHW52进行SNP位点筛选。从全部多态位点中选出在玉米10条染色体上均匀分布的192个SNP标记对F2(S313×PHW52)群体各30个高抗、高感单株进行KASP基因分型。进一步在分型获得的与抗性基因连锁标记的染色体片段周围开发新的SNP标记19个,利用这些标记对182株F2(S313×PHW52)群体进行标记分型。进一步在玉米第10染色体短臂0—2.0 M区间内开发10个新的SNP标记对F2大群体的部分单株进行标记分型。SNP标记开发:利用Affymetrix公司已公布的56K芯片上上述192个SNP位点的侧翼序列信息及设计软件Primer3,设计适于KASP基因分型的SNP引物,其中,上游引物由SNP-1和SNP-2 2条竞争性的序列组成,5′端分别连有不同的荧光(FAM或HEX)标签检测引物序列,3′末端分别为与相应SNP位点匹配的等位变异碱基;下游引物SNP-3由一条通用序列组成。全部引物由英国LGC公司合成。KASP基因分型的PCR反应体系(384孔板载体,Douglas平台SOELLEX高通量PCR仪)为DNA干样(55℃烘干1 h)、KASP Primer mix 0.07 μL、2×KASP Master mix 2.5 μL和ddH2O 2.5 μL。PCR反应程序为94℃ 15 min;94℃ 20 s,61—55℃ 60 s,10个循环(每循环退火温度降0.6℃);94℃ 20 s,55℃ 60 s,26个循环。每个384孔板设置1个不添加模板DNA的空白对照。采用多功能荧光阅读仪ARAYA对PCR扩增产物进行扫描,FAM、HEX、对照荧光ROX的激发波长分别为485、528和575 nm,发射波长分别为520、560和610 nm。利用软件Kraken?进行数据分析,在图像坐标上,被FAM或HEX荧光序列标签的等位基因数据分别聚合在接近X轴(蓝色)或接近Y轴(红色)上的位置,位于坐标中间的(绿色)则是包含2个等位基因的杂合型,接近坐标原点的黑色斑点为空白对照。
2017年秋季,从种植的F2(S313×PHW52)大群体中选连续的1 520株作为试验材料,取其中386个感锈病单株叶片提取DNA,在标记Affx-91298359与标记Affx-91182449区间内选择56K芯片上所有可用的10个标记进行SNP标记分型。10个标记分别是AX-86277269(0.21 M)、AX-86255577(0.64 M)、AX-86255581(0.81 M)、A01009(1.21 M)、A005915(1.24 M)、A010010(1.36 M)、A009917(1.39 M)、A010011(1.42 M)、A009920(1.71 M)和A010013(1.93 M)。
1.3 数据分析
利用Joinmap 4.0[20]对182株F2(S313×PHW52)群体进行标记分型所得数据构建局部遗传连锁图,用Kosambi函数计算标记间遗传距离,用ripple命令对标记进行排序,获得的遗传图结合表型数据用WinQTL Cart2.5[21]进行主效QTL定位,其间采用复合区间作图法(composition interval mapping,CIM)确定QTL的位置区间及效应大小,用1 000次模拟测试数据的分析结果确定LOD值。2 结果
2.1 S313、齐319及其相应F1植株的抗性鉴定
经多年田间接种玉米南方锈病和自然发病鉴定,S313高抗南方锈病,且整个植株没有一个病斑,齐319表现抗或中抗。TS647、PHW52、ZD415和368M均表现高感南方锈病,其中TS647和PHW52发病最快,发病程度最重,生育后期锈病病斑漫布整个植株,甚至病重枯死。杂交种方面,8个S313正反交F1植株均表现高抗南方锈病,说明S313高抗南方锈病仅为核基因控制,与细胞质遗传无关。2.2 S313、齐319 F2群体抗、感分离情况
全部F2群体均表现明显的抗性分离,各群体的抗、感分离株数、分离比及显著性检验见表1。从表中可看出,除S313×齐319的F2群体外,其余S313的F2群体抗、感比例均为3﹕1,其中又以S313×PHW52的F2群体性状分离最为明显,该群体中各单株大部分表现为高抗(1级)或高感(7、9级),中间类型很少。说明S313对玉米南方锈病的抗性为1个主效基因所控制,但在特定的群体(遗传背景)中也有若干微效的遗传因子可加强或减弱其主效基因的表达。TS647×齐319的F2群体抗感分离比表现为0.49﹕1,且中间类型(3、5级)的单株比较多,说明齐319也是有1个抗玉米南方锈病主效基因加多个副基因的遗传构成,这与前人报道的齐319抗玉米南方锈病由显性单基因控制的表述有所不同[4]。S313×齐319的F2群体玉米南方锈病抗性也发生分离,266株中只有22株表现感病,根据芯片混池结果说明S313抗玉米南方锈病主基因与齐319的主基因一样位于玉米第10染色体短臂上,但是非等位基因,且2个基因相隔约4 cM。Table 1
表1
表1S313和齐319与高感自交系组配F2群体抗感分离比例统计表
Table 1
| 年份 Year | 群体 Population | 总株数 Total plants | 抗病株数 Resistant plants | 感病株数 Susceptible plants | 卡方值 χ2 value | χ2测验 Chi-square test | 实际抗﹕感值 Actual R﹕S value |
|---|---|---|---|---|---|---|---|
| 2016秋 2016 Autumn | S313×ZD415 | 356 | 271 | 85 | 0.18 | 3﹕1 | 3.19 |
| 2016秋 2016 Autumn | ZD415×S313 | 284 | 209 | 75 | 0.23 | 3﹕1 | 2.79 |
| 2016秋 2016 Autumn | S313×PHW52 | 313 | 232 | 81 | 0.09 | 3﹕1 | 2.86 |
| 2016秋 2016 Autumn | PHW52×S313 | 260 | 189 | 71 | 0.62 | 3﹕1 | 2.66 |
| 2016秋 2016 Autumn | S313×368M | 277 | 217 | 60 | 1.47 | 3﹕1 | 3.62 |
| 2016秋 2016 Autumn | 368M×S313 | 300 | 222 | 78 | 0.11 | 3﹕1 | 2.85 |
| 2016秋 2016 Autumn | S313×TS647 | 288 | 214 | 74 | 0.04 | 3﹕1 | 2.89 |
| 2016秋 2016 Autumn | TS647×S313 | 385 | 285 | 100 | 0.15 | 3﹕1 | 2.85 |
| 2016秋 2016 Autumn | TS647×齐319 | 314 | 103 | 211 | 295.95 | 非3﹕1 Non 3﹕1 | 0.49 |
| 2016秋 2016 Autumn | S313×齐319 | 266 | 244 | 22 | 38.82 | 非3﹕1 Non 3﹕1 | 11.09 |
| 2017春 2017 Spring | S313×TS647 | 747 | 539 | 208 | 3.07 | 3﹕1 | 2.59 |
| 2017春 2017 Spring | S313×PHW52 | 275 | 201 | 74 | 0.44 | 3﹕1 | 2.72 |
| 2017春 2017 Spring | S313×ZD415 | 631 | 457 | 174 | 2.10 | 3﹕1 | 2.63 |
| 2017秋 2017 Spring | S313×PHW52 | 6705 | 4984 | 1721 | 1.56 | 3﹕1 | 2.90 |
| 2017秋 2017 Spring | S313×TS647 | 4206 | 3182 | 1024 | 0.92 | 3﹕1 | 3.11 |
新窗口打开|下载CSV
2.3 F2:3家系抗、感分离情况
从表2可以看出,F2病级为1、3级时,40个家系共有30个家系发生抗感分离,说明其抗性等位基因为Aa,10个家系表现高抗、不分离,等位基因型应为AA。F2病级为5、7、9级的60个家系全部不发生抗性分离,说明其抗性基因型为aa。另外,田间抗性鉴定为5级的F2其相应的F2:3家系全部不发生抗感分离,也说明田间鉴定为5级的植株应被归类为感病,为下一步QTL准确定位提供了表型鉴定基础。Table 2
表2
表2100个F2:3家系抗、感分离比例田间统计表
Table 2
| F2病级 F2 disease grade | 家系数 Family number | F2:3抗病鉴定 F2:3 resistant identification |
|---|---|---|
| 1 | 20 | 6个家系全表现1—3级抗病,14个家系抗感分离 6 families exhibiting resistant of 1-3 grade,14 families exhibiting separation of resistance and susceptible |
| 3 | 20 | 4个家系全表现1—3级抗病,16个家系抗感分离 4 families exhibiting resistant of 1-3 grade,16 families exhibiting separation of resistance and susceptible |
| 5 | 20 | 全感5—9级 All exhibiting susceptible of 5-9 grade |
| 7 | 20 | 全感7—9级 All exhibiting susceptible of 7-9 grade |
| 9 | 20 | 全感7—9级 All exhibiting susceptible of 7-9 grade |
新窗口打开|下载CSV
2.4 亲本多态性标记筛选及连锁标记确定
利用Affymetrix标记总数为56 000个的芯片对2个亲本S313、PHW52进行检测。下机后对原始数据进行统计,S313、PHW52缺失标记数分别为1 710和810个,2个亲本共同非缺失标记数为53 619个,多态标记为16 426个。从所有多态标记中挑选出基因分型质量最高、在玉米10条染色体上均匀分布的192个SNP标记对F2(S313×PHW52)群体各30个高抗、高感单株进行检测。结果表明,位于第10染色体上的1个标记Affx-90241059在30个高感单株中有28株带型与感病亲本PHW52一致,说明此标记与抗南方锈病主效基因连锁。2.5 局部遗传图谱构建及QTL定位
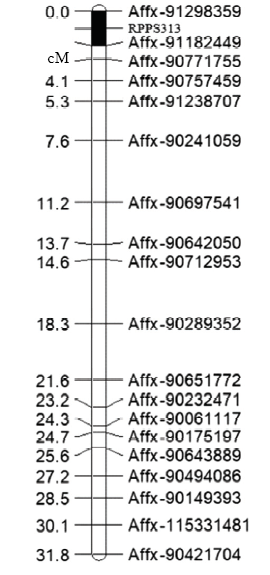
从图1可以看出,19个标记总的遗传距离为31.8 cM,标记间平均距离为1.77 cM,Affx-91182449与Affx-90771755间距离最短,为0.8 cM,Affx-90712953与Affx-90289352间距离最长,为3.7 cM。除了Affx-90643889、Affx-90494086标记外,其余标记的遗传距离与其在参考基因组B73上的真实物理距离相差不大,说明2个双亲在这些标记区段上与B73有良好的共线性。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1182个单株F2群体局部遗传图谱
Fig. 1The partial genetic linkage map of a F2 population with 182 plants
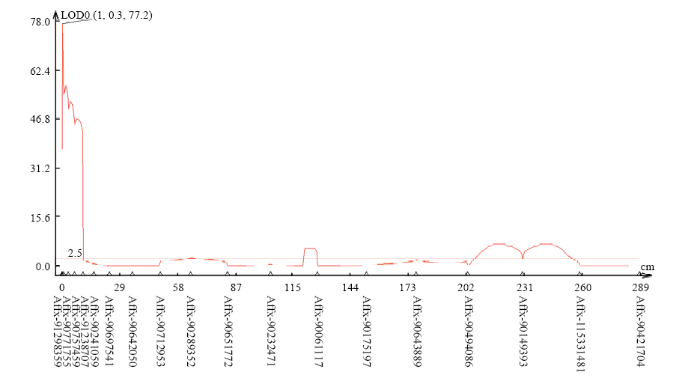
从图2可以看出,主效QTL的峰值被定位在标记Affx-91298359(0.12 M)与标记Afx-91182449(2.03 M)之间,LOD值为77.2,能解释表型变异的83.1%,区间大小约2 M。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2玉米南方锈病主效QTL定位图
Fig. 2The positioning map of a major QTL of Southern Corn Rust
2.6 次级群体构建及定位区间的缩小
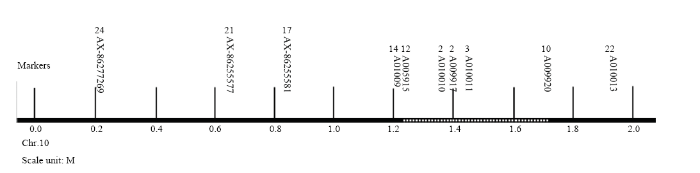
386个感病株中,10个标记AX-86277269(207 864 bp)、AX-86255577(638 032 bp)、AX-86255581(838 120 bp)、A01009(1 212 025 bp)、A005915(1 238 544 bp)、A010010(1 363 238 bp)、A009917(1 393 208 bp)、A010011(1 449 406 bp)、A009920(1 712 625 bp)、A010013(1 932 963 bp)的交换单株数分别是24、21、17、14、12、2、2、3、10和22。因此,按交换单株数量的减少趋势,可以把S313的抗南方锈病主效基因确定在标记A005915和标记A009920之间(图3中虚线处),区间大小为474 K(约0.47 M)。根据MaizeGDB(http://www.maizegdb.org/gbrowse/ maize_v4)提供的B73 Ref Gen_V4参考序列上基因的注释,标记A005915和标记A009920之间共有63个基因,其中3个是假基因(pseudo),2个编码假定蛋白(hypothetical protein),26个编码未知功能的蛋白(uncharacterized protein),5个编码tRNA,其余27个基因编码具有特定功能的蛋白,与抗病性直接相关的基因有3个,分别是LOC103640657(位置1 445 293—1 448 461M)、LOC100191493(位置1 474 451—1 476 950M)、LOC103640673(位置1 680 843—16 871 571M)。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3次级群体中10个SNP标记物理位置及相应交换单株数图
Fig. 3The physical position of 10 SNP markers and corresponding number of exchanged plants
3 讨论
3.1 南方锈病的抗性基因及位置
玉米南方锈病的抗性主要是由主效单基因控制,并且大多数主效QTL被定位在玉米第10染色体短臂上,其中,能查到明确物理位置的主效QTL有7个,分别是RppC[22](在SSR标记umc1380(1.8 M)和umc1291(3.8 M)之间)、RppD[23](在SSR标记umc1291(3.8 M)和CAPS标记(5.8 M)之间)、RppP25[18](在3.1 M附近约40 kb区间内)、RppQ[16](在SSR标记umc1293(2.0 M)和umc2053(4.3 M)之间)、qSCR10.01[24](在SSR标记umc1380(1.8 M)和C(10)3595071(3.1 M)之间),以及热带自交系NC300的主效QTL(在SSR标记umc1380(1.8 M)和bnlg1451(4.9 M)之间)[14]和qSCR10[25](物理位置在SSR标记bnlg1037(33 M)和umc1291(3.8 M)之间),前6个QTL是显性遗传,后1个是隐性遗传。bnlg1037距离两侧的标记umc2705、bnlg1716的物理位置分别为29和33 M,说明抗性亲本W456在该定位区间可能有部分染色体片段发生了倒位或移位,因此,qSCR10的物理位置可宽泛地定位在0—3.8 M的区间内。本研究中S313的抗锈病基因被定位在1.24—1.71 M,说明该基因与上述6个显性主效QTL位置没有重叠,S313与W456显隐关系不同,也不可能是等位基因,另外S313与齐319的等位性试验表明2个材料的抗性基因所在位置也不同。S313定位区间内的3个候选基因中,LOC103640657编码1个含锚蛋白重复序列(ankyrin repeat-containing)的蛋白质,已知含锚蛋白结构域(ankyrin domain- containing)的蛋白在植物抗病性中有重要的作用[26,27]。LOC100191493编码1个凝集素域受体样蛋白激酶(lectin-domain receptor-like protein kinase,LecRLKs),LecRLKs在植物防御病原菌及害虫上起重要作用[28]。LOC103640673编码1个与抗病基因RPP13类似的蛋白,RPP13是拟南芥中发现的1个霜霉病抗性基因[29]。
3.2 QTL定位的算法选择
QTL初定位的准确程度是下一步大规模群体精细定位的基础。在得到遗传图谱后,结合群体表型数据就可以进行QTL分析。QTL分析常见的算法有单标记作图法(single mapping,sM)、区间作图法(interval mapping,IM)、复合区间作图法(composition interval mapping,CIM)、多重区间作图法(multiple interval mapping,MIM)和贝叶斯区间作图法(bayesian interval mapping,BIM)。单标记法是最简单、粗略的算法,由于不能剔除邻近标记重组率对QTL效应大小估计的影响[30],亦不能计算出QTL的位置,现已几乎不用。IM法对单个存在的QTL能做到无偏估计,但一个连锁群邻近区间有连锁的QTL时会影响其位置和效应的估计[31,32]。因此,IM法适用于有大效应QTL且只关注检测大效应QTL的情形,或者在小群体(30—100)定位时,此时主要是小的样本量制约了QTL定位的精度,因此IM法已足敷使用[33]。CIM在IM基础上结合多重标记的回归分析,从而控制其他区间或染色体上存在的QTL对待测QTL的影响[34,35],比IM有更强的统计功效且适用1条染色体有多个QTL的情形[32]。与IM、CIM对染色体各个区段分别进行QTL检测不同[36],MIM是同时对染色体所有区段进行QTL分析,即把全部标记的信息作为遗传背景的同时对多个QTL进行定位,并能对各QTL间可能存在的上位性进行分析[36,37]。MIM算法是真正基于多QTL数学建模及同步对各QTL位置、效应及互作进行分析的算法[38],其统计功效比前述算法都更好,也是第一种能进行QTL上位性分析的算法。基于马氏链蒙特卡洛抽样(markov chain monte carlo,MCMC)的贝叶斯算法是一种比较迟于面世的QTL定位算法,在统计上属于贝叶斯学派,与基于极大似然估计的IM、CIM、MIM截然不同[39]。贝叶斯算法首先是任意选定某个先验分布,在此基础上采用双向可逆跳转算法(reversable jump algorithm,RJA)推导出后验分布后进行参数估计,常规的极大似然估计可认为是贝叶斯模型的1个特例[38,39]。因此,如果1个待进行QTL定位的性状事先能知道其样本的概率分布(如人的身高属正态分布),则使用基于极大似然的CIM等算法就足够拟合出所求的各个参数,不需要进行贝叶斯分析,因其运算量大且复杂[38]。反之如果1个性状被研究得少,其分布模型位置则可考虑用贝叶斯算法。本研究中,用复合区间法(CIM)定位是获得了仅1个峰的QTL图,用区间作图特别是单标记作图时却得到了几个峰的QTL图(QTL图在此未列出),而已知该群体的抗、感分离比是3﹕1,符合单基因模型,因此,QTL图只可能是有1个峰的,这也说明了CIM比SM、IM有更高的定位准确度及更低的假阳性率。3.3 次级群体的规模
已知的次级定位群体规模在1 500—12 000。所需群体的大小主要取决于QTL在染色体上的位置,如果1个QTL离着丝粒越近,交换单株就越少,则所需群体越大,反之离端粒越近,交换单株增加,需要群体就小。本研究中的抗性QTL位于第10染色体短臂的末端,根据前人的研究[40],玉米染色体的两端其实际交换率是物理距离的6—8倍甚至更高,即相隔1M物理距离的2个标记在100株(200个配子)的种植群体中其交换株可达12—16株(6—8×2)株。因此,本研究的次级定位群体如果种植4 000株,取1 000株的隐性感病单株进行检测,按6倍的交换率计算,则1000K(1M)/6/2/10=8K是被定位QTL和与其至少有1个交换单株的SNP的距离。换言之,4 000株的群体能保证把该QTL定位在16K的区间内,当然前提是QTL附近有足够的SNP标记。4 结论
S313的玉米南方锈病抗性由主效单基因控制,其抗性表达强,受环境影响小,检测到的主效基因位于玉米第10染色体短臂约0.47 M的区间内,区间包括了3个与植物抗病性相关的候选基因。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
DOI:10.2135/cropsci1975.0011183X001500040044xURL [本文引用: 1]
[本文引用: 1]
DOI:10.1007/s00122-003-1506-7URL [本文引用: 3]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 2]
URL [本文引用: 2]
[本文引用: 1]
DOI:10.2135/cropsci1980.0011183X002000060035xURL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s00122-006-0466-0URL [本文引用: 2]
[本文引用: 1]
DOI:10.1007/s00438-007-0288-zURL [本文引用: 2]
URLMagsci [本文引用: 1]

以玉米南方型锈病免疫自交系P<SUB>25</SUB>和感病自交系F<SUB>349</SUB>及F<SUB>1</SUB>、F<SUB>2</SUB>、B<SUB>1</SUB>和B<SUB>2</SUB>为材料,采用主基因-多基因混合遗传模型研究了P<SUB>25</SUB>的抗病遗传规律。结果表明:自交系P<SUB>25</SUB>的抗病基因为一主基因,表现为加性效应,没有检测出多基因,其在F<SUB>2</SUB>、B<SUB>1</SUB>和B<SUB>2</SUB>群体的遗传率分别为81.88%、38.14%和55.1%。利用SSR分子标记技术,以组合P<SUB>25</SUB>×F<SUB>349</SUB>的F<SUB>2:3</SUB>家系作为构图群体,构建了玉米SSR遗传连锁图谱,并将玉米抗南方型锈病基因定位于10号染色体上,与phi059标记的遗传距离为5.8 cM。
URLMagsci [本文引用: 1]

以玉米南方型锈病免疫自交系P<SUB>25</SUB>和感病自交系F<SUB>349</SUB>及F<SUB>1</SUB>、F<SUB>2</SUB>、B<SUB>1</SUB>和B<SUB>2</SUB>为材料,采用主基因-多基因混合遗传模型研究了P<SUB>25</SUB>的抗病遗传规律。结果表明:自交系P<SUB>25</SUB>的抗病基因为一主基因,表现为加性效应,没有检测出多基因,其在F<SUB>2</SUB>、B<SUB>1</SUB>和B<SUB>2</SUB>群体的遗传率分别为81.88%、38.14%和55.1%。利用SSR分子标记技术,以组合P<SUB>25</SUB>×F<SUB>349</SUB>的F<SUB>2:3</SUB>家系作为构图群体,构建了玉米SSR遗传连锁图谱,并将玉米抗南方型锈病基因定位于10号染色体上,与phi059标记的遗传距离为5.8 cM。
DOI:10.1111/jipb.12027URL [本文引用: 2]
URLMagsci [本文引用: 1]
URLMagsci [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1104/pp.112.197152URL [本文引用: 1]
DOI:10.1007/s10528-009-9238-2URL [本文引用: 1]
DOI:10.1093/mp/sst033URL [本文引用: 1]
DOI:10.1046/j.1365-313x.2000.00664.xURL [本文引用: 1]
DOI:10.1214/ss/1030037909URL [本文引用: 1]
DOI:10.1038/hdy.1992.131 [本文引用: 1]
[本文引用: 2]
DOI:10.1007/s10709-004-2705-0URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1017/S0016672399004255URL [本文引用: 2]
DOI:10.1007/s00122-007-0650-xURL [本文引用: 1]
[本文引用: 3]
[本文引用: 2]
DOI:10.1111/j.1439-0523.2011.01866.xURL [本文引用: 1]
