 ,1,2
,1,2Silencing and Overexpressing SMAD Family Member 1 (SMAD1) Gene and Its Effect on Myogenesis in Primary Myoblast of Qinchuan Cattle (Bos taurus)
NING Yue1, MI Xue1, CHEN XingYi1, SHAO JianHang1, ZAN LinSen ,1,2
,1,2通讯作者:
编委: 林鉴非
收稿日期:2018-12-6接受日期:2019-02-26网络出版日期:2019-05-16
| 基金资助: |
Received:2018-12-6Accepted:2019-02-26Online:2019-05-16
作者简介 About authors
宁越,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (5157KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
宁越, 米雪, 陈星伊, 邵建航, 昝林森. SMAD1基因的沉默和过表达及对秦川牛原代成肌细胞生肌的影响[J]. 中国农业科学, 2019, 52(10): 1818-1829 doi:10.3864/j.issn.0578-1752.2019.10.014
NING Yue, MI Xue, CHEN XingYi, SHAO JianHang, ZAN LinSen.
0 引言
【研究意义】秦川牛(Bos taurus)是我国著名的地方黄牛品种,具有耐粗饲、抗逆性(病)好、肉质好的优点,但仍存在生长慢、产肉量低且脂肪沉积欠佳等缺点[1]。随着人们生活水平的不断提高,牛肉供应紧缺,提高牛肉的产量、质量成为当务之急[2,3,4]。【前人研究进展】研究表明,骨骼肌生长和肌内脂肪含量对畜禽的产肉性能和肉质有着至关重要的影响。TGF-β(transforming growth factor-β)信号通路主要参与调节细胞生长、增殖、分化、迁移和凋亡,可介导组织与器官的正常生长和发育(胚胎发育、骨骼器官形成)、机体的免疫反应等生物过程,其在抑制脂肪细胞和成肌细胞分化中的作用十分重要[5,6]。SMAD蛋白家族作为细胞内重要的信号转导蛋白,直接参加与TGF-β超家族成员TGF-β1、TGF-β2、TGF-β3以及骨形态发生蛋白(bone morphogenetic protein, BMP)、活化素等多个成员的信号转导[7]。目前,共有8种SMAD成员被报道(SMAD1-8),按照结构和功能可分为3类[8,9,10]。第一类,特异性SMADs(亦称receptor- activated SMAD,R-SMADs),包括SMAD1、2、3、5、8,其中SMAD1、5、8能被BMP-Ⅰ型受体(ALK1、2、3、6)磷酸化而激活,参与BMP信号通路;而SMAD2、3能被活化素或者TGFβ-Ⅰ型受体(ALK4、5)和孤儿Ⅰ型受体(ALK7)激活,作为TGF-β信号通路的直接作用底物,可对成肌因子及成肌分化过程起关键作用。第二类,共有型SMADs(common SMAD, C-SMAD),即SMAD4,它能与激活的R-SMADs形成异源的多聚复合物,转录到细胞核内调控下游基因。第三类,抑制型SMADs(Ⅰ-SMADs),包括SMAD6、7,它们能抑制R-SMADs和C-SMAD复合物的活性。【本研究切入点】BMP信号通路作为调控骨/软骨形态发生的重要通路而被熟知。近年来,研究发现SMAD1/5/8通过参与BMP信号通路对调控肌肉量有着十分重要的作用[11]。试验发现,在鼠的骨骼肌细胞细胞核中定位到SMAD1、SMAD5、SMAD8蛋白,并且通过成年在鼠骨骼肌细胞中敲除SMAD1/5/8基因两周后,观察到其肌肉量减少了20%。此外,还有试验证实,BMP-SMAD1/5/8通路可通过与activin/ myostatin-SMAD2/3通路竞争SMAD4从而促进肌肉量及成肌分化过程[12]。【拟解决的关键问题】鉴于SMAD1基因的重要功能,本试验以秦川牛背最长肌组织为试验材料,克隆秦川牛SMAD1基因,设计合成了RNA干扰序列、构建了腺病毒过表达载体,获得了具有干扰能力的RNA序列siSMAD1和对SMAD1有过表达能力的腺病毒AD-bSMAD1,研究其在秦川牛成肌细胞分化过程中的调控作用,为进一步研究该基因和BMP信号通路在秦川牛肌肉组织生长发育过程中发挥的作用奠定基础。1 材料与方法
本研究于2016年9月至2018年4月在西北农林科技大学国家肉牛改良中心完成。1.1 试验材料
秦川牛第1代原代成肌细胞[13]、背最长肌组织(第12—13肋骨间)均冻存于西北农林科技大学国家肉牛改良中心种质资源库。所用试剂有:pDC316-mCMV- EGFP载体质粒、JM109感受态细胞、Polyfectine转染试剂均购自百恩维生物科技有限公司(中国,深圳);FastPfu DNA Polymerase、质粒小提试剂盒、Trans2K Plus II DNA Marker购自全式金生物技术有限公司(中国,北京);琼脂糖凝胶回收试剂盒、Endo-free Plasmid Kit购自Omega Bio-tek股份有限公司(美国);T4 DNA 连接酶、限制性内切酶NotI、NheI购自NEB有限公司(中国,北京);DMEM培养基、胎牛血清(FBS)、马血清(HS)、胰蛋白酶Trypsin 0.25% EDTA、Lipofectamine? 3000购自Invitrogen公司(美国);青链霉素双抗购自Gibco(美国);腺病毒纯化试剂盒ViraBind购于Cell Biolabs公司(美国);PrimeScriptTM RT Reagent Kit with DNA Eraser反转录试剂盒、SYBR? Primix Ex TaqTMⅡ试剂盒购自宝日医生物技术有限公司(中国,北京)。1.2 生物信息学分析
登录NCBI数据库(Table 1
表1
表19种物种SMAD1氨基酸序列信息
Table 1
| 物种 Species | 登录号 Accession | 物种 Species | 登录号 Accession | |
|---|---|---|---|---|
| 牛 Bos Taurus | NP_001069691.2 | 猪 Sus scrofa | NP_999130.1 | |
| 羊 Capra hircus | XP_017917067.1 | 小鼠 Mus musculus | NP_032565.2 | |
| 绵羊 Ovis aries | XP_014956993.1 | 大鼠 Rattus norvegicu | NP_037262.2 | |
| 人 Homo sapiens | NP_005891.1 | 鸡 Gallus gallus | NP_001188384.1 | |
| 狗 Canis lupus | XP_022259170.1 |
新窗口打开|下载CSV
1.3 诱导分化秦川牛原代成肌细胞
复苏第1代的秦川牛原代成肌细胞,差速贴壁两次后进行传代培养至第3代,将细胞按2×105个/孔接种于6孔培养板中,使用未诱导分化培养基(20%FBS+DMEM/F12)培养。待细胞融合率达到80%后用含2%HS的分化培养基进行诱导分化培养,隔日换液。1.4 沉默秦川牛SMAD1基因
1.4.1 设计并合成siRNA 按照siRNA设计原则,以Genbank上牛SMAD1基因mRNA序列(NM_ 001077107.2),应用Invitrogen公司在线设计工具(Table 2
表2
表2siRNA序列
Table 2
| 序列名称 Sequence name | 序列 (5'→3') Sequences (5'→3') |
|---|---|
| siSMAD1 | sense:5'-CCAUCUCUGCCUUCAGAAATT-3' |
| antisense:5'-UUUCUGAAGGCAGAGAUGGTT-3' | |
| siRNA-NC | sense:5'-UUCUCCGAACGUGUCACGUTT-3' |
| antisense:5'-ACGUGACACGUUCGGAGAATT-3' |
新窗口打开|下载CSV
1.4.2 转染原代成肌细胞 用无血清培养液饥饿处理原代成肌细胞,LipofectamineTM3000分别转染siSMAD1和阴性对照siRNA-NC。转染6h后,更换为含2%HS的分化培养基进行成肌分化诱导,隔天换液。观察细胞分化融合情况并提取转染第0、1、3、6、9天的总RNA。
1.5 过表达牛SMAD1基因
1.5.1 构建秦川牛SMAD1基因腺病毒过表达载体 用Primer 5.0软件根据牛SMAD1基因mRNA序列设计特异性引物(表3),并在引物中引入酶切位点NheI和NotI。以原代成肌细胞cDNA为模板扩增CDS区序列,产物长1 452 bp。PCR体系为:含模板的DNA 100ng、正反向引物各4μL、dNTP Mix(2.5mmol·L-1)4μL、FastPfu polymerase 1μL、5×FastPfu buffer 10μL,用灭菌蒸馏水补足50μL。PCR扩增条件:95℃ 3 min;95℃ 20 s,55℃ 30 s,72℃ 2 min,30 个循环;72℃ 5 min。将PCR产物经双酶切(NheI和NotI)回收后与pDC316-mCMV-EGFP真核表达载体大片段进行连接,22℃反应2h。反应体系为:目的片段6μL、pDC316-mCMV-EGFP大片段2μL、10×DNA Ligase Buffer 1μL、T4 DNA Ligase 1μL。将上述连接产物取10μL与100μL JM109感受态细胞均匀混合,冰浴30min后42℃热激45s,再立即冰浴2min,加入预热至室温的400μL LB培养基后37℃摇床培养1h,以4 000r/min离心1min后弃去400μL培养上清,再用移液器将剩余100μL吹打混匀后涂布于LB平板上(氨苄抗性含100μg·mL-1),37℃恒温培养箱倒置培养过夜。次日挑取2个单克隆菌落并接种到5ml含氨苄抗性的LB培养液(氨苄浓度为100μg·mL-1)中,250r/min,37℃恒温摇床培养过夜,用小量质粒抽提试剂盒抽提质粒,质粒经NheI和NotI双酶切鉴定无误后,送上海生工生物工程股份有限公司进行测序。Table 3
表3
表3PCR引物序列
Table 3
| 基因名称 Gene name | 登录号 Accession No. | 引物序列 (5'→3') Primer sequences (5'→3') | 产物 Size(bp) |
|---|---|---|---|
| CDS-SMAD1 | NM_001077107.2 | F:CTAGCTAGCCACCATGAATGTGACAAGTTTATTTTCCTTCAC | 1452 |
| R:ATTTGCGGCCGCCTACAGATCCTCTTCTGAGATGAGTTTTTGTTCC | |||
| RT-SMAD1 | NM_001077107.2 | F:TTCGCATGAGCTTTGTGAAG | 98 |
| R:GTGAGCCCATCTGGGTAAGA | |||
| RT-MyoD | NM_001040478 | F:TCCGCGACGTAGACTTGA | 84 |
| R:CGAAACACGGGTCATCATAGAA | |||
| RT-MyoG | NM_001111325 | F:GGCGTGTAAGGTGTGTAAG | 85 |
| R:CTTCTTGAGTCTGCGCTTCT | |||
| RT-Myf5 | NM_174116.1 | F:CCTCTAGTTCCAGGCTCATCTA | 90 |
| R:ACCTCCTTCCTCCTGTGTAATA | |||
| RT-GAPDH | NM_001034034 | F: CCAACGTGTCTGTTGTGGAT | 80 |
| R: CTGCTTCACCACCTTCTTGA |
新窗口打开|下载CSV
1.5.2 pDC316-mCMV-EGFP-bSMAD1和对照腺病毒包装 将293细胞接种在6孔板中培养,细胞汇合度达到70%—80%,用转染试剂Polyfectine转染质粒,具体步骤参照说明书进行。转染后观察出毒迹象,即细胞收缩变圆,伴有细胞脱落。在大部分细胞病变并从培养瓶壁脱落后,作为病毒母液P1进行收毒。
扩增病毒AD-bSMAD1。扩增培养HEK 293细胞,当细胞达到80%—90%汇合度时加入P1代病毒AD-bSMAD1。在病毒侵染48h后收集细胞,在-80℃/37℃下冷冻/解冻3次,离心(10 000×g,10min)收集病毒上清,标记为P2。用P2代病毒以相同方法扩增病毒至P3代,再通过腺病毒纯化试剂盒对P3代病毒纯化。
PCR鉴定目的基因。收集P2代病毒,在沸水孵育10分钟后立即置于冰上。短暂离心后,取上清液作模板进行PCR反应。PCR鉴定条件与扩增目的基因相同。
1.5.3 病毒生物学滴度的测定 在滴度测定前一天将HEK 293细胞接种到48孔板中。用DMEM完全培养基10倍梯度稀释病毒。具体做法如表4:在96孔板每孔中加入90μL培养基,向第一横排孔中加入待测病毒原液各10μL,混匀后取10μL混合液转至第二横排孔,如此稀释至第八横排孔。取稀释好的病毒混合液10μL加入相应的48孔板中。侵染48h后,通过荧光显微镜计数荧光细胞情况。在最高稀梯度m的孔数出N个带荧光的细胞,则病毒滴度为N×10m/mL(m为稀释梯度),若N>10,则需继续稀释。
Table 4
表4
表4病毒浓度梯度
Table 4
| 稀释倍数 Diluted multiples | 上一梯度病毒液 Virus of upper gradient | DMEM完培 DMEM complete medium | 上样量 Volume of the sample | 滴定量 Volume of the virus |
|---|---|---|---|---|
| 103 | 10 | 90 | 10 | 1μL |
| 104 | 10 | 90 | 10 | 0.1μL |
| 105 | 10 | 90 | 10 | 0.01μL |
| 106 | 10 | 90 | 10 | 0.001μL |
| 107 | 10 | 90 | 10 | 0.0001μL |
| … | … | … | … | … |
新窗口打开|下载CSV
1.5.4 测定腺病毒侵染细胞最佳MOI值 复苏实验室保存的第1代秦川牛原代成肌细胞,传代培养后,将细胞以1×104 个/孔铺板至两个24孔培养板中。分别加入不同剂量的腺病毒(MOI分别为25、50、75、100、125和150),每个处理设置3个重复,48 h后根据细胞的生长情况及绿色荧光的表达情况来确定最佳的侵染浓度。
1.5.5 腺病毒侵染秦川牛原代成肌细胞 复苏第1代秦川牛原代成肌细胞,传代培养到第3代时,将细胞以2×105个/ 孔铺至6孔培养板中,使用增殖培养基(20%FBS+ DMEM/F12)培养。试验共设计2个处理组,AD-bSMAD1,AD-NC。当原代成肌细胞汇合度达到90%时,根据测定的MOI值加毒,12h后换成成肌细胞诱导分化培养基;侵染48h后,替换成分化培养基并隔天换液。在培养的第0、1、3、6、9天时收集细胞,提取总RNA并观察细胞分化融合情况。
1.6 细胞总RNA的提取及反转录PCR
用Trizol试剂提取处理第0、1、3、6、9天的成肌细胞总RNA,-80保存。用琼脂糖凝胶电泳和分光光度计测定提取的细胞RNA的质量。将质量符合要求的RNA用PrimeScriptTM RT Reagent Kit with DNA Eraser反转录试剂盒进行反转,反应得到的cDNA第一链保存于-20℃冰箱。1.7 实时荧光定量PCR 检测
各取1μg RNA,用PrimeScriptTM RT Reagent Kit with gDNA Eraser反转录试剂盒进行反转录得到cDNA。用SYBR? Primix Ex TaqⅡ试剂盒进行实时定量PCR,反应体系为20 μL,其中SYBR? Primix Ex TaqⅡ 10 μL,上下游引物各0.8 μL,ROX Reference DyeⅡ 0.4 μL,cDNA模板2 μL,dH2O 6 μL。反应在7500 Real Time PCR仪(ABI公司)上进行,具体循环参数为:95℃预变性30 s;95℃变性5 s,60℃退火34 s,循环40次。熔解曲线程序为: 95℃ 15 s,60℃ 1 min,95℃ 15 s。每个样品进行3次试验重复。以GAPDH基因为内参,检测SMAD1基因及肌分化标志基因的表达。引物相关参数见表3。1.8 统计分析
试验数据以“平均值±标准误(mean±SE)”表示,利用SPSS16.0软件进行单因素方差分析,用t检验(t-test)对不同试验处理之间的差异进行显著性分析,*P<0.05为差异显著,**P<0.01为差异极显著。2 结果
2.1 物种间SMAD1蛋白质序列比对
对反刍动物、单胃动物等9种不同物种的蛋白质序列多重比较结果显示:牛(Bos taurus)与山羊(Capra hircus)、绵羊(Ovis aries)、人(Homo sapiens)、狗(Canis lupus)、猪(Sus scrofa)SMAD1蛋白质序列的相似性极高,均为99%;与小鼠(Mus musculus)、大鼠(Rattus norvegicu)、鸡(Gallus gallus)SMAD1蛋白质序列的相似性稍低,分别为98%、97%和96%。因此,不难看出SMAD1蛋白序列在各物种间十分保守(图1)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1物种间SMAD1氨基酸序列比对(差异部分)
100%一致性氨基酸位点用白色背景标注,0%一致性的位点使用黑色背景标注,具体保守性在下方line图中
Fig. 1Multi-sequences comparison of SMAD1 amino acids (differences in part)
The amino acid sites with 100% consistency are marked with white background, and 0% consistency sites are marked with black background. The specific conservatism is shown in the line diagram below
2.2 检测沉默效率
提取siSMAD1转染牛原代成肌细胞第0、1、3、6、9天的细胞总RNA进行qRT-PCR。结果显示,与对照组相比,在转染siSMAD1后,SMAD1基因分别被下调了75.4%、66.7%、60.0%、54.7%(P<0.01,图2)。结果表明,通过RNA干扰技术可有效降低成肌细胞SMAD1基因的mRNA水平,且沉默效率至少可持续至第9天。图2
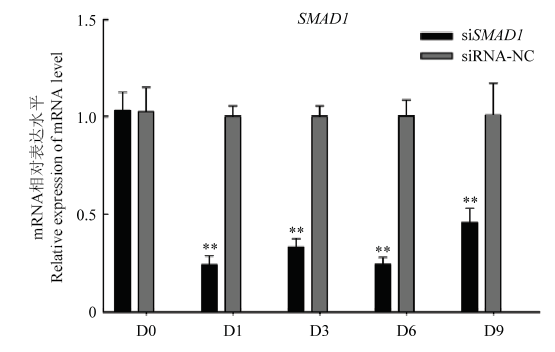 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2siSMAD1干扰效率检测
Fig. 2Detection of interference efficiency of siSMAD1
2.3 构建pDC316-mCMV-EGFP-bSMAD1腺病毒载体
以秦川牛成肌细胞cDNA为模板,利用PCR技术扩增SMAD1基因CDS区序列,经1%琼脂糖凝胶电泳检测发现,条带清晰且符合预期(图3-A)。将PCR产物胶回收后克隆到pDC316-mCMV-EGEP载体上,构建pDC316-mCMV-EGFP-bSMAD1腺病毒载体。质粒双酶切(NheI和NotI)后经电泳鉴定,得到5 803bp和1 452bp两条条带,所得线性化质粒和目的片段大小符合预期(图3-B),同时测序结果也显示pDC316-mCMV-EGFP-bSMAD1腺病毒载体构建成功。图3
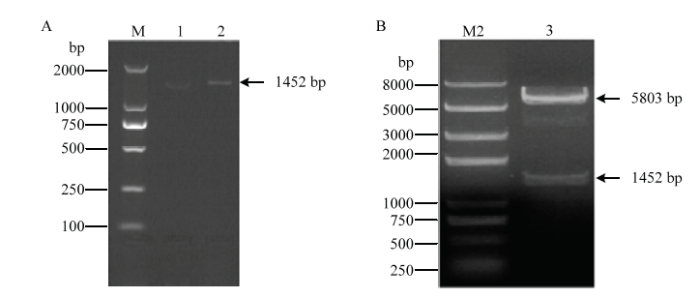 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3秦川牛SMAD1基因腺病毒载体pDC316-mCMV-EGFP-bSMAD1的构建
A:秦川牛SMAD1基因CDS区序列PCR产物;B:pDC316-mCMV-EGFP-bSMAD1质粒酶切鉴定结果。M1:DL2000 DNA marker;M2:Trans2K plus marker;泳道1,2为SMAD1基因在两种成肌细胞cDNA中的PCR产物;泳道3为pDC316-mCMV-EGFP-bSMAD1的NheI和NotI双酶切鉴定结果
Fig. 3Construction of the adenovirus vector pDC316-mCMV-EGFP-bSMAD1
A: PCR products of SMAD1 gene CDS region in Qinchuan cattle; B: Identification of recombinant plasmid pDC316-mCMV-EGFP-bSMAD1 by double digestion of NheI and NotI. M1: DL2000 DNA marker; M2: Trans2K plus marker; lane1 and 2: PCR products of SMAD1 gene in two kinds of myoblasts; lane 3: Identification of pDC316-mCMV-EGFP-bSMAD1 by double digestion of NheI and NotI
2.4 包装、扩繁pDC316-mCMV-EGFP-bSMAD1和对照腺病毒
共转染携带目的基因的重组质粒pDC316- mCMV-EGFP-bSMAD1和骨架质粒到HEK293细胞中,在倒置荧光显微镜下观察到(图4 A-C):转染1d后有大量绿色荧光蛋白(GFP)表达;9d后出现彗星状的荧光聚集现象;在12—14d后大部分细胞病变并从培养瓶壁脱落,将其收集为病毒母液P1。为了获得强侵染能力的病毒,通过反复“侵染-冻融-收集”对病毒AD-bSMAD1进行大量扩繁[14]。图4-D是第3代纯化后的腺病毒侵染细胞48 h时GFP表达情况。腺病毒滴度采用LaSRT法测定为1×1010pfu/mL。图4
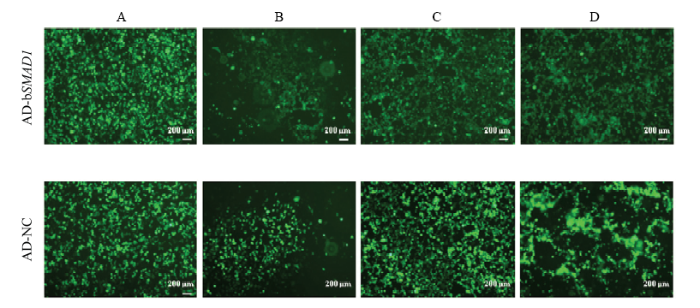 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4重组腺病毒AD-bSMAD1的包装与扩繁
A:转染目的质粒到293细胞24h,GFP表达情况;B:转染9天后,病变细胞开始出毒,绿色荧光呈现葡萄串样的聚集现象;C:AD-bSMAD1转染14d以及AD-NC转染12d时,大部分细胞收缩变圆,开始从培养瓶壁脱落,将其收集为病毒母液P1;D:高滴度病毒(P3)侵染293细胞48h,GFP表达情况。原始放大倍数:40× (OLYMPUS IX71, 比例尺:200 μm)
Fig. 4Adenovirus packaging and amplification
A: GFP Expression of 293 cells infected after 24 h; B: Green fluorescence showed a grapes-like gathering and adenovirus started to appear after 9 d; C: After 14d-infection of AD-bSMAD1 and 12d-infection of AD-NC, most cells became shrinkage, roundout and shedding, gathered as the first-generation adenovirus; D: GFP expression of 293 cells after 48h-infection of high titers adenovirus (P3). Original magnification: 40× (OLYMPUS IX71, scale bars: 200 μm)
2.5 测定腺病毒侵染细胞最佳MOI值
复苏的秦川牛原代成肌细胞经培养后得到的第3代细胞,在倒置显微镜下观察发现细胞形态多呈短梭形或多角形,细胞核呈圆形或椭圆形。将其铺至24孔培养板中,分别侵染不同剂量的腺病毒。48 h后在显微镜下观察到AD-bSMAD1,AD-NC的MOI值(multiplicity of infection, 侵染复数)分别为100和25时细胞GFP表达量较多且尚未出现明显病变,因此确定此浓度为最佳侵染浓度。2.6 检测过表达效率
腺病毒AD-bSMAD1侵染秦川牛前体成肌细胞第1、3、6、9天后,在荧光显微镜下观察到95%以上的细胞可成功表达GFP。分别提取各时期细胞的总RNA,利用实时荧光定量PCR检测SMAD1基因的表达水平,结果显示SMAD1基因的表达量较对照组分别上调了约2.10倍(诱导1d)、3.19倍(诱导3d)、105.3倍(诱导6d,P<0.01)和144倍(诱导9d,P<0.01,图5)。上述结果说明所包装的过表达腺病毒可有效升高SMAD1基因的mRNA水平,且过表达效率可至少持续至第9天。图5
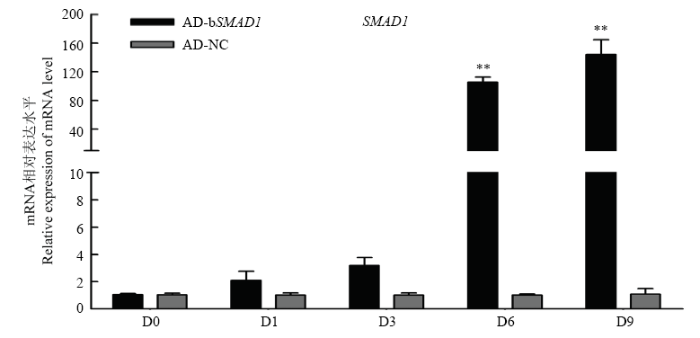 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5AD-bSMAD1过表达效率检测
Fig. 5Detection of overexpression efficiency of AD-bSMAD1
2.7 SMAD1基因促进秦川牛成肌细胞分化
显微镜观察转染siSMAD1第6天的牛原代成肌细胞发现,处理组细胞的肌管形成过程较对照组明显受损,所形成的肌管更小、更短、更少(图6-A)。腺病毒AD-bSMAD1侵染并诱导成肌细胞分化6天时,在显微镜下观察发现,与对照组相比,AD-bSMAD1侵染组的细胞肌管的更大、更长、更多(图6-B)。由实时荧光定量PCR结果知(图6-C),与siRNA-NC相比,siSMAD1处理组的肌分化标志基因MyoD,Myf5和MyoG的mRNA水平均显著下降(P<0.01)。反之,与对照组AD-NC相比,AD-bSMAD1组的成肌标志基因MyoD,Myf5和MyoG的mRNA水平均显著升高(图6-D,P<0.01)。以上结果表明,SMAD1基因能够有效的正向调控秦川牛原代成肌细胞分化。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6沉默、过表达SMAD1基因调控牛原代成肌细胞分化
A:转染siSMAD1并诱导分化6天时牛原代成肌细胞分化融合情况;B:侵染腺病毒AD-bSMAD1并成肌诱导分化6天时秦川牛原代成肌细胞分化融合情况;C:沉默SMAD1后肌分化标志基因的mRNA水平检测;D:过表达SMAD1后肌分化标志基因的mRNA水平检测。原始放大倍数:40× (OLYMPUS IX71, 比例尺:200 μm)
Fig. 6Regulation of bovine primary myoblasts differentiation by silencing and overexpressing SMAD1 gene
A: Cell micrographs of bovine primary myoblasts after 6 days induction transfected with siSMAD1; B: Cell micrographs of bovine primary myoblasts after 6 days induction infected with AD-bSMAD1; C: Relative mRNA expression of MyoD, Myf5 and MyoG after silencing SMAD1 gene; D: Relative mRNA expression of MyoD, Myf5 and MyoG after overexpression of SMAD1 gene. Original magnification: 40× (OLYMPUS IX71, scale bars: 200 μm)
3 讨论
大理石花纹作为衡量牛肉品质的重要指标,主要受到肌肉和脂肪含量的比例影响。一直以来,人们对BMP信号通路的研究主要集中在骨的形成发育过程上,但自2013年起,其在调控肌肉发育上的重要功能开始为人们了解。研究证明,BMP信号通路在调控成年后的肌肉量变化的重要作用主要是由SMAD1/5/8完成的[11,12],且这条新的信号通路可以同广泛存在的TGF-β通路的activin/myostatin- SMAD2/3轴竞争结合SMAD4。这种竞争作用,一方面可以降低activin/ myostatin-SMAD2/3的作用浓度,减少其对肌肉发育的抑制作用;另一方面可以增加BMP-SMAD1/5/8的优势作用。获得优势的SMAD1/5/8磷酸化后可同SMAD4结合,进而将信号从细胞膜转录至细胞核内进而调控下游靶基因的转录,从而促进肌肉发育。牛SMAD1基因定位在其17号染色体,编码区长1 398个碱基,共编码465个氨基酸。本试验主要通过在秦川牛成肌细胞中下调、上调SMAD1基因表达量,观察其对肌管融合过程及研究标志基因在肌生成过程中作用,从而研究该基因在成肌分化中的重要作用。与传统的基因工程技术相比,RNA干扰(RNAi)是一种高效、稳定、特异性强的干扰技术。因此本试验首先设计并筛选到一条有效的siRNA。试验发现,转染siSMAD1可有效下调目的基因的表达量,SMAD1在转染后的第1、3、6、9天分别下调了75.4%、66.7%、60.0%、54.7%(P<0.01)。说明所合成的siSMAD1可持续稳定、高效得下调基因的mRNA水平,且该沉默水平可至少维持9d。另外,为了从另一角度研究基因功能,采取将外源基因导入真核细胞从而实现过表达目的基因以观察相关生理过程的变化。与脂质体介导的化学试剂转染法、电转移、核转移等物理方法相比,这种过表达方法能直接将目的基因插入到病毒基因组中,再利用病毒的侵染性实现目的基因在真核细胞内的过表达,最大程度的保护细胞保持良好状态而不受损伤。20世纪中期,重组腺病毒载体作为一个新兴的表达载体,开始应用于表达外源基因。与其他病毒载体系统相比,腺病毒载体系统可以有效地侵染原代细胞,并且可以侵染分裂期、非分裂期和增殖缓慢的细胞以及体内组织,更易获得高滴度病毒、可携带大片段外源基因而不与宿主基因组整合等[15,16,17,18,19]。腺病毒载体的这些优点使其成为细胞试验最常用的病毒载体之一,也是基因表达和传递的主要候选载体[14, 20]。本试验采用秦川牛原代成肌细胞所提的RNA进行反转录,以得到的cDNA为模板,在高保真酶的作用下成功克隆得到秦川牛SMAD1基因编码区序列。为了更好地研究SMAD1基因在秦川牛肌肉的生长发育中的调控作用,本试验选用Ad5腺病毒改造的AdMaxTM重组腺病毒包装系统,而不是前期使用的AdEasyTM Adenoviral Vector System。前期使用的这种腺病毒包装系统需要将目的基因线性化后转染到含有骨架载体pAd-Easy-1的E. coli BJ5183大肠杆菌感受态中,再在细菌中实现腺病毒的重组[21,22]。而本试验采用的AdMaxTM系统是由Ad5腺病毒改建,不需要多次连接,可直接将共转染到HEK293细胞中的腺病毒载体穿梭质粒和骨架质粒在重组酶的作用下产生重组腺病毒,病毒包装不需要不断传代就可获得高滴度和高侵染效率的腺病毒[14, 23]。包装成功的病毒扩繁到第三代时滴度可达到1×1010 pfu/mL。按MOI值(AD-bSMAD1,AD-NC分别为100和25)侵染秦川牛原代成肌细胞第6和9天时,与对照组相比,SMAD1基因的表达水平显著上调了105.3倍(P<0.01)和144倍(P<0.01)。由此获得了可有效调控基因表达的工具,siSMAD1和AD-bSMAD1,为下一步研究SMAD1基因在成肌分化过程中的作用奠定了强有力的基础。
骨骼肌分化是一类由多种信号通路和转录因子调控的复杂的级联反应[24,25,26]。成肌因子能够诱导肌肉干细胞的激活和终末分化,在成肌增殖和分化中发挥重要作用。在成肌发生的早期阶段,甚至是在增殖的成肌细胞分化前,MyoD和Myf5作为成肌分化的早期决定因子首先被激活。MyoD在骨骼肌卫星细胞的自我更新和增殖方面起到至关重要的作用[27]。已有研究表明,在肌卫星细胞中缺失 MyoD,会使卫星细胞更倾向于自我的更新交替,而不会进行细胞的融合形成肌管[28]。MyoD被激活后可进而调控下游成肌基因MyoG的表达,是在成肌终末分化期起决定性作用的转录因子,进而促进肌管的形成[29,30,31,32]。最新研究表明,SMAD1对成年后肌肉量的调控十分关键,但其具体的调控机制及在肌肉形成过程中的功能还不甚清楚。为了更好地研究SMAD1基因的作用机制,本试验利用前期获得的有效RNA干扰序列和高滴度腺病毒侵染秦川牛原代成肌细胞,通过对SMAD1基因mRNA水平表达量及细胞分化融合情况观察,发现SMAD1基因的表达量在转染siSMAD1后的诱导分化1—9d内均极显著低于对照组,但是诱导1—6d的干扰效率在60%以上,而第9天的干扰效率有所下降(为54.7%),此外,在诱导第6天时成肌细胞的分化过程已呈现出明显的细胞表型(具体表现为肌管融合过程明显受损,所形成的肌管更小更少更短);而过表达SMAD1基因后其mRNA水平从细胞诱导分化的第六天开始显著上调且超过100倍,对照组相比,所形成的肌管与更多、更长。因此,综合干扰、过表达SMAD1基因后其mRNA水平和细胞表型的变化来看,诱导分化第6天都是一个很重要且有效的时间点,可以作为后续检测标志基因的时间点。另外,实时荧光定量PCR结果证明,SMAD1基因可正向调控成肌基因MyoD、Myf5、MyoG的表达。以上结果提示,SMAD1很有可能参与了成肌分化的早期/终末期调控,是成肌分化的一个正向调控基因。而SMAD1对MyoD、Myf5、MyoG的准确调控机制仍需进一步探究。
4 结论
本研究成功筛选到靶向沉默秦川牛SMAD1基因的RNA干扰序列siSMAD1,同时成功构建了秦川牛SMAD1基因过表达重组腺病毒载体。通过在秦川牛原代成肌细胞中沉默、过表达SMAD1基因,检测相关标志基因的转录表达,证实SMAD1基因可正向调控原代成肌细胞分化。(责任编辑 林鉴非)
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.yexcr.2010.04.031URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/S0092-8674(03)00432-XURL [本文引用: 1]
[本文引用: 1]
DOI:10.1038/ng.2772 [本文引用: 2]
DOI:10.1016/j.tem.2014.06.002URL [本文引用: 2]
[本文引用: 1]
DOI:10.1016/j.bbrc.2004.04.171URL [本文引用: 3]
DOI:10.1038/s41467-017-02088-wURL [本文引用: 1]
DOI:10.1073/pnas.95.5.2509URL [本文引用: 1]
DOI:10.1016/S0022-5223(96)70422-1URL [本文引用: 1]
DOI:10.3864/j.issn.0578-1752.2013.07.014Magsci [本文引用: 1]

【目的】旨在通过构建秦川牛FABP4基因的重组腺病毒载体,为在细胞水平研究FABP4基因的功能和作用机制做准备。【方法】根据GenBank收录的牛FABP4基因mRNA序列设计引物,PCR扩增并克隆测序。将目的基因连接到穿梭载体pAdTrack-CMV上并用PmeⅠ线性化后,转化含有腺病毒骨架载体pAdEasy-1的E. coli BJ5183感受态细胞进行同源重组,得到重组质粒pAd-FABP4,并用PacⅠ酶切鉴定。将经过PacⅠ线性化的pAd-FABP4转染HEK 293A细胞进行病毒包装和扩增,TCID50法测定病毒滴度。【结果】经测序鉴定本次克隆的FABP4 序列与GenBank收录的一致。 酶切鉴定、绿色荧光观察、PCR及测序检测均证明,重组腺病毒载体构建成功并获得重组腺病毒AD-FABP4,病毒滴度为1.58×109 PFU•mL-1。【结论】成功构建了秦川牛FABP4基因重组腺病毒载体并获得高滴度的重组腺病毒。
DOI:10.3864/j.issn.0578-1752.2013.07.014Magsci [本文引用: 1]

【目的】旨在通过构建秦川牛FABP4基因的重组腺病毒载体,为在细胞水平研究FABP4基因的功能和作用机制做准备。【方法】根据GenBank收录的牛FABP4基因mRNA序列设计引物,PCR扩增并克隆测序。将目的基因连接到穿梭载体pAdTrack-CMV上并用PmeⅠ线性化后,转化含有腺病毒骨架载体pAdEasy-1的E. coli BJ5183感受态细胞进行同源重组,得到重组质粒pAd-FABP4,并用PacⅠ酶切鉴定。将经过PacⅠ线性化的pAd-FABP4转染HEK 293A细胞进行病毒包装和扩增,TCID50法测定病毒滴度。【结果】经测序鉴定本次克隆的FABP4 序列与GenBank收录的一致。 酶切鉴定、绿色荧光观察、PCR及测序检测均证明,重组腺病毒载体构建成功并获得重组腺病毒AD-FABP4,病毒滴度为1.58×109 PFU•mL-1。【结论】成功构建了秦川牛FABP4基因重组腺病毒载体并获得高滴度的重组腺病毒。
[本文引用: 1]
[本文引用: 1]
DOI:10.1038/gt.2015.34 [本文引用: 1]
DOI:10.1038/nprot.2007.135 [本文引用: 1]
DOI:10.11843/j.issn.0366-6964.2013.08.022Magsci [本文引用: 1]

<p><span >克隆秦川牛的</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因并构建重组腺病毒表达载体,包装扩繁获得高滴度病毒,拟为在细胞水平上开展基因功能的研究奠定基础。本试验以秦川牛脂肪组织为试验材料,提取总</span><span lang="EN-US">RNA</span><span >并反转得到</span><span lang="EN-US">cDNA</span><span >,以</span><span lang="EN-US">GenBank</span><span >收录的牛的</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因</span><span lang="EN-US">mRNA</span><span >序列设计引物,</span><span lang="EN-US">PCR</span><span >扩增</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因与克隆载体</span><span lang="EN-US">pMD19</span><span lang="EN-US">-</span><span lang="EN-US">T Simple</span><span >连接并测序鉴定。挑选测序正确的</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因酶切后连接到腺病毒穿梭载体上构建</span><span lang="EN-US">pAdTrack</span><span lang="EN-US">-</span><span lang="EN-US">CMV</span><span lang="EN-US">-</span><span lang="EN-US">SREBP1</span><span >表达载体,用</span><em ><span lang="EN-US">Pme</span></em><span >Ⅰ限制酶酶切线性化,然后转染到含有骨架载体</span><span lang="EN-US">pAdEasy</span><span lang="EN-US">-</span><span lang="EN-US">1</span><span >的</span><em ><span lang="EN-US">E. coli</span></em><span lang="EN-US"> BJ5183</span><span >感受态进行同源重组,得到腺病毒重组载体</span><span lang="EN-US">pAd</span><span lang="EN-US">-</span><span lang="EN-US">SREBP1</span><span >。用</span><em ><span lang="EN-US">Pac</span></em><span >Ⅰ限制酶酶切线性化</span><span lang="EN-US">pAd</span><span lang="EN-US">-</span><span lang="EN-US">SREBP1</span><span >载体并回收质粒大片段,转染</span><span lang="EN-US">293A</span><span >细胞包装病毒并扩繁提高病毒滴度,绿色荧光蛋白</span><span lang="EN-US">(GFP)</span><span >标记法测定腺病毒的滴度。本试验成功克隆了秦川牛的</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因,测序结果与</span><span lang="EN-US">GenBank</span><span >收录的牛的基因序列比较有</span><span lang="EN-US">2</span><span >处位点突变,均已排除扩增酶的保真性不高等外界因素造成的。将</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因与穿梭载体连接构建了</span><span lang="EN-US">pAdTrack</span><span lang="EN-US">-</span><span lang="EN-US">CMV</span><span lang="EN-US">-</span><span lang="EN-US">SREBP1</span><span >表达载体,并与骨架载体重组得到重组腺病毒载体</span><span lang="EN-US">pAd</span><span lang="EN-US">-</span><span lang="EN-US">SREBP1</span><span >,用</span><em ><span lang="EN-US">Pac</span></em><span >Ⅰ酶切线性化包装病毒,扩繁得到病毒滴度为</span><span lang="EN-US">1.5</span><span >×</span><span lang="EN-US">10<sup>9 </sup>GFU</span><span >·</span><span lang="EN-US">mL</span><sup><span >-</span><span lang="EN-US">1</span></sup><span >高滴度病毒。本研究成功克隆秦川牛</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因并重组成病毒重组子,包装扩繁得到高滴度腺病毒。</span></p>
DOI:10.11843/j.issn.0366-6964.2013.08.022Magsci [本文引用: 1]

<p><span >克隆秦川牛的</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因并构建重组腺病毒表达载体,包装扩繁获得高滴度病毒,拟为在细胞水平上开展基因功能的研究奠定基础。本试验以秦川牛脂肪组织为试验材料,提取总</span><span lang="EN-US">RNA</span><span >并反转得到</span><span lang="EN-US">cDNA</span><span >,以</span><span lang="EN-US">GenBank</span><span >收录的牛的</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因</span><span lang="EN-US">mRNA</span><span >序列设计引物,</span><span lang="EN-US">PCR</span><span >扩增</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因与克隆载体</span><span lang="EN-US">pMD19</span><span lang="EN-US">-</span><span lang="EN-US">T Simple</span><span >连接并测序鉴定。挑选测序正确的</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因酶切后连接到腺病毒穿梭载体上构建</span><span lang="EN-US">pAdTrack</span><span lang="EN-US">-</span><span lang="EN-US">CMV</span><span lang="EN-US">-</span><span lang="EN-US">SREBP1</span><span >表达载体,用</span><em ><span lang="EN-US">Pme</span></em><span >Ⅰ限制酶酶切线性化,然后转染到含有骨架载体</span><span lang="EN-US">pAdEasy</span><span lang="EN-US">-</span><span lang="EN-US">1</span><span >的</span><em ><span lang="EN-US">E. coli</span></em><span lang="EN-US"> BJ5183</span><span >感受态进行同源重组,得到腺病毒重组载体</span><span lang="EN-US">pAd</span><span lang="EN-US">-</span><span lang="EN-US">SREBP1</span><span >。用</span><em ><span lang="EN-US">Pac</span></em><span >Ⅰ限制酶酶切线性化</span><span lang="EN-US">pAd</span><span lang="EN-US">-</span><span lang="EN-US">SREBP1</span><span >载体并回收质粒大片段,转染</span><span lang="EN-US">293A</span><span >细胞包装病毒并扩繁提高病毒滴度,绿色荧光蛋白</span><span lang="EN-US">(GFP)</span><span >标记法测定腺病毒的滴度。本试验成功克隆了秦川牛的</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因,测序结果与</span><span lang="EN-US">GenBank</span><span >收录的牛的基因序列比较有</span><span lang="EN-US">2</span><span >处位点突变,均已排除扩增酶的保真性不高等外界因素造成的。将</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因与穿梭载体连接构建了</span><span lang="EN-US">pAdTrack</span><span lang="EN-US">-</span><span lang="EN-US">CMV</span><span lang="EN-US">-</span><span lang="EN-US">SREBP1</span><span >表达载体,并与骨架载体重组得到重组腺病毒载体</span><span lang="EN-US">pAd</span><span lang="EN-US">-</span><span lang="EN-US">SREBP1</span><span >,用</span><em ><span lang="EN-US">Pac</span></em><span >Ⅰ酶切线性化包装病毒,扩繁得到病毒滴度为</span><span lang="EN-US">1.5</span><span >×</span><span lang="EN-US">10<sup>9 </sup>GFU</span><span >·</span><span lang="EN-US">mL</span><sup><span >-</span><span lang="EN-US">1</span></sup><span >高滴度病毒。本研究成功克隆秦川牛</span><em ><span lang="EN-US">SREBP</span></em><span lang="EN-US">1</span><span >基因并重组成病毒重组子,包装扩繁得到高滴度腺病毒。</span></p>
[本文引用: 1]
DOI:10.1016/0092-8674(93)90610-3URL [本文引用: 1]
DOI:10.1111/joa.2015.227.issue-3URL [本文引用: 1]
[本文引用: 1]
DOI:10.1126/science.1114758URL [本文引用: 1]
[本文引用: 1]
DOI:10.4238/2015.October.16.23URL [本文引用: 1]
DOI:10.1038/nrg2369 [本文引用: 1]
[本文引用: 1]
DOI:10.1007/s00018-011-0629-2URL [本文引用: 1]
