 ,中国农业科学院农业资源与农业区划研究所农业农村部农业微生物资源收集保藏重点实验室,北京100081
,中国农业科学院农业资源与农业区划研究所农业农村部农业微生物资源收集保藏重点实验室,北京100081Molecular Regulation of Trichoderma harzianum ACCC32527 Response to NaCl Based on Transcriptome and Metabolome Analysis
XIANG Jie, CHEN JingShi, XIA XinXin, LIU Kuai, LI ShiGui, GU JinGang ,Key Laboratory of Microbial Resources Collection and Preservation, Ministry of Agriculture and Rural Affairs, Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081
,Key Laboratory of Microbial Resources Collection and Preservation, Ministry of Agriculture and Rural Affairs, Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081通讯作者:
责任编辑: 岳梅
收稿日期:2019-01-21接受日期:2019-03-18网络出版日期:2019-06-16
| 基金资助: |
Received:2019-01-21Accepted:2019-03-18Online:2019-06-16
作者简介 About authors
向杰,E-mail: 18801076480@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (6641KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
向杰, 陈敬师, 夏鑫鑫, 刘快, 李世贵, 顾金刚. 基于转录-代谢联合分析哈茨木霉ACCC32527 对NaCl胁迫的分子调节[J]. 中国农业科学, 2019, 52(12): 2079-2091 doi:10.3864/j.issn.0578-1752.2019.12.006
XIANG Jie, CHEN JingShi, XIA XinXin, LIU Kuai, LI ShiGui, GU JinGang.
0 引言
【研究意义】土壤盐渍化是由自然因素或人类活动引起的环境风险之一,是世界范围内农业发展所面临的严重威胁。土壤过度盐渍化不仅抑制土壤有机质的积累,改变土壤渗透势和基质潜力,土壤团聚体减少[1],还可使植物吸水困难,导致作物生长不良,病虫害发生加剧,严重阻碍农业生产[2]。研究表明,通过耐盐碱微生物作用可改善植物根际环境,减轻盐分对作物生长的抑制作用[3,4,5]。木霉菌(Trichoderma spp.)是一类能有效抑制植物病害的生防真菌,部分木霉菌株可定殖于植物根际形成共生体,一定程度上增加植物根系养分吸收利用率,促进植物生长,提高农作物产量并诱导植物增强抗逆性[6]。RAWAT等[7]从分离得到的54株Trichoderma spp.中发现,耐盐能力较强的木霉菌具有更快的产孢速度和更强的拮抗尖镰孢(Fusarium oxysporum)能力;HASHEM等[8]研究发现,接种钩状木霉(T. hamatum)能显著降低NaCl胁迫下沙漠灌木桨果木犀草(Ochradenus baccatus)叶片中丙二醛含量,进一步提高部分抗氧化酶的活力。因此,研究木霉菌对盐离子的耐受机理,对于提高木霉菌的耐盐性、提高对植物病害的防治效果和改善植物根系的微生态环境具有重要意义。【前人研究进展】高浓度盐离子胁迫下,微生物易产生渗透胁迫,并出现氧化损伤、细胞膜通透性改变、代谢活动停滞,菌落生长受到明显抑制[9,10,11]。在长期的进化过程中,微生物也形成了一定的防御机制,主要包括离子转运系统和胞内渗透调节系统等[12]。DURAN等[13]认为丝状真菌(如Aspergillus sp.)响应渗透胁迫的主要机制包括由MAPKs激活HOG(high osmolarity glycerol)通路合成甘油等渗透保护性物质、细胞骨架的重组和细胞壁再生等。哈茨木霉(T. harzianum)hog1是酿酒酵母(Saccharomyces cerevisiae)控制高渗应激反应的HOG1同源基因,沉默哈茨木霉hog1后,发现该菌对高渗环境的抵抗力降低,并对甜菜茎点霉(Phoma betae)和炭疽病菌(Colletotrichum acutatum)等植物病原菌拮抗能力下降[14]。超氧化物歧化酶(SOD)是一种能有效催化超氧化物阴离子降解的金属蛋白酶,通过农杆菌介导法向哈茨木霉导入SOD相关基因可以提高木霉对高温(40℃)和NaCl(2 mol?L-1)的耐受性[15]。棘孢木霉(T. asperellum)SOD相关编码基因敲除后,突变株在1.2 mol?L-1 NaCl胁迫下的渗透调节能力减弱,并对新月弯孢(Curvularia lunata)、拟轮枝镰孢(Fusarium verticillioides)和立枯丝核菌(Rhizoctonia solani)的拮抗能力降低[16]。【本研究切入点】微生物的耐盐机理是一个极其复杂的过程,仅通过部分抗盐相关基因的克隆与功能研究不能更好地诠释耐盐机理。多层组学的发展使微生物逆境生理研究获得更加丰富与完整的基因表达和代谢产物信息。木霉菌是生防领域中应用最广泛的真菌之一,但其在盐胁迫下的转录组和代谢组差异分析尚未见报道。本课题组前期自盐碱地中筛选得到哈茨木霉菌株ACCC32527,该菌可在8% NaCl胁迫条件下生长,并对烟草黑胫病菌(Phytophthora parasitica var. nicotianae)具有一定的防治效果[17]。【拟解决的关键问题】采用RNA-seq和GC-TOF-MS技术,对耐盐哈茨木霉ACCC32527在0(T1)、0.4 mol?L-1(T2)、0.6 mol?L-1(T3)NaCl胁迫条件下的差异转录组和次级代谢产物进行分析,筛选与耐盐机制调控相关的功能基因及次级代谢产物,为探讨木霉菌的耐盐机理提供依据。1 材料与方法
试验于2018年3—8月在中国农业微生物菌种保藏与管理重点实验室完成。1.1 材料
供试哈茨木霉菌株ACCC32527,保藏于中国农业微生物菌种保藏管理中心(ACCC)。1.2 方法
1.2.1 NaCl胁迫处理 无菌水收集PDA平板上ACCC32527孢子,并稀释至1.0×106孢子/mL,按1%接种量分别接种于含0、0.2、0.4、0.6 mol?L-1 NaCl液体培养基(葡萄糖40 g?L-1、蛋白胨20 g?L-1、K2HPO4?3H2O 8 g?L-1、MgSO4?7H2O 2.5 g?L-1),28℃、180 r/min避光连续培养。培养4 d后,用8层纱布过滤,ddH2O洗涤收集菌丝,冻干并称重。参照DNS法[18]分别检测培养结束后发酵液中葡萄糖剩余量,计算形成单位质量菌丝量所消耗的葡萄糖量,葡萄糖利用量(g/生物量)=(对照液葡萄糖含量-发酵液葡萄糖含量)/生物量。每组样品3个生物学重复。1.2.2 NaCl胁迫下ACCC32527转录差异分析 cDNA文库构建及测序:收集的各组样品委托北京百迈客生物科技有限公司进行后续处理,包括使用Trizol法提取样本总RNA,EBNext?UltraTM RNA Library Prep Kit试剂盒完成cDNA文库构建,并使用Illumina HiseqXTen高通量测序平台对cDNA文库进行测序。每组样品3个生物学重复。
基因注释和表达定量分析:使用Illumina HiseqXTen测序平台对各样品cDNA文库进行测序,得到原始数据(Raw Data),对Raw Data进行过滤,去除其中的接头序列及低质量序列得到Clean Data。通过Trinity软件对Clean Data进行组装,获得ACCC32527的unigene库。使用BLAST软件将unigene序列与NR、Swiss-Prot、GO、COG、KOG、eggNOG4.5和KEGG数据库比对,使用KOBAS2.0得到unigene在KEGG(Kyoto Encyclopedia of Genes and Genomes)中的KEGG Orthology分析结果,预测完unigene的氨基酸序列之后使用HMMER软件与Pfam数据库比对,获得unigene的注释信息。采用Bowtie将测序得到的序列与unigene库进行比对,根据比对结果,结合RSEM软件进行表达量水平估计。利用FPKM(每百万Reads中来自比对到某一基因每千碱基长度的Reads数目)值表示对应unigene的表达丰度。
差异表达基因(DEG)筛选:T1、T2、T3样品间DEG定量分析通过DEseq2完成。在筛选过程中,采用Benjamini-Hochberg方法对原有假设检验得到的显著性P值(P-value)进行校正,并最终得到校正后的P值,即FDR(false discovery rate,错误发生率),作为DEG筛选的关键指标。将得到的FDR<0.01且差异倍数FC(fold change,两样品间表达量的比值)≥2作为筛选标准。
1.2.3 NaCl胁迫下ACCC32527差异代谢组分析 样品准备:取冻干后菌体样本(50±1)mg置于2 mL EP管中,加入450 μL提取液(甲醇﹕氯仿=3﹕1),再加入10 μL L-2-氯苯丙氨酸,涡旋30 s;加入瓷珠,45 Hz研磨仪处理4 min,超声5 min(冰浴),重复3次;将样本4℃,12 000 r/min离心15 min;移取350 μL上清液于1.5 mL EP管中;在真空浓缩器中干燥提取物;向干燥后的代谢物加入60 μL甲氧胺盐试剂(甲氧胺盐酸盐溶于吡啶20 mg?mL-1),轻轻混匀后,放入烘箱中80℃孵育30 min;向每个样品中加入80 μL BSTFA(含有1% TMCS,v/v),将混合物70℃孵育1.5 h;准备上机检测。每组样品3个生物学重复。
数据处理:使用LECO-Fiehn Rtx5数据库对质谱数据进行匹配,采取将student’s t-test的P值和OPLS-DA模型的VIP值相结合的方法来筛选差异代谢物,筛选的标准为P-value≤0.05,VIP>1。
1.2.4 实时荧光定量PCR(RT-qPCR) 为检测转录组数据的准确性,从NaCl胁迫下DEG中选取7个差异表达显著的基因,用Primer 5.0设计引物(表1)。使用PrimeScriptTM 1st strand cDNA Synthesis Kit反转录试剂盒合成cDNA模板。以cDNA链为模板,UCE(泛素结合酶)为内参基因[19],使用TB GreenTM Premix EX TaqTM荧光定量试剂盒、QuantStudioTM real-time PCR软件(Applied Biosystems公司)进行荧光定量检测,采用-ΔΔCt法计算相对表达量,每个样品3个生物学重复。
Table 1
表1
表1RT-qPCR验证基因及引物设计
Table 1
| 基因ID Gene ID | 引物序列Primer sequence (5′→3′) |
|---|---|
| c55075.graph_c0 | F-5′ ATTCCCGTCTTAGGGTTCG 3′; R-5′ TGTTGGCTGCTACGCTTT 3′ |
| c56173.graph_c0 | F-5′ CCAGCCTTCCTTCTCCTC 3′; R-5′ ATGGTGCCACAGTCTATTCC 3′ |
| c44870.graph_c0 | F-5′ TGCTGAAGCGTGAGGTTG 3′; R-5′ AAGCCCGAGTCTTGTTGC 3′ |
| c57043.graph_c0 | F-5′ ATTGGCAGGTAGAGTCGT 3′; R-5′ TCATTGATAAACTGGTCCTT 3′ |
| c60715.graph_c3 | F-5′ GCGGGAAATCTGCCTTAG 3′; R-5′ GCTGGGTGACGCATAGCT 3′ |
| c60689.graph_c1 | F-5′ TACGACCAAACGAGTGCG 3′; R-5' GGCGTCAAGCAGGTGTCT 3′ |
| c55738.graph_c0 | F-5′ CTGCCGATTGTTCCGTAT 3′; R-5' GCTTATTAGCCAAGTTGTTTCT 3′ |
| UCE | F-5′ GTGGCGGCAGCACTTGTTAT 3′; R-5'ATGACGAACGAAAAGCACCG 3′ |
新窗口打开|下载CSV
2 结果
2.1 NaCl胁迫对ACCC32527生物量的影响
不同浓度NaCl胁迫对哈茨木霉ACCC32527生物量的影响如图1所示,0.2、0.4、0.6 mol?L-1 NaCl胁迫对ACCC32527生长抑制率分别为5.66%、24.08%和47.24%。其中,0.4、0.6 mol?L-1 NaCl胁迫下,ACCC32527单位质量生物量消耗的葡萄糖分别为4.61 g和4.65 g,分别较对照提高32.84%和34.16%。2.2 NaCl胁迫下ACCC32527差异转录组分析
2.2.1 差异基因共表达趋势分析及GO功能注释 经筛选,从T1 vs T2比较组中共获得637个差异表达基因(DEG),包括389个上调表达基因和248个下调表达基因;从T1 vs T3比较组中共获得1 570个DEG,包括900个上调表达基因和670个下调表达基因。为观察DEG在不同处理下各样品表达量变化,根据log2 (FPKM+1)值进行DEG共表达趋势分析。趋势分析结果显示,1 921个DEG共聚类为16种基因表达模式,其中950个DEG共聚类为9种基因持续上调表达模式(图2-A—C、2-E、2-G—H、2-J—L),662个DEG共聚类为3种基因持续下调表达模式(图2-F、2-I、2-P),309个DEG共聚类为4种不规则表达模式(图2-D、2-M—O)。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2差异表达基因GO分类
Fig. 2Go classification of DEGs
对16种表达模式的基因分别进行GO功能注释,共包括分子功能、细胞组分和生物学进程3个基本分类和42个小类(图2)。16种表达模式所包含基因共有的功能分类是催化活性、结合、细胞器、细胞膜部分、细胞膜、细胞部分、细胞、单组织过程和代谢过程,且占主要比例,约为61%—94%,说明这9种功能分类所涉及的基因主要响应ACCC32527的胁迫应答过程。除此之外,每个趋势图基因还包含转运活性和生物调节等几个甚至几十个功能小类。
2.2.2 KEGG代谢通路分析 KEGG通路数据库包含了各生物通路中分子相互作用网络和生物体所特有的变化形式,从而确定蛋白质参与的最重要的信号转导通路和生化代谢通路。T2、T3处理下ACCC32527差异表达基因KEGG通路分析表明,分别有225和535个差异基因富集于20条KEGG通路,主要包括真菌核糖体生物合成、嘌呤代谢、嘧啶代谢和剪切体等(图3)。其中,分别有12和19个基因极显著(Correct P-valueT1vsT2=1.9×10-4,P-valueT1vsT3=1.6×10-5)富集于真菌核糖体生物合成途径。T2处理下,该通路共有12个核糖体蛋白相关基因差异表达下调;T3处理下,共有DKC1、NHP2、UTP15等18个核糖体蛋白相关基因下调和CK2A蛋白相关编码基因表达上调。
图3
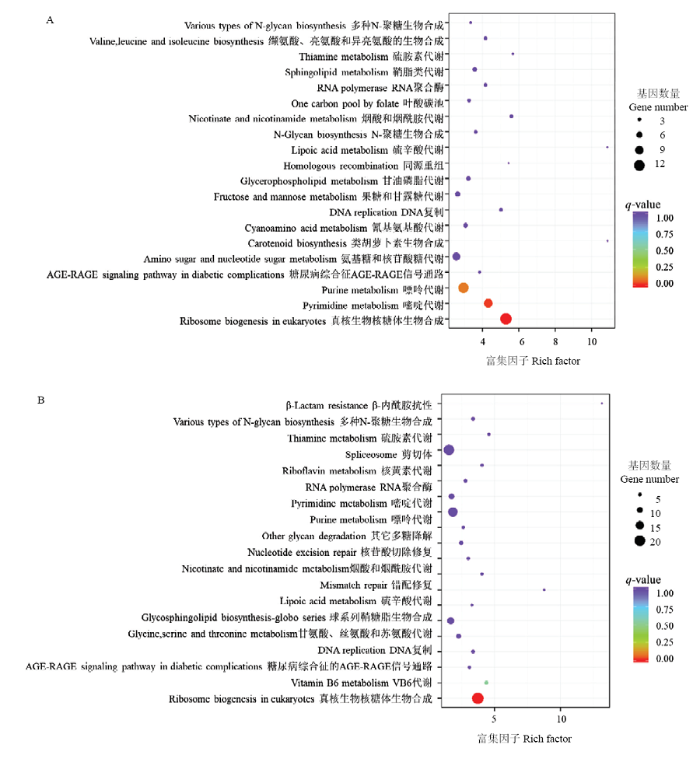 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3差异表达基因KEGG通路富集
A: T1 vs T2; B: T1 vs T3
Fig. 3Enriched KEGG terms of DEGs
2.2.3 NaCl对ACCC32527抗逆相关基因的影响 与T1相比,T2或T3处理下ACCC32527大量氧化还原蛋白发生差异表达,包括8个过氧化物酶、1个谷胱甘肽过氧化物酶、26个单加氧酶、5个过氧化氢酶和4个硫还原蛋白等,且多数为上调表达。另外,共发现有11个ABC转运蛋白相关基因发生差异表达,其中8个基因上调表达,3个基因下调表达。本研究检测到1个编码真菌classⅡ疏水蛋白基因(c60770.graph_c0)在T2和T3处理下表达量均发生上调。离子转运方面,筛选得到1个上调表达的Na+/K+-ATPase合成相关基因(图4)。
图4
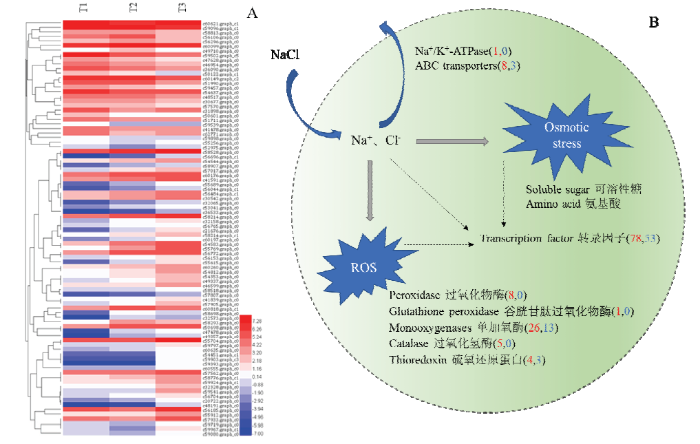 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4推测哈茨木霉ACCC32527耐盐机理
A:抗氧化酶相关基因聚类分析Cluster analysis of antioxidative enzyme-related gene;B:推测ACCC32527抗逆相关机制。红色数字代表上调基因数目,蓝色数字代表下调基因数目Diagram of ACCC32527 resistance to NaCl. The red numbers represent up-regulated genes’ number, and the blue numbers represent down-regulated genes’ number
Fig. 4Speculated mechanism of T. harzianum ACCC32527 resistance to NaCl
2.3 代谢组分析
2.3.1 偏最小二乘法判别分析 为从各样品中检测并筛选出具有重要生物学意义和统计显著差异的代谢物,并以此为基础阐明NaCl胁迫下ACCC32527的代谢变化机制,分别对T1、T2、T3处理后样品进行转录组学分析。基于GC-TOF-MS数据对T1、T2和T3各样品数据进行偏最小二乘法判别分析(partial least square method-discrimination analysis,PLS-DA)。本试验中R2X、R2Y>0.6,且Q2>0.3,T1和T3组内聚类效果较好,组间差异明显,但T2处理下3个样品散点分散,重复性较差,与T1、T3组间差距较小(图5)。因此,将重点分析T1和T3的差异代谢产物。图5
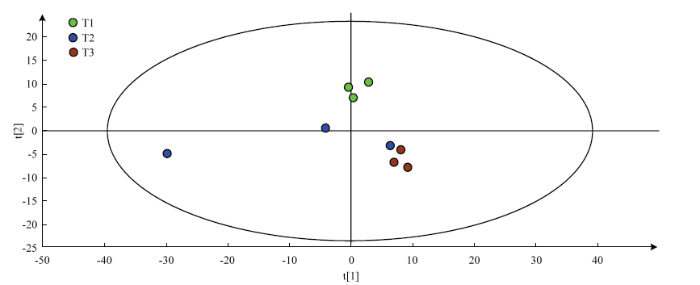 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5各样本PLS-DA得分图
Fig. 5PLS-DA score map of samples
2.3.2 差异代谢产物筛选及注释 以VIP>1,P-value≤0.05作为筛选标准,共得到336种代谢产物信息。与T1相比,T3处理后ACCC32527累积量增加的代谢产物有30种,减少的代谢产物有53种,而253个代谢产物含量保持不变。
在83种差异物质中,只有34种物质能够在LECO-Fiehn Rtx5数据库中找到匹配物质(表2),主要包括以下几类:(1)氨基酸及其衍生物,如天冬氨酸和N-甲酰-L-蛋氨酸;(2)糖类及其衍生物,如赤藓糖和葡萄糖-1-磷酸;(3)脂肪酸,如豆蔻酸和花生四烯酸;(4)有机酸,如柠檬酸和马来酸;(5)醇类,如丙三醇和丁三醇;(6)核酸及其衍生物,如2-脱氧尿苷和尿嘧啶。盐胁迫下,真菌普遍利用的渗透调节物质包括多元醇、糖类和部分氨基酸及其衍生物。在累积量上调的差异代谢物中,发现10种含量上调的氨基酸,包括L-组氨酸甜菜碱、酪氨酸和鸟氨酸等。甘油是丝状真菌和酵母菌的重要渗透保护物质,T3处理下ACCC32527胞内甘油累积量发生上调(FC=1.504),维持胞内渗透平衡。
Table 2
表2
表2哈茨木霉ACCC32527差异代谢产物
Table 2
| Category 种类 | 分析物 Analyte | 保留时间RT (min) | log2 FC | P-value | VIP | Regulated |
|---|---|---|---|---|---|---|
| 氨基酸及其衍生物Amino acids and their derivatives | 天冬氨酸Aspartic acid | 13.568 | 0.6834 | 0.0247 | 1.3218 | Up |
| 谷氨酸Glutamic acid | 14.744 | 1.2283 | 0.0017 | 1.5026 | Up | |
| 谷氨酸盐Glutamine | 16.503 | 3.2743 | 0.0443 | 1.4131 | Up | |
| 异亮氨酸Isoleucine | 10.588 | 1.1547 | 0.0232 | 1.3751 | Up | |
| 蛋氨酸Methionine | 13.578 | 0.9800 | 0.0227 | 1.3712 | Up | |
| N-甲酰-L-蛋氨酸N-formyl-L-methionine | 15.729 | -0.4150 | 0.0463 | 1.3166 | Down | |
| 羟脯胺酸Oxoproline | 13.649 | 0.6648 | 0.0402 | 1.3251 | Up | |
| 鸟氨酸Ornithine | 16.915 | 1.2580 | 0.0489 | 1.3506 | Up | |
| 酪氨酸Tyrosine | 18.255 | 1.3905 | 0.0027 | 1.4861 | Up | |
| 苯基丙氨酸Phenylalanine | 14.860 | 0.8506 | 0.0268 | 1.3273 | Up | |
| L-组氨酸甜菜碱N(alpha), N(alpha)-dimethyl-L-histidine | 17.136 | 1.2927 | 0.0064 | 1.4160 | Up | |
| 糖类及其衍生物 Sugars and their derivatives | 赤藓糖Erythrose | 12.687 | -0.6572 | 0.0008 | 1.5139 | Down |
| 塔格糖Tagatose | 17.197 | 1.1699 | 0.0181 | 1.4103 | Up | |
| 6-脱氧-D-葡萄糖6-deoxy-D-glucose | 16.175 | 2.1378 | 0.0091 | 1.4189 | Up | |
| 葡萄糖-1-磷酸Glucose-1-phosphate | 16.379 | 0.9139 | 0.0438 | 1.2903 | Up | |
| 葡萄糖-6-磷酸Glucose-6-phosphate | 21.850 | -1.6865 | 0.0154 | 1.4795 | Down | |
| 脂肪酸 Fatty acid | 豆蔻酸Myristic acid | 17.327 | 2.6436 | 0.0109 | 1.5117 | Up |
| 花生四烯酸Arachidonic acid | 22.200 | -1.9118 | 0.0413 | 1.3907 | Down | |
| 有机酸 Organic acid | 柠檬酸Citric acid | 9.8766 | -0.7485 | 0.0009 | 1.5087 | Down |
| 马来酸Maleic acid | 10.698 | -0.4605 | 0.0464 | 1.2939 | Down | |
| 3-羟丁酸3-hydroxybutyric acid | 8.7102 | -1.5905 | 0.0214 | 1.4670 | Down | |
| 3-羟基-3-甲基戊二酸3-hydroxy-3-methylglutaric acid | 14.526 | -1.2892 | 0.0037 | 1.5065 | Down | |
| 3-邻羟基苯乙酸3-hydroxyphenylacetic acid | 14.727 | -1.1634 | 0.0010 | 1.5084 | Down | |
| β-甘露糖基甘油酸β-mannosylglycerate | 20.685 | 2.0396 | 0.0442 | 1.3879 | Up | |
| 莽草酸Shikimic acid | 16.753 | 1.9183 | 0.0215 | 1.4382 | Up | |
| 醇类 Alcohol | 丙三醇Glycerol | 10.320 | 0.5890 | 0.0249 | 1.3618 | Up |
| 丁三醇2-deoxyerythritol | 10.509 | -0.5241 | 0.0464 | 1.2975 | Down | |
| 核酸及其衍生物Nucleic acids and their derivatives | 2-脱氧尿苷2-deoxyuridine | 10.419 | -0.8792 | 0.0008 | 1.5304 | Down |
| 尿嘧啶Uracil | 11.224 | 1.9685 | 0.0212 | 1.4209 | Up | |
| 胞苷-1-磷酸Cytidine-monophosphate | 18.965 | -0.6101 | 0.0481 | 1.2821 | Down | |
| 其他 Others | 2-羟基莠去津Atrazine-2-hydroxy | 17.975 | 2.6033 | 0.0285 | 1.3645 | Up |
| N-环已基甲酰胺N-cyclohexylformamide | 10.544 | -0.4960 | 0.0233 | 1.4012 | Down | |
| 21-羟基孕烯醇酮21-hydroxypregnenolone | 27.105 | -1.8590 | 0.0395 | 1.3045 | Down | |
| 1,2,4-苯三酚1,2,4-benzenetriol | 14.634 | -1.0837 | 0.0006 | 1.5169 | Down |
新窗口打开|下载CSV
2.3.3 差异代谢物KEGG通路富集分析 对T1和T3组的差异表达代谢物进行KEGG通路富集分析,主要涉及的通路包括代谢、遗传信息过程和环境信息过程3类,包括代谢途径、抗生素的合成、次级代谢产物的合成、ABC转运蛋白和氨基酸的生物合成等40个通路发生变化。其中,有85%的通路中的差异代谢产物以累积量上调为主,下调的代谢产物集中在酪氨酸代谢和代谢通路(图6)。
图6
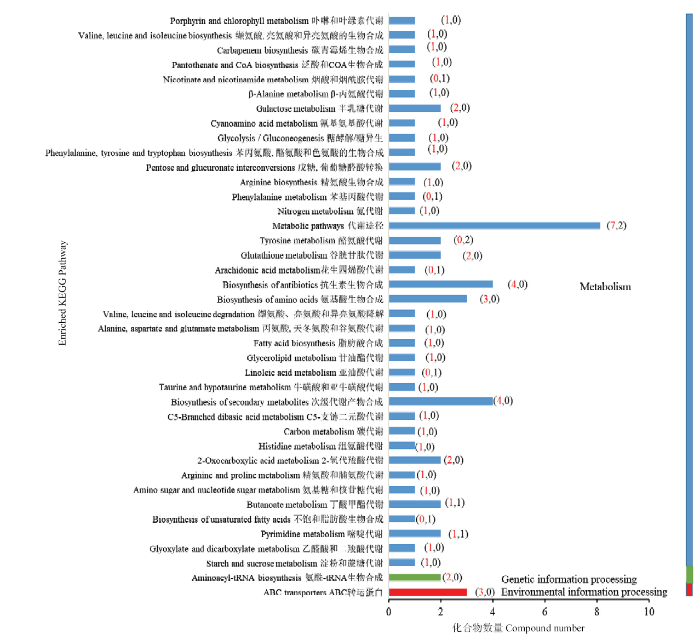 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6KEGG富集柱状图
红色数字代表累积上调的代谢产物数量,黑色数字代表累积下调的代谢产物数量
Fig. 6Enriched column map of KEGG
The red numbers represent the cumulative up-regulated metabolites, and the black numbers represent the cumulative down-regulated metabolites
2.4 RT-qPCR验证
为验证RNA-seq数据的准确性,从T3处理下的DEG中随机选取7个差异表达显著的基因,包括3个上调表达基因和4个下调表达基因,设计引物并利用RT-qPCR进行对照组和NaCl胁迫下基因的表达量变化分析。DEG的RT-qPCR结果与转录组测序的结果在基因表达幅度上有一定的差异,但基因的表达趋势一致(图7),说明转录组测序的结果是可信的。图7
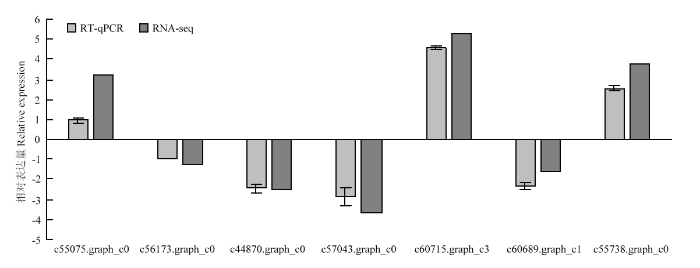 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7差异表达基因的RT-qPCR验证
Fig. 7Quantitative real-time PCR validation of relative expression levels of DEGs
3 讨论
多层组学技术的发展使对环境胁迫下的细胞抗逆生理研究从生理代谢和形态结构适应的层面发展到细胞的内在适应机制及大分子物质网络互作、转录水平和翻译水平调控的分子层面上来[20]。为深入了解盐胁迫下木霉的分子调控机制,本研究对不同NaCl胁迫浓度下的耐盐哈茨木霉ACCC32527进行转录和代谢差异分析,共获得44 594条unigene和336个代谢产物信息,通过与GO、COG、KEGG、Swiss-Prot、NR等数据库比对,发现多条与盐胁迫相关的功能基因及代谢产物。T2和T3处理下的DEG通过共表达趋势分析,获得1 921个DEG的16种基因表达模式,基因的GO功能注释表明,NaCl对细胞的影响主要集中在催化、结合、细胞器、细胞膜、细胞膜部分、细胞和细胞部分,但上调、下调或不规则变化趋势基因在主要GO功能分类上并无明显差异,表明每部分功能区域所涉及的基因并非全部积极响应NaCl胁迫,而是其中一部分基因发生上调或下调表达变化。
由于盐离子的毒性作用,使细胞产生大量ROS,ROS造成的氧化损伤是破坏生物大分子结构和细胞稳态的重要因素[21]。核糖体RNA(rRNA)是细胞内含量最多的一类RNA,约占RNA总量的80%,更易遭受ROS的攻击,形成稳定的氧化基损伤[22]。有研究表明,环境胁迫下细胞核糖体的生物合成受到明显抑制,如LI等[23]研究TDCPP(磷酸三(1,3-二氯-2-丙基)酯)对低等生物毒性试验时发现,TDCPP能够抑制四膜虫(Tetrahymena Thermophila)21个核糖体蛋白编码基因,并猜测该基因是TDCPP作用的靶标基因;HASE等[24]发现E. coli核糖体成熟因子(RsgA、RbfA、RimM和RrmJ)或核糖体蛋白S6的缺失可以提高细胞的耐盐能力,外源添加翻译抑制剂,如春雷霉素和氯霉素也可以提高细胞的抗逆特性,因此推断E. coli极可能存在一条由核糖体调节的应急响应通路。本研究中,T2和T3处理下分别有12和18个下调表达基因极显著富集于核糖体生物合成通路中,表明NaCl胁迫下ACCC32527核糖体合成受到明显抑制,该现象是否与细胞的耐盐能力相关,目前仍未可知。
根据葡萄糖利用情况和转录组数据可知,NaCl胁迫下ACCC32527对氨基酸、糖类和脂类代谢能力加强。高浓度NaCl(T3)胁迫下,氨基酸代谢相关上调基因比例下降7%,但对糖类和脂类的代谢分别上调3%和9%。细胞膜的基本结构是磷脂双分子层,与脂类的代谢密不可分,T3处理下,筛选到一个编码溶血磷脂酰乙醇胺酰基转移酶(lysophosphatidylethanolamine acyltransferase,LPEAT)(log2 FC=1.01),该蛋白在细胞膜脂肪酸组成的不对称性和多样性以及三酰甘油(TAG)中长链多不饱和脂肪酸(PUFA)等特殊脂肪酸的引入、改变细胞膜的通透性中起着非常重要的作用[25]。另外,甘油激酶能够催化甘油生成3-磷酸甘油,与胞内甘油的积累密切相关。T3处理下ACCC32527编码甘油激酶合成的两个相关基因均发生下调表达,代谢组数据表明胞内甘油含量上升,可能与细胞累积甘油作为渗透调节物质有关。
微生物的耐盐机制研究主要集中在:(1)离子转运系统;(2)活性氧清除系统;(3)细胞渗透调节系统;(4)细胞壁结构。这些机制共同作用使细胞能在高盐环境下生存[12],如Synechocystis sp. PCC 6803编码K+通道蛋白相关基因(kdpA、ntpJ)的敲除降低细胞对NaCl的耐受性[26];TEJERA等[27]研究发现,25 mmol?L-1 NaCl胁迫下,根瘤菌HB10 SOD活性提高40%—70%,50 mmol?L-1 NaCl胁迫下,根瘤菌HB12和HB13 SOD活性提高200%;高盐环境下,MEENA等[28]发现不动杆菌(Acinetobacter baylyi)能通过提高胞内甘露醇和谷氨酸含量来平衡细胞渗透压,并发现一个受高盐诱导,参与甘露醇合成的甘露醇-1-磷酸脱氢酶基因(mltD)。NaCl胁迫下,ACCC32527差异表达基因中筛选到60个氧化还原蛋白基因,其中54个为上调表达基因,包括过氧化物酶、谷胱甘肽过氧化物酶、单加氧酶、过氧化氢酶和硫还原蛋白,参与胞内活性氧的清除。离子转运调节方面,筛选得到1个上调表达Na+/K+-ATPase相关基因和8个上调表达的ABC转运蛋白,维持胞内盐离子的平衡,调节渗透压。几丁质是真菌细胞壁的重要组分之一,在真菌抵御渗透压、机械力和重金属等胁迫中起到关键作用[29]。KUNCIC等[30]指出细胞壁增厚是真菌Wallemia ichthyophaga在极端高盐环境下生存的重要机制。木霉几丁质酶在自身细胞壁的重塑及循环过程中起着极其重要的作用[31]。NaCl胁迫下,ACCC32527共有9个几丁质酶合成相关基因发生差异表达,且8个基因为上调表达。因此,推测NaCl胁迫条件下细胞壁几丁质的降解十分活跃,可能与细胞壁的重塑、再生与加厚密切相关。王丽荣等[19]在0.6 mmol?L-1 Cu2+胁迫下哈茨木霉Th-33差异表达基因中筛选发现5个上调表达和3个下调表达的几丁质酶合成相关基因,并推测是因为Cu2+促进了细胞壁不同几丁质间的合成与转化,以维持细胞壁的稳定性。疏水蛋白是细胞壁的延伸结构,是细胞壁外层的一类小分子蛋白,覆盖在真菌表面,能够保护真菌抵御恶劣环境[32,33]。本研究中仅检测到1个上调表达的Ⅱ型疏水蛋白编码基因,可能一方面形成的疏水表面有利于营养菌丝的生长和孢子扩散,另一方面与细胞壁中的几丁质β-1,3/1,6-糖苷键结合,保护细胞壁结构的完整性。
微生物在外部压力下会导致基因表达和蛋白质产生的变化,这两种变化都受到胞内各种稳态控制和反馈机制的影响,这些变化在代谢组的水平上被放大。代谢组学反应的是生物体内小分子物质的含量变化,如氨基酸、有机酸、单糖等,是对转录组结果的有效补充[34]。T3处理下,共检测到ACCC32527胞内83种代谢产物含量发生变化,这些物质一部分作为代谢网络的中间产物,参与细胞生长调节;另一部分为细胞合成的胁迫响应物质,作为渗透调节物质,维持胞内渗透压稳定,增强菌体耐盐能力。在差异的代谢产物中,只有34种物质能在LECO-Fiehn Rtx5得到注释,其中氨基酸及其衍生物变化最为明显,且含量多为上升,包括谷氨酸、谷氨酸盐和酪氨酸等。葡萄糖-6-磷酸是各个糖代谢途径的交叉点,可以进一步在磷酸葡萄糖变位酶作用下产生葡萄糖-1-磷酸。葡萄糖-1-磷酸是细胞内低聚糖和多聚糖通过底物磷酸化降解的产物,在合成代谢中是糖原和核苷酸合成的前体[35]。T3处理下,葡萄糖-6-磷酸含量下降而葡萄糖-1-磷酸含量上升,表明ACCC32527在NaCl胁迫下可能加速糖原的合成,为细胞储存能源和碳源。6-脱氧-D-葡萄糖作为葡萄糖类似物,通过在细胞内大量积累可以抑制糖酵解作用[36]。NaCl胁迫下,ACCC32527的6-脱氧-D-葡萄糖的含量上升,结合转录组数据,可能意味着糖酵解途径受到抑制而磷酸戊糖途径等其他途径得到加强。
此外,本研究仍有近50%差异表达基因被注释为假定蛋白和约59%未知的差异小分子代谢产物,表明在NaCl胁迫下,存在许多未知的基因及代谢产物待挖掘。
4 结论
通过转录组分析获得T1 vs T2比较组中637个DEG、T1 vs T3比较组中1 570个DEG和T1 vs T3比较组中的336种差异代谢产物。T2或T3处理下,哈茨木霉ACCC32527核糖体合成途径受到明显抑制,而抗氧化酶、转运蛋白及胞外结构相关基因多数发生上调表达。结合代谢转录组及代谢组数据,发现甘油在胞内累积量上升,推测可能参与胞内的渗透调节。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1007/s12517-014-1514-8URL [本文引用: 1]
[本文引用: 1]
DOI:10.1111/plb.12173URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
Del.)
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1071/FP12355URL [本文引用: 2]
DOI:10.3390/toxins2040367URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 2]
URL [本文引用: 2]
[本文引用: 1]
DOI:10.1111/tpj.2017.90.issue-5URL [本文引用: 1]
DOI:10.1093/nar/gkx1308URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/mmi.2007.66.issue-2URL [本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.chemosphere.2016.01.091URL [本文引用: 1]
DOI:10.7506/spkx1002-6630-201611049URLMagsci [本文引用: 1]

<p>代谢组学是系统生物学的重要研究领域,具有独特的优势。近年来,微生物代谢组学这一新兴领域已受到广泛的关注,它不仅提供了代谢途径的广阔图谱,而且还阐明了微生物与宿主之间的相互作用机制。本文主要阐述了微生物代谢组学研究过程中样品制备、代谢物分析鉴定以及数据分析等主要研究方法,介绍了微生物代谢组学在乳酸菌、肠道菌群、病原菌以及食品和营养学研究领域中的研究进展及其应用,并讨论了微生物代谢组学中的主要问题和发展趋势。</p>
DOI:10.7506/spkx1002-6630-201611049URLMagsci [本文引用: 1]

<p>代谢组学是系统生物学的重要研究领域,具有独特的优势。近年来,微生物代谢组学这一新兴领域已受到广泛的关注,它不仅提供了代谢途径的广阔图谱,而且还阐明了微生物与宿主之间的相互作用机制。本文主要阐述了微生物代谢组学研究过程中样品制备、代谢物分析鉴定以及数据分析等主要研究方法,介绍了微生物代谢组学在乳酸菌、肠道菌群、病原菌以及食品和营养学研究领域中的研究进展及其应用,并讨论了微生物代谢组学中的主要问题和发展趋势。</p>
[本文引用: 1]
[本文引用: 1]
