 ,11
,11 2
3
Expression of p66Shc and Its Relationship with Cytoplasmic Redox Homeostasis in Sheep Oocytes
ZHANG Tong1,2, LI RuiLan1,2, FAN XiaoMei1,3, LIU ChunJie1, HAI RiHan1, HUO Min1, ZHANG JiaXin ,1
,1通讯作者:
责任编辑: 林鉴非
接受日期:2019-04-17网络出版日期:2019-06-16
| 基金资助: |
Accepted:2019-04-17Online:2019-06-16
作者简介 About authors
张通,Tel:13363420309;E-mail: imauzt@126.com。

摘要
关键词:
Abstract
Keywords:
PDF (1364KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
张通, 栗瑞兰, 范晓梅, 刘春洁, 海日汗, 霍敏, 张家新. p66Shc在绵羊卵母细胞中的表达及其与胞质氧化还原稳态的关系[J]. 中国农业科学, 2019, 52(12): 2183-2192 doi:10.3864/j.issn.0578-1752.2019.12.015
ZHANG Tong, LI RuiLan, FAN XiaoMei, LIU ChunJie, HAI RiHan, HUO Min, ZHANG JiaXin.
0 引言
【研究意义】哺乳动物胚胎体外生产效率低,很大程度上与卵母细胞和胚胎暴露于不利的体外培养环境中造成的氧化应激有关[1,2]。哺乳动物卵母细胞胞质氧化还原稳态失衡是影响卵母细胞体外成熟质量以及胚胎发育潜能的关键因素。近年的研究表明,原癌基因SHC编码的亚型66KD线粒体氧化应激蛋白(p66Shc)及其信号特性在调控细胞氧化应激、细胞凋亡和机体衰老过程中发挥了重要作用[3,4]。因此,如果能从卵母细胞入手,研究p66Shc基因调控卵母细胞线粒体氧化还原代谢机制,从基因角度探究改善胚胎抗氧化应激能力的方法,从基因角度改善胚胎抗氧化应激能力,这对于优化家畜胚胎体外生产体系和提升人类辅助生殖技术水平具有重要的理论意义和现实意义。【前人研究进展】p66Shc作为少数确定的哺乳动物氧化应激调控基因之一。在小鼠模型中发现,p66Shc基因缺失突变体能增强细胞对活性氧类物质的抗性并延长机体寿命[5],还能抵制年龄相关的疾病,如动脉粥样硬化[6],内皮紊乱[7],糖尿病依赖性肾小球病[8]和乙醇诱导的肝病[9]等。哺乳动物卵母细胞和胚胎体外发育迟缓、阻滞很大程度上是由氧化应激引起胞质氧化还原稳态失衡所导致。有报道表明哺乳动物早期胚胎发育阻滞与线粒体氧化应激蛋白p66Shc的表达有关[10,11,12]。REN等[13]表明,砷可以显著诱导小鼠2-cell早期胚胎的发育阻滞和线粒体氧化应激蛋白p66Shc的表达上调。通过显微注射p66Shc的siRNA到小鼠的受精卵原核,结果导致p66Shc mRNA和蛋白水平以及活性氧水平的显著下降,从而使砷诱导的2-cell阻滞减少,同时桑椹胚发育率得到提高。此外,BETTS等[14]在牛合子阶段同样利用p66Shc RNA干扰技术,数据表明p66Shc敲除的胚胎表现出细胞内ROS水平降低、DNA损伤减少、锰过氧化物歧化酶(MnSOD)表达水平升高,胚胎发育至囊胚阶段的比例升高。上述结果表明p66Shc敲除能够显著增加胚胎的氧化应激抗性改善体外胚胎的发育能力。【本研究切入点】哺乳动物卵母细胞胞质氧化还原稳态的维持对于卵母细胞成熟质量以及发育能力的获得至关重要。p66Shc作为细胞内氧化还原稳态调控的重要感受蛋白,开展探究p66Shc对绵羊卵母细胞胞质氧化还原稳态调控的分子机制具有重要意义。但迄今报道关于p66Shc在哺乳动物卵母细胞中的表达及其对氧化应激反应调控的文献较少。【拟解决的关键问题】本研究比较分析了成熟前后不同质量卵母细胞中p66Shc mRNA和蛋白的表达规律、线粒体分布与活性、ROS水平以及氧化还原稳态,为进一步研究p66Shc调控绵羊卵母细胞氧化还原机制以及p66Shc的功能提供重要的理论参考。1 材料与方法
试验于2017年在内蒙古农业大学动物遗传育种与繁殖重点实验室完成。1.1 试剂与药品
TCM-199培养液,含Ca2+、Mg2+磷酸盐缓冲液(Dulbecco's Phosphate-Buffered Saline, DPBS),青链霉素合剂(Penicillin-Streptomycin, PS)均为Gibco公司产品;促卵泡生成素(FSH)、促黄体生成素(LH)购自Bioniche公司;雌二醇(E2)、胎牛血清(FBS)、透明质酸酶(Hya)、牛血清白蛋白(BSA)、聚乙烯醇(PVA)、半胱胺均购自Sigma公司;p66Shc兔源一抗和Alexa 488标记的山羊抗兔的二抗均购自Proteintech公司,MitoTracker? Red CMXRos购自Invitrogen公司;活性氧检测试剂盒购自Beyotime公司。1.2 试验方法
1.2.1 卵母细胞的采集与体外成熟 试验所用绵羊卵巢来源于呼和浩特屠宰场,用添加有青链霉素的灭菌生理盐水清洗卵巢3次,然后放入37℃水浴锅内保温。从卵巢表面抽取直径为3—6 mm的卵泡,在体视显微镜下挑选卵母细胞。根据卵母细胞质均匀程度、卵丘细胞形态及其与卵母细胞结合的紧密程度分为优质和劣质卵母细胞,优质(high quality, HQ)卵母细胞:形状规则、胞质均匀、色泽一致、卵丘细胞层包裹紧密完整(图1-a);劣质(poor quality, PQ)卵母细胞:形状规则,胞质不均、色泽不一,卵丘细胞包裹不完整(图1-b)。选用优质卵母细胞用于体外成熟,分为常规24 h成熟组 (图1-c) 和成熟30 h老化组 (图1-d)。成熟培养液为:TCM-199+10% (v:v) FBS+1% (v:v) PS + 10 μg·mL-1 FSH +10 μg·mL-1 LH + 1 μg·mL-1E2 +100 nmol·L-1半胱胺。1.2.2 实时荧光定量PCR 分别收集成熟前优质卵母细胞、劣质卵母细胞、常规成熟24 h卵母细胞、老化组的卵母细胞,每组样品收集卵母细胞数为50枚。按照RNeasy Mini kit (Qiagen)微量样品总RNA提取试剂盒提取卵母细胞的总RNA,用Takara反转录试剂盒合成cDNA,并将所得cDNA置于-80℃保存备用。根据GenBank查找绵羊的p66Shc序列和β-actin序列,利用Primer 5.0设计引物,引物序列见表1,由上海生工合成,以反转录得到的cDNA作为模板,以SYBR为荧光染料,用Takara公司的SYBR Premix Ex Taq Ⅱ进行荧光定量PCR扩增,每组试验重复3次。以β-actin为内参,根据2-ΔΔCt计算p66Shc相对表达量。
图1
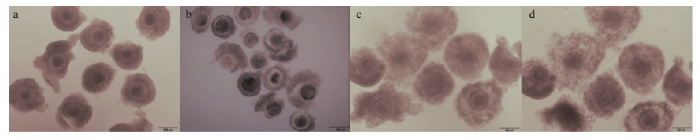 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1成熟前后不同质量的绵羊卵母细胞
a:成熟前优质卵母细胞;b:成熟前劣质卵母细胞;c:常规24 h成熟组;d:成熟30 h老化组
Fig. 1Different quality sheep oocytes before and after maturation
a: high quality immature oocytes; b: poor quality immature oocytes; c: conventional 24 h matured oocytes; d: matured 30 h (aged oocytes)
Table 1
表1
表1p66Shc和β-actin基因引物序列
Table 1
| 基因 Gene | 基因ID Gene ID | 退火温度 Annealing temperature (℃) | 引物序列(5'-3') The sequence of primer | 产物长度 Product length (bp) |
|---|---|---|---|---|
| p66Shc | 101113548 | 60 | F: CGGGGTTTCCTACTTGGTT R: ACGGCTACAGGGCTTTCTC | 169 |
| β-actin | 443052 | 60 | F: GTCATCACCATCGGCAATGA R: CGTGAATGCCGCAGGATT | 88 |
新窗口打开|下载CSV
1.2.3 线粒体染色和细胞免疫荧光 分别收集成熟前优质卵母细胞、劣质卵母细胞、常规成熟24 h卵母细胞、老化组的卵母细胞,涡旋处理以去除卵丘细胞。裸卵在含有0.01% PVA的PBS缓冲液中洗涤3次,转入500 nmol·L-1 MitoTracker Red CMXRos(Cat#M7512, Invitrogen, USA)孵育30 min,使用4%多聚甲醛室温固定15 min,将固定的卵母细胞在0.1% Triton X-100的PBS中透化20 min,随后在5%山羊血清中室温封闭1 h,将卵母细胞在p66Shc兔源一抗(Proteintech)(1﹕100)中4℃孵育过夜。将洗涤后的卵母细胞转入二抗(Alexa 488标记的山羊抗兔)孵育30 min,用1 μg·mL-1 DAPI染色15 min。将染色的卵母细胞转移到35 mm的共焦皿中,并在Olympus FluoView FV10i共聚焦激光扫描显微镜系统(Olympus,Tokyo,Japan)下观察。检测p66Shc(Ex: 495 nm; Em: 519 nm),MitoTracker Red(Ex: 578 nm; Em: 598 nm)和DAPI(Ex: 359 nm; Em: 461 nm)。每组试验重复3次,使用Image J软件进行图像分析。
1.2.4 ROS检测 分别收集成熟前优质卵母细胞、劣质卵母细胞、常规成熟24 h卵母细胞、老化组的卵母细胞各30枚,涡旋处理以去除卵丘细胞,转入含有200 μL 10 mmol·L-1 ROS水平检测工作液(DCFH-DA)的平皿中,置于39℃培养箱中孵育30 min,将染色的卵母细胞转移到35 mm的共焦皿中,并在Olympus FluoView FV10i共聚焦激光扫描显微镜系统(Olympus, Tokyo, Japan)下观察检测FITC(Ex: 495 nm; Em: 519 nm)。每组试验重复3次,使用Image J软件进行图像分析。
1.2.5 氧化还原稳态检测 分别收集成熟前优质卵母细胞、劣质卵母细胞、常规成熟24 h卵母细胞、老化组的卵母细胞各30枚,涡旋处理以去除卵丘细胞,将卵母细胞转移到35 mm的共焦皿中,并在Olympus FluoView FV10i共聚焦激光扫描显微镜系统(Olympus, Tokyo, Japan)下观察。检测FAD++(Ex: 490 nm; Em: 540 nm)和NAD(P)H(Ex: 420 nm; Em: 460 nm)。每组试验重复3次,使用Image J软件进行图像分析。
1.2.6 过氧化氢诱导处理 收集成熟前优质卵母细胞,分为对照组(30 min和1 h)、处理组(100 μmol·L-1 H2O2 处理30 min和1 h),每组样品20枚卵母细胞,首先比较对照组和处理组ROS水平和氧化还原稳态的变化,然后检测H2O2诱导的氧化应激对p66Shc蛋白表达影响。将卵母细胞在p66Shc兔源一抗(Proteintech)(1: 100)中4℃孵育过夜。将洗涤后的卵母细胞转入二抗(Alexa 488标记的山羊抗兔)孵育30 min,用1 μg·mL-1DAPI染色15 min。将染色的卵母细胞转移到35 mm的共焦皿中,并在Olympus FluoView FV10i共聚焦激光扫描显微镜系统(Olympus, Tokyo, Japan)下观察。检测p66Shc(Ex: 495 nm; Em: 519 nm)。每组试验重复3次,使用Image J软件进行图像分析。
1.3 统计分析
采用SPSS软件中的 ANAVO 进行单因素方差分析和显著性检验。P<0.05表示差异显著。2 结果
2.1 p66Shc在成熟前后不同质量卵母细胞中的相对表达量
如图2所示,RT-qPCR试验分析结果表明,p66Shc在绵羊成熟前后不同质量卵母细胞中均有表达,成熟前劣质卵母细胞p66Shc mRNA的相对表达量显著高于同时期优质的卵母细胞(P<0.05)。成熟后老化的卵母细胞p66Shc mRNA的相对表达量显著高于常规成熟24 h的卵母细胞(P<0.05)。然而优质卵母细胞成熟前后p66Shc mRNA表达量没有显著差异(P>0.05)。图2
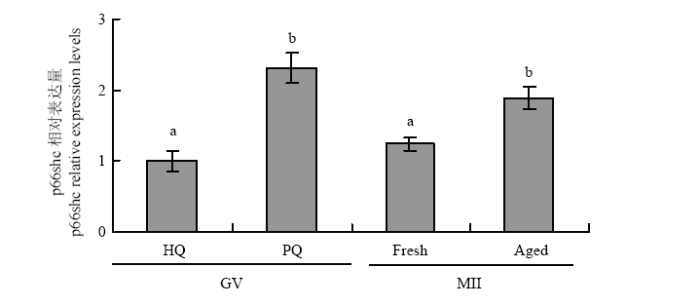 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2p66Shc在成熟前后不同质量卵母细胞中的相对表达量
不同字母表示差异显著(P<0.05), 相同字母表示差异不显著(P>0.05)
Fig. 2The relative expression of p66Shc in different quality oocytes before and after maturation
The different superscripts mean significant difference (P<0.05), and the same superscripts mean no significant difference (P>0.05)
2.2 p66Shc蛋白与线粒体在成熟前后不同质量卵母细胞的共定位
采用细胞免疫荧光技术和MitoTracker Red线粒体探针对p66Shc蛋白质和线粒体在绵羊成熟前后不同质量卵母细胞进行共定位,如图3所示,p66Shc蛋白质在绵羊成熟前后不同质量卵母细胞中均有表达,且主要呈现周边定位并且集中在线粒体分布活跃的区域。成熟前劣质卵母细胞p66Shc蛋白质表达量显著高于成熟前优质卵母细胞(P<0.05),成熟后老化的卵母细胞p66Shc蛋白质表达量显著高于常规24 h成熟的卵母细胞(P<0.05)。然而优质卵母细胞成熟后p66Shc蛋白表达显著低于成熟前卵母细胞(P>0.05)。成熟前卵母细胞线粒体在整个胞质中呈现明显的周边分布和中央弥散分布模式,成熟前优质卵母细胞线粒体活性显著高于成熟前劣质卵母细胞。优质卵母细胞常规成熟后线粒体聚集在皮质区域,然而老化卵母细胞的线粒体分布出现紊乱。图3
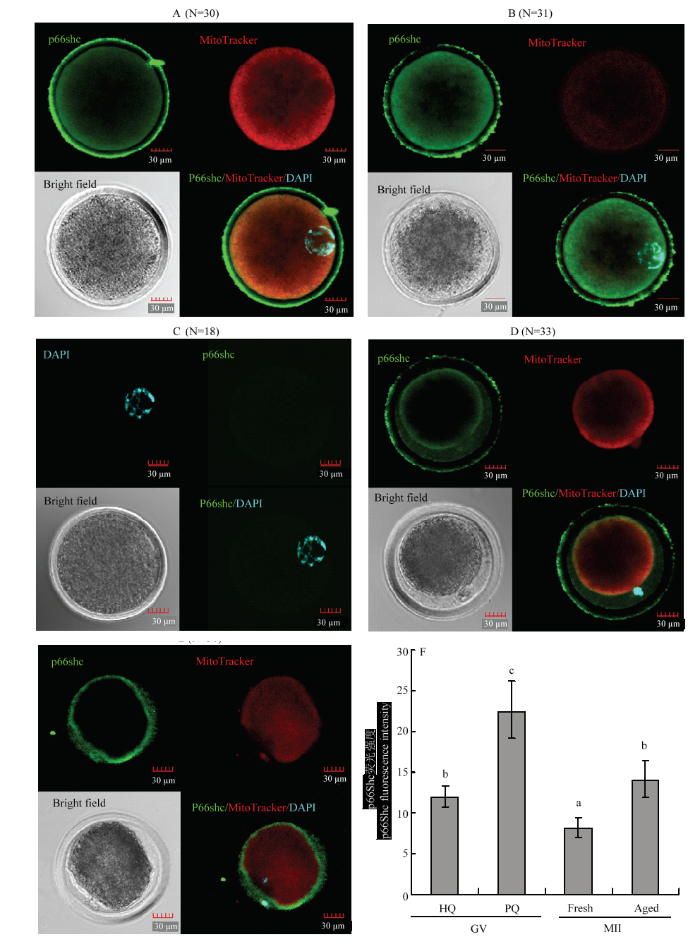 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3p66Shc蛋白与线粒体在成熟前后不同质量卵母细胞的共定位
A:成熟前优质卵母细胞;B:成熟前劣质卵母细胞;C:阴性对照(成熟前);D:常规24 h成熟卵母细胞;E:成熟后老化的卵母细胞;F:p66Shc蛋白荧光强度。绿色标记p66Shc,红色标记线粒体,蓝色标记细胞核,比例尺表示30 μm。不同字母表示差异显著(P<0.05), 相同字母表示差异不显著(P>0.05)
Fig. 3Co-localization of p66Shc protein and mitochondria in different quality oocytes before and after maturation
A: High quality immature oocytes; B: Poor quality immature oocytes; C: Negative control (immature oocytes); D: Conventional 24 h matured oocytes; E: Aged oocytes; F: p66Shc protein fluorescence intensity. Green labeled p66Shc, red labeled mitochondrial, blue labeled nuclear, the scale bar represents 30 μm. The different superscripts mean significant difference (P<0.05), and the same superscripts mean no significant difference (P>0.05)
2.3 成熟前后不同质量卵母细胞的ROS水平
利用荧光探针DCFH-DA对成熟前后不同质量卵母细胞内ROS水平进行检测,结果如图4所示,成熟前劣质卵母细胞的ROS水平显著高于成熟前优质卵母细胞(P<0.05),成熟后老化的卵母细胞的ROS水平显著高于常规24 h成熟的卵母细胞(P<0.05),优质卵母细胞成熟后的ROS水平显著高于成熟前的卵母细胞(P<0.05)。图4
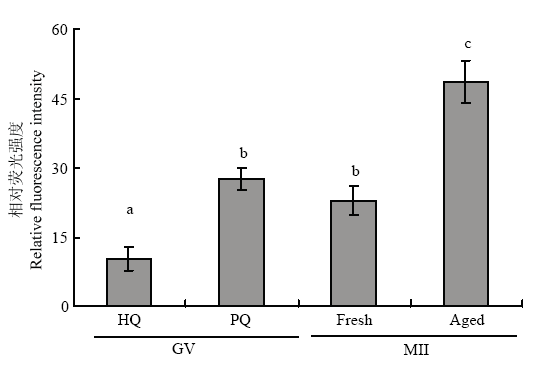 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4不成熟前后不同质量卵母细胞的ROS水平
不同字母表示差异显著(P<0.05), 相同字母表示差异不显著(P>0.05)
Fig. 4ROS levels of different quality oocytes before and after maturation
The different superscripts mean significant difference (P<0.05), and the same superscripts mean no significant difference(P>0.05)
2.4 成熟前后不同质量绵羊卵母细胞的氧化还原稳态
通过检测成熟前后不同质量绵羊卵母细胞FAD++/NAD(P)H比率来评价胞质氧化还原稳态。结果如图5所示,成熟前劣质卵母细胞的FAD++/ NAD(P)H比率显著高于成熟前优质卵母细胞(P<0.05),成熟后老化卵母细胞的FAD++/NAD(P)H比率显著低于常规24 h成熟的卵母细胞(P<0.05)。优质卵母细胞成熟前后FAD++/NAD(P)H比率没有显著差异(P>0.05)。图5
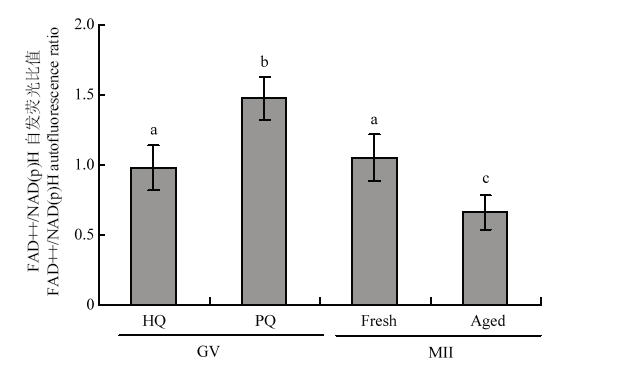 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5成熟前后不同质量卵母细胞的氧化还原稳态
FAD++/NAD(P)H 荧光比值。不同字母表示差异显著(P<0.05), 相同字母表示差异不显著(P>0.05)
Fig. 5Redox homeostasis of different quality oocytes before and after maturation
FAD ++ / NAD (P) H fluorescence ratio. The different superscripts mean significant difference (P<0.05), and the same superscripts mean no significant difference (P>0.05)
2.5 过氧化氢诱导的氧化应激上调 p66Shc的表达
为了进一步研究p66Shc对氧化应激的反应,采用外源100 μmol·L-1 H2O2处理成熟前优质绵羊卵母细胞,结果如图6所示,100 μmol·L-1 H2O2处理30 min和1 h诱导的氧化应激ROS水平显著高于对照组(P<0.05,图6-A),FAD++/NAD(P)H比率显著低于对照组(P<0.05) (图6-B)。通过细胞免疫荧光表明H2O2诱导的氧化应激显著上调p66Shc蛋白的表达(P<0.05),并且促使p66Shc由胞质向细胞核定位(图6-C、D)。图6
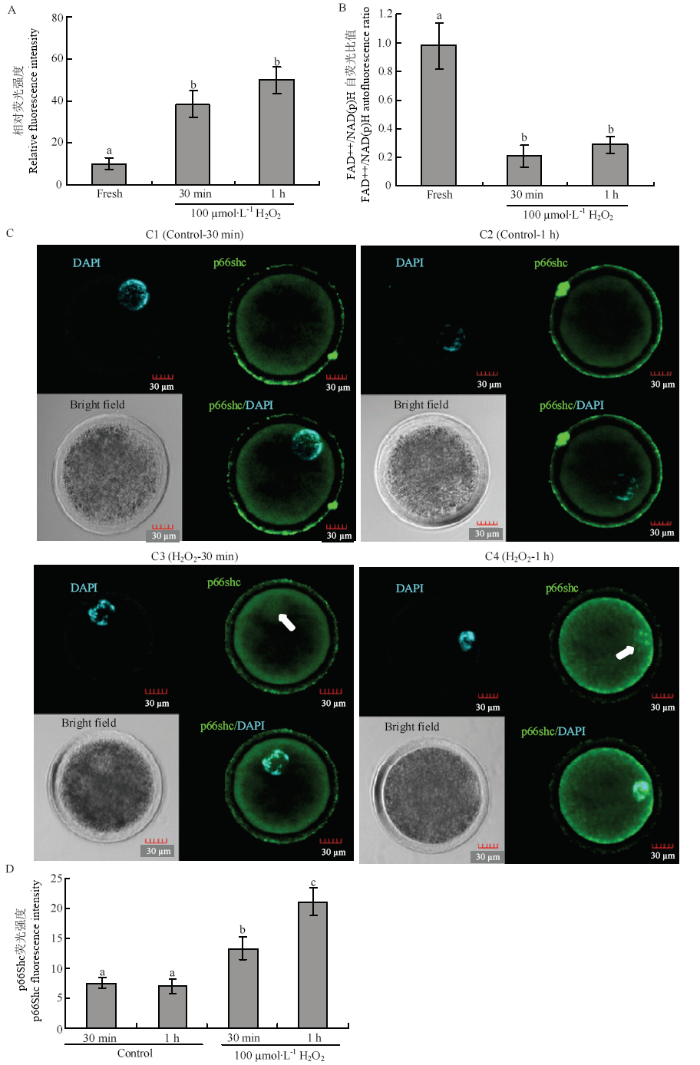 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6过氧化氢诱导的氧化应激上调 p66Shc的表达
A:ROS 水平;B:FAD++/NAD(P)H 比率;C1、C2:对照组(30 min 和1 h);C3、C4:处理组(100 μM H2O2 分别处理30 min 和1 h); 绿色标记p66Shc,蓝色标记细胞核,白色箭头指向细胞核,比例尺 表示30 μm。不同字母表示差异显著(P<0.05), 相同字母表示差异不 显著(P>0.05)
Fig. 6Hydrogen peroxide induced oxidative stress upregulated the expression of p66Shc
A: ROS level; B: FAD ++ / NAD (P) H fluorescence ratio; C1、C2: Control group (30 min or 1 h); C3、C4: treatment group (100 μM H2O2 treatment 30 min or 1 h, respectively); Green labeled p66Shc, blue labeled nuclear, white arrows point to the nucleus, The scale bar represents 30 μm. The different superscripts mean significant difference (P<0.05), and the same superscripts mean no significant difference (P>0.05)
3 讨论
活性氧簇(reactive oxygen species, ROS)主要包括超氧阴离子($\mathop{{O}}_{2}^{{\mathop{}_{\ ·}^{-}}}$)、过氧化氢(H2O2)、羟基自由基(HO·)等,这些都是氧化损伤的有效诱导剂并且参与氧化应激反应的调节,例如生殖细胞老化与凋亡、早期胚胎发育阻滞等[15,16,17]。有报道研究表明,体外胚胎生产过程中由于配子和胚胎暴露在外部环境下,内源性和外源性高水平的ROS诱导的氧化应激反应可能导致基因表达和表观遗传修饰的改变以及细胞氧化还原稳态的紊乱,进而导致卵母细胞成熟质量差、早期植入前胚胎的发育阻滞和凋亡[18,19]。p66Shc作为少数确定的哺乳动物氧化应激调控基因之一,在调控细胞氧化应激方面,主要表现为参与破坏线粒体的代谢网络、引起细胞色素c的释放和caspase的级联活化[20,21,22]。因而从基因角度说,p66Shc介导的氧化应激被认为是细胞氧化损伤的关键基因。哺乳动物卵母细胞的氧化还原稳态是保证卵母细胞正常成熟和胚胎正常发育的关键性因素。在本研究中,从mRNA和蛋白两个水平对绵羊成熟前后不同质量卵母细胞氧化应激蛋白p66Shc mRNA的表达量进行了比较分析。实时荧光定量PCR结果表明,p66Shc基因在成熟前劣质和成熟后老化卵母细胞p66Shc mRNA的相对表达量都显著高于成熟前优质和常规24 h成熟的卵母细胞,然而优质卵母细胞常规成熟前后没有显著差异(图2)。FAVETTA等[23]对氧化应激蛋白p66Shc在正常发育与早期发育阻滞的牛胚胎表达的研究中,发现p66Shc mRNA在成熟前后的牛卵母细胞中表达没有显著差异,这与本研究的结果相似。BAIN等[11]在牛胚胎中发现胚胎质量差与p66Shc氧化应激蛋白高表达有关,因此推测p66Shc基因参与调控卵母细胞和早期胚胎氧化应激的能力。利用细胞免疫荧光结合MitoTracker Red探针对p66Shc和线粒体进行共定位,结果表明成熟前劣质和成熟后老化卵母细胞p66Shc的蛋白表达显著高于成熟前优质和常规24 h成熟的卵母细胞,这与mRNA表达模式一致(图3)。线粒体作为卵母细胞和胚胎能量代谢的核心,在卵母细胞体外成熟和胚胎发育期间的各种生物过程中起重要作用,越来越多的证据表明细胞质线粒体的区域再分布以及活性大小能够作为哺乳动物卵母细胞发育能力的决定因素[24,25]。本研究中,比较分析了成熟前后不同质量绵羊卵母细胞线粒体的分布与活性,成熟前优质卵母细胞线粒体呈现周边聚集和胞质的弥散分布模式(图3),这可能与成熟过程中的卵母细胞与外界能量交换密切对线粒体需求较多有关,成熟前劣质卵母细胞线粒体的活性显著低于优质卵母细胞(图3)。常规成熟24 h的卵母细胞线粒体更多地聚集到卵母细胞的皮质区域,这可能与卵母细胞为受精做准备有关,然而成熟30 h的卵母细胞线粒体分布模式紊乱(图3)。总之,本研究的结果显示,p66Shc表达水平的高低与线粒体的分布和活性反应了成熟前后卵母细胞的质量。
卵母细胞在正常生理条件下,ROS的产生和清除系统处于动态平衡状态。由于种种原因,导致细胞内ROS过度产生而ROS清除能力下降,细胞就会出现氧化应激[26]。p66Shc对线粒体ROS代谢的调节依赖于线粒体呼吸链。研究发现p66Shc基因敲除小鼠的细胞内ROS的水平显著降低,同时检测到反映细胞氧化应激状态的重要标志物—8-氧代脱氧鸟苷和硝基酪氨酸的下降[27]。为了进一步探究成熟前后不同质量卵母细胞p66Shc与ROS水平和氧化还原稳态的关系,笔者利用荧光探针DCFH-DA和卵母细胞自发荧光分别对成熟前后不同质量卵母细胞内ROS水平和氧化还原稳态进行检测,结果表明成熟前劣质和成熟后老化卵母细胞ROS水平分别显著高于成熟前优质和常规24 h成熟的卵母细胞(图4),因此,卵母细胞质量差很大成程度上与ROS代谢失衡有关。TAKAHASHI等[28]同样发现质量差的小鼠卵母细胞ROS水平显著高于正常的卵母细胞。FAD++/NADH荧光强度比称之为氧化还原比,常用来确定细胞氧化还原状态的相对变化来反映细胞代谢状态的变化[29,30]。与成熟前优质和常规24 h成熟的卵母细胞相比,成熟前劣质和成熟后老化卵母细胞表现出氧化还原稳态失衡的状态(图5)。因此,卵母细胞质量下降与ROS水平升高及氧化还原稳态失衡有关。过氧化氢(H2O2)被广泛用作外源ROS的来源诱导氧化应激[31,32],采用外源100 μmol·L-1 H2O2分别诱导成熟前优质卵母细胞30 min和1 h,结果表明H2O2处理引起ROS显著上升和氧化还原稳态的失衡,并且H2O2诱导的氧化应激显著上调p66Shc蛋白表达并促使 p66Shc由胞质向细胞核定位(图6)。因此,p66shc在氧化应激条件下的表达上调,可能触发了卵母细胞氧化应激“闸门”的开启。但p66shc对卵母细胞氧化应激反应的具体调节机制还需进一步研究。
4 结论
p66Shc在劣质和老化的绵羊卵母细胞中呈现高水平的表达特征,而且p66Shc高表达影响了绵羊卵母细胞胞质氧化还原稳态。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1093/humupd/dmv034URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1186/s12943-015-0354-9URL [本文引用: 1]
DOI:10.1038/46311 [本文引用: 1]
DOI:10.1016/j.atherosclerosis.2011.10.035URL [本文引用: 1]
DOI:10.1161/CIRCRESAHA.111.243592URL [本文引用: 1]
DOI:10.2337/db13-0894URL [本文引用: 1]
[本文引用: 1]
DOI:10.1186/1471-213X-7-132URL [本文引用: 1]
[本文引用: 2]
DOI:10.1093/molehr/gan035URL [本文引用: 1]
DOI:10.1016/j.reprotox.2013.10.008URL [本文引用: 1]
DOI:10.1371/journal.pone.0086978URL [本文引用: 1]
DOI:10.5534/wjmh.2014.32.1.1URL [本文引用: 1]
DOI:10.1186/s12929-016-0253-4URL [本文引用: 1]
DOI:10.3864/j.issn.0578-1752.2012.01.020URLMagsci [本文引用: 1]

【目的】探讨冷冻保存对牛体外生产胚胎能量代谢、有氧代谢造成的影响。【方法】采用常规法或玻璃化法(open pulled straw,OPS法)冷冻保存牛体外受精(in vitro fertilization,IVF)囊胚和体细胞核移植(somatic cell nuclear transfer,SCNT)囊胚,利用ATP Bioluminescence Assay Kit HS II 和 GENMED ROS Assay Kit检测了冷冻-解冻后囊胚ATP含量和ROS水平。【结果】(1)IVF和SCNT囊胚OPS法冷冻-解冻后存活率((93.25±5.17)%和(77.56±3.52)%)均显著高于常规冷冻法((81.25±4.98)%和(49.41±2.24)%)(P<0.05);(2)IVF囊胚和SCNT囊胚OPS法冷冻-解冻后ATP含量((0.63±0.05)和(0.33±0.02)pmol)均显著高于常规冷冻法((0.45±0.03)和(0.22±0.01)pmol)(P<0.05);但是均显著低于相应的IVF或SCNT新鲜囊胚((0.76±0.04)和(0.40±0.02)pmol)(P<0.05);(3)玻璃化冷冻IVF囊胚、SCNT囊胚ROS水平((74.34±4.24)和(43.21±3.35)cps)高于新鲜IVF囊胚((48.52±2.65)cps)、SCNT囊胚((27.36±2.23)cps)(P<0.05),常规冷冻组则与此相反((35.61±4.32)和(16.56±2.52)cps)(P<0.05)。【结论】玻璃化冷冻较适用于牛IVF、SCNT囊胚冷冻保存;玻璃化冷冻和常规冷冻均显著影响牛IVF囊胚、SCNT囊胚中ATP含量和ROS水平。
DOI:10.3864/j.issn.0578-1752.2012.01.020URLMagsci [本文引用: 1]

【目的】探讨冷冻保存对牛体外生产胚胎能量代谢、有氧代谢造成的影响。【方法】采用常规法或玻璃化法(open pulled straw,OPS法)冷冻保存牛体外受精(in vitro fertilization,IVF)囊胚和体细胞核移植(somatic cell nuclear transfer,SCNT)囊胚,利用ATP Bioluminescence Assay Kit HS II 和 GENMED ROS Assay Kit检测了冷冻-解冻后囊胚ATP含量和ROS水平。【结果】(1)IVF和SCNT囊胚OPS法冷冻-解冻后存活率((93.25±5.17)%和(77.56±3.52)%)均显著高于常规冷冻法((81.25±4.98)%和(49.41±2.24)%)(P<0.05);(2)IVF囊胚和SCNT囊胚OPS法冷冻-解冻后ATP含量((0.63±0.05)和(0.33±0.02)pmol)均显著高于常规冷冻法((0.45±0.03)和(0.22±0.01)pmol)(P<0.05);但是均显著低于相应的IVF或SCNT新鲜囊胚((0.76±0.04)和(0.40±0.02)pmol)(P<0.05);(3)玻璃化冷冻IVF囊胚、SCNT囊胚ROS水平((74.34±4.24)和(43.21±3.35)cps)高于新鲜IVF囊胚((48.52±2.65)cps)、SCNT囊胚((27.36±2.23)cps)(P<0.05),常规冷冻组则与此相反((35.61±4.32)和(16.56±2.52)cps)(P<0.05)。【结论】玻璃化冷冻较适用于牛IVF、SCNT囊胚冷冻保存;玻璃化冷冻和常规冷冻均显著影响牛IVF囊胚、SCNT囊胚中ATP含量和ROS水平。
DOI:10.1007/s10495-015-1136-yURL [本文引用: 1]
[本文引用: 1]
DOI:10.1093/molehr/gaw043URL [本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
.
URL [本文引用: 1]
DOI:10.1093/molehr/gah057URL [本文引用: 1]
[本文引用: 1]
URLMagsci [本文引用: 1]

<P><FONT face=Verdana>【目的】通过对正常受精胚胎、山羊同克隆胚胎(山羊去核卵与布尔山羊耳皮肤成纤维细胞重组)以及牛-山羊异种克隆胚胎(山羊去核卵与布尔山羊耳皮肤成纤维细胞重组)中线粒体超微结构的观察与比对,从亚细胞水平揭示异种克隆胚胎出现异常的原因,为异种克隆技术的进一步研究提供新思路。【方法】利用透射电镜分别对山羊正常受精胚胎、山羊同种克隆胚胎及牛-山羊异种克隆胚胎的原核、2-细胞、4-细胞、8-细胞及桑椹胚阶段的早期胚胎进行线粒体超微结构观察。【结果】山羊自然受精胚胎、山羊同种克隆胚胎的线粒体均为帽状,随着胚胎的发育,线粒体由电子密度高、嵴少的未成熟状态发育为电子密度低、嵴丰富的成熟线粒体,而牛-山羊异种克隆胚胎从2-细胞胚胎至桑椹胚都存在一种具有多个分叶的线粒体,但这种形态异常的线粒体同样也能够形成电子密度低、嵴丰富的成熟线粒体。【结论】牛卵母细胞与山羊体细胞之间不能有效的进行核-质互作,本研究中具体表现为出现多分叶形线粒体,从而影响牛-山羊异种克隆胚胎的发育。<BR></FONT></P>
URLMagsci [本文引用: 1]

<P><FONT face=Verdana>【目的】通过对正常受精胚胎、山羊同克隆胚胎(山羊去核卵与布尔山羊耳皮肤成纤维细胞重组)以及牛-山羊异种克隆胚胎(山羊去核卵与布尔山羊耳皮肤成纤维细胞重组)中线粒体超微结构的观察与比对,从亚细胞水平揭示异种克隆胚胎出现异常的原因,为异种克隆技术的进一步研究提供新思路。【方法】利用透射电镜分别对山羊正常受精胚胎、山羊同种克隆胚胎及牛-山羊异种克隆胚胎的原核、2-细胞、4-细胞、8-细胞及桑椹胚阶段的早期胚胎进行线粒体超微结构观察。【结果】山羊自然受精胚胎、山羊同种克隆胚胎的线粒体均为帽状,随着胚胎的发育,线粒体由电子密度高、嵴少的未成熟状态发育为电子密度低、嵴丰富的成熟线粒体,而牛-山羊异种克隆胚胎从2-细胞胚胎至桑椹胚都存在一种具有多个分叶的线粒体,但这种形态异常的线粒体同样也能够形成电子密度低、嵴丰富的成熟线粒体。【结论】牛卵母细胞与山羊体细胞之间不能有效的进行核-质互作,本研究中具体表现为出现多分叶形线粒体,从而影响牛-山羊异种克隆胚胎的发育。<BR></FONT></P>
[D].
URL [本文引用: 1]
[D].
URL [本文引用: 1]
DOI:10.1073/pnas.0609656104URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.redox.2015.09.005URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
