 ,1,2, 白爱宁3, 白雪3, 陈娟3, 郭林1, 刘春明
,1,2, 白爱宁3, 白雪3, 陈娟3, 郭林1, 刘春明 ,1,3,*
,1,3,*Phenotypic and genetic analyses of a rice mutant eed1 with defected embryo and endosperm development
YANG Jin ,1,2, BAI Ai-Ning3, BAI Xue3, CHEN Juan3, GUO Lin1, LIU Chun-Ming
,1,2, BAI Ai-Ning3, BAI Xue3, CHEN Juan3, GUO Lin1, LIU Chun-Ming ,1,3,*
,1,3,*通讯作者: *刘春明, E-mail:liuchunming@caas.cn
收稿日期:2021-02-18接受日期:2021-04-26网络出版日期:2022-05-17
| 基金资助: |
Received:2021-02-18Accepted:2021-04-26Published online:2022-05-17
| Fund supported: |
作者简介 About authors
E-mail:jinyang201587@163.com

摘要
从由化学诱变剂甲基磺酸乙酯(ethylmethane sulfonate, EMS)处理的粳稻品种中花11突变体库中, 筛选到一个可稳定遗传的胚胎和胚乳发育缺陷的突变体, 命名为embryo and endosperm defective 1 (eed1)。eed1籽粒千粒重、颖果的粒长、粒宽、粒厚、萌发率、总淀粉、直链淀粉和贮藏蛋白系列指标较野生型均显著降低。eed1颖果严重皱缩, 且胚乳呈粉质。利用扫描电镜观察发现, 与中花11相比, eed1胚乳中淀粉粒排列疏松, 多以单一、分散的淀粉粒存在, 且呈近似球形。eed1胚胎结构异常, 部分颖果未见有胚胎分化的痕迹。qRT-PCR发现, eed1胚乳中参与淀粉和贮藏蛋白合成的大部分基因表达下调。利用eed1与籼稻南京6号杂交得到的F2分离群体进行基因定位分析, 将EED1定位于9号染色体长臂672 kb的范围内, 包含114个开放读码框。本研究为进一步解析EED1基因调控水稻胚胎和胚乳发育的机制奠定了基础。
关键词:
Abstract
A stably inherited embryo and endosperm defective mutant, named embryo and endosperm defective 1 (eed1), was obtained from the mutant population of rice Zhonghua 11, generated by ethylmethane sulfonate (EMS). The 1000-grain weight, grain length, grain width, grain thickness, germination rate, total starch, amylose, and storage protein contents in eed1 mature caryopses were significantly decreased compared with wild type. In eed1, the caryopses were shrunken and the endosperm was opaque. Scanning electron microscopy observation revealed that starch granules in eed1 endosperm cells were loosely packed, in single, disperse and spherical forms. The embryo of eed1 was abnormal, and some caryopses showed no sign of embryonic differentiation. Most genes involved in biosynthesis of starch and storage protein were down-regulated in eed1 endosperm by qRT-PCR. EED1 was mapped in an interval of 672 kb on chromosome 9 using a F2 population derived from a cross between eed1 and Nanjing 6. The region contained 114 open reading frames. This study lays a foundation for further studying EED1 gene in regulating development of rice embryo and endosperm.
Keywords:
PDF (9466KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
杨谨, 白爱宁, 白雪, 陈娟, 郭林, 刘春明. 水稻胚胎和胚乳双缺陷突变体eed1的表型与遗传分析. 作物学报, 2021, 48(2): 292-303 DOI:10.3724/SP.J.1006.2022.12013
YANG Jin, BAI Ai-Ning, BAI Xue, CHEN Juan, GUO Lin, LIU Chun-Ming.
水稻(Oryza sativa L.)作为全球一半以上人口的主食, 是最重要的粮食作物之一[1]。水稻籽粒结构复杂, 由颖果(俗称糙米)以及包裹着颖果的内外稃片和护颖组成。水稻颖果有3种不同的遗传组分: (1) 二倍体的母本组织, 包括果皮、种皮和珠心组织; (2) 二倍体的子代胚胎组织; (3) 三倍体的子代胚乳组织[2]。胚胎是其繁育组织, 胚乳是终端营养组织。胚胎和胚乳发育是水稻颖果发育的关键, 对稻米的产量和品质至关重要。
水稻颖果的发育起始于双受精完成之后[3,4]。胚胎是双受精产物之一, 一个单倍体精细胞与一个单倍体卵细胞形成二倍体受精卵即合子, 合子激活并启动胚胎发育, 经历顶基极性建立, 细胞命运决定, 胚胎模式建成(辐射模式和背腹模式)和组织器官分化等过程最终发育成胚胎[5,6,7,8]。水稻胚胎发育突变体的研究增进了我们对水稻早期胚胎发生过程的了解。Globular Embryo 4 (GLE4)基因介导了胚胎发育早期L2和L3层的分化, gle4在胚胎发育的辐射模式建成中存在缺陷[7]。Gamete Cells Defective 1 (GCD1)对胚胎发育和胚胎背腹模式的建成至关重要[9]。水稻胚胎的顶基、辐射及背腹轴向所定义的位置信息, 影响了胚胎相应组织和器官的分化, 从而决定胚胎基本形态的建成[6]。
胚乳是双受精过程的另一个产物, 是由1个精细胞与2个中央极核融合形成的三倍体的初生胚乳核发育而来[10]。水稻的胚乳由内部淀粉胚乳和外部糊粉层组成[11]。在种子发育过程中, 胚乳积累高水平的营养物质(主要是淀粉和贮藏蛋白), 为种子萌发和幼苗的早期生长提供能量和养分[12,13]。淀粉在水稻中占糙米干重的60%~80% [14]。Grain Incomplete Filling 2 (GIF2)、Starch Synthase IIIa (SSIIIa)、Granule Bound Starch Synthase-Binding Protein (GBP)和Basic Leucine Zipper Factor 58 (bZIP58)等基因调控水稻胚乳中淀粉的合成过程[15,16,17,18]。贮藏蛋白是水稻胚乳中仅次于淀粉的第二大类营养物质, 一般占糙米干重的8%~10% [19]。在水稻中, 基本亮氨酸拉链转录因子Rice Seed B-Zipper 1 (RISBZ1)和水稻醇溶蛋白盒结合因子Rice Prolamin Box Binding Factor (RPBF)协同调控种子贮藏蛋白和淀粉的合成。RISBZ1与RPBF RNA干扰的转基因植株的种子中贮藏蛋白和淀粉的含量显著降低, 且胚乳呈现粉质表型[20]。Floury Endosperm 2 (FLO2)影响水稻胚乳中淀粉和贮藏蛋白的累积, 在调控水稻籽粒大小和淀粉品质方面发挥重要作用[21]。因此, 在胚乳发育过程中, 营养物质的累积是决定稻米的产量和品质的重要生理过程[22]。
水稻颖果的发育, 是一个伴随胚胎胚乳同步发育的微妙而复杂的生物学过程[23]。有证据表明胚胎的发育依赖于胚乳发育, 胚乳早期发育失败也会导致胚胎发育受阻[24], 如拟南芥fertilization independent seed 2 (fis2)和endosperm defective 1 (ede1)中胚乳细胞化异常, 胚胎发育受损[25,26]; 也有证据表明胚胎与胚乳发育存在协调相互作用, 水稻编码CYP78A亚家族P450单加氧酶的Giant Embryo (GE)基因是控制胚胎和胚乳大小的必需基因, 该基因主要在胚胎盾片的上皮组织中表达[27,28]。而拟南芥最近一项研究表明, 2个膜蛋白Gamete-expressed 2 (GEX2)或Domain of Unknown Function 679 Membrane Protein 8/9 (DMP8/9)的突变体会产生无胚胎种子, 但这2个突变体中的胚乳依然可以同野生型胚乳一样正常发育。这一发现表明胚乳发育是一个不依赖于卵细胞受精和胚胎信号的自主程序化过程[29]。
综上, 迄今为止, 水稻中虽然已经发现了一些参与胚胎、胚乳以及二者协同发育的基因, 但胚胎和胚乳的发育机制及它们之间的信号交流、协调作用的分子机制, 还有待更加深入的解析。本研究以一个稳定遗传的胚胎胚乳发育双缺陷突变体eed1为材料, 对该突变体籽粒的表型进行了详细的观察与分析, 并检测了EED1突变后对淀粉和贮藏蛋白合成基因表达的影响, 同时利用不同遗传背景杂交的F2分离群体进行遗传分析和基因定位, 旨在为进一步解析水稻胚胎和胚乳的发育机制奠定基础。
1 材料与方法
1.1 材料
从化学诱变剂EMS处理的粳稻品种中花11号(Oryza sativa L. ssp. japonica cultivar Zhonghua 11, ZH11)突变体库中, 筛选到一个稳定遗传的胚胎且胚乳发育缺陷的突变体, 命名为embryo and endosperm defective 1 (eed1)。将其与籼稻品种南京6号(Oryza sativa L. ssp. indica cultivar Nanjing 6, NJ6)杂交组合获得F1, F1自交得到用于EED1基因定位的F2分离群体。所有材料均种植于中国科学院植物研究所北京香山实验基地网室条池、试验田或海南三亚南繁基地。1.2 成熟种子横切面的扫描电镜观察
扫描电镜观察参照前人方法进行[30]。取ZH11和eed1成熟干燥籽粒(受粉后35 d左右)各5粒, 去掉内外稃片后用镊子将其横向掰断, 胚乳横断面镀金后采用日立S-4800高分辨率扫描电子显微镜对其中央部位进行观察并拍照。1.3 TTC染色
2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride, TTC)与活细胞中的脱氢酶反应生成红色稳定的三苯基甲臢(1,3,5-triphenylformazan, TPF), 可以根据染色部位和染色深浅程度来鉴定胚胎的活力。取野生型(wild type, WT)和突变体eed1成熟颖果(籽粒去掉谷壳)各20粒, 4℃浸种过夜, 之后使用单面刀片进行纵切, 放入15 mL离心管中。称取0.1 g避光保存的TTC粉末, 溶于100 mL磷酸缓冲液(pH 7.0)中。每个离心管中分别加入10 mL现配的0.1% TTC溶液, 避光放置于30℃培养箱, 湿育2 h后取出, 蒸馏水反复冲洗, 之后置于白纸上观察染色情况并照相。1.4 突变体胚胎愈伤组织的诱导与培养
水稻愈伤组织的诱导和培养参照前人的方法进行[31,32]。首先对水稻颖果进行表面消毒, 将去掉谷壳的颖果, 置于适当体积的75%乙醇中表面消毒5 min, 之后去掉乙醇加入稀释5倍的次氯酸钠溶液(活性氯终浓度为2%), 浸泡消毒20 min, 无菌水冲洗6~8次。用无菌滤纸吸干颖果表面的水分, 将胚胎一侧朝上, 置于愈伤诱导培养基NB2上。每个13 cm×13 cm的方皿中接种30~40粒, 28℃暗培养4周, 诱导愈伤组织形成。愈伤组织形成后, 需继代培养以扩大愈伤量, 将诱导出的浅黄色致密的胚性愈伤组织, 转接于继代培养基NB1上, 置于28℃培养箱内, 24 h黑暗条件下培养2周, 愈伤组织可继代培养2次。将愈伤组织转移至预分化培养基RE1上进行分化培养, 先暗培养2周, 再置于光下(光强45~55 mmol m-2 s-1)培养2周, 已分化出不定芽的愈伤组织, 转移到分化培养基RE2上, 光照培养2周。待根系生长良好, 小苗长至8~10 cm时, 打开盖炼苗6~15 d。取出组织培养苗, 转移到土壤中, 放到无阳光直射的温室中驯化培养, 然后移入室外栽培。1.5 成熟颖果淀粉含量测定和总蛋白提取及SDS-PAGE分析
取ZH11成熟籽粒、eed1与ZH11回交F2群体中纯合野生型植株上发育正常的成熟籽粒(wild type, WT)和杂合体植株上分离得到的eed1成熟籽粒(受粉后35 d左右), 50℃烘干至恒重, 去谷壳研磨成糙米粉进行测定。使用GB-7648-87法进行直链淀粉含量的测定; 总淀粉含量采用酸解法-DNS测定。每个样品称取100 mg, 重复测定3次。以上3种样品, 各称取40 mg, 分别提取总蛋白, 并进行SDS-PAGE分析[33]。1.6 RNA提取与qRT-PCR分析
取ZH11和eed1受粉后11~15 d的颖果, 用镊子剥离果皮得到种皮与胚乳的混合组织, 使用TRIzol法提取其总RNA, 而后使用试剂盒(天根生化科技(北京)有限公司)反转录为cDNA; 采用荧光定量PCR检测系统(BIO-CFX 96 Touch, 美国), 以水稻Ubiquitin (Os03g0234200)为内参[34] (表1)进行PCR。反应体系为cDNA模板1 μL (300 ng μL-1)、2×iTaq Universal SYBR Green Supermix 10 μL、正反向引物[21,35]各1 μL (10 μmol L-1)和ddH2O 7 μL。反应程序为: 95℃ 30 s; 95℃ 5 s, 60℃ 30 s, 40个循环。采用2-ΔΔCT法对数据进行处理[36]。Table 1
表1
表1实时荧光定量PCR分析所用的引物
Table 1
| 基因名 Genes ID | 正向引物序列 Forward sequences (5'-3') | 反向引物序列 Reverse sequences (5'-3') |
|---|---|---|
| Ubiquitin | CTGTCAACTGCCGCAAGAAG | GGCGAGTGACGCTCTAGTTC |
| OsAGPL1 | GGAAGACGGATGATCGAGAAAG | CACATGAGATGCACCAACGA |
| OsAGPL2 | AGTTCGATTCAAGACGGATAGC | CGACTTCCACAGGCAGCTTATT |
| OsAGPL3 | AAGCCAGCCATGACCATTTG | CACACGGTAGATTCACGAGACAA |
| OsAGPS1 | GTGCCACTTAAAGGCACCATT | CCCACATTTCAGACACGGTTT |
| OsAGPS2a | ACTCCAAGAGCTCGCAGACC | GCCTGTAGTTGGCACCCAGA |
| OsAGPS2b | AACAATCGAAGCGCGAGAAA | GCCTGTAGTTGGCACCCAGA |
| OsSS I | GGGCCTTCATGGATCAACC | CCGCTTCAAGCATCCTCATC |
| OsS IIa | GCTTCCGGTTTGTGTGTTCA | CTTAATACTCCCTCAACTCCACCAT |
| OsSS IIc | GACCGAAATGCCTTTTTCTCG | GGGCTTGGAGCCTCTCCTTA |
| OsSS IIIa | GCCTGCCCTGGACTACATTG | GCAAACATATGTACACGGTTCTGG |
| OsSS IIIb | ATTCCGCTCGCAAGAACTGA | CAACCGCAGGATAACGGAAA |
| OsSS IVa | GGGAGCGGCTCAAACATAAA | CCGTGCACTGACTGCAAAAT |
| OsSS IVb | ATGCAGGAAGCCGAGATGTT | ACGACAATGGGTGCCAAGAT |
| OsGBSS I OsGBSS II | AACGTGGCTGCTCCTTGAA AGGCATCGAGGGTGAGGAG | TTGGCAATAAGCCACACACA CCATCTGGCCCACATCTCTA |
| OsBE I OsBE IIa | TGGCCATGGAAGAGTTGGC GCCAATGCCAGGAAGATGA | CAGAAGCAACTGCTCCACC GCGCAACATAGGATGGGTTT |
| OsBE IIb | ATGCTAGAGTTTGACCGC | AGTGTGATGGATCCTGCC |
| OsISA1 | TGCTCAGCTACTCCTCCATCATC | AGGACCGCACAACTTCAACATA |
| OsISA2 | TAGAGGTCCTCTTGGAGG | AATCAGCTTCTGAGTCACCG |
| OsISA3 | ACAGCTTGAGACACTGGGTTGAG | GCATCAAGAGGACAACCATCTG |
| OsPUL | ACCTTTCTTCCATGCTGG | CAAAGGTCTGAAAGATGGG |
| OsDPE2 | CAAGTACACCACAAGACCAGCAA | CGTCCAACAGCGAATCCAAT |
| OsPHOL | TTGGCAGGAAGGTTTCGCT | CGAAGCCTGAAGTGAACTTGCT |
| OsPHOH | CACCAAGACGAAGCTCATCAAG | TTCACTCGTTGCTGGGTTCTC |
| GluA1 | CATTTGAGCCAATTCGGAGT | GGCCTGATTGTTGGAACTGT |
| GluA2 | GCAAGAGCAGGAACAAGGAC | CCTCATGGTGCAAAAGGTCT |
| GluA3 | TGAAAACCAACCCTGACTCC | ACTCATCTCCCCTGTTGTGC |
| GluB1 | GCCAAAGTCAGAGCCAAAAG | GAACCAATGTGCAACACCAG |
| GluB4 | GCGACCAGAAGGCTACAAAG | TTGCTTGTTGATCGTTGCTC |
| Glutelinλ | TGGCGACCATAGCTTTCTCT | GGGTTGTGCCATGGATTTAC |
| Globulin1 | ATCGAGAACGGCGAGAAGT | GGACGGAGATGGTATGGAGA |
| Globulin2 | CGACGAGGTGTTCTACGTCA | GTGTTGGCGGAGTAGACGAT |
| 11S-Globulin | CACCAAACCCGATCTTCAGT | CGGAACAGCTTCTCCATCTC |
| 19kD-Globulin | GCCAGTAATTGCAGGGGATA | AGGTCACCACCAACGTAAGC |
| Prolamin | TCTCCAACCAACAATAGCAATG | TGCGTAGCTATCTGTGCCCGTC |
| 10kD-Prolamin | TGCAGTATTTCCCACCAACA | ACATGAACATGGCTGTGGAG |
| 13kD-Prolamin | CACAGCGCAGTTTGATGTTT | GCTTGCCGCAATGCTATACT |
| 17kD-Prolamin | TTTGATGCTTGCACCTATGG | GCAGCTGCTCAGTTTTAGCC |
| RA16 | AGGTAGTGATCTCGGCGTTG | CCGATTCCTGGCTGACATAG |
| RA17 | TTCTCGGTATTGCTCCTCGT | CTTATTCCTGGCCGACATTG |
新窗口打开|下载CSV
1.7 基因定位
以突变体eed1为母本, NJ6作为父本进行杂交, 得到的F1植株其自交获得F2种子。由于eed1纯合致死, 故在F2群体中鉴定杂合体分离单株, 并使用SDS法分别提取其叶片基因组DNA。利用实验室已有的和新开发的分子标记引物(表2), 筛选在eed1和NJ6之间具有多态性的分子标记。确定连锁标记后, 利用水稻数据库(Table 2
表2
表2EED1基因定位所用分子标记
Table 2
| 引物名 Primers ID | 正向引物序列 Forward sequences (5'-3') | 反向引物序列 Reverse sequences (5'-3') |
|---|---|---|
| OS907 | CTTCTAACTTTTCCATCACATCG | CCTCCAACTACCAGCCATAA |
| InDel950 InDel976 | ACTTTCTAACTTCCTAATAAG GTTAAATCTTCTCTCAATCT | GTTCTGGAATGAAATATTAGA TCTCTCCGGTCTCTCCCTGC |
| RM107 | AGATCGAAGCATCGCGCCCGAG | ACTGCGTCCTCTGGGTTCCCGG |
| RM201 | GTACTCTCGCCGTTCACAACTCC | TTAGTGACCGGGATGACACAGC |
| RM245 | ATGCCGCCAGTGAATAGC | CTGAGAATCCAATTATCTGGGG |
| InDel908 | TGGGAGAACTAAGGAGCAA | CTGTTATCTGGCAATCTG |
新窗口打开|下载CSV
2 结果与分析
2.1 突变体eed1表型分析
突变体eed1去谷壳的成熟干燥颖果, 表现为严重皱缩, 胚胎褐色且轮廓不清晰, 胚乳粉质不透明; 而ZH11成熟干燥颖果饱满, 胚胎轮廓清晰, 胚乳硬质呈透明状(图1-A, B)。相较ZH11, eed1成熟颖果的粒长、粒宽和粒厚显著变小(图1-C)。eed1成熟籽粒, 千粒干重也显著降低, 仅为ZH11的37.34% (图1-D)。利用扫描电镜观察eed1和ZH11成熟颖果横断面, 发现ZH11胚乳淀粉颗粒紧密堆积, 呈现多面体的晶体结构(图1-E)。而eed1胚乳中淀粉粒之间存在较大的缝隙, 排列疏松, 多以单一、分散的淀粉粒存在, 且淀粉粒呈近似球形(图1-F)。这些表型说明, EED1基因的突变显著影响了水稻胚胎和胚乳的发育。图1
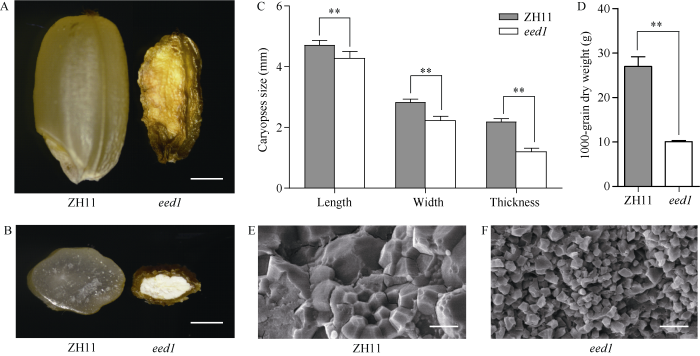 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1ZH11与eed1成熟颖果表型分析
A: ZH11与eed1整粒成熟颖果外观比较, 标尺为1 mm; B: ZH11与eed1成熟颖果横切面比较, 标尺为1 mm; C: ZH11与eed1的成熟颖果大小比较, n = 20; D: ZH11与eed1的成熟烘干籽粒千粒重比较, n = 3。数值为平均值±标准差; 采用Student’s t测验, **表示P < 0.01; E~F: ZH11 (E)与eed1 (F)成熟颖果扫描电镜观察, 标尺为5 μm。
Fig. 1Phenotypic analyses of mature caryopses of ZH11 and eed1
A: appearance comparison of the whole and mature caryopses between ZH11 and eed1, bar: 1 mm. B: cross-sections of ZH11 and eed1 mature caryopses, bar: 1 mm. C: comparison of mature caryopses size between ZH11 and eed1, n = 20. D: 1000-grain dry weight of ZH11 and eed1 mature grains, n = 3. Values are means ± SDs by Student’s t-test. **: P < 0.01. E-F: the scanning electron microscopic observation of mature caryopses of ZH11 (E) and eed1 (F), bar: 5 μm.
2.2 EED1基因突变影响了胚胎的发育
突变体eed1萌发的颖果, 长出0.5~1.0 cm的嫩芽, 之后会停止生长, 难以存活(图2-A)。因此, 该突变体纯合致死, 只能以杂合体保存。对eed1与ZH11回交F2群体中纯合野生型植株上发育正常的颖果(WT)和杂合体植株上分离得到的eed1颖果进行萌发试验, 发现eed1的萌发率显著降低, 仅为WT的13.33% (图2-B)。为了检测eed1胚胎的活力, 我们使用细胞活力特异性染料TTC对WT和eed1纵切的颖果进行了染色。结果显示, WT颖果胚胎被染成深红色, 且胚胎内部结构清晰(图2-C); 而eed1胚胎染色较浅, 且不同颖果的染色深浅程度不一(图2-D, E), 说明eed1胚胎细胞活力呈现不同程度的降低。而且与WT相比, eed1胚胎结构异常(图2-D), 部分颖果未见有胚胎分化的痕迹(图2-E)。因此, EED1突变影响了胚胎的发育。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2eed1胚胎萌发率与细胞活力分析
A: WT与eed1成熟颖果吸水7 d后的表型, 标尺为3 cm; B: WT与eed1成熟颖果吸水7 d后的萌发率分析; C~E: WT (C)与eed1 (D、E)成熟颖果纵切面的TTC染色, 标尺为1 mm; 数值为平均值±标准差; 采用Student’s t测验, **表示P < 0.01。
Fig. 2Germination rate and cell viability of eed1
A: phenotypes of WT and eed1 mature caryopses at 7 days after imbibition, bar: 3 cm; B: germination rate of WT and eed1 mature caryopses at 7 days after imbibition; C-E: TTC staining in longitudinally sectioned mature caryopses of WT (C) and eed1 (D, E), bar: 1 mm; values are means ± SDs by Student’s t-test. **: P < 0.01.
2.3 突变体eed1胚胎可诱导产生纯合再生植株
为了获得eed1纯合植株, 利用发育状态较好的eed1颖果, 成功诱导出胚性愈伤组织, 对其进行再分化培养, 可长出不定芽和不定根(图3-A), 继而获得了eed1纯合株系(图3-B)。我们分析了愈伤分化而来的ZH11和eed1植株的颖果的整个发育过程中鲜重和干重的变化。从受粉后(day after pollination, DAP) 15 d开始, eed1颖果的鲜重显著低于ZH11 (图3-C); 与ZH11相比, eed1颖果的干重, 从9 DAP起开始显著降低, 且随着颖果的发育, eed1和ZH11颖果干重之间的差异越来越明显(图3-D), 说明eed1的灌浆速率显著低于ZH11。就ZH11与eed1不同发育时期颖果外观变化而言, 自6 DAP时起便可见ZH11颖果胚胎轮廓清晰且随着颖果的发育胚乳逐渐变得透明; 而eed1颖果直到30 DAP, 也没有观察到具有清晰轮廓的胚胎, 且形成了不透明的胚乳组织(图3-E)。这种差异在颖果烘干之后更为明显, 相较于ZH11, 24、27和30 DAP的eed1颖果烘干后, 胚胎轮廓不清晰, 整粒颖果严重皱缩, 且胚乳不透明(图3-F), 这与之前观察到的表型一致(图1-A, B)。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3ZH11与eed1再生植株颖果表型分析
A~B: eed1愈伤组织在RE2培养基上分化产生不定芽和不定根(A), 最终长成小苗(B), 标尺为2 cm; C~D: ZH11与eed1不同发育时期颖果的鲜重(C)和干重(D)变化; E: ZH11与eed1受粉后0~30 d新鲜颖果的表型, 标尺为1 mm; F: ZH11与eed1受粉后24、27、30 d颖果烘干之后的表型, 标尺为1 mm; DAP为受粉后天数; 数值为平均值±标准差; 采用Student’s t测验, *表示P < 0.05, **表示P < 0.01。
Fig. 3Caryopses phenotype analyses from regenerated plantlets of ZH11 and eed1
A-B: the eed1 callus can differentiate into adventitious buds and roots on RE2 medium (A), and eventually grow into plantlets (B), bar: 2 cm; C-D: changes in the fresh (C) and dry (D) weight of ZH11 and eed1 caryopses of different stages; E: phenotypes of fresh caryopses of ZH11 and eed1 at 0-30 days after pollination, bar: 1 mm; F: phenotypes of dry caryopses of ZH11 and eed1 at 24, 27, and 30 DAP (days after pollination), bar: 1 mm; values are means ± SDs by Student’s t-test. *: P < 0.05; **: P < 0.01.
2.4 突变体eed1成熟颖果主要贮藏物质分析
相比ZH11和WT, 突变体eed1成熟颖果总淀粉含量分别下降了25.44%和29.64% (图4-A), 直链淀粉含量分别下降18.61%和20.72% (图4-B)。WT成熟颖果总淀粉和直链淀粉含量略高于ZH11。SDS-PAGE分析显示, eed1贮藏蛋白质谱带与ZH11和WT相比均发生明显的变化。其中, 谷蛋白37~39 kD的酸性亚基、20~22 kD的碱性亚基、α-球蛋白、13 kD和16 kD的醇溶蛋白以及分子量在14~16 kD之间的清蛋白等的积累量显著降低(图4-C)。因此, EED1的基因突变影响了水稻颖果中淀粉和贮藏蛋白的累积。图4
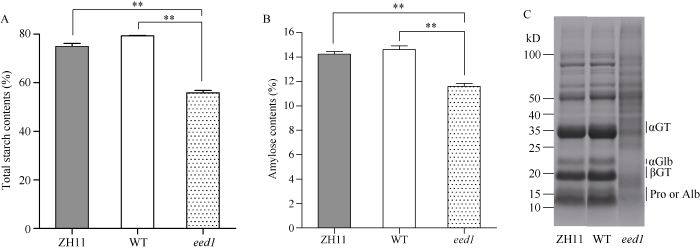 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4eedl颖果中淀粉含量和贮藏蛋白累积分析
A~B: ZH11、WT和eed1成熟颖果的总淀粉(A)和直链淀粉(B)含量的测定, n = 3。数值为平均值±标准差; 采用Student’s t测验, **表示P < 0.01; C: ZH11、WT和eed1成熟颖果总蛋白SDS-PAGE电泳图谱; αGT: 谷蛋白酸性亚基, αGlb: 球蛋白; βGT: 谷蛋白碱性亚基; Pro or Alb: 醇溶蛋白或清蛋白。
Fig. 4Starch contents and storage protein accumulations in eedl caryopses
A-B: the determination of the contents of total starch (A), amylose (B) in ZH11, WT, and eed1 mature caryopses, n = 3. Values are means ± SDs by Student’s t-test; **: P < 0.01; C: SDS-PAGE profiles of total protein in ZH11, WT, and eed1 mature caryopses; αGT: glutelin acidic subunits; αGlb: α-globulin; βGT: glutelin basic subunits; Pro or Alb: prolamins or albumins.
2.5 EED1突变影响胚乳中淀粉和贮藏蛋白合成基因的表达
水稻籽粒在10~15 DAP处于活跃的灌浆期。11~15 DAP ZH11和eed1胚乳中淀粉和贮藏蛋白生物合成基因相对表达量试验表明, 与ZH11相比, eed1胚乳中参与淀粉生物合成的大部分基因的表达量下降, 包括淀粉生物合成的限速酶AGPase各亚基的编码基因(OsAGPS2a除外) (图5-A), 只有OsAGPS2a、OsSSIIIb、OsSSIVa、OsISA3和OsDPE2基因表达量上调(图5-A)。相较于ZH11, eed1胚乳中参与贮藏蛋白生物合成的大多数基因的表达量也降低(图5-B), 仅有编码球蛋白的11S-Globulin、19kD-Globulin和RA17 (清蛋白编码基因之一)基因的表达量上调(图5-B)。说明EED1的突变严重影响了发育胚乳中淀粉和贮藏蛋白的合成,进而导致胚乳粉质。图5
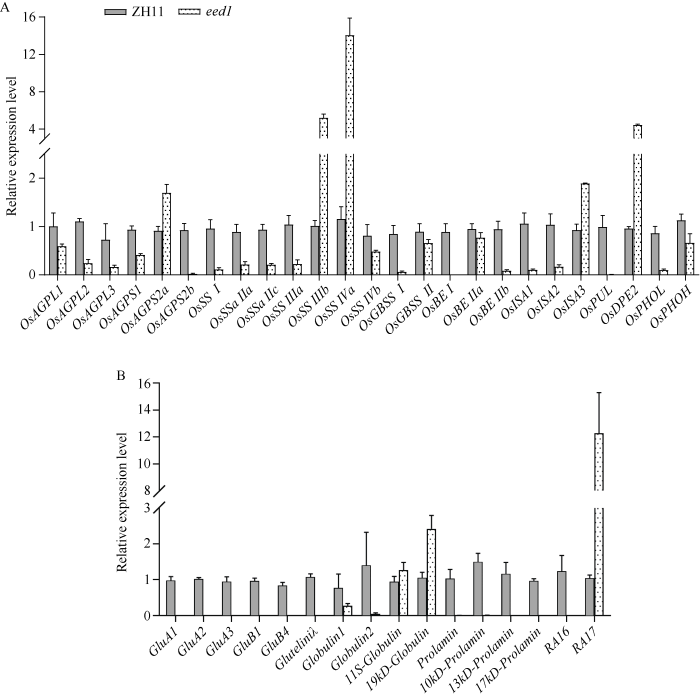 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5eed1胚乳中淀粉和贮藏蛋白合成基因的表达水平分析
A: 参与淀粉生物合成的基因在ZH11与eed1胚乳中的相对表达水平; B: 参与贮藏蛋白生物合成的基因在ZH11与eed1胚乳中的相对表达水平。
Fig. 5Relative expression profile of starch and storage protein biosynthesis genes in eed1
A: relative expression levels of genes involved in starch biosynthesis in endosperm of ZH11 and eed1; B: relative expression levels of genes involved in storage protein biosynthesis in endosperm of ZH11 and eed1.
2.6 EED1的遗传分析和基因定位
对杂合植株所产生的籽粒表型分析发现, 发育正常籽粒与胚胎且胚乳发育缺陷的eed1籽粒的性状分离比符合孟德尔3∶1的分离比率(χ2 < χ20.05,1 = 3.84, P > 0.05, 表3), 说明胚胎胚乳发育双缺陷的表型受1对隐性性状基因控制, 将该基因命名为Embryo and Endosperm Defective 1 (EED1)。Table 3
表3
表3EED1/eed1所产生籽粒的遗传分析
Table 3
| 表型 Phenotype | 杂合植株-1 Heterozygous plant-1 | 杂合植株-2 Heterozygous plant-2 | 杂合植株-3 Heterozygous plant-3 |
|---|---|---|---|
| 正常籽粒 Normal grains | 157 | 152 | 133 |
| 胚胎且胚乳缺陷籽粒 eed1 grains | 47 | 50 | 45 |
| χ2(3:1) | 0.418 < 3.84 (P > 0.05) | 0.006 < 3.84 (P > 0.05) | 0.007 < 3.84 (P > 0.05) |
新窗口打开|下载CSV
利用eed1与籼稻品种NJ6进行杂交, F1植株自交后获得用于基因定位的F2群体材料。通过观察该群体中F2植株所结F3籽粒的表型, 鉴定纯合野生型分离单株(所产生F3籽粒全部发育正常)和杂合体分离单株(所产生的F3籽粒中有1/4的籽粒胚胎和胚乳发育存在缺陷)。通过图位克隆的方法, 使用32株纯合野生型分离单株将EED1定位于9号染色体长臂分子标记OS907和InDel 908之间(图6-A)。进一步对61株杂合体分离单株进行分子标记连锁分析, 将该基因定位在分子标记InDel 950和RM201之间, 物理距离约672 kb (图6-B)。利用水稻数据库(http://rice.plantbiology.msu.edu/)查询该区间, 预测存在114个开放读码框(open reading frames, ORFs)。
图6
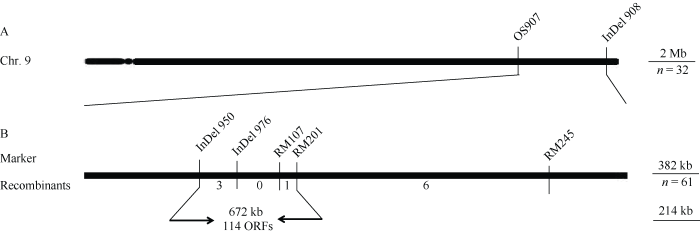 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6EED1基因的遗传定位
A: EED1基因与9号染色体长臂上的分子标记OS907和InDel908连锁; B: 利用61个分离单株将EED1定位到672 kb的区间内, 该区间内有114个ORFs。
Fig. 6Genetic mapping of EED1
A: EED1 was linked with makers OS907 and InDel908 on the long arm of chromosome 9; B: EED1 was mapped to a 672 kb region based on 61 segregated plants. The region contained 114 ORFs.
3 讨论
在水稻颖果发育过程中, 胚胎和胚乳的发育, 既相互独立, 又存在一定的依赖关系。目前已经有多个胚乳发育缺陷且胚胎致死突变体的研究报道, 如水稻中Guanylate Kinase 1 (GK1)基因编码一个线粒体和质体双定位的鸟苷酸激酶。GK1功能缺陷会导致水稻种子中线粒体和造粉体发育异常, 进而产生了胚胎致死以及胚乳粉质皱缩的表型[37]; Floury and Shrunken Endosperm 4 (FSE4)编码脯氨酸合成途径中的关键限速酶Δ1-吡咯啉-5-羧酸合成酶基因, fse4胚乳粉质且胚胎活力极低。通过外源喷施脯氨酸可部分恢复fse4种子萌发缺陷的表型[38]; flo13通过影响种子发育过程中能量的供应, 导致胚胎致死和胚乳中淀粉合成受阻[39]。本实验室之前发现Radicleless 1 (RL1)基因突变, 导致种子萌发延迟, 且不能产生主根, 胚乳呈现垩白的表型。将胚乳特异性启动子Glutelin C (GluC)驱动RL1的ORF载体转入rl1突变体中, 发现获得的转基因植株的种子不仅恢复了胚乳垩白的表型, 而且转基因植株种子的萌发也恢复正常且可以长出主根。这表明胚乳发育可能在胚胎发育中起作用[40]。虽然以上这些基因突变均引起胚胎和胚乳发育缺陷, 但是胚胎发育异常和胚乳发育缺陷之间的关联并没有解释清楚。本研究发现eed1突变体具有胚胎胚乳发育双缺陷的表型, 具体表现为eed1颖果干燥后皱缩, 胚乳粉质, 胚胎呈褐色(图1-A, B)。相较于WT, eed1颖果的萌发率显著降低(图2-B), 虽然个别eed1颖果可以萌发, 但随后会停止生长难以存活(图2-A)。TTC染色发现eed1胚胎活力呈现不同程度的降低(图2-D, E)。推测eed1萌发率低, 与其胚胎形态发生异常、胚乳营养物质累积缺陷和颖果发育后期耐脱水能力下降等因素有关。EED1可能同时在胚胎和胚乳中表达, 参与调控胚胎和胚乳的发育。因此, eed1突变体是解析胚胎和胚乳发育机制以及二者信号交流的优良材料。eed1突变表型是由于胚乳发育缺陷而导致胚胎败育, 还是由于胚胎发育缺陷不能与胚乳进行正常的信号交流, 导致胚乳中贮藏物质合成出现问题, 这一问题仍需要深入研究。水稻粉质胚乳的形成是由于胚乳中淀粉和贮藏蛋白充实不良, 导致淀粉粒之间存在空隙而形成的一种光学特性[41]。关于粉质胚乳突变体前人已经进行了大量的研究, 如水稻中粉质胚乳flo16突变体总淀粉和直链淀粉含量显著降低, 淀粉粒的形成存在缺陷[42]; FLO15编码质体乙二醛酶I, 影响了水稻胚乳中淀粉的生物合成和复合淀粉粒的形成[43]; FLO12编码水稻的丙氨酸转氨酶1, 该基因突变后导致籽粒中直链淀粉含量明显降低, 胚乳中淀粉粒排列疏松[44]; 玉米中编码β-胡萝卜素羟化酶3的基因Vitreous endosperm 1 (Ven1)突变会改变淀粉体膜的物理化学性质, 使淀粉体膜稳定性增强从而阻碍了蛋白与淀粉粒之间的相互作用, 最终导致粉质胚乳的形成[45]。本研究发现, 与ZH11和WT相比, eed1胚乳中淀粉含量(图4-A, B)和贮藏蛋白的累积(图4-C)显著降低。qRT-PCR分析显示, eed1中参与淀粉生物合成的关键基因显著下调(图5-A), 这些基因表达量的降低, 也许是eed1突变体颖果中总淀粉和直链淀粉含量下降的原因, 说明EED1也许参与调控水稻胚乳淀粉的生物合成过程。eed1中大部分贮藏蛋白编码基因的表达水平也显著降低(图5-B), 进而导致eed1颖果中贮藏蛋白的累积明显下降(图4-C), 这一结果暗示了EED1也很可能在贮藏蛋白的合成中发挥重要作用。
总之, 我们的研究表明, eed1突变体不仅胚胎发育存在缺陷, 而且胚乳中营养物质的累积也受到了影响, 暗示EED1在水稻胚胎和胚乳发育的调控中具有重要作用。之后, 这一研究还将进一步开展基因的精细定位、测序和后续基因功能的研究, 以解析水稻种子发育调控的分子机理。
4 结论
本研究分离鉴定了一个隐性突变体eed1, 该突变体胚胎形态发生和胚乳营养物质累积存在缺陷, 利用图位克隆的方法, 将EED1定位在9号染色体长臂InDel 950和RM201这2个分子标记内, 物理距离约为672 kb。在该区间内没有已克隆的籽粒发育相关的基因, 因此EED1是一个新的调控水稻籽粒发育的基因, 该基因在水稻胚胎和胚乳发育的调控中起重要作用。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
