 ,1,2,**, 孙超
,1,2,**, 孙超 ,1,2,**, 毕真真1,2, 秦天元1,2, 王一好1,2, 李成举1,2, 范又方1,2, 刘寅笃1,2, 张俊莲1, 白江平
,1,2,**, 毕真真1,2, 秦天元1,2, 王一好1,2, 李成举1,2, 范又方1,2, 刘寅笃1,2, 张俊莲1, 白江平 ,1,2,*
,1,2,*Identification of StDRO1 gene polymorphism and association analysis with root traits in potato
XU De-Rong ,1,2,**, SUN Chao
,1,2,**, SUN Chao ,1,2,**, BI Zhen-Zhen1,2, QIN Tian-Yuan1,2, WANG Yi-Hao1,2, LI Cheng-Ju1,2, FAN You-Fang1,2, LIU Yin-Du1,2, ZHANG Jun-Lian1, BAI Jiang-Ping
,1,2,**, BI Zhen-Zhen1,2, QIN Tian-Yuan1,2, WANG Yi-Hao1,2, LI Cheng-Ju1,2, FAN You-Fang1,2, LIU Yin-Du1,2, ZHANG Jun-Lian1, BAI Jiang-Ping ,1,2,*
,1,2,*通讯作者: *白江平, E-mail:baijp@gsau.edu.cn
第一联系人:
收稿日期:2020-11-8接受日期:2021-04-14网络出版日期:2021-06-16
| 基金资助: |
Corresponding authors: *E-mail:baijp@gsau.edu.cn
First author contact:
Received:2020-11-8Accepted:2021-04-14Published online:2021-06-16
| Fund supported: |
作者简介 About authors
许德蓉,E-mail:1830204585@qq.com
孙超,E-mail:sunc@gsau.edu.cn

摘要
为鉴定与马铃薯根系性状相关联的StDRO1基因单核苷酸多态性(single nucleotide polymorphism, SNP)位点, 本研究对110份同源四倍体马铃薯材料StDRO1基因的编码区进行了克隆和测序, 筛选其SNP, 并对StDRO1的SNP位点与马铃薯总根表面积、总根体积和平均根系直径等主要根系性状参数进行了关联分析。结果显示, StDRO1第2外显子上检测到1个SNP位点, 命名为G64C; 第3外显子上检测到10个SNP位点, 分别命名为G152A、A214G、A297G、C314T、A337T、T353C、T560A、C577A、C620A和C625A; 在第4外显子上检测到1个SNP位点, 命名为T793A。关联分析结果表明, StDRO1基因G152A位点在总根体积表现为GA类基因型>GG类基因型(P<0.05); C314T位点在平均根系直径表现为CC类基因型>CT类基因型(P<0.05); A337T位点在总根表面积、鲜重和干重均表现为AT类基因型>AA类基因型(P<0.05), 而在平均根系直径则表现为AA类基因型>AT类基因型(P<0.05); T353C位点在总根表面积、总根体积和鲜重均表现为TC类基因型>TT类基因型(P<0.05); C620A位点在总根体积表现为CA类基因型>CC类基因型(P<0.05); T793A位点在总根表面积、总根体积和鲜重均表现为AT类基因型>TT类基因型(P<0.05)。综上, StDRO1基因的上述6个SNP对马铃薯根系性状有显著影响, 其中A337T、T353C和T793A位点尤为重要。研究结果为后续马铃薯根系构型研究和遗传改良提供了理论参考, 但能否作为马铃薯根系性状遗传标记还需扩大群体样本进一步验证。
关键词:
Abstract
In order to identify the single nucleotide polymorphism (SNP) of StDRO1 gene associated with potato root traits, StDRO1 gene coding region of the 110 tetraploid potato genotypes was cloned and sequenced. The association analysis between the StDRO1 SNPs and the major root traits of potato such as surface area, volume, and average diameter were carried out. The results showed that a SNP (G64C) was detected in the second exon of the StDRO1, 10 SNPs (G152A, A214G, A297G, C314T, A337T, T353C, T560A, C577A, C620A, and C625A) were identified in the third exon, and a SNP (T793A) was detected in the fourth exon. The association analysis indicated that in the total root volume, G152A locus of StDRO1 gene showed that GA genotype was superior to GG genotype (P < 0.05). In the average root diameter, C314 locus showed that CC genotype were superior to CT genotype (P < 0.05). In the root surface area, fresh weight, and dry weight, A337T locus showed that AT genotype were better than AA genotype (P < 0.05), while the locus in the average root diameter showed that AT genotype was significantly lower than AA genotype (P < 0.05). The root surface area, root volume, and fresh weight were showed as TC genotype > TT genotype (P < 0.05) in T353C site; the root volume was showed as CA genotype > CC genotype (P < 0.05) in C620A site; the root surface area, root volume, and fresh weight were showed as AT genotype > TT genotype (P < 0.05) in T793A site. In summary, the above six SNPs of StDRO1 genes had a significant impact on potato root traits, and the A337T, T353C, and T793A sites were particularly important. These results provide a basic theoretical reference for subsequent potato root architecture research and genetic improvement, but whether it could be used as a genetic marker for potato root traits need to be further verified by expanding the population sample.
Keywords:
PDF (538KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
许德蓉, 孙超, 毕真真, 秦天元, 王一好, 李成举, 范又方, 刘寅笃, 张俊莲, 白江平. 马铃薯StDRO1基因的多态性鉴定及其与根系性状的关联分析. 作物学报, 2022, 48(1): 76-85 DOI:10.3724/SP.J.1006.2022.04241
XU De-Rong, SUN Chao, BI Zhen-Zhen, QIN Tian-Yuan, WANG Yi-Hao, LI Cheng-Ju, FAN You-Fang, LIU Yin-Du, ZHANG Jun-Lian, BAI Jiang-Ping.
马铃薯(Solanum tuberosum L.)作为第四大主粮作物, 富含淀粉、蛋白质、维生素C、粗纤维、钾和钙等, 营养成分全面, 营养结构合理, 在世界各地均有种植, 对提高全球营养水平和粮食安全具有重要意义[1]。近年来, 对块茎块根类作物根系的研究发现, 根系形态结构的优化与该类作物产量形成高度相关, 作物根系的空间分布在很大程度上决定植物获得土壤资源的能力, 对于提高作物水分和养分利用效率, 提高作物在非生物胁迫条件下的适应性具有深远意义[2,3]。在禾本科等作物中, 已经将根系性状作为重要的育种指标[4,5]。而马铃薯作为典型的浅根系块茎类作物, 其根系在紧实土壤中的穿透力较弱, 出苗至成熟各个时期的非生物胁迫都会降低块茎的产量和品质[6,7,8]。因此, 根系性状的研究对马铃薯高产抗逆育种具有重要意义。随着分子生物学的不断发展, 分子遗传标记技术的优势日益突出, 相较于单一的传统育种技术, 分子遗传标记和重要性状的关联分析可大大缩短育种周期, 提高育种效率和准确性。
Uga等[9,10]对水稻(Oryza sativa L.)中克隆到的OsDRO1 (DEEPER ROOTING 1)研究发现, OsDRO1在生长素信号通路下游发挥作用, 控制水稻根系的向重力性弯曲, OsDRO1过表达能增加根系深度, 减小根系的垂直角度, 使其生长方向更为竖直, 从深层土壤中吸收更多的水分, 显著提高了干旱条件下水稻的产量; 随后在拟南芥(Arabidopsis thaliana L.)中对AtDRO1基因功能的验证发现, AtDRO1主要分布在根尖上, AtDRO1突变导致侧根水平角度增大, 而AtDRO1过表达则导致侧根角度变陡、叶片向上卷曲和角果变短, 表明DRO1基因在调控根系构型方面发挥着重要作用[11,12]。马铃薯StDRO1基因(NCBI登记号: LOC102585440)属于IGT基因家族, 包含5个外显子和4个内含子, 编码282个氨基酸[13]。本课题组前期对StDRO1的研究发现, StDRO1参与调控侧根角度、侧根数和根尖角度, 而对主根长无显著调控作用, 与水稻和拟南芥的DRO1基因的功能相似[13]。因此, 本研究通过对110份参试马铃薯材料StDRO1基因的测序和SNPs位点鉴定, 寻找与根系性状关联的SNPs, 以期为马铃薯根系性状的遗传改良发掘分子标记并提供理论参考。
1 材料与方法
1.1 植物材料
本研究以110份同源四倍体马铃薯试管苗为试验材料, 包括大西洋、费乌瑞它、青薯9号、甘农薯2号、陇薯3号、陇薯6号及甘肃农业大学甘肃省种质改良与创新重点实验室从国际马铃薯中心(International Potato Center, CIP)引进的104份马铃薯高代品系(表1)。这些高代品系由国际马铃薯中心从秘鲁和玻利维亚及周边国家收集的不同马铃薯四倍体野生种和栽培种组成, 来自于7个不同育种群体以及一些不同来源的原始品种, 遗传背景差异大, 表型丰富多变, 适合做基因多样性分析[14,15]。剪取1~2 cm上述材料的组培苗茎段, 放置于在培养板上, 竖直培养21 d后观测根系表型并采集DNA提取所需材料。Table 1
表1
表1110份马铃薯材料信息表
Table 1
| 材料编号 Material code | CIP号 CIP code | 材料编号 Material code | CIP号 CIP code | 材料编号 Material code | CIP号 CIP code |
|---|---|---|---|---|---|
| C2 | CIP391065.69 | C56 | CIP394034.65 | C99 | CIP388615.22 |
| C4 | CIP392617.54 | C57 | CIP394034.7 | C100 | CIP389468.3 |
| C5 | CIP392634.52 | C58 | CIP394579.36 | C101 | CIP390637.1 |
| C8 | CIP393227.66 | C59 | CIP394600.52 | C102 | CIP391180.6 |
| C9 | CIP393228.67 | C60 | CIP394611.112 | C103 | CIP391533.1 |
| C10 | CIP393371.164 | C61 | CIP394613.139 | C104 | CIP391724.1 |
| C11 | CIP391004.18 | C62 | CIP394613.32 | C105 | CIP392032.2 |
| C13 | CIP393280.64 | C63 | CIP394614.117 | C106 | CIP392740.4 |
| C14 | CIP391047.34 | C64 | CIP394881.8 | C107 | CIP392745.7 |
| C15 | CIP391058.175 | C65 | CIP395186.6 | C108 | CIP392759.1 |
| C16 | CIP393085.5 | C66 | CIP395193.6 | C109 | CIP393613.2 |
| C17 | CIP398192.213 | C67 | CIP395195.7 | C110 | CIP393615.6 |
| C18 | CIP398098.119 | C68 | CIP395196.4 | C112 | CIP397030.31 |
| C19 | CIP398098.203 | C70 | CIP395432.51 | C113 | CIP397035.26 |
| C20 | CIP398180.253 | C71 | CIP395434.1 | C114 | CIP302428.20 |
| C21 | CIP398180.289 | C72 | CIP395436.8 | C115 | CIP302476.108 |
| C23 | CIP398180.612 | C74 | CIP396311.1 | C116 | CIP302499.30 |
| C27 | CIP398208.33 | C79 | CIP397029.21 | C117 | CIP304345.102 |
| C28 | CIP398208.58 | C80 | CIP397036.7 | C119 | CIP304350.118 |
| C29 | CIP398208.704 | C81 | CIP397039.51 | C120 | CIP304350.95 |
| C30 | CIP301024.14 | C82 | CIP397044.25 | C121 | CIP304371.67 |
| C32 | CIP301040.63 | C83 | CIP397055.2 | C122 | CIP304383.41 |
| C33 | CIP300046.22 | C84 | CIP397065.2 | C123 | CIP304383.80 |
| C34 | CIP300048.12 | C85 | CIP397067.2 | C124 | CIP304387.39 |
| C35 | CIP300054.29 | C86 | CIP397069.5 | C127 | CIP397077.16 |
| C39 | CIP300072.1 | C87 | CIP397073.15 | C128 | CIP391919.3 |
| C41 | CIP300099.22 | C88 | CIP397078.12 | C130 | CIP391931.1 |
| C43 | CIP379706.27 | C89 | CIP397079.26 | C131 | CIP394906.6 |
| C44 | CIP385499.11 | C90 | CIP397079.6 | C132 | CIP395438.1 |
| C46 | CIP388676.1 | C91 | CIP397098.12 | C133 | CIP394904.20 |
| C48 | CIP390478.9 | C92 | CIP397099.6 | Atl | 大西洋Atlantic |
| C49 | CIP391207.2 | C93 | CIP397100.9 | QS9 | 青薯9号Qingshu 9 |
| C50 | CIP391382.18 | C94 | CIP397196.3 | GN2 | 甘农薯2号Gannongshu 2 |
| C51 | CIP392781.1 | C95 | CIP397196.8 | LS3 | 陇薯3号Longshu 3 |
| C52 | CIP392797.22 | C96 | CIP397197.9 | LS6 | 陇薯6号Longshu 6 |
| C53 | CIP392822.3 | C97 | CIP398014.2 | Fa | 费乌瑞它Favorita |
| C54 | CIP392973.48 | C98 | CIP388611.22 |
新窗口打开|下载CSV
1.2 基因组DNA提取
利用植物基因组DNA提取试剂盒(天根生化科技(北京)有限公司)提取马铃薯试管苗基因组DNA, 用超微量分光光度计检测DNA的质量和浓度, 检测合格后, -20℃保存备用。1.3 引物设计及合成
根据NCBI上公布的马铃薯DRO1基因的序列信息(XM_006361272.2), 使用Primer Premier 5软件设计StDRO1基因特异扩增引物, 引物序列见表2。由北京擎科生物科技有限公司西安分公司合成引物。Table 2
表2
表2PCR引物序列
Table 2
| 引物 Primer | 引物序列 Primer sequences (5′-3′) | 退火温度 Annealing temperature (℃) | 产物片段长度 Product fragment length (bp) |
|---|---|---|---|
| DRO1-F | CCATTCAAACATCATCACAAGA | 55 | 1670 |
| DRO1-R | GAAATGGAACAACTAGCAGAGA |
新窗口打开|下载CSV
1.4 目的基因扩增
使用普通PCR仪进行StDRO1基因扩增, PCR反应体系50 µL, 包含2 × buffer 25 µL、dNTP (2 mm) 12.5 µL、ddH2O 7.5 µL、上下游引物各自1 µL、KOD FX酶1 µL、DNA模板2 µL。PCR反应程序为95℃预变性5 min; 95℃变性30 s, 55℃退火30 s, 72℃延伸2 min, 共35个循环; 72℃延伸10 min; 4℃保存。1.5 PCR产物测序和序列分析
PCR产物各取5 µL, 经1.0%琼脂糖凝胶电泳检测合格后, 送北京擎科生物科技有限公司西安分公司测序。为验证PCR产物直接测序结果是否准确, 同时随机选取20份材料的PCR产物送通用生物系统(安徽)有限公司做单克隆测序, 单克隆测序结果与PCR产物直接测序结果一致。用DNAMAN软件对测序结果序列进行拼接, 用DNAMAN软件进行多序列比对并寻找SNP位点。1.6 根系指标测定
用根系扫描仪扫描获取马铃薯试管苗总根表面积、平均根系直径、总根体积等主要根系性状参数; 根系干鲜重: 将马铃薯试管苗根系剪下后用无菌水清洗干净, 用滤纸吸掉根系表面残留的水分, 称量鲜重。称量完鲜重后将根系放在玻璃培养皿中于烘箱中105℃杀青10 min, 85℃烘干至恒重, 称量干重。1.7 数据统计
使用 Microsoft Excel 2016软件计算基因频率、基因型频率、遗传纯合度(homozygosity, Ho)、遗传杂合度(heterozygosity, He)、有效等位基因数(effective number of allele, Ne)、多态信息含量(polymorphism information content, PIC)和卡平方(χ2)检验分析, 并对试验所用110份马铃薯材料的各个根系指标数据(总根表面积、平均根系直径、总根体积、鲜重和干重)进行整理; 使用SPSS 22.0软件进行数据的显著性分析。2 结果与分析
2.1 StDRO1基因PCR扩增结果
采用1.0%琼脂糖凝胶电泳检测PCR产物发现(图1), 片段长度与预期目的片段大小吻合, 条带明亮无杂带, 符合后续测序试验要求。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1StDRO1基因PCR产物电泳检测结果
M为DNA 2000分子标记; 1、2、3、4和5分别表示材料C2、C4、C5、C8和C9的StDRO1扩增片段。
Fig. 1PCR detection of StDRO1 genes
M: DNA 2000 marker; Number of 1, 2, 3, 4, and 5 represent StDRO1 amplified fragments from materials C2, C4, C5, C8, and C9, respectively.
2.2 StDRO1基因测序结果比对
将110份四倍体马铃薯材料的StDRO1克隆后进行测序, 对外显子序列进行比对分析, 部分结果见图2。经比对分析, StDRO1编码区共发现12处SNP位点(表3)。在StDRO1基因第2外显子64 bp处上发现1个SNP位点(G64C), 在StDRO1基因第3外显子上发现10个SNP位点(G152A、A214G、A297G、C314T、A337T、T353C、T560A、C577A、C620A和C625A), 在StDRO1基因第4外显子上793 bp发现1个SNP位点(T793A), 且每个SNP在该群体中都只检测到2种基因型(表4)。图2
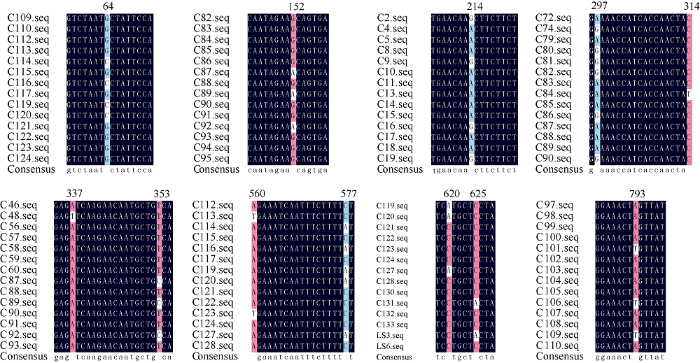 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2马铃薯StDRO1基因序列比对结果
Fig. 2Sequence alignment of StDRO1 genes in potato
Table 3
表3
表3不同马铃薯材料StDRO1基因编码区的单核苷酸变异
Table 3
| 碱基类型 Base type | 碱基位置Base site (bp) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 64 | 152 | 214 | 297 | 314 | 337 | 353 | 560 | 577 | 620 | 625 | 793 | |
| 参考基因组碱基类型 Base type of reference genome | G | G | A | A | C | A | T | T | C | C | C | T |
| 变异碱基类型 Variant base type | C | A | G | G | T | T | C | A | A | A | A | A |
新窗口打开|下载CSV
Table 4
表4
表4马铃薯StDRO1的基因型频率和基因频率
Table 4
| 单核苷酸多态性位点 SNP | 样本数 Sample number | 基因型频率 Genotype frequency | 基因频率 Gene frequency | 卡平方 χ2 | ||
|---|---|---|---|---|---|---|
| G64C | 110 | GG 0.2818 (31) | GC 0.7182 (79) | G 0.6409 | C 0.3591 | 34.5310 |
| G152A | 110 | GG 0.8364 (92) | GA 0.1636 (18) | G 0.9182 | A 0.0818 | 0.8734 |
| A214G | 110 | AA 0.3909 (43) | AG 0.6091 (67) | A 0.6955 | G 0.3045 | 21.0940 |
| A297G | 110 | AA 0.2545 (28) | AG 0.7455 (82) | A 0.6273 | G 0.3727 | 38.8385 |
| C314T | 110 | CC 0.6818 (75) | CT 0.3182 (35) | C 0.8409 | T 0.1591 | 3.9372 |
| 单核苷酸多态性位点 SNP | 样本数 Sample number | 基因型频率 Genotype frequency | 基因频率 Gene frequency | 卡平方 χ2 | ||
| A337T | 110 | AA 0.6818 (75) | AT 0.3182 (35) | A 0.8409 | T 0.1591 | 3.9372 |
| T353C | 110 | TT 0.8182 (90) | TC 0.1818 (20) | T 0.9091 | C 0.0909 | 1.1000 |
| T560A | 110 | AA 0.6182 (68) | AT 0.3818 (42) | A 0.8091 | T 0.1909 | 6.1242 |
| C577A | 110 | CC 0.2818 (31) | CA 0.7182 (79) | C 0.6409 | A 0.3591 | 34.5310 |
| C620A | 110 | CC 0.3545 (39) | CA 0.6455 (71) | C 0.6773 | A 0.3227 | 24.9768 |
| C625A | 110 | CC 0.6545 (72) | CA 0.3455 (38) | C 0.8273 | A 0.1727 | 4.7953 |
| T793A | 110 | AT 0.7909 (87) | TT 0.2091 (23) | A 0.3955 | T 0.6045 | 47.0682 |
新窗口打开|下载CSV
2.3 马铃薯DRO1基因型频率和基因频率
由表4可知, 在G64C、A214G、A297G、C577A、C620A和T793A位点, 杂合基因型为优势基因型; G152A、C314T、A337T、T353C、T560A和C625A位点, 纯合基因型为优势基因型。卡方检验结果显示, G152A和T353C位点处于Hardy-Weinberg平衡状态(P>0.05), 其余位点偏离Hardy-Weinberg平衡状态(P<0.05)。2.4 马铃薯DRO1基因群体遗传特异性
由表5可知, 马铃薯DRO1基因G152A、C314T、A337T、T353C、A560T和C625A位点的纯合度(Ho)均高于杂合度(He), 说明这6个位点在该群体中变异程度都较小; G64C、A214G、A297G、C577A、C620A和A793T位点的纯合度(Ho)略高于杂合度(He), 遗传变异程度处于中等水平; G152A、C314T、A337T、T353C和C625A位点的多态性偏低(PIC<0.25); G64C、A214G、A297G、A560T、C577A、C620A和A793T位点处于中度多态性(0.25<PIC<0.5)。Table 5
表5
表5马铃薯StDRO1基因群体遗传特异性
Table 5
| 单核苷酸多态性位点SNP | 纯合度 Homozygosity | 杂合度Heterozygosity | 有效等位基因数 Effective number of alleles | 多态信息含量 Polymorphism information content (PIC) |
|---|---|---|---|---|
| G64C | 0.5397 | 0.4603 | 1.8528 | 0.3544 |
| G152A | 0.8498 | 0.1502 | 1.1768 | 0.1390 |
| A214G | 0.5764 | 0.4236 | 1.7349 | 0.3339 |
| A297G | 0.5324 | 0.4676 | 1.8783 | 0.3583 |
| C314T | 0.7324 | 0.2676 | 1.3653 | 0.2318 |
| A337T | 0.7324 | 0.2676 | 1.3653 | 0.2318 |
| T353C | 0.8347 | 0.1653 | 1.1980 | 0.1516 |
| A560T | 0.6911 | 0.3089 | 1.4470 | 0.2612 |
| C577A | 0.5397 | 0.4603 | 1.8528 | 0.3544 |
| C620A | 0.5629 | 0.4371 | 1.7767 | 0.3416 |
| C625A | 0.7142 | 0.2858 | 1.4001 | 0.2449 |
| A793T | 0.5219 | 0.4781 | 1.9162 | 0.3638 |
新窗口打开|下载CSV
2.5 马铃薯DRO1基因SNP与根系性状的关联分析
2.5.1 单个SNP位点与马铃薯根系性状的关联分析 由表6可知, G152A位点上GA类基因型的总根体积显著高于GG类基因型(P<0.05); C314T位点上CC类基因型的平均根系直径显著高于CT类基因型(P<0.05); A337T位点上AT类基因型的总根表面积、鲜重和干重均显著高于AA类基因型(P<0.05), 而平均根系直径则显著低于AA类基因型(P<0.05); T353C位点上TC类基因型的总根表面积、总根体积和鲜重均显著高于TT类基因型(P<0.05); C620A上位点CA类基因型的总根体积显著高于CC类基因型(P<0.05); T793A位点上AT类基因型的总根表面积、总根体积和鲜重均显著高于TT类基因型(P<0.05)。Table 6
表6
表6StDRO1基因多态性与马铃薯根系性状的关联分析
Table 6
| 单核苷酸多态性位点SNP | 基因型Genotype | 总根表面积 Surface area (cm2) | 平均根系直径 Average diameter (mm) | 总根体积 Root volume (cm3) | 鲜重 Fresh weight (g) | 干重 Dry weight (g) |
|---|---|---|---|---|---|---|
| G64C | GG | 14.9413±3.1468 a | 0.4150±0.0604 a | 0.1412±0.0495 a | 0.1393±0.0649 a | 0.0107±0.0047 a |
| GC | 14.0160±3.7477 a | 0.4270±0.1101 a | 0.1482±0.0577 a | 0.1352±0.0568 a | 0.0100±0.0053 a | |
| G152A | GG | 13.9844±3.5567 a | 0.4237±0.1040 a | 0.1415±0.0529 b | 0.1335±0.0571 a | 0.0102±0.0052 a |
| GA | 15.7710±3.5351 a | 0.4233±0.0660 a | 0.1702±0.0629 a | 0.1514±0.0672 a | 0.0102±0.0048 a | |
| A214G | AA | 13.5207±3.4322 a | 0.4401±0.1031 a | 0.1509±0.0590 a | 0.1283±0.0586 a | 0.0094±0.0053 a |
| AG | 14.7620±3.6443 a | 0.4131±0.0948 a | 0.1432±0.0531 a | 0.1416±0.0590 a | 0.0106±0.0049 a | |
| A297G | AA | 14.5685±3.2391 a | 0.4056±0.0572 a | 0.1340±0.0462 a | 0.1400±0.0635 a | 0.0107±0.0051 a |
| AG | 14.1772±3.7271 a | 0.4298±0.1087 a | 0.1504±0.0578 a | 0.1351±0.0576 a | 0.0100±0.0051 a | |
| C314T | CC | 13.9384±3.4374 a | 0.4378±0.1073 a | 0.1475±0.0578 a | 0.1302±0.0573 a | 0.0096±0.0051 a |
| CT | 15.0018±3.8743 a | 0.3934±0.0683 b | 0.1434±0.0503 a | 0.1498±0.0609 a | 0.0114±0.0050 a | |
| A337T | AA | 13.7373±3.4046 b | 0.4372±0.1061 a | 0.1465±0.0593 a | 0.1282±0.0553 b | 0.0094±0.0048 b |
| AT | 15.4327±3.7782 a | 0.3946±0.0731 b | 0.1455±0.0466 a | 0.1541±0.0633 a | 0.0118±0.0053 a | |
| 单核苷酸多态性位点SNP | 基因型Genotype | 总根表面积 Surface area (cm2) | 平均根系直径 Average diameter (mm) | 总根体积 Root volume (cm3) | 鲜重 Fresh weight (g) | 干重 Dry weight (g) |
| T353C | TT | 13.9052±3.5271 b | 0.4238±0.1050 a | 0.1407±0.0527 b | 0.1312±0.0555 b | 0.0100±0.0051 a |
| TC | 15.9487±3.5253 a | 0.4229±0.0639 a | 0.1712±0.0613 a | 0.1597±0.0691 a | 0.0109±0.0052 a | |
| T560A | AA | 13.7829±3.3268 a | 0.4295±0.1115 a | 0.1381±0.0521 a | 0.1303±0.0545 a | 0.0100±0.0051 a |
| AT | 15.0764±3.9096 a | 0.4142±0.0732 a | 0.1593±0.0585 a | 0.1462±0.0649 a | 0.0104±0.0051 a | |
| C577A | CC | 14.5161±3.7664 a | 0.4038±0.0608 a | 0.1363±0.0477 a | 0.1432±0.0617 a | 0.0109±0.0049 a |
| CA | 14.1828±3.5511 a | 0.4314±0.1092 a | 0.1501±0.0579 a | 0.1337±0.0580 a | 0.0099±0.0052 a | |
| C620A | CC | 14.0477±3.6818 a | 0.4018±0.0589 a | 0.1307±0.0449 b | 0.1407±0.0627 a | 0.0103±0.0050 a |
| CA | 14.4026±3.5725 a | 0.4356±0.1132 a | 0.1548±0.0589 a | 0.1340±0.0570 a | 0.0101±0.0052 a | |
| C625A | CC | 14.3825±3.5532 a | 0.4159±0.0926 a | 0.1450±0.0551 a | 0.1334±0.0552 a | 0.0099±0.0051 a |
| CA | 14.0765±3.7234 a | 0.4384±0.1087 a | 0.1485±0.0565 a | 0.1420±0.0658 a | 0.0106±0.0052 a | |
| T793A | TT | 12.4573±2.7287 b | 0.4114±0.0964 a | 0.1259±0.0515 b | 0.1134±0.0482 b | 0.0086±0.0041 a |
| AT | 14.7578±3.6593 a | 0.4269±0.0994 a | 0.1516±0.0554 a | 0.1425±0.0602 a | 0.0106±0.0053 a |
新窗口打开|下载CSV
2.5.2 不同SNP位点组合与马铃薯根系性状的关联分析 将对马铃薯总根表面积和鲜重都有显著影响的A337T、T353C和T793A位点不同基因型组合后发现, 组合7-7和7-3的总根表面积都显著大于组合7-2和7-6 (P<0.05), 组合7-7的鲜重显著高于组合7-2 (P<0.05), 其余各组合之间无显著差异(P>0.05) (表7); 将对平均根系直径有显著影响的C314T和A337T位点不同基因型组合后发现, 各组合的平均根系直径之间无显著差异(P>0.05) (表8); 将对马铃薯总根体积有显著影响的G152A、T353C、C620A和T793A位点不同基因型组合后发现, 组合9-6和9-9的总根体积显著大于除组合9-8之外的其他组合(P<0.05), 组合9-8的总根体积显著大于组合9-2 (P<0.05), 其余各组合间无显著差异(P>0.05) (表9)。
Table 7
表7
表7不同SNP位点组合与马铃薯总根表面积和鲜重的关联分析
Table 7
| 基因型组合编号 Code of genotype combinations | 基因型组合 Genotype combinations | 总根表面积 Surface area (cm2) | 鲜重 Fresh weight (g) |
|---|---|---|---|
| 7-1 | 337AA+353TT+793AT | 13.7148±3.3564 ab | 0.1290±0.0530 ab |
| 7-2 | 337AA+353TT+793TT | 12.0009±2.2114 b | 0.1028±0.0364 b |
| 7-3 | 337AA+353TC+793AT | 16.0900±3.6150 a | 0.1532±0.0674 ab |
| 7-4 | 337AA+353TC+793TT | 14.7243±3.3069 ab | 0.1583±0.0783 ab |
| 7-5 | 337AT+353TT+793AT | 15.3848±3.8763 ab | 0.1515±0.0621 ab |
| 7-6 | 337AT+353TT+793TT | 11.6084±2.0201 b | 0.1250±0.0230 ab |
| 7-7 | 337AT+353TC+793AT | 16.7491±3.0515 a | 0.1808±0.0621 a |
新窗口打开|下载CSV
Table 8
表8
表8不同SNP位点组合与马铃薯平均根系直径的关联分析
Table 8
| 基因型组合编号 Code of genotype combinations | 基因型组合 Genotype combinations | 平均根系直径 Average diameter (mm) |
|---|---|---|
| 8-1 | 314CC+337AA | 0.4420±0.1073 a |
| 8-2 | 314CC+337AT | 0.3794±0.0992 a |
| 8-3 | 314CT+337AA | 0.3708±0.0600 a |
| 8-4 | 314CT+337AT | 0.3971±0.0698 a |
新窗口打开|下载CSV
Table 9
表9
表9不同SNP位点组合与马铃薯总根体积的关联分析
Table 9
| 基因型组合编号 Code of genotype combinations | 基因型组合 Genotype combinations | 总根体积 Root volume (cm3) |
|---|---|---|
| 9-1 | 152GG+353TT+620CC+793AT | 0.1399±0.0441 bc |
| 9-2 | 152GG+353TT+620CC+793TT | 0.0967±0.0229 c |
| 9-3 | 152GG+353TT+620CA+793AT | 0.1500±0.0558 bc |
| 9-4 | 152GG+353TT+620CA+793TT | 0.1344±0.0561 bc |
| 9-5 | 152GG+353TC+620CA+793AT | 0.1343±0.0098 bc |
| 9-6 | 152GG+353TC+620CA+793TT | 0.2247±0.0198 a |
| 9-7 | 152GA+353TC+620CC+793AT | 0.1347±0.0494 bc |
| 9-8 | 152GA+353TC+620CC+793TT | 0.1754±0.0511 ab |
| 9-9 | 152GA+353TC+620CA+793AT | 0.2186±0.0543 a |
| 9-10 | 152GA+353TC+620CA+793TT | 0.1053±0.0553 bc |
新窗口打开|下载CSV
3 讨论
干旱是旱作条件下影响马铃薯生产的主要非生物胁迫, 而目前中国60%左右的马铃薯种植于年均降水量低于500 mm的干旱和半干旱地区。马铃薯作为浅根系干旱敏感作物, 这些地区的间歇性恶劣气候以及长期的水资源缺乏严重影响着马铃薯植株的生长发育、块茎的产量和商品性[16]。根系作为植物汲取土壤水分和养分的重要地下功能器官, 如果植株根系在土壤中的分布达到最佳状态, 可帮助植株汲取更多的水分和养分来避免干旱胁迫。因此, 根系构型的改良可作为马铃薯耐旱育种评鉴与筛选指标之一。已有研究表明禾本科类作物根系性状受DRO1等关键基因的调控[9,10]。DRO1作为水稻深根抗旱的主效数量性状位点(quantitative trait locus, QTL)被克隆以来, 除了在拟南芥中进行了根系发育调控的深入研究外, 近年来在小麦、大麦和玉米等作物中也证实了其参与调控根系构型[17,18,19]。本课题组也一直对DRO1是否参与调控马铃薯根系发育和耐旱性十分关注, 我们发现StDRO1所在的IGT家族共有10个成员, 其中StDRO1、PGSC0003DMG400016036、PGSC0003DMG400000126、PGSC0003DMG4000413 71、PGSC0003DMG401019811、PGSC0003DMG40 0035280和PGSC0003DMG400042006等多个成员响应干旱胁迫[20,21]。本课题组对模式植物拟南芥的过表达遗传转化试验表明, StDRO1参与调控根系角度、根尖数等重要的根系性状, 并提高了拟南芥的抗旱性[13]。因此, 本研究选用StDRO1作为马铃薯根系性状相关的候选基因, 寻找StDRO1基因编码区与根系性状关联的SNPs位点。
栽培种马铃薯大多为同源四倍体(2n=4x=48), 基因组高度杂合, 对其进行DNA序列变异的基因分型比在二倍体物种中更具挑战性, 因为一个给定的基因可能在每个基因型的每个位点上最多有4个不同的等位基因[22]。Herman等[23]对129,156份马铃薯材料的基因分型研究发现, 马铃薯种质表现出大量相对罕见的变异和单倍型, 具有很高的核苷酸多态性, 外显子的平均变异密度为1SNP/24 bp, 内含子的平均变异密度为1SNP/15 bp。本研究对110份马铃薯材料StDRO1基因的测序分析表明, StDRO1基因外显子的变异密度为1SNP/71 bp, 检测到的12个变异位点都只存在2种基因型, 而马铃薯StDRO1基因是否有更多的变异位点和基因型需要在更大的群体中加以验证。
基因多态性和性状的关联研究表明, 对马铃薯根系发育影响的变异位点主要集中在StDRO1基因的第3外显子上, 第2和第4外显子分别只检测到1个变异位点, 第1和第5外显子上尚未发现变异位点。其中, StDRO1基因G152A位点对马铃薯总根体积有显著影响(P<0.05); C314T位点对平均根系直径有显著影响(P<0.05); A337T位点对总根表面积、平均根系直径、鲜重和干重均有显著影响(P<0.05); T353C位点对总根表面积、总根体积和鲜重有显著影响(P<0.05); C620A位点对总根体积有显著影响(P<0.05); T793A位点对总根表面积、总根体积和鲜重均有显著影响(P<0.05); 而G64C、A214G、A297G、T560A、C577A和C625A位点对根系发育的影响不显著(P>0.05)。因此, A337T、T353C和T793A位点作为与根系指标关联度最高的3个SNP, 可作为分子标记辅助马铃薯根系改良和耐旱的常规遗传育种, 缩短育种周期, 提高育种效率。此外, 随着作物基因编辑在近年来的迅速发展, 单核苷酸定向突变已在禾本科作物中顺利实现[24]。本研究发现的StDRO1三个位点的优势基因型分别为AT类(337)、TC类(353)和AT类(793), 可以此3种基因型为目标, 在马铃薯栽培种中进行定向基因编辑等分子育种相关的尝试, 通过改变根系构型, 以期获得在已有优良性状基础上增加水肥高效利用和抗旱的新种质。再者, 通过筛选, 我们发现集合了StDRO1所有优势基因型位点的材料有11个(C8、C21、C39、C52、C82、C83、C96、C103、C07、C110和C122), 这些材料可以作为后续马铃薯遗传育种的优异亲本。
DRO1所在的IGT基因家族除调控根系性状外, 还参与调控地上部的分支角度[25,26,27,28,29,30]。形态分析学表面, 水稻la1-ZF802和tac1突变体植株相较于野生型表现为分蘖展开表型, la1-ZF802突变体的叶片角度也比野生型更大[25,26]。T-DNA插入和RNA干扰AtLAZY1基因使得拟南芥的花序分枝角度从野生型的42°增加到81°, 而lzy1lzy2lzy3三重突变植株表现出更严重的向重力性缺陷, 侧枝几乎倾向于水平方向生长, 证明AtLZY1、AtLZY2和AtLZY3 (AtDRO1)基因共同参与拟南芥地上分支角度的调控[27,28]。水稻和拟南芥的功能同源基因ZmLA1的突变体植株表现为匍匐生长[29]。此外, 李属植物的PpeTAC1也调控其地上部分的分支角度[30]。地上部分作为光合作用的主要场所, 其分支角度和茎叶构型对马铃薯等作物的能量转化效率具有重要影响, 进而影响其产量和抗逆性。因此, DRO1基因和其他IGT基因家族成员也可以作为马铃薯地上部分性状关联分析的候选基因, 进行深入研究。
4 结论
本研究发现, 马铃薯StDRO1基因第2外显子上检测出1个SNP位点; 第3外显子上检测出10个SNPs位点; 第4外显子上检测出1个SNP位点。StDRO1基因第3外显子上A337T、T353C位点和第4外显子上的T793A位点对总根表面积有显著影响; 第3外显子上C314T和A337T位点对平均根系直径有显著影响; 第3外显子上G152A、T353C和C620A位点, 以及第4外显子上T793A位点对总根体积有显著影响; 第3外显子上A337T、T353C位点, 以及第4外显子上T793A位点对马铃薯根系鲜重有显著影响; 第3外显子上A337T位点对根系干重有显著影响, 且上述各位点组合后对马铃薯的根系性状也有显著影响。但这些位点是否可作为培育优良马铃薯根系构型的参考依据, 需在更大的群体中加以验证。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
