 ,1,*, 王显亚1, 刘一灵2, 赵杰宏3
,1,*, 王显亚1, 刘一灵2, 赵杰宏3NtPHYB1 interacts with light and temperature signal to regulate seed germination in Nicotiana tabacum L.
LI Zhen-Hua ,1,*, WANG Xian-Ya1, LIU Yi-Ling2, ZHAO Jie-Hong3
,1,*, WANG Xian-Ya1, LIU Yi-Ling2, ZHAO Jie-Hong3通讯作者: *李振华, E-mail:lixing_19841014@126.com
收稿日期:2020-12-15接受日期:2021-04-14网络出版日期:2021-06-28
| 基金资助: |
Corresponding authors: *E-mail:lixing_19841014@126.com
Received:2020-12-15Accepted:2021-04-14Published online:2021-06-28
| Fund supported: |

摘要
光照和温度是影响种子萌发的2个重要环境因子, 光敏色素是光和温度的受体, 研究光敏色素协同光温信号调控种子萌发对于指导作物播种具有重要意义。本研究旨在探索NtPHYB1基因型如何响应光温环境变化而调控烟草种子萌发。结果表明, 15种光温条件下萌发率的均值为野生型(wild type, WT)种子显著大于NtPHYB1-RNAi和NtPHYB1-OE种子。在持续光照下, NtPHYB1-OE种子萌发被抑制, 而在黑暗下NtPHYB1-RNAi种子萌发被抑制。在15℃, 3种基因型种子萌发均被抑制, NtPHYB1-OE种子萌发率最低; 在20℃和25℃, 光促进或抑制种子萌发作用不明显, 3种基因型种子萌发率均较高, NtPHYB1-OE和WT种子达到最大萌发率; 在30℃和35℃, 光对于种子维持较高萌发率是必不可少的, NtPHYB1-RNAi种子达到最大萌发率。综上所述, NtPHYB1、光周期和温度三者之间在调控烟草种子萌发时存在交互作用, 通过修饰NtPHYB1基因和改善播种环境均可显著提高烟草种子的萌发率。
关键词:
Abstract
Temperature and light are two important environmental factors affecting seed germination, and phytochromes are the sensors of light and temperature. It is of great significance to investigate the interaction of phytochromes with light and temperature to regulate seed germination for guiding crop sowing. The aim of this study is to explore how the NtPHYB1 genotype regulates seed germination in response to change in light and temperature environments in tobacco. The average germination frequency of WT seeds was significantly higher than that of NtPHYB1-OE and NtPHYB1-RNAi seeds under 15 environments. The germination of NtPHYB1-OE seeds was inhibited by continuous light exposure, while the germination of NtPHYB1-RNAi seeds was repressed by darkness. At 15℃, the germinations of all three genotypic seeds were inhibited by the low-temperature, and the germination frequency of NtPHYB1-OE seeds was significantly lower than that of WT and NtPHYB1-RNAi seeds; while there was no significant effect in light signal. At 20℃ and 25℃, the temperature signal promoted the ability of seed germination, and the signal of light was dispensable, resulting in the highest germination frequencies for NtPHYB1-OE and WT seeds. At 30℃ and 35℃, the light signal was indispensable to maintain seed germination for all three genotypic seeds, resulting in the highest germination frequency for NtPHYB1-RNAi seeds. To sum up, there were interactions among NtPHYB1, photoperiod, and temperature in the regulation of seed germination in tobacco. The germination frequencies of tobacco seeds could be significantly improved by modifying NtPHYB1 gene or improving the cultivation environment.
Keywords:
PDF (638KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李振华, 王显亚, 刘一灵, 赵杰宏. NtPHYB1与光温信号互作调控烟草种子萌发. 作物学报, 2022, 48(1): 99-107 DOI:10.3724/SP.J.1006.2022.04275
LI Zhen-Hua, WANG Xian-Ya, LIU Yi-Ling, ZHAO Jie-Hong.
在我国东北、华北、西北和西南地区春播时节, 温度是影响作物种子萌发的主要环境因子。对于光敏感种子, 除温度外, 光照也影响种子的萌发速度和整齐性, 且光温存在交互作用。研究表明, 光敏色素(phytochrome, PHY)不仅是光受体, 而且是温度受体[1,2]。因此, 研究光敏色素协同光温信号精确调控种子萌发, 对于指导作物播种具有重要意义。在拟南芥中, 光敏色素家族包括5个成员PHYA~PHYE。在依赖光调控的种子萌发中PHYA和PHYB起关键作用, 空间上它们分别被定位于胚和胚乳中, 时间上PHYA的作用要稍晚于PHYB[3,4]。另外, 光敏色素其他成员PHYC、PHYD和PHYE也在特定的环境下参与种子萌发调控, 它们的作用主要受波长和辐射照度影响[5,6,7,8]。
光敏色素一个新的功能逐渐被大家熟知, 它还参与温度依赖调控的种子萌发, 在不同温度区间光敏色素家族成员存在分工。适温时种子萌发主要依赖于PHYA参与, 低温时种子萌发主要依赖于PHYE参与, 而PHYB在较宽泛的温度区间内调控种子萌发[9]。PHYB对未经历低温吸胀的种子萌发至关重要, PHYD是高温吸胀种子完成萌发所必须的。当种子吸胀时经历由高温向低温转变, PHYE具有重要作用[10]。种子成熟阶段温度影响光敏色素成员调控种子萌发的功能, 当种子在温暖环境成熟时, PHYA和PHYE缺失突变体种子萌发显著减少, PHYA突变体种子甚至在收获的当季不能萌发; 当种子在冷凉环境成熟时, PHYB缺失突变体的种子萌发显著减少[11,12]。
光和温度调控莴苣和钝叶酸模种子萌发时存在相互作用[13,14]。在拟南芥中发现, 光敏色素不仅感知光信号, 而且感知温度信号[1,2]。Halliday和Davis[15]提出了光敏色素整合光温信号的工作模型, 红光调控非活性Pr-Pr或Pfr-Pr向活性Pfr-Pfr的转变, 而远红光可逆转此过程; 光调控光敏色素活性转变均较为迅速, 而温度调控Pfr-Pfr向Pfr-Pr转变比较缓慢, 调控Pfr-Pr向Pr-Pr的转变比较迅速。Sellaro等[16]发现在田间PHYB动态逃离光平衡(红光和远红光可逆反应), 在晴朗天气, PHYB的活性主要受光平衡调控; 而在多云天气, PHYB逃离光平衡, 主要受温度调控。Arana等[17]研究表明, PHYB整合光温信号调控拟南芥种子萌发。然而, 在复杂气候下, 随着光温信号变化, 光敏色素如何整合光温信号精确调控种子萌发却未见相关报道。
烟草是研究双子叶有胚乳种子萌发的模式植物, 光照和温度均影响烟草种子萌发。王玉芳等[18]研究表明, 烟草种子萌发的适宜温度为25~30℃, 以25℃时发芽势、发芽率、发芽指数和活力指数最高。王树会等[19,20]研究表明, 烟草种子可萌发的最低温度为8℃, 最高温度为40℃; 在8℃时, 烟草种子萌发时间长达37 d; 在40℃时, 种子萌发率显著降低; 在44℃时, 种子将不能萌发。招启柏等[21]研究表明, 光可以显著加快烟草种子萌发, 但对最终发芽率的影响不大; 光照和温度调控烟草种子萌发存在互作, 在20℃, 光照促进烟草种子萌发, 而在黑暗条件下, 30℃高温明显抑制烟草种子萌发。因此, 本研究将着重研究NtPHYB1基因如何响应光温条件变化而精确调控烟草种子萌发, 分析烟草种子萌发的基因型效应、温度效应、光周期效应和它们的互作效应。研究结果不仅有助于揭示光敏感种子萌发的分子生态机制, 而且将为光敏感种子播种技术提升奠定理论基础。
1 材料与方法
1.1 供试材料
烟草K326野生型(WT)、NtPHYB1K326-OE和NtPHYB1K326-RNAi转基因种子均由贵州省烟草科学研究院提供。前期, 课题组克隆了烟草NtPHYB1, 通过生物信息学分析其编码蛋白与拟南芥AtPHYB同源性为75%。构建NtPHYB1的RNA干扰载体(NtPHYB1K326-RNAi)和超量表达载体(NtPHYB1K326- OE), 将测序正确的表达载体转化农杆菌, 然后将构建好的植物表达载体转化烟草叶片获得转基因愈伤组织, NtPHYB1K326-OE和NtPHYB1K326-RNAi转基因植株株高较WT有所增高和降低, 通过RT-PCR技术检测目的基因在转基因植株中的表达量, 上述试验详细步骤见本课题组已公开发表论文[22]。以T2代种子为材料进行萌发试验, 为避免种子光休眠、成熟度和后熟期差异对试验结果造成影响, 所有种子均为授粉后40 d收获, 在40℃机械烘干36 h脱粒, 在室温下存放6个月完成后熟[23], 然后进行种子萌发试验。1.2 试验设计
模拟自然界气候特点, 设置基因型、光周期和温度处理的三因素试验。其中基因型设WT、NtPHYB1K326-OE和NtPHYB1K326-RNAi 3个水平; 光周期处理设持续光照、12 h光照/12 h黑暗、持续黑暗3个水平; 温度处理设15℃、20℃、25℃、30℃、35℃ 5个水平, 通过比较3种基因型种子在15种光温条件下萌发率的差异, 分析烟草种子萌发的基因型效应、温度效应、光周期效应和它们的互作效应。1.3 萌发试验
首先, 采用0.5%硫酸铜溶液进行种子消毒处理; 15 min后, 用蒸馏水反复冲洗已消毒的种子; 最后, 用滤纸掠取种子表面水分待用。配置0.8%的琼脂溶液, 然后进行高压灭菌, 将灭菌液倒入9 cm直径的培养皿中制作琼脂发芽床。每个处理设3次重复, 每次重复100粒种子, 以10×10模式均匀点播在琼脂床表面, 然后将培养皿放置在人工气候箱中(宁波, 江南仪器, RXZ-36C), 设置光照强度为245 μmol m-2 s-1, 相对湿度为80%, 光周期和温度见试验设计。每天统计种子萌发情况, 共统计7 d, 种子萌发判断标准为胚根突破胚乳和种皮露白[24], 以第7天数据进行统计分析。1.4 统计分析
采用SPSS Statistics 17.0软件进行统计分析。以萌发率为因变量, 基因型、光周期和温度为自变量。采用一般线性模型(general linear model, GLM)中的全因子模型及III型平方和评价基因型、光周期和温度及其互作对种子萌发率的影响。基因型、温度和光周期及所有可能的互作都被作为固定效应分析。采用Duncan’s多重比较法分析3种基因型在15种环境下的萌发率差异。
2 结果与分析
2.1 光、温度显著影响烟草种子萌发
在45个处理中烟草种子萌发率变幅较大(表1), 最小值仅为3%, 最大值达到87%, 极值主要由环境效应所致, 其中低温影响较大, 15℃时所有种子萌发率均低于50%。从多个环境萌发率的均值来看(表2), 12 h光周期条件下种子萌发率的组间均值显著大于持续光照和持续黑暗处理(P<0.001), 25℃条件下种子萌发率组间均值显著大于15℃、20℃、30℃和35℃处理。说明光和温度均显著影响烟草种子萌发(P<0.001, 表3), 25℃适温和光暗交替普遍促进烟草种子萌发, 高(低)温和持续光照(黑暗)普遍抑制烟草种子萌发。Table 1
表1
表1基因型、光照、温度及其互作对烟草种子萌发的影响
Table 1
| 基因型 Genotype (G) | 光 Light treatment (L) | 温度 Temperature (T, ℃) | 均值(L×T×G) Mean value (L×T×G) | 标准偏差 Standard deviation | 样本数 Sample number |
|---|---|---|---|---|---|
| NtPHYB1过表达 | 持续黑暗Dark | 15 | 17.78 qrstu NOP | 8.36 | 9 |
| NtPHYB1-OE | 20 | 72.00 abcdefg ABCDE | 9.26 | 9 | |
| 25 | 78.00 abcdef ABC | 7.91 | 9 | ||
| 30 | 26.78 opqr LMNO | 13.14 | 9 | ||
| 35 | 2.89 u Q | 2.62 | 9 | ||
| NtPHYB1 RNA干扰 | 15 | 31.83 nopq KLMN | 4.92 | 6 | |
| NtPHYB1-RNAi | 20 | 65.67 cdefghi BCDEFG | 7.50 | 6 | |
| 25 | 75.00 abcdef ABCD | 10.12 | 6 | ||
| 30 | 46.00 lmn GHIJKL | 8.67 | 6 | ||
| 35 | 5.00 tu Q | 1.41 | 6 | ||
| 野生型WT | 15 | 38.00 mno IJKLM | 6.93 | 3 | |
| 20 | 85.67 ab AB | 2.08 | 3 | ||
| 25 | 80.67 abc ABC | 8.14 | 3 | ||
| 30 | 62.00 fghij CDEFGH | 3.46 | 3 | ||
| 35 | 5.00 tu Q | 2.00 | 3 | ||
| NtPHYB1过表达 | 12 h光照/12 h 黑暗 | 15 | 16.22 rstu NOP | 10.97 | 9 |
| NtPHYB1-OE | 12 h light/12 h dark | 20 | 48.33 klm FGHIJK | 15.36 | 9 |
| 基因型 Genotype (G) | 光 Light treatment (L) | 温度 Temperature (T, ℃) | 均值(L×T×G) Mean value (L×T×G) | 标准偏差 Standard deviation | 样本数 Sample number |
| 25 | 63.33 efghi CDEFGH | 10.55 | 9 | ||
| 30 | 74.11 abcdef ABCD | 6.41 | 9 | ||
| 35 | 73.67 abcdef ABCD | 10.32 | 9 | ||
| NtPHYB1 RNA干扰 | 15 | 18.83 qrst MNOP | 5.12 | 6 | |
| NtPHYB1-RNAi | 20 | 55.00 hijkl DEFGHI | 7.90 | 6 | |
| 25 | 64.17 defghi CDEFGH | 11.96 | 6 | ||
| 30 | 78.50 abcde ABC | 9.67 | 6 | ||
| 35 | 79.33 abcde ABC | 4.37 | 6 | ||
| 野生型WT | 15 | 21.67 pqrs MNOP | 4.93 | 3 | |
| 20 | 69.33 cdefgh ABCDE | 7.51 | 3 | ||
| 25 | 75.00 abcdef ABCD | 2.65 | 3 | ||
| 30 | 79.67 abcd ABC | 4.51 | 3 | ||
| 35 | 87.33 aA | 3.06 | 3 | ||
| NtPHYB1过表达 | 持续光照Light | 15 | 8.67 stu OP | 6.02 | 9 |
| NtPHYB1- OE | 20 | 38.11 mno IJKLM | 18.31 | 9 | |
| 25 | 53.11 jkl EFGHIJ | 22.13 | 9 | ||
| 30 | 57.22 ghijk DEFGHI | 10.93 | 9 | ||
| 35 | 65.00 cdefghi BCDEFG | 17.68 | 9 | ||
| NtPHYB1 RNA干扰 | 15 | 20.67 pqrs MNOP | 8.98 | 6 | |
| NtPHYB1-RNAi | 20 | 44.83 lmn HIJKL | 7.88 | 6 | |
| 25 | 68.33 cdefghi ABCDEF | 8.07 | 6 | ||
| 30 | 70.33 bcdefgh ABCDE | 11.33 | 6 | ||
| 35 | 66.17 cdefghi BCDEF | 9.79 | 6 | ||
| 野生型WT | 15 | 11.33 stu OP | 3.51 | 3 | |
| 20 | 34.00 mnop JKLMN | 5.29 | 3 | ||
| 25 | 65.00 cdefghi BCDEFG | 2.65 | 3 | ||
| 30 | 74.00 abcdef ABCDE | 3.00 | 3 | ||
| 35 | 70.67 bcdefgh ABCDE | 6.43 | 3 |
新窗口打开|下载CSV
Table 2
表2
表2基因型、光照和温度处理均值的组内差值比较
Table 2
| 来源 Source | I | J | 平均差 Mean difference (I-J) |
|---|---|---|---|
| 基因型Genotype | NtPHYB1过表达NtPHYB1-OE | NtPHYB1 RNA干扰NtPHYB1-RNAi | -6.30*** |
| 野生型WT | -10.94*** | ||
| NtPHYB1 RNA干扰NtPHYB1-RNAi | NtPHYB1过表达NtPHYB1-OE | 6.30*** | |
| 野生型WT | -4.64* | ||
| 野生型WT | NtPHYB1过表达NtPHYB1-OE | 10.94*** | |
| NtPHYB1 RNA干扰NtPHYB1-RNAi | 4.64* | ||
| 光Light | 持续黑暗Dark | 12 h光照/12 h黑暗 12 h light/12 h dark | -14.70*** |
| 持续光照Light | -5.04** | ||
| 来源 Source | I | J | 平均差 Mean difference (I-J) |
| 12 h光照/12 h黑暗 12 h light/12 h dark | 持续黑暗Dark | 14.70*** | |
| 持续光照Light | 9.66*** | ||
| 持续光照Light | 持续黑暗Dark | 5.04** | |
| 12 h光照/12 h黑暗 12 h light/12 h dark | -9.66*** | ||
| 温度Temperature | 15℃ | 20℃ | -36.31*** |
| 25℃ | -48.74*** | ||
| 30℃ | -41.00*** | ||
| 35℃ | -30.39*** | ||
| 20℃ | 15℃ | 36.31*** | |
| 25℃ | -12.43*** | ||
| 30℃ | -4.69* | ||
| 35℃ | 5.93** | ||
| 25℃ | 15℃ | 48.74*** | |
| 20℃ | 12.43*** | ||
| 30℃ | 7.74*** | ||
| 35℃ | 18.35*** | ||
| 30℃ | 15℃ | 41.00*** | |
| 20℃ | 4.69* | ||
| 25℃ | -7.74*** | ||
| 35℃ | 10.61*** | ||
| 35℃ | 15℃ | 30.39*** | |
| 20℃ | -5.93** | ||
| 25℃ | -18.35*** | ||
| 30℃ | -10.61*** |
新窗口打开|下载CSV
Table 3
表3
表3NtPHYB1、光和温度互作调控烟草种子萌发的多因素方差分析
Table 3
| 来源 Source | III 型平方和 III sum of squares | 自由度 DF | 均方差 MS | F值 F-value | 显著性水平 Significant |
|---|---|---|---|---|---|
| 基因型Genotype (G) | 4800.759 | 2 | 2400.380 | 22.199*** | 0.000 |
| 光处理Light (L) | 7936.154 | 2 | 3968.077 | 36.697*** | 0.000 |
| 温度处理Temperature (T) | 63,436.466 | 4 | 15,859.116 | 146.666*** | 0.000 |
| G×L | 975.230 | 4 | 243.807 | 2.255 | 0.064 |
| G×T | 1206.704 | 8 | 150.838 | 1.395 | 0.200 |
| L×T | 61,711.869 | 8 | 7713.984 | 71.339*** | 0.000 |
| G×L×T | 3070.141 | 16 | 191.884 | 1.775* | 0.036 |
新窗口打开|下载CSV
2.2 光温互作调控烟草种子萌发
光和温度是影响烟草种子萌发的2个重要环境因子, 多因素方差分析结果表明光和温度调控烟草种子萌发存在交互作用(P<0.001, 表3)。在持续黑暗条件下, 种子萌发率随温度升高(15~35℃)呈正态分布, 15℃和35℃较低, 而25℃较高(图1-A)。在12 h光周期或持续光照条件下, 随着温度的升高, 种子萌发呈对数式增长(图1-A)。表明种子萌发对温度的敏感性受光信号的影响。在有光条件下, 烟草种子萌发适宜的环境温度更宽泛(20~35℃)。在黑暗条件下, 烟草种子萌发适宜的环境温度变窄(<30℃)。图1
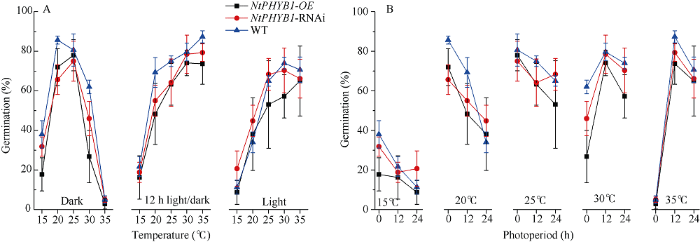 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1在恒定光周期随着温度变化烟草种子萌发的变化(A)和在恒定温度随着光周期变化烟草种子萌发的变化(B)
Fig.1Variation of seed germination under fixed temperature with photoperiodic change (A) and fixed photoperiodic with temperature change (B) in tobacco
在15℃或20℃, 黑暗条件下种子萌发率较高; 在25℃, 无论光照与否种子萌发均较高, 且变幅较小; 而在30℃或35℃, 适当的光照时间允许种子保持较高的萌发率, 特别是在35℃ (图1-B)。表明种子萌发对光的敏感性受温度信号的影响, 在适温区间, 温度可以主导萌发, 而光信号并不是必需的。然而, 在高温或者低温环境(>30℃或<20℃), 种子萌发受光温信号协同调控。低温协同黑暗或高温协同光照环境对种子萌发有益, 反之, 低温时光照充足, 高温时光照不足环境不利于种子萌发。
2.3 NtPHYB1协同光温信号调控烟草种子萌发
3种基因型种子萌发率呈显著差异(表3, P<0.001), 且受光和温度信号强烈影响, 三者存在交互作用(表3, P<0.05)。在T15L0、T20L12、T25L24、T30L0和T30L24等5种环境下, WT种子萌发率显著高于NtPHYB1-OE种子; 在T20L0和T30L0 2种环境下, WT种子萌发率显著高于NtPHYB1-RNAi种子; 在T25L24环境下, NtPHYB1-RNAi种子萌发率显著高于NtPHYB1-OE种子(表4)。WT种子在T20L0、T25L0、T25L12、T30L12、T30L24和T35L12等6种环境下达到最大萌发率; NtPHYB1-OE种子在T20L0、T25L0、T30L12和T35L12等4种环境下达到最大萌发率; 而NtPHYB1-RNAi种子在T30L12、T30L24和T35L12等3种环境下达到最大萌发率。WT种子在T15L24和T35L0 2种环境下萌发率最小; NtPHYB1-OE种子在T15L0、T15L12、T15L24和T35L0等4种环境下萌发率最小; 而NtPHYB1-RNAi种子在T35L0 1种环境下萌发率最小。15种光温环境下萌发率均值为WT种子显著高于NtPHYB1-RNAi和NtPHYB1-OE种子(表2, P<0.001)。表明, 野生型种子对不同生态环境的适应能力较强, 在更广泛的环境尺度可以达到最大萌发率; 而其他2种类型种子环境适应范围相对较窄。Table 4
表4
表4NtPHYB1响应光照和温度信号互作调控种子萌发
Table 4
| 不同基因型种子萌发差异 Germination ratio among different genotype (G) | 光和温度的环境组合 Environmental combinations of light and temperature |
|---|---|
| 无显著差异 No significant difference | NtPHYB1-OE, WT and NtPHYB1-RNAi: T15L12, T15L24, T20L24, T25L0, T25L12, T30L12, T35L0, T35L12, and T35L24. |
| 显著差异 Significant difference | WT>NtPHYB1-OE: T15L0, T20L12, T25L24,T30L0, T30L24; WT>NtPHYB1-RNAi: T20L0 and T30L0; NtPHYB1-RNAi>NtPHYB1-OE: T25L24. |
| 极大值 Maximum | NtPHYB1-OE: T20L0, T25L0, T30L12, T35L12; WT: T20L0, T25L0, T25L12, T30L12, T30L24, T35L12; NtPHYB1-RNAi: T30L12, T30L24, T35L12. |
| 极小值 Minimum | NtPHYB1-OE: T15L0, T15L12, T15L24, T35L0; WT: T15L24, T35L0; NtPHYB1-RNAi: T35L0 |
新窗口打开|下载CSV
在T15L12、T15L24、T20L24、T25L0、T25L12、T30L12、T35L0、T35L12和 T35L24等9种环境条件下WT、NtPHYB1-OE和NtPHYB1-RNAi种子萌发率无显著差异(表1和表3)。这可能是由于环境效应远大于基因型效应对种子萌发的影响。基因型与光周期, 基因型与温度之间的交互作用并不显著, 而基因型、光周期和温度三者之间的交互作用达到显著水平(表3, P<0.05)。说明NtPHYB1协同光和温度信号调控烟草种子萌发。
3 讨论
3.1 光温互作调控种子萌发
种子萌发始于吸水, 止于胚根突破胚乳和种皮等露白[25], 其过程受多种环境因素影响, 如水分、温度、氧气和光照等。环境因子间彼此紧密联系, 以确保种子在适宜的时节开始新的生命周期。前人研究已经表明莴苣[13]、拟南芥[17]和烟草[21]种子萌发时光和温度存在互作。本研究也发现光温互作调控烟草种子萌发。Borthwick等[13]发现, 黑暗低温条件莴苣种子可正常萌发, 而在高温黑暗条件下莴苣种子萌发被抑制, 在光照高温条件时种子亦可正常萌发。招启柏等[21]研究表明, 在黑暗条件下高温明显抑制烟草种子萌发, 而光照高温条件下烟草种子萌发正常。本研究发现, 低温协同黑暗或高温协同光照对烟草种子萌发有益, 反之, 低温时光照充足, 高温时光照不足环境不利于烟草种子萌发。3.2 光敏色素整合光温信号精确调控种子萌发
早在1952年, Borthwick等[13]就发现, 莴苣种子萌发受红光/远红光可逆转换, 红光将钝化形式的Pr转变为活性形式的Pfr促进萌发, 而远红光将活性形式的Pfr逆转为钝化的Pr抑制萌发。近30年来, 科学家们通过大量的遗传学试验证实光敏色素感知光信号调控拟南芥种子萌发[26,27,28]。Donohue等[11,12]发现, 光敏色素感知温度信号调控拟南芥种子萌发。Arana等[17]研究发现, 光敏色素整合光温信号调控拟南芥种子萌发。本研究发现, 光敏色素整合光温信号精确调控烟草种子萌发, 在低温区间(<15℃), 低温抑制种子萌发, 光信号的作用微乎其微, 在适温区间(~25℃), 温度可以主导烟草种子萌发, 而光信号的作用并不是必需的; 然而, 在高温区间(>30℃), 种子萌发强烈依赖于光信号参与(图2)。目前, 关于光敏色素整合光温信号调控种子萌发的机理仍知之甚少。参考Halliday和Davis[15]提出的光敏色素工作模型, 本研究认为在低温环境, 种子中积累的活性光敏色素色素Pfr-Pfr感知温度信号抑制萌发。在适温环境, 黑暗下种子中的活性Pfr-Pfr向非活性Pfr-Pr和Pr-Pr转变较为缓慢, 所以温度可以主导种子萌发, 光信号的作用并不是必需的。而在高温环境, 黑暗下高温将加速种子中的活性Pfr-Pfr向非活性Pfr-Pr和Pr-Pr的转变, 从而抑制种子萌发; 此时, 光信号的作用是必需的, 它可以抑制活性Pfr-Pfr向非活性Pfr-Pr和Pr-Pr的转变, 从而促进种子萌发。该结果有助于揭示为什么温暖的春季和秋季更适合播种, 而寒冷的冬季和炎热的夏季不宜播种(图2), 人类播种习惯可能是长期自然选择的结果。
图2
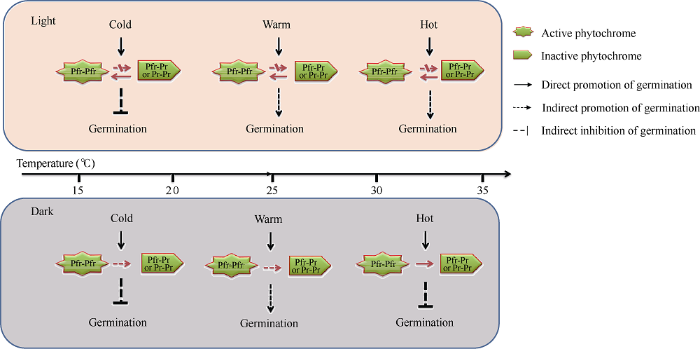 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2光敏色素整合光温信号调控种子萌发响应季节变化
粉色模块是指暴露在地表的种子, 灰色模块是指埋在土壤中的种子。在冬季和早春(<15℃), 光敏色素感知低温信号抑制种子萌发, 而光信号的作用微乎其微。在晚春早秋(约20℃), 温度信号独立激活光敏色素促进种子萌发。在夏季和初秋(>30℃), 光是维持光敏色素活性和促进种子萌发所必需的。
Fig. 2Diagram of phytochrome B integrates light and temperature signal to regulate seed germination in different seasons
The pink block are seeds exposed to the ground, while the grey blocks are seeds buried underground. represents quick, slow, and obstructive conversions. In winter and early spring (<15℃), the low-temperature signal sensed by phytochrome B inhibited seeds germination, and the effect of the light signal was almost ineffective. During late spring and autumn (~20℃), temperature signal initiated germination with the combination of the light. In summer and early autumn (>30℃), light is indispensable to maintain seed germination by persistently activating the PHYB.
3.3 光敏色素家族成员感知光温信号存在分工
在模式作物拟南芥中, 在光介导调控的种子萌发中光敏色素PHYB和PHYA起关键作用[3,4]; 红光激活PHYB启动种子萌发, 而远红光激发PHYA启动种子萌发。在茄科作物番茄中PHYB可能是促进种子萌发的唯一光敏色素[29], 在红光和远红光下PHYA均抑制种子萌发。说明在光介导调控的种子萌发中光敏色素家族成员存在分工, 且物种间存在差异。适温时拟南芥种子萌发主要依赖于PHYA参与, 低温时拟南芥种子萌发主要依赖于PHYE参与, 而PHYB在较宽泛的温度区间内调控拟南芥种子萌发[9,10]。说明在温度介导调控的种子萌发中光敏色素家族成员存在分工。近来, 研究表明PHYB整合光温信号调控拟南芥种子萌发[17]。本研究也表明NtPHYB整合光温信号精确调控烟草种子萌发。然而, 关于其他光敏色素成员是否亦可整合光温信号调控种子萌发, 目前仍不清楚, 值得今后去研究。拟南芥和烟草种子是光敏感种子, 其萌发均依赖于光信号参与, 而主要农作物是光中性种子, 光照与否种子均可正常萌发, 这可能是因为不同物种已经进化出差异化的光敏色素系统以适应环境[30]。例如, 在拟南芥、番茄和烟草中光敏色素家族均包含5个成员(PHYA~PHYE)[31,32,33], 其种子萌发对光和温度均敏感, 而禾本科作物仅包含3个成员(PHYA~PHYC), 其种子萌发对光不敏感。可能是因为人工驯化过程中, 种子光敏感性已经丧失, 这样有利于作物适应不同播种深度。然而, 种子温度敏感性仍然保留, 因为在不合适的温度下萌发是致命的。目前, 关于种子萌发光温敏感性与光敏色素家族成员的关系仍不清楚, 值得今后去探索。
4 结论
光和温度是调控烟草种子萌发的2个重要环境因子, 且两者存在交互作用, 低温协同黑暗或高温协同光照对种子萌发有益, 反之, 低温时光照充足, 高温时光照不足不利于种子萌发。光敏色素是光温二受体, NtPHYB1协同光温信号精确调控烟草种子萌发, 在有光的条件下, 种子萌发适宜的环境温度更宽泛(20~35℃)。而在黑暗条件下, 种子萌发适宜的环境温度变窄(<30℃)。综上所述, NtPHYB1、光周期和温度三者之间在调控烟草种子萌发时存在交互作用, 通过修饰NtPHYB1基因和(或)改善种子栽培环境均可显著提高烟草种子的萌发率。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 4]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 4]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
