 ,, 崔亚男, 张俊, 刘娟, 臧秀旺, 高伟, 刘兵, 董文召, 汤丰收
,, 崔亚男, 张俊, 刘娟, 臧秀旺, 高伟, 刘兵, 董文召, 汤丰收 ,*河南省农业科学院经济作物研究所 / 农业农村部黄淮海油料作物重点实验室 / 河南省油料作物遗传改良重点实验室, 河南郑州 450002
,*河南省农业科学院经济作物研究所 / 农业农村部黄淮海油料作物重点实验室 / 河南省油料作物遗传改良重点实验室, 河南郑州 450002Effects of hydrogen peroxide soaking on germination and physiological metabolism of seeds in peanut
HAO Xi ,, CUI Ya-Nan, ZHANG Jun, LIU Juan, ZANG Xiu-Wang, GAO Wei, LIU Bing, DONG Wen-Zhao, TANG Feng-Shou
,, CUI Ya-Nan, ZHANG Jun, LIU Juan, ZANG Xiu-Wang, GAO Wei, LIU Bing, DONG Wen-Zhao, TANG Feng-Shou ,*Industrial Crops Research Institute, Henan Academy of Agricultural Sciences / Key Laboratory of Oil Crops in Huanghuaihai Plains, Ministry of Agriculture and Rural Affairs / Henan Provincial Key Laboratory for Oil Crops Improvement, Zhengzhou 450002, Henan, China
,*Industrial Crops Research Institute, Henan Academy of Agricultural Sciences / Key Laboratory of Oil Crops in Huanghuaihai Plains, Ministry of Agriculture and Rural Affairs / Henan Provincial Key Laboratory for Oil Crops Improvement, Zhengzhou 450002, Henan, China通讯作者: * 汤丰收, E-mail:fshtang@126.com
收稿日期:2020-08-12接受日期:2021-01-21网络出版日期:2021-02-19
| 基金资助: |
Corresponding authors: * E-mail:fshtang@126.com
Received:2020-08-12Accepted:2021-01-21Online:2021-02-19
| Fund supported: |
作者简介 About authors
E-mail:hx1997@163.com

摘要
为明确过氧化氢浸种对低温条件下花生发芽及种子生理代谢的影响, 以花生品种开农176为材料, 测定了过氧化氢浸种后的种子发芽及相关生理指标。结果表明, 过氧化氢浸种显著提高了花生的发芽能力, 发芽势从0提高到24.45%, 发芽率从39.33%提高到90.99%。过氧化氢提高了花生种子赤霉素含量, 同时降低了脱落酸含量, 发芽0、24、48 h的赤霉素含量分别比对照提高10.82%、5.73%、18.64%, 脱落酸含量分别比对照降低44.98%、36.45%、39.70%。同时, 提高了抗氧化酶SOD、CAT的活性以及可溶性糖、可溶性蛋白的含量, 降低了丙二醛的含量; 促进了大分子贮藏物质脂肪、蛋白质、淀粉的分解代谢, 为种子发芽提供更多的ATP和蛋白质、核酸的合成底物。研究表明, H2O2通过介导抗氧化酶、ABA和GA以及贮藏物质的分解来促进低温胁迫下花生种子的萌发。
关键词:
Abstract
To investigate the effects of hydrogen peroxide soaking on peanut germination and seed physiological metabolism, the seed germination and related physiological indexes after seed soaking were determined using peanut variety Kainong 176 as experimental material. The results showed that the germination vigor of peanut was increased from 0 to 24.45%, and the germination percentage was increased from 39.33% to 90.99% by hydrogen peroxide soaking. Hydrogen peroxide treatment increased the content of gibberellin in peanut seeds and decreased the content of abscisic acid at germination stage. The contents of gibberellin in germinating seeds at 0, 24, and 48 hour(s) were 10.82%, 5.73%, and 18.64% higher than those of control, and the contents of abscisic acid were 44.98%, 36.45%, and 39.70% lower than that of control, respectively. At the same time, hydrogen peroxide treatment enhanced the activities of antioxidant enzyme SOD and CAT, increased the contents of soluble sugar and soluble protein, decreased the content of MDA, promoted the catabolism of macromolecular storage substances such as fat, protein, and starch, and provided more ATP and substrates for protein and nucleic acid synthesis. Studies revealed that hydrogen peroxide could promote peanut seed germination under low-temperature stress by mediating antioxidant enzymes, ABA and GA, and storage matter decomposition.
Keywords:
PDF (561KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
郝西, 崔亚男, 张俊, 刘娟, 臧秀旺, 高伟, 刘兵, 董文召, 汤丰收. 过氧化氢浸种对花生种子发芽及生理代谢的影响. 作物学报[J], 2021, 47(9): 1834-1840 DOI:10.3724/SP.J.1006.2021.04187
HAO Xi, CUI Ya-Nan, ZHANG Jun, LIU Juan, ZANG Xiu-Wang, GAO Wei, LIU Bing, DONG Wen-Zhao, TANG Feng-Shou.
花生是我国植物蛋白和食用植物油的重要来源[1], 种植面积、总产分别居世界第二、第一[2]。低温胁迫是影响我国花生发芽出苗的重要因素, 北方地区的“倒春寒”、华南地区的“秋季冷害”等常引起花生低温烂种, 导致花生严重减产[3]。国内多家单位相继开展了花生耐播种期低温品种筛选、发芽生理及调控技术等研究[4,5,6,7,8]。低温影响花生种子的贮存物质分解代谢、细胞膜及渗透调节物质、活性氧代谢及抗氧化酶活性、核酸及蛋白质合成等[9]。因此, 研究花生在低温冷害条件下的发芽生理及调控技术, 对促进我国花生的高产优质高效具有重要意义。
过氧化氢(hydrogen peroxide, H2O2)作为植物体内的信号分子参与种子休眠与发芽、胁迫应答和激素信号等多种代谢途径[10]。前人已开展了H2O2在作物种子发芽中的调控作用研究, 如黄瓜[11]、水稻[12]、油菜[13]、甜菜[14]、大豆[15]等, 明确了适宜浓度的H2O2可以促进作物种子的萌发, 提高抗逆性。研究发现, 0.05% H2O2浸种显著增强油菜种子的抗氧化能力和抗寒相关基因的表达, 从而提高了耐低温发芽能力[13]。朱利君等[11]发现, 0.3% H2O2能够缓解盐胁迫对黄瓜种子发芽的抑制。NADPH氧化酶产生的活性氧参与水稻发芽过程中胚根和根系的伸长[16]。
脱落酸(abscisic acid, ABA)和赤霉素(gibberellins, GA)是2种重要的植物激素, 在作物种子的萌发过程中具有重要作用。ABA在种子休眠的诱导和维持过程中起主要作用, 而GA在打破种子休眠和促进种子萌发中发挥关键作用[17]。过氧化氢参与植物种子休眠的释放和萌发的启动[18,19], 目前认为过氧化氢主要通过疏松坚硬的种皮促进种子吸水, 以及调控脱落酸与赤霉素的含量来促进种子发芽。H2O2缓解盐胁迫对黄瓜种子发芽的抑制, 主要通过调控抗氧化酶系统以及ABA和GA的代谢[11]。在种子发芽过程中, ABA和GA均受到H2O2的调控[20]。研究发现, H2O2促进ABA分解从而降低ABA含量, 促进GA合成[21]。但H2O2对花生种子发芽生理的影响及调控技术等方面, 尚未开展系统研究。鉴于此, 本研究开展H2O2浸种对花生低温发芽生理特性的研究, 以期为实现花生一播全苗与壮苗增产提供指导。
1 材料与方法
1.1 试验设计
试验于2019年在河南省农业科学院经济作物研究所实验室进行。选择前期试验中对发芽期低温较敏感的花生品种开农176为试验材料, 该品种为开封市农林科学院选育。选择饱满一致、无病斑的花生种子用0.5%次氯酸钠消毒3 min, 然后用无菌水冲洗3遍。消过毒的种子在25℃条件下浸种12 h, 浸种溶液分为蒸馏水、50 mmol L-1 H2O2 2个处理, 以蒸馏水浸种处理为对照; 浸种结束后, 种子分别摆放于直径15 cm的培养皿中发芽7 d, 环境条件为15℃恒温暗培养, 重复3次, 每重复30粒种子。1.2 测定项目与方法
发芽期间, 分别调查第4天发芽势和第10天的萌发率、发芽率, 并计算发芽指数。种子胚根刚突破种皮, 为萌发;
发芽势=第4天芽长≥2 mm种子数/种子总粒数× 100%;
发芽率=第10天芽长≥2 mm种子数/种子总粒数× 100%;
发芽指数=∑(Gt/Dt)
式中Gt为种子在t日的发芽数, Dt为发芽天数。
分别在15℃恒温发芽的0、24、48 h取种子样品, 液氮冷冻后保存于-80℃超低温冰箱。采用微量法试剂盒(苏州科铭生物技术有限公司)测定赤霉素GA3、脱落酸、丙二醛、可溶性糖、可溶性蛋白、三磷酸腺苷(ATP)含量及SOD、POD、CAT、α-淀粉酶的活性。
1.3 数据统计与分析
采用Microsoft Excel 2007录入、整理和计算数据, 运用DPS数据处理系统进行分析, 采用LSD法进行数据间的多重比较, Microsoft Excel 2007作图。2 结果与分析
2.1 H2O2浸种对花生种子发芽能力的影响
与对照相比, H2O2浸种显著提高了花生的萌发率、发芽势、发芽率和发芽指数, 萌发率从72.8%提高到97.06%, 发芽势从0提高到24.4%, 发芽率从39.3%提高到90.99%, 发芽指数从0提高到2.14; 4个指标在H2O2与对照间的差异均达到极显著水平(表1)。说明H2O2浸种显著提高了花生低温条件下的发芽能力。Table 1
表1
表1H2O2浸种处理对花生发芽的影响
Table 1
| 处理 Treatment | 萌发率 Germination rate (%) | 发芽势 Germination vigor (%) | 发芽率 Germination percentage (%) | 发芽指数 Germination index |
|---|---|---|---|---|
| 对照CK | 72.79±2.21 B | 0±0 A | 39.33±1.83 A | 0±0 A |
| H2O2浸种H2O2 soaking | 97.06±2.94 A | 24.45±6.80 B | 90.99±2.76 B | 2.14±0.49 B |
新窗口打开|下载CSV
2.2 H2O2浸种对花生种子发芽过程中GA和ABA含量的影响
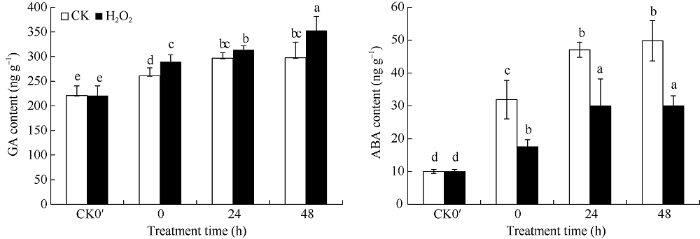
由图1可知, 在发芽后0~48 h内, GA和ABA含量均呈现逐渐增加的趋势。与对照相比, H2O2浸种显著提高了花生种子发芽过程中的GA含量, 降低了ABA含量。H2O2浸种处理后, 在发芽0、24、48 h的GA含量分别比对照提高10.82%、5.73%、18.64%, 其中在发芽0 h、48 h 2个时间点处理与对照间差异达到显著水平; 在发芽0、24、48 h, ABA含量分别比对照降低44.98%、36.45%、39.70%, 均达到显著差异水平。说明H2O2处理对花生种子ABA含量的影响更大。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1H2O2处理对花生种子发芽过程中赤霉素和脱落酸含量的影响
CK0′、0 h、24 h、48 h分别代表干种子、浸种结束种子(发芽0 h)、发芽24 h种子、发芽48 h种子。误差线表示3次重复的标准差。柱上标以不同小写字母表示差异达0.05显著水平。
Fig. 1Effects of H2O2 soaking treatments on the contents of GA and ABA at seed germination stage in peanut
CK0′, 0 h, 24 h, and 48 h represent dry seed, seed after soaking (germination 0 hour), germinating seed after 24 hours, germinating seed after 48 hours, respectively. Error bars show the standard deviations of three replicates. Different lowercase letter above the bar means significant difference at the 0.05 probability level.
2.3 H2O2浸种对花生种子发芽过程中抗氧化酶活性的影响
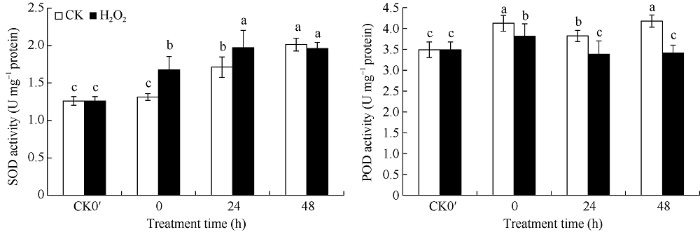
2个处理的种子SOD酶活性在发芽开始后0~48 h内均呈上升趋势。但与对照处理相比, H2O2浸种处理的酶活性在0~24 h内增速更快。从图2可知, 在发芽0、24、48 h, SOD酶活性分别比对照提高27.51%、15.22%、-2.53%, 其中在发芽0 h、24 h 2个时间点处理与对照间差异均达显著水平。在发芽0、24、48 h, H2O2浸种处理的POD酶活性均低于对照, 分别比对照降低7.57%、11.43%、18.32%, 均达到显著差异水平。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2H2O2处理对花生种子发芽过程中SOD和POD活性的影响
CK0′、0 h、24 h、48 h分别代表干种子、浸种结束种子(发芽0 h)、发芽24 h种子、发芽48 h种子。误差线表示3次重复的标准差。柱上标以不同小写字母表示差异达0.05显著水平。
Fig. 2Effects of H2O2 soaking treatments on SOD and POD activities at seed germination stage in peanut
CK0′, 0 h, 24 h, and 48 h represent dry seed, seed after soaking(germination 0 hour), germinating seed after 24 hours, germinating seed after 48 hours, respectively. Error bars show the standard deviations of three replicates. Different lowercase letter above the bar means significant difference at the 0.05 probability level.
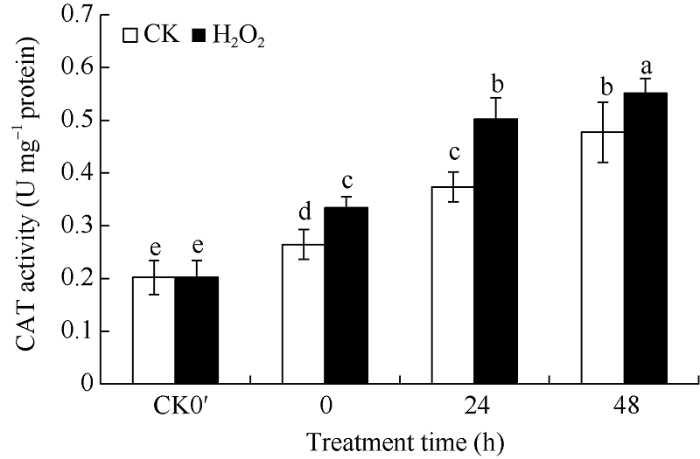
2个处理的种子CAT酶活性在发芽开始后0~48 h内均呈上升趋势。但与对照处理相比, H2O2浸种处理的酶活性增加幅度更大。从图3可知, 在发芽0、24、48 h, CAT酶活性分别比对照提高26.28%、34.43%、15.49%, 均达到显著差异水平。H2O2浸种主要提高花生种子SOD和CAT的酶活性, 而POD酶活性低于对照, 并且H2O2处理后CAT酶活性提高的幅度大于SOD。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3H2O2处理对花生种子发芽过程中CAT活性的影响
CK0′、0 h、24 h、48 h分别代表干种子、浸种结束种子(发芽0 h)、发芽24 h种子、发芽48 h种子。误差线表示3次重复的标准差。柱上标以不同小写字母表示差异达0.05显著水平。
Fig. 3Effects of H2O2 soaking treatments on CAT activities at seed germination stage in peanut
CK0′, 0 h, 24 h, and 48 h represent dry seed, seed after soaking (germination 0 hour), germinating seed after 24 hours, germinating seed after 48 hours, respectively. Error bars show the standard deviations of three replicates. Different lowercase letter above the bar means significant difference at the 0.05 probability level.
2.4 H2O2浸种对花生种子发芽过程中可溶性糖、可溶性蛋白和丙二醛含量的影响
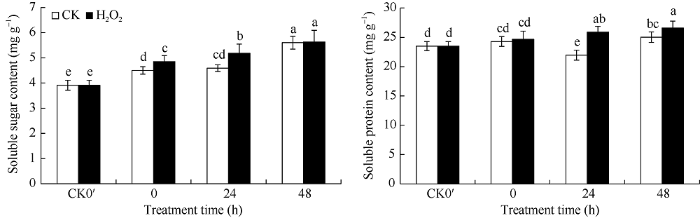
2个处理的种子可溶性糖含量在发芽开始后0~48 h内均呈上升趋势。与对照相比, H2O2浸种提高了花生种子发芽过程中的可溶性糖含量, 发芽0、24、48 h的可溶性糖含量分别比对照提高7.78%、12.85%、0.54% (图4); 其中在0 h、24 h 2个时间点, 处理与对照间差异均达到显著水平。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4H2O2处理对花生种子发芽过程中可溶性糖和可溶性蛋白含量的影响
CK0′、0 h、24 h、48 h分别代表干种子、浸种结束种子(发芽0 h)、发芽24 h种子、发芽48 h种子。误差线表示3次重复的标准差。柱上标以不同小写字母表示差异达0.05显著水平。
Fig. 4Effects of H2O2 soaking treatments on soluble sugar and soluble protein content at seed germination stage in peanut
CK0′, 0 h, 24 h, and 48 h represent dry seed, seed after soaking (germination 0 hour), germinating seed after 24 hours, germinating seed after 48 hours, respectively. Error bars show the standard deviations of three replicates. Different lowercase letter above the bar means significant difference at the 0.05 probability level.
由图4可知, 对照的种子可溶性蛋白含量在发芽开始后0~48 h内呈先下降后上升趋势, 而H2O2处理则呈现持续上升趋势。H2O2浸种提高了种子可溶性蛋白的含量, H2O2浸种后发芽0、24、48 h的可溶性蛋白含量分别比对照提高1.57%、17.82%、6.32%, 其中在24 h、48 h 2个时间点, 处理与对照间均达到显著差异水平。
从图5可知, 对照的丙二醛含量在发芽开始后0~48 h比较稳定, 在90.15~92.00 nmol g-1之间, 而H2O2处理则表现为逐渐下降趋势。H2O2浸种降低了花生种子的丙二醛含量, 提高了种子细胞膜的稳定性。H2O2浸种后发芽0、24、48 h的丙二醛含量分别比对照降低8.33%、23.83%、37.39%, 其中在24 h、48 h 2个时间点, 处理与对照间均达到显著差异水平。H2O2浸种处理较低的丙二醛含量, 与其具有较高的SOD、CAT酶活性及可溶性糖和可溶性蛋白含量有关。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5H2O2处理对花生种子发芽过程中丙二醛含量的影响
CK0′、0 h、24 h、48 h分别代表干种子、浸种结束种子(发芽0 h)、发芽24 h种子、发芽48 h种子。误差线表示3次重复的标准差。柱上标以不同小写字母表示差异达0.05显著水平。
Fig. 5Effects of H2O2 soaking treatments on MDA content at seed germination stage in peanut
CK0′, 0 h, 24 h, and 48 h represent dry seed, seed after soaking (germination 0 hour), germinating seed after 24 hours, germinating seed after 48 hours, respectively. Error bars show the standard deviations of three replicates. Different lowercase letter above the bar means significant difference at the 0.05 probability level.
2.5 H2O2浸种对花生种子发芽过程贮藏物质分解代谢的影响
与对照相比, H2O2浸种加快了种子脂肪的分解, 提高了花生种子发芽过程中的游离脂肪酸含量。H2O2浸种后发芽0、24、48 h的游离脂肪酸含量分别比对照提高19.26%、4.70%、26.37%, 其中在0 h、48 h两个时间点, 处理与对照间均达到显著差异水平(图6)。图6
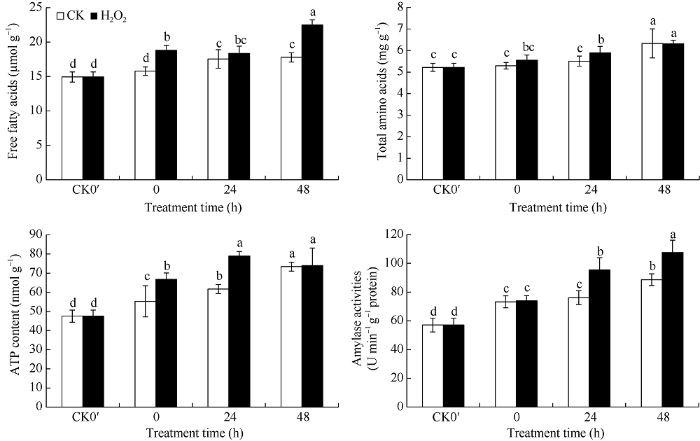 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6H2O2处理对花生种子发芽过程中游离脂肪酸、总氨基酸、ATP含量及α-淀粉酶活性的影响
CK0′、0 h、24 h、48 h分别代表干种子、浸种结束种子(发芽0 h)、发芽24 h种子、发芽48 h种子。误差线表示3次重复的标准差。柱上标以不同小写字母表示差异达0.05显著水平。
Fig. 6Effects of H2O2 soaking treatments on free fatty acids, total amino acids, ATP content, and α-amylase activities at seed germination stage in peanut
CK0′, 0 h, 24 h, and 48 h represent dry seed, seed after soaking (germination 0 hour), germinating seed after 24 hours, germinating seed after 48 hours, respectively. Error bars show the standard deviations of three replicates. Different lowercase letter above the bar means significant difference at the 0.05 probability level.
从图6可知, H2O2浸种加快了花生种子蛋白质的分解代谢, 提高了花生种子的总氨基酸含量, 发芽0、24、48 h的总氨基酸含量分别比对照提高4.89%、7.10%、0.28%。H2O2浸种也提高了花生种子的α-淀粉酶活性。在H2O2浸种后发芽的0、24、48 h, 种子α-淀粉酶活性分别比对照提高0.93%、25.31%、21.34%, 其中在24 h、48 h两个时间点, 处理与对照间均达到显著差异水平。
与对照相比, H2O2浸种提高了花生种子的ATP含量, 可以为种子发芽提供更多的能量。H2O2浸种处理后, 在发芽0、24、48 h的ATP含量分别比对照提高20.82%、28.07%、0.75%, 其中在0 h、24 h两个时间点, 处理与对照间差异均达到显著差异(图6)。
3 讨论
3.1 H2O2处理对花生种子低温萌发条件下抗氧化酶活力的调控
低温导致植物活性氧水平升高, 引起细胞膜脂过氧化程度加剧, 严重影响植物的生长与发育[22]。植物的抗氧化酶活性与抗氧化物质含量受到低温胁迫的诱导, 提高了细胞的活性氧清除能力, 从而有利于维持植物正常的生长与代谢。本研究表明, 低温发芽条件下H2O2处理显著提高了花生品种开农176的SOD、CAT酶活性, 最高增幅分别达到27.51%、34.43%; 而POD酶活性在发芽0~48 h内均低于对照。表明H2O2浸种主要提高低温胁迫下花生种子SOD和CAT的酶活性, 并且CAT酶活性提高的幅度大于SOD, 而抗氧化能力的提高有助于降低过量活性氧的积累及对细胞膜的伤害, 降低丙二醛含量[23]。这与前人得出的H2O2浸种处理可同时提高低温等逆境条件下种子内SOD、POD和CAT活性的结论不完全一致[11,12,13]。这种结果差异可能与选择不同的处理温度, 或者与研究的作物种类不同有关。3.2 H2O2处理对花生种子GA和ABA含量的调控
GA和ABA是调控种子萌发过程的主要植物激素[24]。GA具有解除种子休眠、促进种子萌发和拮抗脱落酸的作用, 它通过促进基因表达、激活种子中多种水解酶来促进种子萌发; ABA具有维持种子休眠和抑制种子的萌发作用[12]。本研究发现, H2O2浸种显著提高了开农176种子发芽过程中的GA含量, 降低了ABA含量, 发芽48 h的GA含量比对照提高18.64%, ABA含量比对照降低39.70%, 因此H2O2通过改变花生种子GA与ABA的含量, 从而促进了种子发芽。H2O2是通过促进ABA的分解还是抑制ABA的合成来调控ABA的含量, 则需要进一步的试验来验证。3.3 H2O2处理对花生贮藏物质分解代谢的调控
蛋白质、脂肪等营养物质含量的变化反映了种子的存在状态, 可溶性糖含量是种子能否顺利萌发和生长的重要生理基础[25]。花生是重要的油料作物, 脂肪、蛋白质是其主要的贮藏物质, 约占80%左右, 是种子萌发期间所需养分和能量的主要来源。多数可溶性蛋白是参与各种代谢的酶类, 其含量的变化能够反映种子生命活动的强弱。本研究发现, H2O2浸种后开农176种子内蛋白、脂肪等物质的分解代谢加速, 提高了种子发芽过程中的可溶性糖、可溶性蛋白、游离脂肪酸、总氨基酸和ATP的含量, 其中发芽后24 h的可溶性糖、可溶性蛋白、ATP含量分别比对照提高12.85%、17.82%、28.07%, 可为种子发芽过程中蛋白质、核酸的合成提供了所需的底物和能量。花生种子脂肪含量平均为54.2%, 蛋白质含量约为24.5% [26], 本研究也发现, H2O2浸种后游离脂肪酸的增幅大于总氨基酸, 表明H2O2处理主要促进了脂肪的分解代谢。H2O2处理如何调控花生发芽过程中的营养物质分解代谢过程, 主要调控哪些代谢途径及相关的酶活性、基因表达等, 有待下一步的深入研究。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 4]
[本文引用: 4]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOIURL [本文引用: 1]
DOIURL [本文引用: 1]
DOIURL [本文引用: 1]
DOIURL [本文引用: 1]
DOIURL [本文引用: 1]
DOIURL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI [本文引用: 1]

Reactive oxygen species (ROS) are versatile compounds which can have toxic or signalling effects in a wide range living organisms, including seeds. They have been reported to play a pivotal role in the regulation of seed germination and dormancy but their mechanisms of action are still far from being fully understood. In this review, we sum-up the major findings that have been carried out this last decade in this field of research and which altogether shed a new light on the signalling roles of ROS in seed physiology. ROS participate in dormancy release during seed dry storage through the direct oxidation of a subset of biomolecules. During seed imbibition, the controlled generation of ROS is involved in the perception and transduction of environmental conditions that control germination. When these conditions are permissive for germination, ROS levels are maintained at a level which triggers cellular events associated with germination, such as hormone signalling. Here we propose that the spatiotemporal regulation of ROS production acts in concert with hormone signalling to regulate the cellular events involved in cell expansion associated with germination.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
