 ,, 杨向芸, 贾磊, 李玉如, 项月, 岳洁瑜, 王华忠
,, 杨向芸, 贾磊, 李玉如, 项月, 岳洁瑜, 王华忠 ,*天津师范大学生命科学学院 / 天津市动植物抗性重点实验室, 天津 300387
,*天津师范大学生命科学学院 / 天津市动植物抗性重点实验室, 天津 300387Virus-mediated expression of GFP-ATG8 for autophagy monitoring in wheat
HU Rui-Jie ,, YANG Xiang-Yun, JIA Lei, LI Yu-Ru, XIANG Yue, YUE Jie-Yu, WANG Hua-Zhong
,, YANG Xiang-Yun, JIA Lei, LI Yu-Ru, XIANG Yue, YUE Jie-Yu, WANG Hua-Zhong ,*School of Life Sciences, Tianjin Normal University / Tianjin Key Laboratory of Animal and Plant Resistance, Tianjin 300387, China
,*School of Life Sciences, Tianjin Normal University / Tianjin Key Laboratory of Animal and Plant Resistance, Tianjin 300387, China通讯作者: * 王华忠, E-mail:skywhz@tjnu.edu.cn, Tel: 022-23766539
收稿日期:2020-12-7接受日期:2021-04-14网络出版日期:2021-05-13
| 基金资助: |
Corresponding authors: * E-mail:skywhz@tjnu.edu.cn, Tel: 022-23766539
Received:2020-12-7Accepted:2021-04-14Published online:2021-05-13
| Fund supported: |
作者简介 About authors
E-mail:1124144490@qq.com

摘要
自噬相关因子ATG8定位于自噬结构的膜上, 荧光蛋白标记的ATG8在过表达细胞内所呈现的点状荧光常用于表征自噬结构和监测自噬活性。病毒介导的过表达(virus-mediated over-expression, VOX)是一种简便、快速制备目的基因过表达植株的技术。采用基于狗尾草花叶病毒FoMV的VOX技术(FoMV-VOX)在小麦植株中表达GFP标记的小麦ATG8家族成员TaATG8a, 建立小麦活体植株的自噬活性监测技术平台。构建了融合基因GFP-TaATG8a的FoMV-VOX载体, 采用Agroinfiltration方法在本氏烟草叶片中表达携带GFP-TaATG8a的FoMV基因组RNA和组装病毒粒子, 将烟草汁液中的病毒粒子摩擦接种于小麦幼苗植株叶片, 对接种植株叶片和根组织中的荧光信号进行观察和特征鉴定。结果表明, 采用FoMV-VOX技术在小麦植株上不仅可以实现GFP-TaATG8a在接种叶片中的高效表达, 还可以借助病毒的系统侵染实现该融合基因在未接种叶片和根组织中的高效表达。经饥饿处理激活自噬, 融合蛋白GFP-TaATG8a在植株叶表皮、叶肉以及根细胞中呈现表征自噬结构的点状荧光。采用FoMV-VOX技术获得的GFP-TaATG8a过表达植株可以应用于小麦多种组织类型中的自噬活性调节机制和生理功能研究。
关键词:
Abstract
ATG8 is an essential autophagy-related factor decorating on the membranes of autophagic structures. Fluorescence protein-tagged ATG8 expressed in live cells has been widely used to visualize autophagic structures and to monitor the activity of autophagy. Virus-mediated over-expression (VOX) is a simple technique for rapid expression of genes of interest in plants. Here the foxtail mosaic virus (FoMV)-based VOX was adopted for preparation of wheat seedlings over-expressing the GFP-tagged form of the wheat ATG8 family member TaATG8a. An FoMV-VOX vector was constructed for expression of the recombinant FoMV genomic RNA carrying the GFP-TaATG8a sequence. Expression of FoMV genomic RNA and assembly of FoMV virions were accomplished in Nicotiana benthamiana leaves through agroinfiltration. N. benthamiana leave extract containing FoMV virions was used to inoculate leaves of wheat seedlings. Fluorescence microscopy of virus-inoculated wheat seedlings showed the efficient expression of GFP-TaATG8a was in not only inoculated leaves but also systemic uninoculated leaves and roots. Moreover, punctate fluorescence of GFP-TaATG8a representing autophagic structures was clearly observed in leaf epidermal cells, mesophyll cells, and root cells of wheat seedlings subjected to autophagy-stimulating starvation stress. The autophagy activity in these cells could be evaluated by quantifying the GFP-TaATG8a-labeled autophagic structures. These results lay a foundation for studies of the regulating mechanisms and physiological roles of autophagy in various wheat tissues.
Keywords:
PDF (5858KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
胡蕊洁, 杨向芸, 贾磊, 李玉如, 项月, 岳洁瑜, 王华忠. 病毒介导的GFP-ATG8在小麦上的表达和在自噬活性监测上的应用. 作物学报, 2021, 47(12): 2371-2378 DOI:10.3724/SP.J.1006.2021.01094
HU Rui-Jie, YANG Xiang-Yun, JIA Lei, LI Yu-Ru, XIANG Yue, YUE Jie-Yu, WANG Hua-Zhong.
细胞自噬(autophagy, 简称自噬)与植物生长、发育、衰老、细胞死亡和逆境响应等过程密切相关[1,2,3]。自噬结构的观察和自噬活性的监测是开展自噬调节机制和生理功能研究的必要手段, 定位于自噬膜上的ATG8是观察细胞内结构的重要靶标。具体研究中, 通常将荧光蛋白标记的ATG8在细胞或个体水平进行过表达, 继而采用荧光显微技术对其细胞内荧光进行观察和分析[4]。由农杆菌和基因枪等介导的稳定转化是获得目的基因过表达植株的常用技术, 但该类技术在包括小麦在内的多数植物上的使用涉及繁琐的组织培养过程和对无菌操作的严格要求, 获得转基因植株的周期长, 工作量大。近年来发展起来的病毒介导的过表达(virus-mediated over-expression, VOX)技术为快速获得目的基因的过表达植株提供了一个新的技术选择[5]。
病毒是转运外源基因的天然载体, 可通过高效的侵染过程将携带在其基因组上的目的基因导入到被接种细胞中进行表达, 还可以通过病毒粒子的增殖和移动将目的基因导入到宿主个体的非接种位置进行表达。植物上被开发为载体的病毒主要是RNA病毒, 利用此类载体的具体技术包括VOX和病毒诱导的基因沉默(virus-induced gene silencing, VIGS)两类, 后者利用了RNA病毒的复制中间体dsRNA诱发的RNAi效应[6,7]。病毒的宿主种属特异性决定了以特定病毒开发出来的VOX/VIGS技术只能应用于特定范围的宿主植物。重要农作物小麦上, 大麦条斑花叶病毒BSMV (barley stripe mosaic virus)是唯一被广泛应用于VIGS的病毒[7]。BSMV也能应用于VOX, 但其载体能稳定携带的基因片段较小(小于450~500 bp), 而且目的基因只能以与病毒γb基因融合的形式进行表达[5,8]。最近, 马铃薯X病毒属单分子正义RNA病毒——狗尾草花叶病毒FoMV (foxtail mosaic virus)也被开发为可在小麦上应用的VIGS/VOX载体, 该载体采用农杆菌介导的转化方法在烟草叶片中表达病毒基因组RNA和组装病毒粒子, 随后使用含有病毒粒子的烟草汁液摩擦接种小麦叶片[5,9-10]。采用FoMV-VOX技术可在小麦上介导长达1800 bp的基因以非融合的形式进行表达[5]。与基因枪、农杆菌等介导的稳定转化技术相比, 使用VOX技术获得目的基因的过表达植株无需繁琐的组织培养过程, 具备简便、快速的特征。
自噬是一种保守的真核生物细胞内物质分解和循环利用机制。在自噬过程中, 细胞质内待降解底物被包裹进双层膜结构的自噬小体, 随着自噬小体外膜与液泡(动物是溶酶体)膜的融合, 内膜及包裹的底物(此时称为自噬小泡)进入液泡腔被分解[11]。多种自噬相关(autophagy-related, ATG)因子参与到自噬小体组装、底物选择、自噬小体与液泡的融合及这其中的信号调控等过程[3,11]。自噬过程和ATG因子在包括酵母、动物和植物在内的真核生物中非常保守[1,12]。ATG8是自噬核心机制中研究得最清楚的ATG因子, 其在被蛋白酶ATG4加工后通过一个类泛素化过程与脂类分子磷脂酰乙醇胺连接定位于自噬结构的内、外膜表面, 继而以互作的方式募集其他ATG因子共同作用于自噬小体的组装及与液泡的融合等过程[13]。鉴于ATG8对自噬膜的标志性装饰作用, 其与GFP或RFP的融合蛋白定位到自噬膜上后所呈现的点状荧光可作为细胞内自噬小体和自噬小泡等自噬结构存在的证据, 点状荧光的数量可用来表征细胞内的自噬活性[4]。近年来, 模式植物拟南芥和水稻上都报道了过表达GFP/RFP-ATG8转基因材料的获得和在自噬分子机制、生理功能研究上的应用[14,15], 但此类材料在小麦上还未见报道, 极大地限制了小麦上相关研究的开展。鉴于FoMV- VOX技术在小麦上的成功使用和其简便、快速的特征, 有必要尝试采用这一技术在小麦上制备GFP/ RFP-ATG8的过表达植株。
高等生物ATG8是由多个成员构成的基因家族。此前我们在小麦上鉴定了9个ATG8基因(TaATG8a- 8i), 证实它们参与了小麦的细胞自噬过程[16]。本研究选择TaATG8a, 采用FoMV-VOX技术在小麦幼苗植株上表达了GFP-TaATG8a融合蛋白, 通过荧光观察对融合蛋白在叶片和根组织中的表达情况和亚细胞定位情况进行了鉴定, 建立了在小麦活体植株上以过表达的GFP-TaATG8a为靶标进行自噬活性监测的技术平台。研究结果为深入探索重要农作物小麦的自噬调控机制和生理功能奠定了基础。
1 材料与方法
1.1 试验材料
本氏烟草(Nicotiana benthamiana)和小麦品种扬麦158种子播种于装有营养土和蛭石的盆钵中, 置于23℃、16 h光照/8 h黑暗条件的光照培养箱中生长。4~5周龄的本氏烟草植株叶片用于农杆菌agroinfiltration, 二叶期的小麦幼苗用于病毒接种。1.2 GFP-TaATG8a融合基因的VOX载体构建
使用基于FoMV的VOX载体[5]构建GFP- TaATG8a融合基因的表达载体, 该载体上含有35S启动子驱动的FoMV基因组cDNA, 其上设计有2个重复的亚基因组启动子, 前一个亚基因组启动子用于驱动外源基因的表达。设计合成引物对Fo-G8a-F (ACAGTCGACAGCTATATGGTGAGCAA GGGCGAG)和Fo-G8a-R (GCGGTCGTTGAGTGT CTAGAGCAATCCGAAGGTGT), 引物5′端添加了载体上插入位点两侧的同源臂(下画线序列)。使用该引物对, 以GFP-TaATG8a融合基因表达载体pGFP- G8a[16]为模板, 使用高保真聚合酶Phanta Max Super-Fidelity DNA Polymerase (南京诺唯赞生物科技股份有限公司)扩增GFP-TaATG8a片段。使用无缝克隆试剂盒pEASY-Basic Seamless Cloning and Assembly Kit (北京全式金生物技术有限公司)将扩增片段替换原始VOX载体上Cla I和Xba I之间的GFP基因片段, 从而构建GFP-TaATG8a的VOX载体pFo-GFP-TaATG8a, 通过DNA测序(生工生物工程(上海)股份有限公司)对构建载体的正确性进行确认。将pFo-GFP-TaATG8a转化到农杆菌GV3101 (pSoup- p19)的化学感受态细胞(上海唯地生物技术有限公司)中, 转化过程参考感受态细胞的使用手册进行。1.3 烟草叶片Agroinfiltration
将固体培养基上生长的农杆菌单菌落接种于3 mL含50 μg mL-1卡那霉素和25 μg mL-1利福平的LB液体培养基中, 29℃振荡培养过夜。按1%的比例将培养液放大到10 mL含相同抗生素及20 mmol L-1 MES、20 μmol L-1乙酰丁香酮的LB液体培养基中, 继续震荡培养12 h。离心收集菌体后将菌体悬浮于适量MMA溶液(10 mmol L-1 MES, 100 μmol L-1乙酰丁香酮, 10 mmol L-1 MgCl2, pH 5.7)并将菌体浓度调至OD600值约为0.3, 29℃条件下静置3 h。使用1 mL去针头的无菌注射器将农杆菌悬浮液从背面注射至烟草叶片中。注射后的烟草于黑暗条件下保存24 h后转移到正常条件下生长。注射农杆菌7 d后, 将注射过的烟草叶片在研钵中用液氮研磨成粉末, 按1:2 (w/v)的比例加入预冷的20 mmol L-1 PBS缓冲液(pH 7.2)制备成含病毒的烟草汁液。烟草汁液可直接用于小麦接种或保存于-80℃冰箱。1.4 小麦幼苗植株的病毒摩擦接种
按1% (w/v)的比例在烟草汁液中添加灭菌的硅藻土(Celite 545, Sigma)配成病毒接种液, 将接种液摩擦接种于二叶期小麦幼苗第2叶, 接种后对幼苗进行超纯水喷雾处理和套袋保湿24 h, 随后置于正常条件下培养。1.5 饥饿和药物处理
使用去针头的1 mL注射器将100 μmol L-1 E-64D或1% DMSO (溶剂对照)直接从烟草叶片背面或从小麦叶片背面主脉切口处(提前用刀片制备)注射到组织中, 然后将叶片剪下置于蒸馏水中并保存于黑暗条件下进行离体饥饿处理。根组织的饥饿处理则是将小麦根部剪下置于蒸馏水中并保存于黑暗条件下, 蒸馏水中添加终浓度为1 μmol L-1的刀豆素A (Concanamycin A)或1% DMSO (溶剂对照)。1.6 荧光观察
使用荧光显微镜(Leica DM5000B)观察烟草叶片组织中的GFP和GFP-TaATG8a荧光, 使用体式荧光显微镜(Nikon SMZ25)观察小麦叶片和根组织中的GFP和GFP-TaATG8a荧光。使用激光共聚焦荧光显微镜(Nikon ECLIPSE Ti2)观察烟草叶表皮细胞和小麦叶表皮、叶肉、根细胞中GFP和GFP-TaATG8a的定位情况。2 结果与分析
2.1 FoMV介导的GFP-TaATG8a在小麦上的表达
将携带GFP (723 bp)或GFP-TaATG8a (1092 bp)基因的FoMV基因组RNA表达载体(图1)分别导入农杆菌后, 使用Agroinfiltration方法转化本氏烟草叶片。转化7 d后在烟草叶片中能够观察到明亮的大片绿色GFP或GFP-TaATG8a荧光(图2)。图1
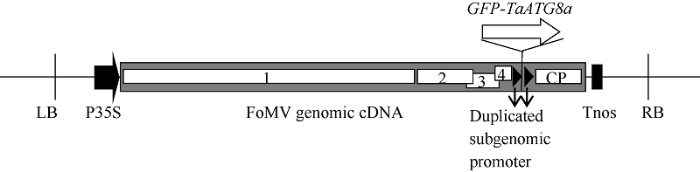 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1融合基因GFP-TaATG8a的VOX载体T-DNA序列示意图
LB和RB: T-DNA的左边界和右边界序列; P35S: CaMV 35S启动子序列; Tnos: Nos终止子序列; 标有数字1、2、3、4和字母CP的白色框分别表示FoMV的ORF1、ORF2、ORF3、ORF4和外壳蛋白(coat protein)基因。
Fig. 1Schematic illustration of the T-DNA sequence in the constructed VOX vector for the expression of GFP-TaATG8a
LB and RB: the left and right border sequences of the T-DNA. P35S: CaMV 35S promoter. Tnos: Nos transcription terminator. The FoMV genome contains five ORFs labeled from 1 to 4 and CP (coat protein).
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2FoMV介导的GFP和GFP-TaATG8a在烟草上的表达
将GFP或GFP-TaATG8a的VOX载体导入农杆菌, 采用Agroinfiltration方法转化烟草叶片。对照(CK)烟草叶片注射不含农杆菌的MMA溶液。转化7 d后在荧光显微镜下观察GFP荧光。标尺为100 μm。
Fig. 2FoMV-mediated expression of GFP and GFP-TaATG8a in N. benthamiana leaves
The GFP-expressing and the GFP-TaATG8a-expressing vector plasmids were transformed into Agrobacterium tumefaciens and agroinfiltrated into N. benthamiana leaves, respectively. Control N. benthamiana leaves were infiltrated with the MMA buffer. GFP fluorescence in N. benthamiana leaves was observed at 7 days after agroinfiltration. Bar: 100 μm.
使用转化后7 d的烟草叶片汁液摩擦接种小麦幼苗第2叶。在接种7 d后的第2叶和20 d后新长出的第3叶上均观察到成片GFP或GFP-TaATG8a绿色荧光(图3), 在接种20 d后的根尖以外的根组织中也观察到同样的绿色荧光(图4)。以上结果表明在转化烟草叶片中发生了FoMV基因组RNA的转录和病毒粒子的组装, 烟草汁液中的病毒粒子可系统性侵染小麦幼苗叶片和根尖以外的根组织, 并介导其携带目的基因在侵染组织中的过表达。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3FoMV介导的GFP和GFP-TaATG8a在小麦叶片中的表达
将表达GFP和GFP-TaATG8a的烟草叶片汁液摩擦接种于二叶期小麦幼苗第2叶, 对照(CK)植株摩擦的汁液来自注射MMA溶液的对照烟草植株叶片。分别于接种后第7天和20天观察第2叶和第3叶中的GFP荧光。标尺为500 μm。
Fig. 3FoMV-mediated expression of GFP and GFP-TaATG8a in wheat leaf tissues
The second leaves of two-leaf-stage wheat seedlings were rub-inoculated with extract prepared from GFP-expressing or GFP-TaATG8a-expressing N. benthamiana leaves containing FoMV virions. For control seedlings, their second leaves were rub-inoculated with extract prepared from N. benthamiana leaves infiltrated with the MMA buffer. GFP fluorescence in the inoculated leaves was observed at 7 days and that in the third uninoculated leaves observed at 20 days after virus inoculation. Bar: 500 μm.
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4FoMV介导的GFP和GFP-TaATG8a在小麦根组织中的表达
将表达GFP和GFP-TaATG8a的烟草叶片汁液摩擦接种于二叶期小麦幼苗第2叶, 对照(CK)植株摩擦的汁液来自注射MMA溶液的对照烟草植株叶片。于接种后第20天观察根中的GFP荧光。标尺为500 μm。
Fig. 4FoMV-mediated expression of GFP and GFP-TaATG8a in the root tissues of wheat
The second leaves of two-leaf-stage wheat seedlings were rub-inoculated with extract prepared from GFP-expressing or GFP-TaATG8a-expressing N. benthamiana leaves containing FoMV virions. For control seedlings, their second leaves were rub-inoculated with extract prepared from N. benthamiana leaves infiltrated with the MMA buffer. GFP fluorescence in the roots was observed at 20 days after virus inoculation. Bar: 500 μm.
2.2 融合蛋白GFP-TaATG8a在叶片细胞中的定位和自噬活性监测
对过表达GFP或GFP-TaATG8a的烟草、小麦植株叶片进行24 h离体黑暗条件下的饥饿处理以激活自噬, 对部分叶片同时施加液泡蛋白酶抑制剂E-64D处理以阻断自噬小泡的降解、积累自噬结构。在饥饿处理的烟草叶表皮细胞(图5)和小麦叶表皮细胞(图6)中, GFP蛋白的荧光弥散于细胞质, 不受E-64D处理的影响; GFP-TaATG8a蛋白的荧光模式明显受到E-64D处理的影响, 未经E-64D处理的情况下弥散于细胞质, 经E-64D处理的情况下则呈现代表自噬结构的绿色亮点。在饥饿处理的小麦叶肉细胞中也观察到施加E-64D处理导致的GFP- TaATG8a绿色亮点的出现(图7)。以上结果表明, 采用FoMV-VOX技术表达的GFP-TaATG8a在激活自噬的小麦叶表皮和叶肉细胞中能够定位到自噬膜上, E-64D的使用可有效地积累细胞内表征自噬结构的GFP-TaATG8a荧光亮点, 进而可以根据自噬结构的数量评价自噬活性的高低。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5融合蛋白GFP-TaATG8a在烟草叶表皮细胞中的定位
从过表达GFP或GFP-TaATG8a的烟草植株叶片背面注射100 μmol L-1 E-64D (+E-64D)或1%溶剂DMSO (-E-64D), 将注射后的叶片剪下置于蒸馏水中并保存于黑暗条件下进行离体饥饿处理。于处理后24 h在共聚焦显微镜下观察表皮细胞中的GFP荧光并照相。标尺为50 μm。
Fig. 5Localization of GFP-TaATG8a proteins in the leaf epidermal cells of N. benthamiana
N. benthamiana leaves expressing GFP or GFP-TaATG8a were injected with 100 μmol L-1 E-64D (+E-64D) or an equal volume of 1% solvent DMSO (-E-64D) from the leaf abaxial side. These leaves were then detached and treated with starvation by keeping them in distilled water under dark conditions. GFP fluorescence in leaf epidermal cells was observed under a laser scanning confocal microscope at 24 hours after starvation treatment. Bar: 50 μm.
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6融合蛋白GFP-TaATG8a在小麦叶表皮细胞中的定位
从过表达GFP或GFP-TaATG8a的小麦植株叶片背面主脉切口处注射100 μmol L-1 E-64D (+E-64D)或1%溶剂DMSO (-E-64D), 将注射后的叶片剪下置于蒸馏水中并保存于黑暗条件下进行离体饥饿处理。于处理后24 h在共聚焦显微镜下观察叶表皮细胞中的GFP荧光并照相。标尺为20 μm。
Fig. 6Localization of GFP-TaATG8a proteins in the leaf epidermal cells of wheat
Wheat leaves expressing GFP or GFP-TaATG8a were injected with 100 μmol L-1 E-64D (+E-64D) or an equal volume of 1% solvent DMSO (-E-64D) from prepared cuts on the main leaf veins. These leaves were then detached and treated with starvation by keeping them in distilled water under dark conditions. GFP fluorescence in the leaf epidermal cells was observed under a laser scanning confocal microscope at 24 hours after starvation treatment. Bar: 20 μm.
图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7融合蛋白GFP-TaATG8a在小麦叶肉细胞中的定位
从过表达GFP或GFP-TaATG8a的小麦植株叶片背面主脉切口处注射100 μmol L-1 E-64D (+E-64D)或1%溶剂DMSO (-E-64D), 将注射后的叶片剪下置于蒸馏水中并保存于黑暗条件下进行离体饥饿处理。于处理后24 h在共聚焦显微镜下观察叶肉细胞中的GFP荧光并照相。标尺为20 μm。
Fig. 7Localization of GFP-TaATG8a proteins in the mesophyll cells of wheat
Wheat leaves expressing GFP or GFP-TaATG8a were injected with 100 μmol L-1 E-64D (+E-64D) or an equal volume of 1% solvent DMSO (-E-64D) from prepared cuts on the main leaf veins. These leaves were then detached and treated with starvation by keeping them in distilled water under dark conditions. GFP fluorescence in the mesophyll cells was observed under a laser scanning confocal microscope at 24 hours after starvation treatment. Bar: 20 μm.
2.3 融合蛋白GFP-TaATG8a在小麦根细胞中的定位和自噬活性监测
对过表达GFP-TaATG8a的小麦植株根组织进行24 h离体黑暗条件下的饥饿处理以激活自噬, 对部分根组织同时施加液泡膜质子泵抑制剂即液泡腔酸化抑制剂刀豆素A处理以阻断自噬小泡的降解、积累自噬结构。荧光观察发现, 在未经饥饿和刀豆素A处理的根细胞中, GFP-TaATG8a的荧光弥散于整个细胞; 而在单独施加饥饿处理以及同时施加饥饿和刀豆素A处理的根细胞中均产生大量的代表自噬结构的GFP-TaATG8a点状荧光(图8)。这一结果表明采用FoMV-VOX技术表达的GFP-TaATG8a能够在激活自噬的根细胞中定位到自噬膜上, 可用于根细胞中自噬结构的观察和自噬活性的监测。此外, 在观察饥饿诱导的小麦根细胞中的自噬结构时, 刀豆素A的使用并非必须。图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8融合蛋白GFP-TaATG8a在小麦根细胞中的定位
将过表达GFP-TaATG8a小麦植株的根部剪下, 置于蒸馏水中并保存于黑暗条件下进行饥饿处理, 蒸馏水中添加终浓度1 μmol L-1的刀豆素A (Starvation/ConA)或1%溶剂DMSO (Starvation/-), 同时设置不经饥饿和刀豆素A处理的非离体根组织对照(-/-)。于处理后24 h在共聚焦显微镜下观察根细胞中的GFP荧光并照相。标尺为75 μm。
Fig. 8Localization of GFP-TaATG8a proteins in the root cells of wheat
Wheat roots expressing GFP or GFP-TaATG8a were detached and treated with starvation (Starvation/-) or starvation plus Concanamycin A (ConA) (Starvation/ConA) by keeping them in distilled water containing 1 μmol L-1 ConA or 1% solvent DMSO under dark conditions. Roots of intact plants that were not treated with starvation and ConA (-/-) were used as controls. GFP fluorescence in root cells was observed under a laser scanning confocal microscope at 24 hours after starvation treatment. Bar: 75 μm.
3 讨论
基于病毒的VIGS和VOX技术在植物基因和蛋白功能研究领域有着广泛的应用[5,7]。本研究采用最近被开发的FoMV-VOX技术在小麦幼苗中成功实现了GFP和GFP-TaATG8a基因的过表达, 验证了该技术的可靠性[5]。从转化烟草叶片开始, 使用FoMV-VOX技术可在30 d之内获得目的基因的过表达小麦植株; 含有病毒粒子的烟草汁液可长期低温保存, 使用保存的烟草汁液接种小麦可进一步简化技术流程、缩短实验周期。此前的FoMV-VOX应用报道只关注了目的基因在叶组织中的表达情况[5]。本研究发现, 在叶片上接种的FoMV病毒粒子除可介导目的基因在叶表皮和叶肉细胞中表达外, 还可借助病毒粒子的系统侵染特性介导目的基因在根组织中高效表达。因此, FoMV-VOX技术对小麦叶和根组织的基因功能研究都适用。鉴于FoMV-VOX技术的这些简便、快速的比较优势, 其在一定程度上可代替常规的稳定转化技术用于小麦过表达植株的制备。需要注意的是, 本研究没有在旺盛分裂的小麦根尖细胞中观察到FoMV-VOX介导的GFP或GFP-TaATG8a基因的表达。FoMV-VOX技术的效果在不同小麦品种上变化较大, 其原因可能是不同基因型的材料对FoMV侵染的敏感性有较大的差异[5]。本研究通过品种筛选发现国内品种扬麦158对FoMV-VOX较为敏感, 适合作为受体材料采用该技术开展基因功能研究。自噬的调控机制和生理功能研究离不开对细胞内自噬活性的实时监测。ATG8由于其特征性的自噬膜定位而成为监测自噬活性的重要靶标, 荧光蛋白标记的ATG8所呈现的点状荧光表征了自噬小体和自噬小泡等自噬结构的存在[4]。此前我们分别采用PEG-Ca2+介导和基因枪介导的瞬时表达方法在原生质体细胞和叶表皮细胞中证明了利用GFP-ATG8融合蛋白监测小麦自噬的可行性[17]。本研究在采用FoMV-VOX技术制备的GFP-TaATG8a过表达小麦植株的叶表皮、叶肉以及根细胞中观察到了受饥饿诱导的表征自噬结构的点状荧光, 表明制备的GFP-TaATG8a过表达植株可以应用于小麦生长发育过程中或环境因素响应过程中的自噬活性监测和自噬功能研究。自噬是一个连续的动态过程(自噬流, autophagic flux), 底物的捕获、自噬小体的成熟、自噬小体与液泡的融合以及自噬小泡在液泡中的降解等都是非常快速的中间环节, 难以在活细胞中捕捉到相应的信息。因此, 为了放大反映自噬活性的信息, 通常使用液泡蛋白酶抑制剂E-64D或液泡酸化抑制剂刀豆素A抑制自噬小泡降解这一终端环节, 达到积累自噬结构以方便监测自噬活性的目的[4]。本研究中, E-64D的使用可有效地在饥饿处理的小麦叶片细胞中积累自噬结构, 方便了自噬活性的监测; 而刀豆素A的使用在饥饿处理的小麦根组织上却并非必须, 在未经刀豆素A处理的根细胞中也能观察到大量的饥饿诱导的自噬结构积累。
4 结论
本研究采用FoMV-VOX技术在小麦幼苗上实现了自噬结构靶标蛋白基因GFP-TaATG8a在多种组织类型中的过表达, 该技术流程具有简单、快速的优势。GFP-TaATG8a蛋白在激活自噬的细胞中呈现表征自噬结构的点状荧光, 因此使用FoMV-VOX技术制备的GFP-TaATG8a过表达植株可以应用于小麦的自噬活性调节机制和生理功能研究。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOIURL [本文引用: 2]
[本文引用: 1]
DOIURL [本文引用: 2]
DOIPMID [本文引用: 4]
DOIURL [本文引用: 9]
DOIPMID [本文引用: 1]

Virus-induced gene silencing (VIGS) is an RNA interference-based technology used to transiently knock down target gene expression by utilizing modified plant viral genomes. VIGS can be adapted to many angiosperm species that cover large phylogenetic distances, allowing the analysis of gene functions in species that are not amenable to stable genetic transformation. With a vast amount of sequence information already available and even more likely to become available in the future, VIGS provides a means to analyze the functions of candidate genes identified in large genomic or transcriptomic screens. Here, we provide a comprehensive overview of target species and VIGS vector systems, assess recent key publications in the field, and explain how plant viruses are modified to serve as VIGS vectors. As many reports on the VIGS technique are being published, we also propose minimal reporting guidelines for carrying out these experiments, with the aim of increasing comparability between experiments. Finally, we propose methods for the statistical evaluation of phenotypic results obtained with VIGS-treated plants, as analysis is challenging due to the predominantly transient nature of the silencing effect.
DOIURL [本文引用: 3]
DOIURL [本文引用: 1]
DOIPMID [本文引用: 1]

Virus-induced gene silencing (VIGS) is a powerful technique to study gene function in plants. However, very few VIGS vectors are available for monocot plants. Here we report that Foxtail mosaic virus (FoMV) can be engineered as an effective VIGS system to induce efficient silencing of endogenous genes in monocot plants including barley (Hordeum vulgare L.), wheat (Triticum aestivum) and foxtail millet (Setaria italica). This is evidenced by FoMV-based silencing of phytoene desaturase (PDS) and magnesium chelatase in barley, of PDS and Cloroplastos alterados1 in foxtail millet and wheat, and of an additional gene IspH in foxtail millet. Silencing of these genes resulted in photobleached or chlorosis phenotypes in barley, wheat, and foxtail millet. Furthermore, our FoMV-based gene silencing is the first VIGS system reported for foxtail millet, an important C4 model plant. It may provide an efficient toolbox for high-throughput functional genomics in economically important monocot crops.© 2016 American Society of Plant Biologists. All Rights Reserved.
[本文引用: 1]
DOIURL [本文引用: 2]
[本文引用: 1]
PMID [本文引用: 1]

Autophagy involves de novo formation of double membrane-bound structures called autophagosomes, which engulf material to be degraded in lytic compartments. Atg8 is a ubiquitin-like protein required for this process in Saccharomyces cerevisiae that can be conjugated to the lipid phosphatidylethanolamine by a ubiquitin-like system. Here, we show using an in vitro system that Atg8 mediates the tethering and hemifusion of membranes, which are evoked by the lipidation of the protein and reversibly modulated by the deconjugation enzyme Atg4. Mutational analyses suggest that membrane tethering and hemifusion observed in vitro represent an authentic function of Atg8 in autophagosome formation in vivo. In addition, electron microscopic analyses indicate that these functions of Atg8 are involved in the expansion of autophagosomal membranes. Our results provide further insights into the mechanisms underlying the unique membrane dynamics of autophagy and also indicate the functional versatility of ubiquitin-like proteins.
[本文引用: 1]
DOIURL [本文引用: 1]
DOIURL [本文引用: 2]
DOIURL [本文引用: 1]
